


2. 湖北省中医院针灸科,湖北 武汉 430061
2. Dept of Acupuncture, Hospital of Traditional Chinese Medicine in Hubei, Wuhan 430061, China
糖尿病是由于胰岛素作用障碍或者分泌缺陷所致的,临床以高血糖为特征的一种代谢性疾病[1]。流行病学调查发现[2],世界范围内糖尿病发病率呈现明显逐年上升趋势,严重威胁人类身体健康及生命安全。目前,西医对于糖尿病发病机制尚未完全阐明,临床上仍缺乏特效的治疗药物。中药因其安全性高,治疗多环节、多层次、多靶点成为了目前治疗糖尿病研究的重要热点[3]。研究表明[4],姜黄素对于糖尿病具有良好的防治作用,但其具体作用机制尚未完全清楚。众所周知,脂肪细胞过度增生会导致肥胖发生,增加糖尿病发生率,脂肪细胞分化不良同样会导致机体能量代谢障碍,导致糖尿病发生,由此可见,脂肪细胞分化与糖尿病的发生发展存在密切联系。本研究旨在探讨姜黄素对3T3-L1前脂肪细胞分化的影响及其作用机制,试图为姜黄素应用于临床治疗糖尿病提供一定理论依据。
1 材料与方法 1.1 材料 1.1.1 细胞系小鼠3T3-L1前脂肪细胞株,购自美国ATCC公司。
1.1.2 试剂与仪器新生小牛血清、DMEM培养基,购自杭州四季青生物公司;姜黄素(纯度为99%)、二甲基亚砜(DMSO)、MTT试剂盒、油红O染料,均购自美国Sigma公司;TRIzol、逆转录试剂盒、dNTPs、Taq DNA聚合酶,均购自大连宝生物有限公司;SYBR PrimeScript RT-PCR Kit,购自日本TaKaRa公司;PCR引物由上海生工生物工程有限公司合成;CCAAT增强子结合蛋白β(CCAAT/enhancer binding protein beta, C/EBPβ)抗体、抗磷酸环磷腺苷反应元件结合蛋白(p-cAMP-response element binding protein, p-CREB)抗体、抗过氧化物体增殖活化受体γ(peroxisome proliferator activated receptor γ, PPARγ)抗体,购自瑞士Adipogen公司。CO2培养箱,购自美国Thermo公司;移液器、低温离心机,购自德国Eppendorf公司;光学显微镜,购自日本Olympus公司;电泳槽、电泳仪、化学发光荧光成像系统,购自美国Bio-Rad公司。
1.2 方法 1.2.1 3T3-L1前脂肪细胞培养将3T3-L1前脂肪细胞接种于高糖DMEM培养基中(含10%小牛血清、100 kU·L-1青霉素、100 mg·L-1链霉素),5% CO2培养箱37℃中恒温培养,每隔24~48 h更换培养液,待细胞状态良好时进行实验研究。
1.2.2 3T3-L1前脂肪细胞诱导分化及处理观察3T3-L1前脂肪细胞生长状态良好,将细胞接种于培养板上,培养2 d,待3T3-L1前脂肪细胞生长至融合后,将3T3-L1前脂肪细胞分为4组,分别给予0、10、20、40 μmol·L-1 浓度姜黄素处理细胞,每组分别添加含有0.5 mmol·L-1异丁基-3-甲基黄嘌呤、10 mg·L-1胰岛素、10%小牛血清、0.25 μmol·L-1 地塞米松的高糖DMEM培养基诱导分化。培养48 h后更换培养基,换成含10 mg·L-1胰岛素、10%小牛血清的高糖DMEM培养基诱导分化,再培养48 h后更换培养基,换成含10%小牛血清的高糖DMEM培养基继续培养,每隔2 d更换1次上述培养液,诱导分化8~12 d,全程同步加药和分化液,且同步更换培养液与药物,待3T3-L1前脂肪细胞约85%以上呈脂肪细胞表型时,留待备用,用于后续实验研究。
1.2.3 MTT实验采用MTT实验检测3T3-L1前脂肪细胞增殖情况,具体操作严格按照试剂盒使用说明书进行。细胞增殖抑制率/%=(1-处理组吸光度/对照组吸光度)×100%。
1.2.4 油红O染色实验收集各组细胞,加入100 μL 10%的甲醛溶液固定5 min,采用油红O染色方法室温染色2 h,随后选用异丙醇处理细胞后,在波长570 nm处检测细胞分化OD值,检测脂肪细胞胞质脂质堆积情况。
1.2.5 实时荧光定量PCRTRIzol法提取3T3-L1脂肪细胞中总RNA,电泳及紫外分光光度计检测所提RNA完整无降解,A260/A280值为1.8~2.0。利用SYBR PrimeScript RT-PCR Kit试剂盒进行实时荧光定量PCR,检测p-CREB、C/EBPβ、C/EBPα、PPARγ mRNA水平,反应总体积10 μL:cDNA 1 μL,SYBR Primix Ex Taq TM 5 μL,引物0.4 μL,RNase H2O 3.2 μL。qRT-PCR反应条件为:95℃预变性5 min,95℃ 15 s,60℃ 20 s,72℃ 30 s进行40个循环。以β-actin为内参,每个样品均设置3个平行孔,结果采用2-ΔΔCT方法处理,其中ΔΔCT=(CT目的基因-CTβ-actin)观察组-(CT目的基因-CTβ-actin)对照组。引物序列见Tab 1。
| Gene | Forward primer(5′-3′) | Reverse primer(5′-3′) |
| C/EBPβ | GGCCGGGCAATGACGCGCAC | GGCTCCGCTGCGTCCCGGTCC |
| C/EBPα | CAAGAACAGCAACGAGTACCG | GTCACTGGTCAACTCCAGCAC |
| PPARγ | GTGATGGAAGACCACTCGC | CCCACAGACTCGGCACTC |
| β-actin | CACTGTGCCCATCTACGA | GAACCCATACCTTAGGAC |
提取3T3-L1脂肪细胞总蛋白并进行蛋白定量,以β-actin作为内参基因,采用Western blot法检测p-CREB、C/EBPβ、C/EBPα、PPARγ蛋白水平,具体操作严格参照试剂盒使用说明进行。
1.3 统计学分析利用统计学软件SPSS 19.1进行研究数据统计学分析,计量资料用x±s表示,多组比较采用单因素方差分析(One-way ANOVA),组间两两比较采用LSD-t检验。
2 结果 2.1 姜黄素对3T3-L1前脂肪细胞增殖的影响MTT结果显示,姜黄素对3T3-L1前脂肪细胞增殖具有明显抑制作用,且呈现一定剂量、时间依赖性(Tab 2)。
| Curcumin concentration/ μmol·L-1 |
Inhibitory rate/% | ||
| 24 h | 48 h | 72 h | |
| 0 | - | - | - |
| 10 | 17.62±3.59* | 36.57±8.16* | 56.39±11.72* |
| 20 | 31.52±8.06*# | 48.73±9.31*# | 65.42±13.28*# |
| 40 | 39.16±10.64*#△ | 60.57±12.58*#△ | 78.71±14.09*#△ |
| P < 0.05 vs 0 μmol·L-1 ; #P < 0.05 vs 10 μmol·L-1 ; △P < 0.05 vs 20 μmol·L-1 | |||
Fig 1油红O染色结果显示,0 μmol·L-1 姜黄素组细胞分化OD值为(0.627±0.051),明显高于10 μmol·L-1 姜黄素组细胞分化OD值(0.506± 0.048),差异有统计学意义(P<0.05);10 μmol·L-1 姜黄素组细胞分化OD值明显高于20 μmol·L-1 姜黄素组细胞分化OD值(0.314±0.037) (P<0.05);20 μmol·L-1 姜黄素组细胞分化OD值明显高于40 μmol·L-1 姜黄素组细胞分化OD值(0.136±0.031) (P<0.05)。即姜黄素可抑制糖尿病大鼠脂肪细胞脂质积聚,抑制脂肪细胞分化,且呈现一定剂量依赖性。
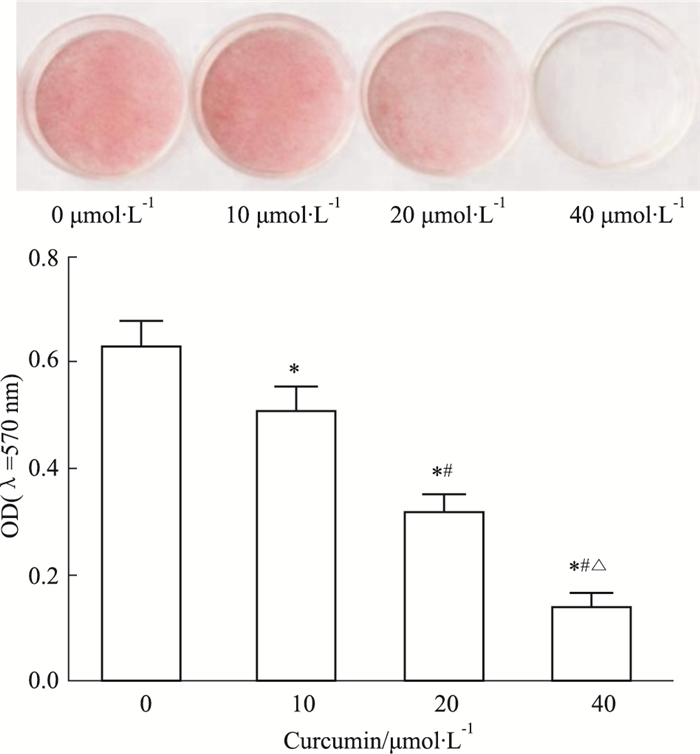
|
| Fig 1 Effect of different concentrations of curcumin on adipocyte differentiation in diabetic rats *P < 0.05 vs 0 μmol·L-1 curcumin; #P < 0.05 vs 10 μmol·L-1 curcumin; △P < 0.05 vs 20 μmol·L-1 curcumin |
如Fig 2所示,0、10、20、40 μmol·L-1 姜黄素处理3T3-L1前脂肪细胞,p-CREB、C/EBPβ mRNA及蛋白水平随姜黄素剂量升高均呈现明显下降趋势(P<0.05)。
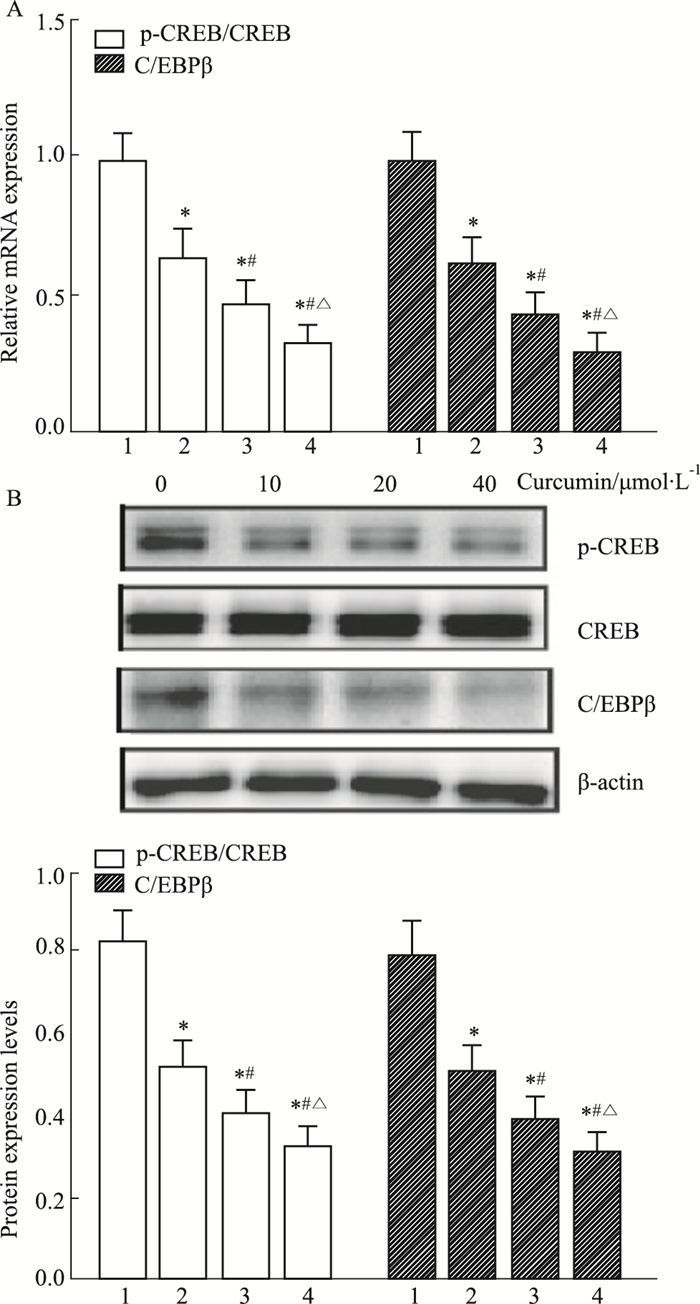
|
| Fig 2 Effect of different concentrations of curcumin on CREB activation and C/EBPβ mRNA(A) and protein(B) expression 1: 0 μmol·L-1 curcumin; 2: 10 μmol·L-1 curcumin; 3: 20 μmol·L-1 curcumin; 4: 40 μmol·L-1 curcumin. *P < 0.05 vs 0 μmol·L-1 curcumin; #P < 0.05 vs 10 μmol·L-1 curcumin; △P < 0.05 vs 20 μmol·L-1 curcumin |
如Fig 3所示,0、10、20、40 μmol·L-1 姜黄素处理3T3-L1前脂肪细胞,C/EBPα、PPARγ mRNA及蛋白水平随姜黄素剂量升高均呈现明显下降趋势(P<0.05)。
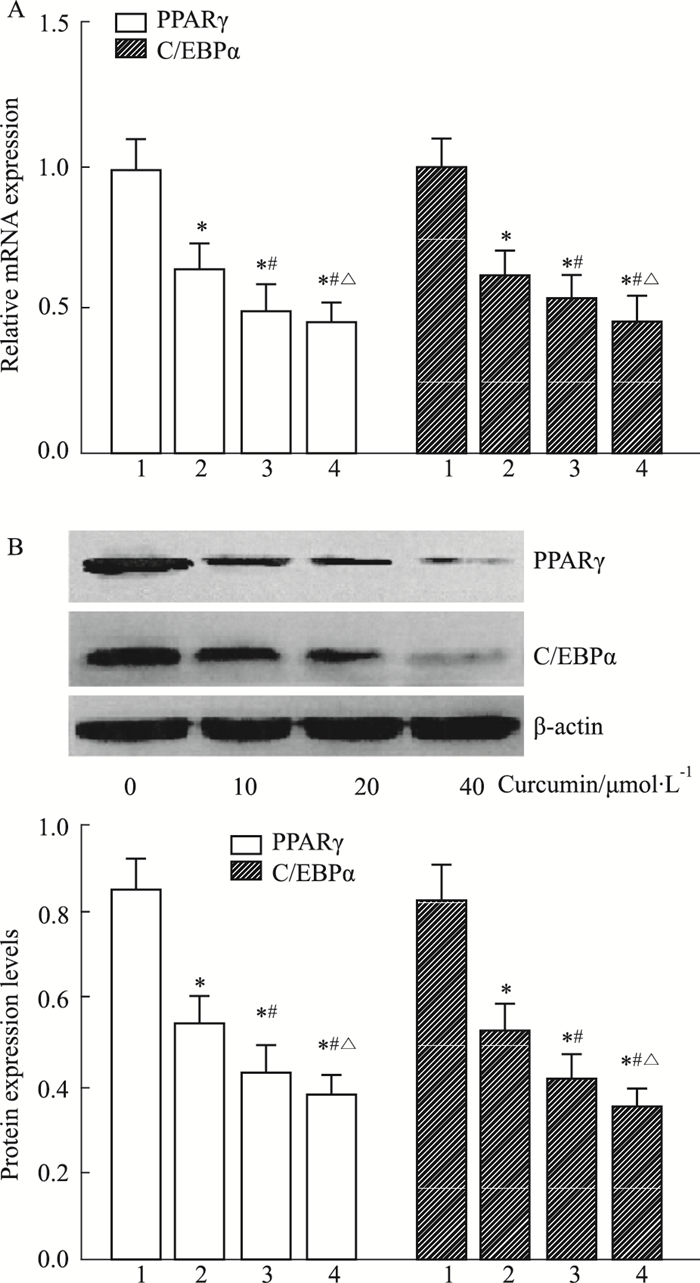
|
| Fig 3 Effect of curcumin on C/EBPα and PPARγ mRNA(A) and protein(B) expression 1: 0 μmol·L-1 curcumin; 2: 10 μmol·L-1 curcumin; 3: 20 μmol·L-1 curcumin; 4: 40 μmol·L-1 curcumin. *P < 0.05 vs 0 μmol·L-1 curcumin; #P < 0.05 vs 10 μmol·L-1 curcumin; △P < 0.05 vs 20 μmol·L-1 curcumin |
目前,我国糖尿病发病年龄日渐低龄化,发病率呈现逐年上升趋势,糖尿病已成为中国乃至世界范围内公共卫生重大问题之一[5]。临床上用于糖尿病治疗的西药虽多,但大多不能根治,且长期服用西药所造成的的毒副作用不可忽视,中药因其安全性高,治疗多层次、多靶点成为了目前糖尿病治疗研究的重要热点[6]。姜黄素是来源于姜黄的干燥根茎,因其具有抗炎、抗肿瘤、降血脂、防治糖尿病、抗氧化等多种药理作用,在临床广泛应用[7-8]。研究表明[9-10],姜黄素可通过抗氧化作用,降低糖尿病大鼠模型血糖水平。姜黄素还可通过作用于脂肪及肝脏内调节糖脂代谢酶,来改善肥胖糖尿病模型机体胰岛素抵抗,增加葡萄糖稳态。脂肪细胞过度增生会导致肥胖发生,增加糖尿病发生率,脂肪细胞分化不良同样会导致机体能量代谢障碍,导致糖尿病发生,脂肪细胞分化与糖尿病的发生发展存在密切联系。本研究旨在探讨姜黄素对3T3-L1前脂肪细胞分化的影响及其作用机制,试图为姜黄素应用于临床治疗糖尿病提供一定理论依据。
脂肪组织是机体的一个巨大内分泌系统,分泌多种活性因子,在机体神经-内分泌-免疫网络调节中扮演重要角色。机体脂肪细胞分化异常可导致脂肪堆积过多,进而导致脂肪细胞内分泌功能失调,从而引发糖尿病的发生[11]。因此,研究药物对于机体脂肪细胞分化的作用,对于早期防止肥胖、糖尿病、血脂紊乱、高血压等疾病发生及治疗具有十分重要的意义。脂肪细胞分化是由分化转录因子激活调控的一个复杂过程[12]。cAMP/PKA信号通路在脂肪细胞分化早期程序中起关键性作用,cAMP/PKA信号通路通过激活CREB磷酸化,发挥调节脂肪细胞分化等重要生理学过程[13]。CREB是cAMP反应性元件结合蛋白,是一种真核生物细胞核内重要的调控因子,在调节基因转录、细胞发育及生存、生理节奏等方面具有重要调控作用[14]。CREB磷酸化是其实现调节转录作用的重要途径。磷酸化的CREB在脂肪分化过程中可诱导C/EBPβ表达,触发级联转录反应,从而促进C/EBPα、PPARγ等重要转录因子的激活[15]。PPARγ是激素核受体超家族成员中最具有脂肪组织特异性的转录因子,在脂肪细胞分化过程中扮演着十分重要的角色[16]。C/EBPα是C/EBP家族中对脂肪细胞分化最具影响的转录因子,对于促进PPARγ的高表达,保持分化细胞的表型有着极为重要的作用[17]。众所周知,C/EBPα、PPARγ在其启动子近端具有C/EBP顺式调控元件,其中C/EBPβ是结合并协调激活转录的重要因子。目前,国内有关姜黄素对于3T3-L1前脂肪细胞CREB转录活性研究尚未见报道,大多研究仅停留于姜黄素对于3T3-L1前脂肪细胞脂肪内脂素、脂联素等基因影响研究[18],对于姜黄素影响3T3-L1前脂肪细胞增殖分化具体作用机制研究内容单一,且不够深入。本研究以cAMP/PKA信号通路为研究出发点,探讨姜黄素对3T3-L1前脂肪细胞分化的影响机制,目前国内尚未见报道。
本研究结果表明,姜黄素对3T3-L1前脂肪细胞增殖具有明显抑制作用,且呈现一定剂量、时间依赖性,油红O染色结果显示,姜黄素可抑制3T3-L1前脂肪细胞分化,且呈现一定剂量依赖性。脂肪细胞增殖、分化在糖尿病发病机制中具有十分重要的作用,姜黄素对于3T3-L1前脂肪细胞增殖、分化均具有明显抑制作用,推测姜黄素之所以发挥防治糖尿病的作用机制,可能是通过抑制了脂肪细胞的增殖、分化来实现的。随后,本研究提取3T3-L1前脂肪细胞RNA及蛋白,探讨姜黄素对脂肪细胞分化相关转录因子p-CREB、C/EBPβ、C/EBPα、PPARγ表达的影响。结果可见,不同浓度姜黄素处理3T3-L1前脂肪细胞,p-CREB、C/EBPβ mRNA及蛋白水平明显下调,且随姜黄素剂量升高均呈现明显下降趋势。CREB对于启动脂肪细胞分化过程至关重要,C/EBPβ是CREB调控的重要靶基因之一,是脂肪细胞分化的早期调节剂。C/EBPβ基因近端具有双顺式调节元件,二者均具有CREB核心结合位点。磷酸化CREB可与C/EBPβ启动子结合,触发一系列级联转录事件,促进C/EBPα、PPARγ基因激活。后续实验结果显示,姜黄素还可明显下调C/EBPα、PPARγ mRNA及蛋白表达,且随姜黄素剂量升高均呈现明显下降趋势。因此,本研究推测姜黄素可能通过抑制CREB活性,导致C/EBPβ引发的转录级联降低,C/EBPα和PPARγ成脂基因表达降低,发挥抑制3T3-L1前脂肪细胞分化的作用。
综上所述,本研究结果表明,姜黄素可有效抑制3T3-L1前脂肪细胞增殖分化,其机制可能与姜黄素抑制CREB转录活性,从而抑制C/EBPβ、C/EBPα、PPARγ表达有关。姜黄素抑制p-CREB与C/EBPβ结合的具体机制,有待进一步深入研究。
( 致谢: 本研究所有实验均在武汉职业技术学院生物工程学院药理实验室及湖北中医药大学针灸重点实验室完成,感谢实验室全体老师的支持及同事们无私的帮助。)
| [1] | 纪立农, 陈莉明, 郭晓蕙, 等. 中国慢性疾病防治基层医生诊疗手册(糖尿病分册)2015年版[J]. 中国糖尿病杂志, 2015, 23(8): 673-701. Ji L N, Chen L M, Guo X H, et al. China handbook for diagnosis and treatment of chronic disease prevention physicians (diabetes section) 2015 edition[J]. Chin J Diabetes, 2015, 23(8): 673-701. |
| [2] | 廖涌. 中国糖尿病的流行病学现状及展望[J]. 重庆医科大学学报, 2015, 40(7): 1042-5. Liao Y. Epidemiological status and prospect of diabetes in China[J]. J Chongqing Med Univ, 2015, 40(7): 1042-5. |
| [3] | 董世芬, 洪缨, 汪瑞祺, 等. 小檗碱对实验性2型糖尿病心肌病大鼠模型心脏保护作用研究[J]. 中国药理学通报, 2013, 29(9): 1216-21. Dong S F, Hong Y, Wang R Q, et al. Cardioprotective effects of berberine on experimental type 2 diabetic cardiomyopathy in rats[J]. Chin Pharmacol Bull, 2013, 29(9): 1216-21. |
| [4] | 蓝宇涛, 旷焱平, 陈垦. 姜黄素抗糖尿病血管内皮氧化损伤的研究进展[J]. 广东药学院学报, 2015, 31(4): 551-3. Lan Y T, Kuang D P, Chen K. Progress of curcumin on attenuating oxidative damages of vascular endothelia in diabetes[J]. J Guangdong Pharm Univ, 2015, 31(4): 551-3. |
| [5] | Zimmet P Z, Alberti K G. Epidemiology of diabetes-status of a pandemic and issues around metabolic surgery[J]. Diabetes Care, 2016, 39(6): 878-83. |
| [6] | 吴亚楠, 梁晓春. 中药对糖尿病免疫功能紊乱的干预作用[J]. 世界中西医结合杂志, 2015, 10(9): 1322-5. Wu Y N, Liang X C. Intervention effect of Chinese herbal medicine on diabetic immune dysfunction[J]. World J Integr Tradit West Med, 2015, 10(9): 1322-5. |
| [7] | 王菊香, 朱新波. 姜黄素对缺血缺氧性脑损伤新生鼠脑组织SOD和MDA含量的影响[J]. 中国药理学通报, 2013, 29(9): 1327-8. Wang J X, Zhu X B. Effects of curcumin on contents of SOD and MDA in brain of neonatal rats with hypoxic-ischemic encephalopathy[J]. Chin Pharmacol Bull, 2013, 29(9): 1327-8. |
| [8] | 朱道琦. 姜黄素抗肿瘤及放射增敏作用及机制研究进展[J]. 中国药理学通报, 2015, 31(b11): 244-5. Zhu D Q. Research progress of anti-tumor and radiosensitization of curcumin and its mechanism[J]. Chin Pharmacol Bull, 2015, 31(b11): 244-5. |
| [9] | 付海尔, 李建民, 刘玉红. 姜黄素对STZ诱导C57BL/6小鼠血糖、血脂影响[J]. 辽宁中医药大学学报, 2016, 18(5): 56-8. Fu H E, Li J M, Liu Y H. Effects of curcumin on blood glucose and blood lipids in C57BL/6 mice induced by STZ[J]. J Liaoning Univ Tradit Chin Med, 2016, 18(5): 56-8. |
| [10] | Nabavi S F, Thiagarajan R, Rastrelli L, et al. Curcumin: a natural product for diabetes and its complications[J]. Curr Top Med Chem, 2015, 15(23): 2445-9. doi:10.2174/1568026615666150619142519 |
| [11] | 施亚雄. 脂肪组织的多面性:糖尿病及其他疾病的治疗靶点[J]. 中华糖尿病杂志, 2015, 7(8): 470-3. Shi Y X. The multifaceted nature of adipose tissue: targets for the treatment of diabetes and other diseases[J]. Chin J Diabetes, 2015, 7(8): 470-3. |
| [12] | 裴舟, 罗飞宏. 脂肪细胞分化的调控通路研究[J]. 国际内分泌代谢杂志, 2011, 31(1): 25-7. Pei Z, Luo F H. Research on regulating pathways of adipocyte differentiation[J]. Int J Endocrinol Metab, 2011, 31(1): 25-7. |
| [13] | Zhang J W, Klemm D J, Vinson C, et al. Role of CREB in transcriptional regulation of CCAAT/enhancer-binding protein beta gene during adipogenesis[J]. J Biol Chem, 2004, 279(6): 4471-8. doi:10.1074/jbc.M311327200 |
| [14] | 张澄, 王萍. 转录因子CREB对细胞周期调控机制的研究进展[J]. 中国细胞生物学学报, 2011, 33(5): 577-83. Zhang C, Wang P. Research progress on regulation mechanism of transcription factor CREB on cell cycle[J]. Chin J Cell Biol, 2011, 33(5): 577-83. |
| [15] | Reusch J E, Colton L A, Klemm D J. CREB activation induces adipogenesis in 3T3-L1 cells[J]. Mol Cell Biol, 2000, 20(3): 1008-20. |
| [16] | 蒋金航, 马云, 王新庄. PPARγ基因调控脂肪细胞分化的研究进展[J]. 中国畜牧杂志, 2014, 50(9): 91-5. Jiang J H, Ma Y, Wang X Z. Recent advance in regulation of adipogenesis by PPARγ gene[J]. Chin J Anim Sci, 2014, 50(9): 91-5. |
| [17] | Bauer R C, Sasaki M, Cohen D M, et al. Tribbles-1 regulates hepatic lipogenesis through posttranscriptional regulation of C/EBPα[J]. J Clin Invest, 2015, 125(10): 3809-18. |
| [18] | 秦培洁, 张东伟, 莫芳芳, 等. 姜黄素对3T3-L1前脂肪细胞增殖分化的影响及机制研究[J]. 山东中医药大学学报, 2014, 38(3): 154-7. Qin P J, Zhang D W, Mo F F, et al. Effect and mechanism of curcumin on proliferation and differentiation of 3T3-L1 preadipocytes[J]. J Shandong Univ Tradit Chin Med, 2014, 38(3): 154-7. |

