


2. 敦煌医学与转化省部共建教育部重点实验室, 甘肃 兰州 730000;
3. 河西学院医学院中医药系, 甘肃 张掖 734000;
4. 甘肃省空间辐射生物学重点实验室, 中国科学院近代物理研究所, 甘肃 兰州 730000;
5. 甘肃省嘉峪关市中医医院内一科, 甘肃 嘉峪关 735100
 ,
LU Zhi-wei5,
WANG Lei1,
ZHANG Li-ying1,
AN Fang-yu1,
HE Jin-peng4,
HUA Jun-rui4,
ZHANG Yan-hui1,
LIU Yong-qi1,2
,
LU Zhi-wei5,
WANG Lei1,
ZHANG Li-ying1,
AN Fang-yu1,
HE Jin-peng4,
HUA Jun-rui4,
ZHANG Yan-hui1,
LIU Yong-qi1,2

2. Key Lab of Dunhuang Medicine and Transformation at Provincial and Ministerial Level, Lanzhou 730000, China;
3. Dept of Traditional Chinese Medicine, Hexi University School of Medicine, Zhangye Gansu 734000, China;
4. Key Lab of Space Radiobiology, Institute of Modern Physics, Chinese Academy of Sciences, Lanzhou 730000, China;
5. the First Dept of Medicine, Jiayuguan Traditional Chinese Medicine Hospital of Gansu Province, Jiayuguan Gansu 735100, China
随着核医学、放射医学、放射诊疗技术的不断提高及广泛应用,电离辐射引起的组织和器官损伤已经不容忽视。电离辐射可引起基因组的不稳定性、增加突变的可能性、诱发染色体畸变等,从而增加辐射致癌的可能性[1-2]。骨髓和脾脏因其具有活跃的造血能力以及免疫细胞分化能力,而对电离辐射高度敏感,是辐射损伤最常见的组织器官[3],因此,研究具有防护辐射对骨髓及脾脏损伤的药物具有非常重要的意义。中药当归乃补血圣药,具有滋阴补血、润肠通便等功效,而当归多糖是当归的主要药效成分之一,且有研究报道当归多糖具有促进造血[4]、提高免疫[5]、抗氧化损伤[6]等功效。本实验通过辐射损伤的动物模型,探索当归多糖对辐射导致的骨髓及脾脏损伤的防护作用,为医学上运用当归多糖防护辐射损伤提供科学依据。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级SD ♂大鼠40只,3月龄,体质量(200±20) g,由第四军医大学实验动物中心提供,许可证号:SCXK(军)2012-0007。实验过程中对动物的处置严格按照实验动物学对实验动物的伦理学标准进行。
1.1.2 药物与试剂当归购于甘肃中医药大学附属医院;当归多糖,经甘肃中医药大学科研中心中药药理与毒理实验室采用水提醇沉法提取有效成分,提取得率2.69%,纯度为66.7%,当归多糖按当归的用量同比换算成相对剂量,即当归多糖高剂量(254 mg·kg-1)、中剂量(127 mg·kg-1)和低剂量(63.5 mg·kg-1)。大鼠IL-4 ELISA检测试剂盒(批号:ERC002)、大鼠IFN-γ ELISA检测试剂盒(批号:ERC101g),均购于深圳欣博盛生物科技有限公司。
1.1.3 仪器X射线仪PRECISION X-RAY(美国),分光光度计(型号:VIS-723N,北京瑞利仪器公司),酶标仪(型号:IMARK,美国Bio-Rad),全自动动物血球分析仪(型号:Abacus5,兰桥医疗)。
1.2 方法 1.2.1 动物分组将40只♂ SD大鼠随机分为空白组、模型组、当归多糖低剂量组(63.5 mg·kg-1)、中剂量组(127 mg·kg-1)、高剂量组(254 mg·kg-1),每组8只。药物组每日以不同浓度的当归多糖2 mL灌胃1次,空白组及模型组用等量的蒸馏水代替,连续给药7 d后,分别对除空白组以外的各组大鼠进行全身X线照射,连续照射2 d,每天3 Gy,辐射总吸收剂量为6 Gy,辐射剂量率为92.26 cGy·min-1,距离皮源为70 cm,末次辐射后d 3,麻醉后采血处死大鼠,检测相应指标。其中模型组大鼠死亡2只,当归多糖低、中剂量组大鼠各死亡1只。
1.2.2 大鼠生存质量的检测第1次辐射后,记录各组大鼠辐射前后的体质量变化、饮食情况、精神状态及活动度,并进行生存质量评分。体质量:升高5 g以上为2分,体质量升高或降低不超过5 g为1分,体质量降低超过5 g为0分;饮食:平均每只大鼠超过20 g为2分,平均每只大鼠在10~20 g为1分,平均每只大鼠小于10 g为0分;精神状态及活动度:反应迅速、精神状态好为2分,反应较慢、精神状态一般为1分,反应迟钝、精神状态差为0分。
1.2.3 血常规的检测抗凝管取血1 mL,轻晃抗凝管使其充分混匀,防止凝血,将全血转入1.5 mL的EP管中,上机检测,检测的指标为白细胞数、红细胞数、血红蛋白含量。
1.2.4 脾脏指数的检测麻醉后处死大鼠,分离脾脏,分析天平测量脾脏质量,计算各组大鼠的脾脏指数:脾脏指数=脾脏质量(mg)/体质量(g)。
1.2.5 骨髓有核细胞的计数方法参照文献[7]。麻醉后处死大鼠,分离各组大鼠的左股骨,用剪刀沿股骨颈将股骨头剪掉,用10 mL 3%的冰醋酸通过5 mL的注射器,将骨髓全部冲出,并用移液枪轻轻吹打使细胞吹散,用血球计数板计数有核细胞的数量。
1.2.6 脾脏的病理学变化HE染色观察脾脏病理变化,每张切片选取3个视野进行脾脏病理评分,评分原则为,0分:脾脏的脾小体明显萎缩,生发中心不明显,白髓和红髓结构紊乱,无明显界限,不能识别,脾窦扩张,间质出血严重,存在明显的淤血,淋巴细胞数量明显减少;1分:脾脏的脾小体模糊,生发中心、红髓和白髓分界尚清晰,可见一定的淤血,炎性细胞浸润;2分:脾脏的脾小体可见,生发中心、红髓和白髓分界尚清晰,未见明显的淤血,炎性细胞浸润减轻;3分:红髓、白髓分界清楚,生发中心、边缘区清晰,未见异常,无增生、萎缩及玻璃样变。
1.2.7 血清中IL-4和IFN-γ的检测股动脉取血, 室温静置1 h后, 3 000 r·min-1离心10 min, 用移液器吸取血清,按照ELISA试剂盒说明书操作,于酶标仪450 nm波长处测定各孔OD值,并计算数值。
1.3 统计学方法采用SPSS 20.0统计软件进行分析。实验数据以x±s表示,各组间比较采用方差分析,方差齐者,采用LSD法,方差不齐者,采用Tamhane法。
2 结果 2.1 各组大鼠生存质量评分的比较如Fig 1所示,与空白组比较,在辐射后的3 d内,模型组大鼠生存质量评分明显降低,差异具有统计学意义(P < 0.05);与模型组比较,在辐射后的3 d内,当归多糖中、高剂量组大鼠生存质量评分明显升高,差异具有统计学意义(P < 0.05)。
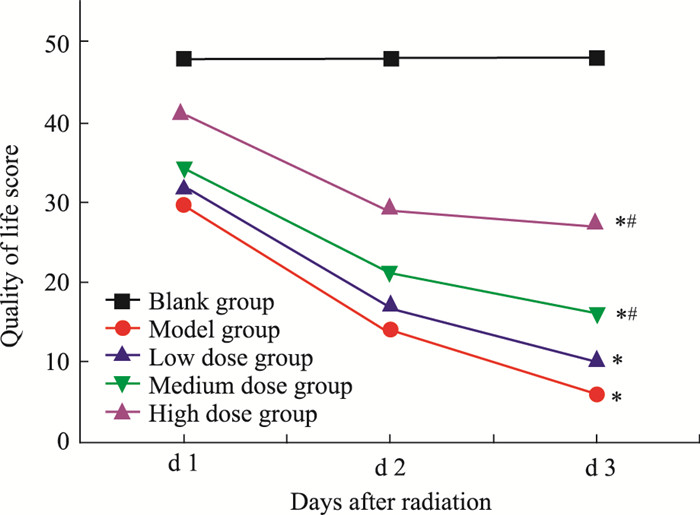
|
| Fig 1 Changes of quality of life score in rats in each group after radiation 3d *P < 0.05 vs blank; #P < 0.05 vs model |
由Tab 1可见,与空白组比较,模型组大鼠白细胞计数明显降低,红细胞计数、血红蛋白含量明显升高,差异具有统计学意义(P < 0.05);与模型组比较,当归多糖低、中、高剂量组白细胞计数明显升高,红细胞计数、血红蛋白含量明显降低,差异具有统计学意义(P < 0.05)。
| Group | n | Leukocyte count/109·L-1 | Erythrocyte count/1012·L-1 | Hemoglobin content /g·L-1 |
| Blank | 8 | 6.64±0.85 | 8.08±0.62 | 153.17±4.88 |
| Model | 6 | 0.08±0.02* | 9.77±0.45* | 189.50±5.69* |
| Low dose | 7 | 1.54±0.18*# | 8.43±0.31# | 160.50±3.02# |
| Medium dose | 7 | 1.63±0.19*# | 8.25±0.47# | 156.50±9.07# |
| High dose | 8 | 1.48±0.24*# | 8.39±0.63# | 160.50±8.80# |
| *P < 0.05 vs blank; #P < 0.05 vs model | ||||
由Tab 2可见,与空白组比较,模型组大鼠脾脏指数及骨髓有核细胞数明显降低,差异具有统计学意义(P < 0.05);与模型组比较,当归多糖中剂量组大鼠脾脏指数升高,差异具有统计学意义(P < 0.05),当归多糖低、中、高剂量组大鼠骨髓有核细胞计数明显升高,差异具有统计学意义(P < 0.05)。
| Group | n | Spleen index /mg·g-1 | Number of nucleated cells in bone marrow |
| Blank | 8 | 1.85±0.17 | 889.50±18.81 |
| Model | 6 | 0.91±0.11* | 39.00±10.28* |
| Low dose | 7 | 0.96±0.12* | 104.67±7.97*# |
| Medium dose | 7 | 1.17±0.40*# | 150.33±12.49*# |
| High dose | 8 | 0.97±0.21* | 126.50±11.64*# |
| *P < 0.05 vs blank; #P < 0.05 vs model | |||
正常组大鼠脾脏被膜完整,红髓、白髓分界清楚,生发中心、边缘区清晰,未见异常,无增生、萎缩及玻璃样变;模型组大鼠脾脏的脾小体明显萎缩,生发中心不明显,白髓和红髓结构紊乱,无明显界限,不能识别,脾窦扩张,间质出血严重,存在明显的淤血,淋巴细胞数量明显减少;当归多糖低、中、高剂量组大鼠脾脏组织的病理损伤有所减轻,脾脏的脾小体可见,生发中心、红髓和白髓分界尚可见,未见明显的淤血,炎细胞浸润减轻(Fig 2、Tab 3)。
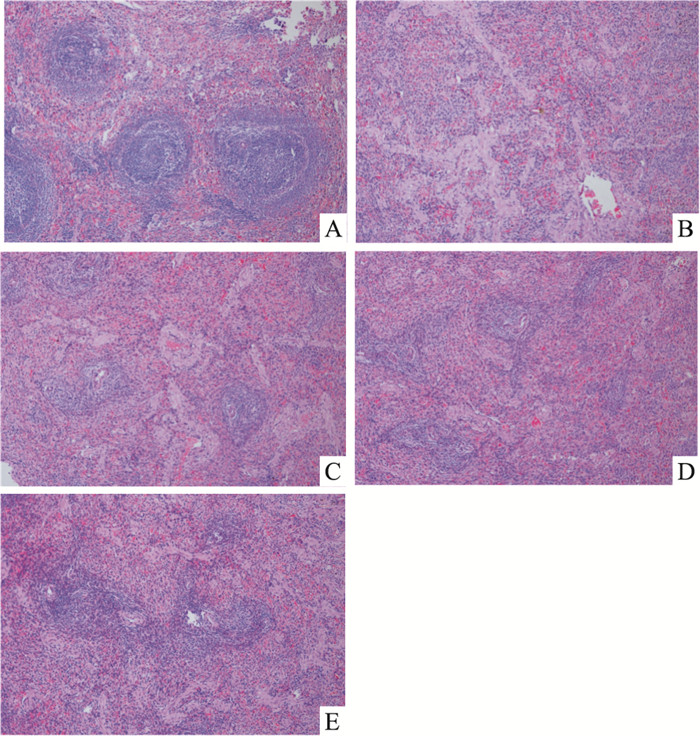
|
| Fig 2 Pathological changes of spleen tissue of rats in each group(HE, ×200) A: Blank group; B:Model group; C:Low dose group; D:Medium dose group; E:High dose group |
| Group | n | Pathological score |
| Blank | 24 | 2.76±0.57 |
| Model | 18 | 0.64±0.17* |
| Low dose | 21 | 0.96±0.34*# |
| Medium dose | 21 | 1.48±0.54*# |
| High dose | 24 | 2.21±0.62*# |
| *P < 0.05 vs blank; #P < 0.05 vs model | ||
由Tab 4可见,与空白组比较,模型组大鼠血清中IL-4及IFN-γ的含量明显降低,差异具有统计学意义(P < 0.05);与模型组比较,当归多糖中、高剂量组大鼠血清中IL-4的含量升高,差异具有统计学意义(P < 0.05),当归多糖低、高剂量组大鼠血清中IFN-γ的含量明显升高,差异具有统计学意义(P < 0.05)。
| Group | n | IL-4/ng·L-1 | IFN-γ/ng·L-1 |
| Blank | 8 | 63.87±6.53 | 34.02±10 |
| Model | 6 | 44.01±11.05* | 15.54±7.6* |
| Low dose | 7 | 53.65±7.49 | 26.46±8.72# |
| Medium dose | 7 | 55.32±7.41# | 23.68±6.55* |
| High dose | 8 | 55.05±11.07# | 25.52±8.07# |
| *P < 0.05 vs blank; #P < 0.05 vs model | |||
电离辐射能够引起机体组织器官的严重损伤,而机体的各个组织器官对辐射的敏感性是有差异性的,其中尤以骨髓、脾脏、胃肠道及生殖系统的敏感性最高[8]。骨髓是各种血细胞和免疫细胞发生和分化的场所,是机体重要的中枢免疫及造血器官[9]。骨髓中富含白细胞、红细胞和各系统不同分化阶段的幼稚细胞,而骨髓中有核细胞的数量可以直接反映机体的造血功能。脾脏是机体重大的免疫器官,含有大量的淋巴细胞和巨噬细胞,是机体细胞免疫和体液免疫的中心,同时脾脏也是机体血液储存的重要器官。研究表明[10],马的脾脏存储了马体内大约30%的红细胞。我们实验的初期观察到,SD大鼠经X线辐照后,生存质量明显降低,而当归多糖给药组生存质量明显较模型组升高。现代药理学研究表明[11],当归多糖能改善小鼠脾脏的萎缩,并能促进小鼠脾细胞和巨噬细胞增殖,且当归多糖能促进小鼠的细胞免疫与体液免疫。此外,当归多糖能够明显增加血虚模型小鼠的外周血红蛋白,同时能够促进骨髓细胞DNA的合成[12]。因此,我们猜想辐射导致了SD大鼠骨髓和脾脏的急性损伤,引起机体造血及免疫系统的崩溃,从而降低了SD大鼠的生存质量;提前给予当归多糖后,能够提高骨髓和脾脏的抗辐射能力,从而表现出生存质量较模型组升高的趋势。因此,我们进一步检测了各组SD大鼠的血常规、脾脏指数、骨髓有核细胞数、脾脏的病理情况及血清中IL-4和IFN-γ的含量,进一步揭示当归多糖防护辐射对SD大鼠骨髓及脾脏的损伤,进而提高生存质量的机制。
实验结果显示,在血常规方面,当归多糖各组能够明显防护辐射导致的白细胞数减少;但在红细胞数、血红蛋白含量上与现代医学对当归多糖的药理学认识是相悖的,而我们认为产生这种结果的原因是由于辐射属于一种强烈的致病因素,具有火热毒邪的特点,故辐射后的3 d内,机体处于严重的伤津耗气状态,火邪灼烧津液血液,导致机体津液与血液的大量耗损,使血液处于一个浓缩的状态,故与空白组比较,模型组血常规中红细胞数、血红蛋白含量是升高的。而提前给予当归多糖干预后,机体血液、津液得到一定补充,可能是当归多糖具有缓解辐射引起的津液耗损等作用,故红细胞数、血红蛋白含量较模型组降低,这虽然与某些研究报道当归多糖具有提高红细胞数及血红蛋白含量相悖[13],但也验证了中药当归具有滋阴养血的作用。在脾脏指数与骨髓有核细胞计数上,当归多糖能明显升高辐射导致的脾脏指数及骨髓有核细胞计数的降低;脾脏病理切片提示,当归多糖能减轻辐射导致的脾脏损伤;在IL-4和IFN-γ的含量方面,当归多糖能升高辐射导致的IL-4和IFN-γ含量的下降。因此,我们得出结论,当归多糖能防护辐射导致的SD大鼠骨髓及脾脏的损伤,从而改善辐射引起的生存质量降低。
在中医学上,辐射导致的损伤归属于火毒热邪的范畴[14]。火热毒邪致病最易伤津耗气,而引起机体的干燥及神疲体倦。而中医学认为“精血同源”与“津血同源”,精气、血液、津液三者之间是相互化生的,再者髓由精生,故补益机体的精气、血液、津液可以提高髓的化生。当归多糖为中药当归的主要药效成分之一,中药当归为补血圣药,归肝、心、脾经,具有滋阴补血、润燥活血的功效。因此,当归补血的同时,也使机体血液、津液得补,则辐射这一“火热毒邪”导致津亏的病理特征可得到极大的改善。这与现代药理学研究表明,当归多糖具有改善血液活力、抗氧化、抗肿瘤、提高机体免疫的作用是一致的[15-17]。
本实验探索了当归多糖对辐射导致的骨髓及脾脏损伤的防护机制,其对X线诱发骨髓及脾脏损伤主要是通过提高外周循环血量、抵抗辐射对免疫细胞及造血细胞的损伤来实现的,在药物作用上符合中医学及现代医学对当归多糖的药理学认识[18]。虽然,目前还没有研发出有效防护辐射引起的组织、器官损伤的药物,但随着对辐射生物学及抗辐射药物的深入研究,未来辐射引起的副作用定能得到极大的降低,而放射治疗、诊断等技术定能更好服务于社会的方方面面。
( 致谢: 本研究在甘肃中医药大学科研实验中心、甘肃省高校重大疾病分子医学与中医药防治研究省级重点实验室完成,在此对实验室各位老师的指导和帮助表示衷心的感谢! )
| [1] | 卢志伟, 王磊, 张利英, 等. 黄芪多糖对电离辐射骨髓间充质干细胞向神经分化潜能的影响[J]. 中国药理学通报, 2017, 33(7): 950-5. Lu Z W, Wang L, Zhang L Y, et al. Effect of Astragalus polysaccharides on the neural differentiation potential of bone marrow mesenchymal stem cells under ionizing radiation[J]. Chin Pharmacol Bull, 2017, 33(7): 950-5. |
| [2] | Ding N, He J P, Wang J F, Zhou G M. Cancer risk of high-charge and -energy ions and the biological effects of the induced secondary particles in space[J]. Rend Fis Acc Lincei, 2014, 25: 59. |
| [3] | 苏燎原, 汪涛, 马祥瑞, 等. 60钴γ线对骨髓、脾脏造血细胞DNA和RNA合成能力的影响[J]. 细胞生物学杂志, 1981, 3(4): 28-31. Su L Y, Wang T, Ma X R, et al. Effects of 60cobalt gamma rays on the synthesis of DNA and RNA in hematopoietic cells of bone marrow and spleen[J]. J Cell Biol, 1981, 3(4): 28-31. |
| [4] | Zhao L, Wang Y, Shen H L, et al. Structural characterization and radioprotection of bone marrow hematopoiesis of two novel polysaccharides from the root of Angelica sinensis (Oliv.)[J]. Diels Fitoterapia, 2012, 83(8): 1712-20. doi:10.1016/j.fitote.2012.09.029 |
| [5] | Wang J, Ge B, Li Z, et al. Structural analysis and immunoregulation activity comparison of five polysaccharides from Angelica sinensis[J]. Carbohydr Polym, 2016, 140: 6-12. doi:10.1016/j.carbpol.2015.12.050 |
| [6] | 张先平, 王乾兴, 陈斌, 等. 当归多糖抑制氧化损伤延缓造血干细胞衰老[J]. 中国中药杂志, 2013, 38(3): 407-12. Zhang X P, Wang Q X, Chen B, et al. Angelica sinensis polysaccharides delay aging of hematopoietic stem cells through inhibitting oxidative damge[J]. China J Chin Mater Med, 2013, 38(3): 407-12. |
| [7] | 张鹤, 张英强, 梅建伟, 等. 补肾强肝活血法对缺血/再灌注大鼠RBC、HGB及骨髓有核细胞计数的影响[J]. 医学研究杂志, 2010, 39(10): 33-6. Zhang H, Zhang Y Q, Mei J W, et al. Effects of Bushenqiangganhuoxue therapy on RBC, HGB and karyote medullares count in ischemia-reperfusion rats[J]. J Med Res, 2010, 39(10): 33-6. doi:10.3969/j.issn.1673-548X.2010.10.013 |
| [8] | 李明, 余祖胤, 邢爽, 等. 大剂量粒细胞集落刺激因子对2.3Gy中子γ射线混合照射比格犬存活和造血重建的影响[J]. 中国实验血液学杂志, 2011, 19(4): 991-8. Li M, Yu Z Y, Xing S, et al. High dose granulocyte colony-stimulatingfactor enhances survival and hematopoietic reconstruction in canines irradiated by 2.3Gy mixed fission neutron and gamma ray[J]. J Exp Hematol, 2011, 19(4): 991-8. |
| [9] | 吴安庆, 陈秋, 刘伟, 等. X射线全身照射对小鼠免疫系统的损伤效应[J]. 现代免疫学, 2013, 33(3): 193-6. Wu A Q, Chen Q, Liu W, et al. Effects of X ray whole body irradiation on immune system in mice[J]. Curr Immunol, 2013, 33(3): 193-6. |
| [10] | 王旭东, 饶家荣, 施大聪, 等. 马红细胞免疫功能的研究[J]. 甘肃农业大学学报, 1992, 27(1): 16-20. Wang X D, Rao J R, Shi D C, et al. Study on the immune function of equine erythrocytes[J]. J Gansu Agric Univ, 1992, 27(1): 16-20. |
| [11] | 杨铁虹, 贾敏, 梅其炳. 当归多糖对小鼠免疫功能的调节作用[J]. 中成药, 2005, 27(5): 563-5. Yang T H, Jia M, Mei Q B. Regulating effect of Angelica polysaccharide on immune function in mice[J]. Propriet Chin Med, 2005, 27(5): 563-5. |
| [12] | 张晓君, 祝晨蔯, 胡黎, 等. 当归多糖的免疫活性和对造血功能影响[J]. 中药药理与临床, 2002, 18(5): 24-5. Zhang X J, Zhu C C, Hu L, et al. Immunological activity of Angelica sinensis polysaccharides and its influence on hematopoietic function[J]. Pharmacol Clin Chin Mater Med, 2002, 18(5): 24-5. |
| [13] | 何晓莉, 张雁, 吴宏, 姜蓉. 当归多糖对辐射损伤小鼠造血系统保护作用的研究[J]. 重庆医学, 2012, 41(35): 3734-6. He X L, Zhang Y, Wu H, Jiang R. Studys of Angelica polysaccharides on the protection of ionizing radiation in injured mice[J]. Chongqing Med, 2012, 41(35): 3734-6. doi:10.3969/j.issn.1671-8348.2012.35.019 |
| [14] | 高明泽, 徐文慧, 王天琪, 等. 急性辐射损伤的中医病因学探讨[J]. 中医杂志, 2016, 57(6): 454-7. Gao M Z, Xu W H, Wang T Q, et al. Etiological study of acute radiation injury in Chinese medicine[J]. J Tradit Chin Med, 2016, 57(6): 454-7. |
| [15] | 张先平, 王乾兴, 陈斌, 等. 当归多糖抑制氧化损伤延缓造血干细胞衰老[J]. 中国中药杂志, 2013, 38(3): 407-12. Zhang X P, Wang Q X, Chen B, et al. Angelica polysaccharide inhibits oxidative damage and delays the aging of hematopoietic stem cells[J]. Chin J Tradit Chin Med, 2013, 38(3): 407-12. |
| [16] | 程尧, 王凯平, 李强, 等. 当归多糖对H22荷瘤小鼠肿瘤生长及体内铁代谢的影响[J]. 中国医院药学杂志, 2015, 35(15): 1359-63. Chen R, Wang K P, Li Q, et al. Effects of Angelica sinensis polysaccharides on tumor growth and iron metabolism in H22 tumor bearing mice[J]. Chin Hosp Pharm J, 2015, 35(15): 1359-63. |
| [17] | 耿卫朴, 徐曼, 罗祎, 等. 灵芝多糖和当归多糖促进人外周血T淋巴细胞增殖和分泌IFN-γ[J]. 中国药理学通报, 2012, 28(5): 655-8. Geng W P, Xu M, Luo Y, et al. Ganoderma lucidum polysaccharides and Angelica polysaccharides promote the proliferation and secretion of IFN-gamma in peripheral blood T lymphocytes[J]. Chin Pharmacol Bull, 2012, 28(5): 655-8. |
| [18] | Wang K, Tang Z, Zheng Z, et al. Protective effects of Angelica sinensis polysaccharide against hyperglycemia and liver injury in multiple low-dose streptozotocin-induced type 2 diabetic BALB/c mice[J]. Food Funct, 2016, 7(12): 4889-97. doi:10.1039/C6FO01196A |