


2. 福州大学 化学学院, 福建 福州 350116;
3. 福州大学 福建省医疗器械与医药技术重点实验室, 福建 福州 350116
2. College of Chemistry, Fuzhou University, Fuzhou 350116, China;
3. Fujian Key Lab of Medical Instrument & Pharmaceutical Technology, Fuzhou University, Fuzhou 350116, China
海蛾(Pegasus laternarius Cuvier),又名海麻雀,隶属于辐鳍鱼纲(Class Actinopterygi),鲈形鱼系(Series Percomorpha),海蛾鱼目(Pegasiformes),海蛾鱼属(Pegasus LinnePlus)[1],是一种海洋底层性生活的小型鱼类,广布于西太平洋及印度洋热带、亚热带水域,一般栖息于暖水性浅海的底层。我国广东、福建一带海域分布较多,其干燥实体为我国传统名贵中药材,性味咸、温,具散结、消肿、解毒之功效。民间常作为温补药材使用。近年来研究发现[2],海蛾鱼体含多种生物活性物质,并进行了多方面药理活性研究。许实波等[3]研究了海蛾提取物的抗血栓活性,结果表明海蛾提取物能够明显抑制大鼠实验性颈动脉血栓的形成,以及诱导剂所致脑血栓的形成,提示海蛾提取物具有明显的抗血栓活性;唐孝礼等[4]研究发现,海蛾提取物可使氢化可的松或环磷酰胺所致免疫力低下的小鼠脾脏和胸腺重量增加,提示海蛾提取物具有提高免疫力的活性;Li等[5]研究发现,海蛾提取物能够明显提高体外培养神经细胞的存活率,对神经细胞突起的生长有明显的促进作用,并对兴奋性氨基酸诱导凋亡、过氧化氢损伤和血清剥夺损伤等3种中枢神经系统细胞损伤具有一定的保护作用,其机制与提高细胞内源性超氧化物歧化酶(superoxide dismutase,SOD)活性,防止脂质过氧化反应有关。虽然我国传统医学中有将海蛾用于肿瘤治疗的记载[6],但有关海蛾活性组分抗肿瘤及其机制探讨方面的研究鲜见报道。本研究以生物活性追踪法提取分离海蛾中可抑制人宫颈癌HeLa细胞的活性组分,并对其抑制肿瘤细胞增殖及诱导凋亡的作用机制进行了探讨。
1 材料与方法 1.1 细胞与试剂人宫颈癌HeLa细胞株购于中国科学院上海典藏细胞库;海蛾药材干品购于福州同春中药有限公司,产自广东汕头海域,由福州大学药物生物技术与工程技术研究所鉴定为短尾海蛾鱼;DMEM培养基、胎牛血清、胰蛋白酶(美国Hyclone公司);二甲基亚砜(DMSO)、MTT,购自美国Sigma公司;吖啶橙/溴乙锭(AO/EB)、碘化丙啶(propidium iodide, PI)、Annexin V-FITC/PI染色试剂盒、RIPA细胞组织裂解液(强)、PMSF蛋白酶抑制剂,购自南京凯基生物技术公司;兔抗人Survivin、Bcl-2、Bax多克隆抗体、兔抗人β-actin单克隆抗体,购自武汉Proteintech公司;超敏ECL、caspase-3活性检测试剂盒、BCA试剂盒,购自北京鼎国生物技术公司;其他化学试剂均为分析纯,购于国药集团化学试剂有限公司。
1.2 仪器CO2培养箱(550型,美国Nuaire公司);流式细胞仪(COULTER EPICS XL型,美国Beckman公司);倒置显微镜(XDS-1B型,重庆光电公司);荧光显微镜(50i型,日本Nikon公司);酶标仪(CENios型,瑞士Tecan公司);全自动凝胶成像分析仪(JS-380C型,上海培清);冷冻离心机(Z323K型,德国Hermle)。
1.3 海蛾抗肿瘤活性组分的分离采用生物活性追踪法对海蛾抗肿瘤组分进行分离。海蛾干品研磨粉碎后,以料液比1 :15(W/V)90%乙醇45℃提取3 h,提取3次,合并提取液。提取液45℃减压浓缩至膏状,得粗提物,-20℃保存。膏状粗提物用丙酮溶解后,与少量硅胶混合,挥发丙酮至干,上硅胶柱,分别采用石油醚、乙酸乙酯、甲醇、50%甲醇/水作为洗脱剂进行洗脱,各洗脱2床层体积(bed volume, Bv),分别收集洗脱液,经减压浓缩真空干燥后,分别得到A1、A2、A3、A4 4个组分。对其中肿瘤细胞抑制活性最高的A2继续进行硅胶柱层析,洗脱剂分别为石油醚、乙酸乙酯和甲醇,各洗脱2 Bv,得到B1、B2、B3 3个组分。对其中活性最高的B2组分继续进行Sephadex LH-20柱层析分离,洗脱剂以氯仿/甲醇5 :5、4 :6、3 :7、2 :8、1 :9的比例阶梯洗脱,各洗脱0.5 Bv,紫外检测器在线检测,检测波长为254 nm,根据洗脱谱图,得到C21、C22、C23 3个组分。后续对其中活性最高的C22进行各项研究。
1.4 MTT法测定受试物对HeLa细胞增殖的抑制作用人宫颈癌HeLa细胞,用DMEM培养基(含15% FBS、100 kU·L-1链霉素、100 kU·L-1青霉素),置于5% CO2、37℃培养箱中培养,每48 h换液1次。取对数生长期的细胞,用0.25%胰酶消化,制备细胞悬液,密度调整至1×108·L-1,每孔100 μL,接种于96孔板,继续培养24 h,随后转换成含各受试物的无血清培养基,继续培养24~48 h。培养板吸去培养基,加入含5 g·L-1 MTT的无血清、无酚红培养基,继续培养4 h,吸弃MTT溶液,加入DMSO溶解所形成的甲臜晶体,570 nm测定吸光度值。
细胞抑制率/%=(对照组吸光值-处理组吸光值)/对照组吸光值×100%
1.5 AO/EB染色观察细胞凋亡形态将处于对数生长期的生长状态良好的HeLa细胞接种于12孔板中,5×104个/孔,进行载玻片爬片培养。待细胞完全贴壁生长后,吸弃旧培养基,分别加入终浓度为20、40、60 mg·L-1的组分C22,并设空白对照组。培养48 h后,吸出培养基,PBS漂洗1次。将AO与EB染料等体积混合成工作染液,向盖玻片上滴加20~100 μL 1 :100稀释的AO/EB染料,避光染色2 min,PBS洗2~3次,每次数秒。510 nm激发波长,荧光显微镜下观察。
1.6 PI染色检测细胞周期分布取对数生长期的HeLa细胞接种于6孔板中,2.0×105个/孔。培养24 h后,培养基换为分别含C22组分10、20、40、60 mg·L-1的无血清培养基,培养48 h后,胰酶消化,2 000 r·min-1×5 min离心收集细胞,PBS洗2次。加1 mL预冷的70%乙醇,于-20 ℃固定12 h,离心收集细胞。按照PI试剂盒说明书操作,对细胞进行PI染色。200目尼龙网过滤,488 nm激发波长,流式细胞仪检测,每次检测收集104个细胞。实验数据由Multicycle for Windows软件分析。
1.7 Annexin V-FITC/PI双染分析细胞凋亡于6孔板中,用含C22分别为5、10、20、40、60 mg·L-1的无血清培养基处理细胞48 h。胰酶消化,2 000 r·min-1×5 min离心收集细胞,PBS洗2次。后续按照Annexin V-FITC/PI试剂盒说明书操作,对细胞进行染色。流式细胞仪检测、分析。激发波长488 nm,发射波长530 nm,FITC标记Annexin V的绿色荧光通过FITC通道(FL1) 检测,PI红色荧光通过PI通道(FL3) 检测。
1.8 细胞caspase-3酶活性分析将处于对数生长期的细胞,按2×105个/孔的密度接种于6孔培养板中,设置空白对照组,培养24 h后,分别加入不同浓度的C22处理细胞48 h,收集蛋白,采用caspase-3酶活性检测试剂盒检测,按照试剂盒说明书操作。
1.9 Western blot分析凋亡相关蛋白的表达取对数生长期的HeLa细胞接种于6孔板中,2.0×105个/孔。培养24 h后,培养基换为分别含C22组分20、40、60 mg·L-1的培养基,培养48 h后,用4℃预冷PBS洗涤细胞2次,吸弃洗液,置于冰上。用细胞刮刀刮下细胞,用预冷PBS收集,4 000×g离心2 min收集细胞。按每106个细胞100 μL加入含PMSF的RIPA裂解液,于冰上充分裂解。于4℃ 12 000×g离心5 min,取上清用于后续实验。蛋白浓度采用BCA试剂盒测定,每份定量为10 μg总蛋白,SDS-PAGE电泳分离蛋白,电转移至PVDF膜。PVDF膜与一抗于4℃孵育过夜,之后用相应HRP标记的二抗37℃孵育1 h。室温下用TBST振荡洗涤3次,每次10 min。将ECL化学发光底物A、B液等体积混合后,与膜蛋白面充分接触。之后将膜移至保鲜膜上,放入X线片夹中,于暗室中,曝光10~30 min。取出X线片,显影,定影,冲去残留定影液,室温下晾干。X胶片用凝胶成像系统拍照。
1.10 数据处理采用Origin软件单因素方差(One-way ANOVA)和Tukey′s检验,结果用x±s表示。
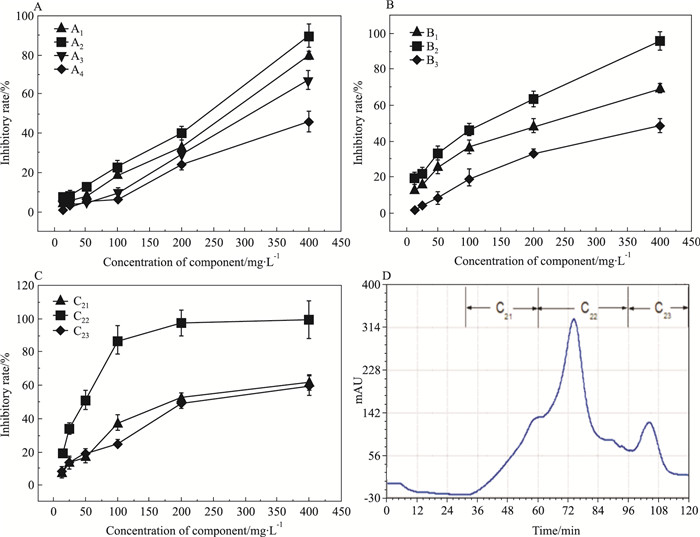
2 结果 2.1 海蛾抑制HeLa细胞增殖活性组分的分离采用生物活性追踪法分离海蛾的抗肿瘤组分。2.7 kg海蛾药材经干燥、粉碎后得到2.33 kg粉状物,采用90%乙醇浸提得到310.2 g粗提物,得率为13.33%。粗提物经第1轮硅胶柱层析后得到A1、A2、A3、A4 4个组分,各组分得率和对HeLa细胞抑制IC50如Tab 1和Fig 1A所示,其中组分A2抑制活性最强,IC50值为182.4 mg·L-1,对其继续进行分离。对A2组分进行第2轮硅胶柱层析,得到B1、B2、B3 3个组分,各组分得率和对HeLa细胞抑制IC50如Tab 1和Fig 1B所示,其中组分B2抑制活性最强,IC50值为83.8 mg·L-1,对其继续进行分离。对组分B2进行第3轮Sephadex LH-20柱层析,洗脱图谱如Fig 1D所示,得到C21、C22、C23 3个组分,其得率和IC50值如Tab 1和Fig 1C所示。其中C22组分抑制活性最强,IC50值达到36.3 mg·L-1。因此,本实验后续研究以C22为受试物,考察其对HeLa细胞增殖的抑制作用及诱导细胞凋亡的作用机制。
| Component | Mass/g | Yield | IC50/mg·L-1 |
| A1 | 112.47 | 4.83% | 235.6±11.3 |
| A2 | 58.10 | 2.5% | 182.4±6.1 |
| A3 | 97.56 | 4.19% | 299.1±12.1 |
| A4 | 24.15 | 1.04% | 435.8±25.6 |
| B1 | 1.07 | 0.5‰ | 180.9±7.4 |
| B2 | 4.87 | 2.1‰ | 83.8±8.3 |
| B3 | 65.50 | 28.1‰ | 398.8±14.6 |
| C21 | 0.86 | 0.37‰ | 209.8±6.7 |
| C22 | 1.71 | 0.73‰ | 36.3±6.3 |
| C23 | 0.62 | 0.27‰ | 249.1±8.4 |
|
| Fig 1 Inhibitory ratios of all fractions on HeLa cells and chromatography of Sephadex LH-20 A:Inhibitory ratios of A series fractions on HeLa cells; B: Inhibitory ratios of B series fractions; C: Inhibitory ratios of C series fractions; D: Sephadex LH-20 chromatograph of C fractions |
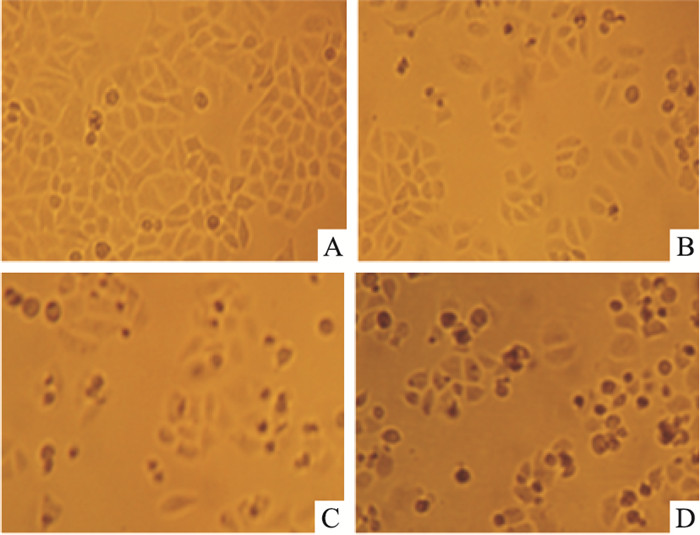
不同浓度的组分C22处理HeLa细胞48 h后,于倒置显微镜下观察细胞形态,结果如Fig 2所示。对照组细胞形态均一,呈明显的梭形结构。随着药物浓度的增加,细胞形态发生变化,梭形细胞数量逐渐减少,细胞形态逐渐变圆或固缩,细胞碎片增多。当药物浓度达到40 mg·L-1时,细胞数量明显减少,固缩细胞增多,视野内可明显观察到细胞碎片。至60 mg·L-1时,大部分细胞生长受到抑制。
|
| Fig 2 Morphological observation of HeLa cells treated with different concentrations of component C22 for 48 h(×100) A: Control; B: C22 20 mg·L-1; C: C22 40 mg·L-1; D: C22 60 mg·L-1 |
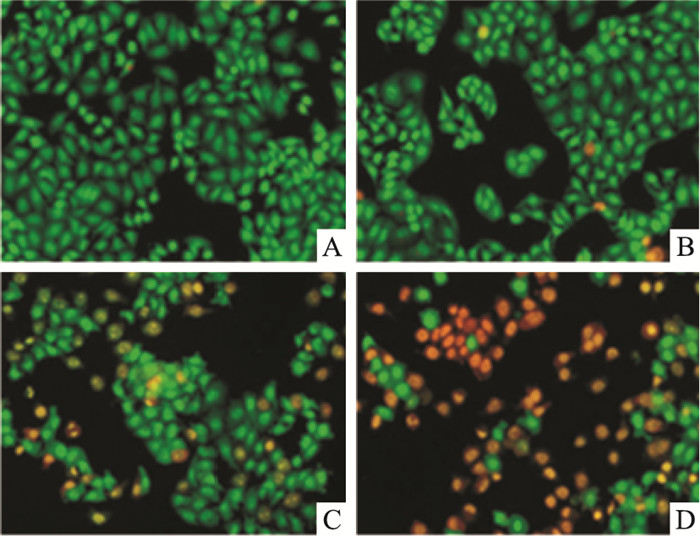
AO/EB染色法观察,正常细胞呈明显梭状结构,显绿色荧光,细胞核与细胞质区分明显,荧光深浅不一。如Fig 3所示,正常对照细胞呈梭形结构,显绿色荧光,轮廓清晰,大小形态较单一;药物作用浓度20 mg·L-1条件下,少量细胞所染绿色不均匀、较模糊,细胞出现长条形、新月形等不规则形态,此即为早期凋亡细胞;至60 mg·L-1时,大部分细胞进入凋亡晚期,呈固缩状或圆珠状,显橘红色荧光,染色质固缩,细胞核碎裂成点状,大小不一。结果表明,组分C22诱导HeLa细胞凋亡,具有剂量依赖性趋势。
|
| Fig 3 Apoptotic morphology of HeLa cells treated with component C22 for 48 h by AO/EB staining A:Control; B:C22 20 mg·L-1; C:C22 40 mg·L-1; D:C22 60 mg·L-1 |
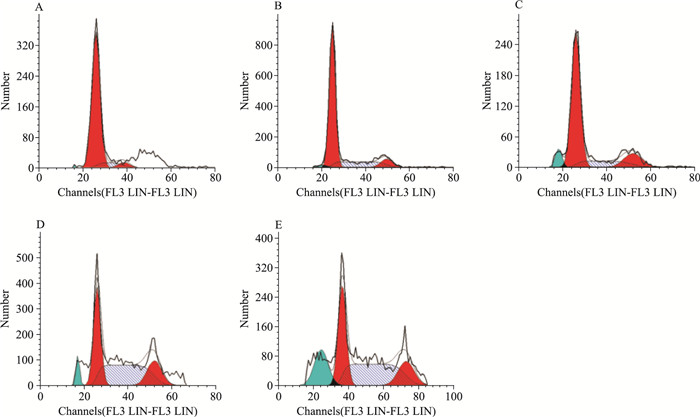
经PI试剂盒染色处理后,采用流式细胞仪分析不同浓度的C22作用于HeLa细胞48 h后的细胞周期分布情况。如Fig 4所示,随着组分C22浓度的增加(10~60 mg·L-1),处于亚二倍期(Sub-G0/G1)的细胞所占比例明显增加(1.4%~19.7%),而处于其他期的细胞数量逐渐减少,表明组分C22对HeLa细胞具有诱导凋亡作用,其诱导凋亡作用与剂量呈正相关。
|
| Fig 4 Effect of cell cycle distributions of HeLa cells treated with different concentrations of component C22 A:Control; B:C22 10 mg·L-1; C:C22 20 mg·L-1; D:C22 40 mg·L-1; E:C22 60 mg·L-1 |
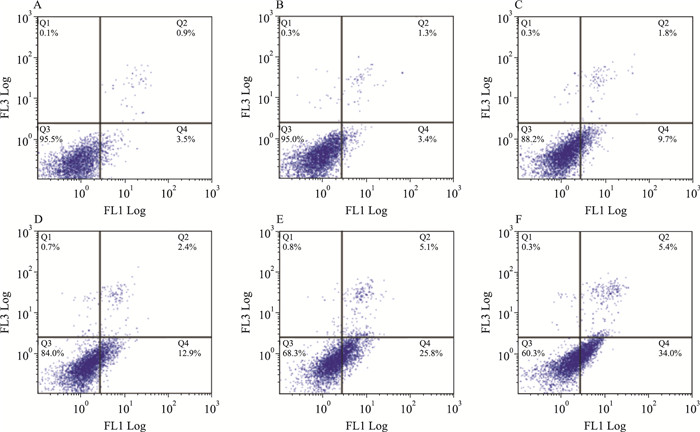
Annexin V-FITC/PI试剂盒分析不同浓度的组分C22处理HeLa细胞48 h的凋亡情况。如Fig 5所示,对照组正常细胞占细胞总数的95.5%。20 mg·L-1的组分C22作用于HeLa细胞48 h后,正常细胞占细胞总数的84%,12.9%的细胞处于凋亡前期,显现出一定的诱导凋亡作用。随着药物浓度的增大,正常细胞比例下降,凋亡率逐渐增加,当C22浓度提高至60 mg·L-1时,处理48 h的HeLa细胞的总凋亡率(Q2+Q4) 上升到39.4%,正常细胞仅占细胞总数的60.3%,明显低于低浓度组,表明组分C22诱导HeLa细胞凋亡作用具有剂量依赖性。
|
| Fig 5 The apoptosis-inducing effect of component C22 tested by AnnexinV/PI staining assay A:Control; B:C22 5 mg·L-1; C:C22 10 mg·L-1; D:C22 20 mg·L-1; E:C22 40 mg·L-1; F:C22 60 mg·L-1 |
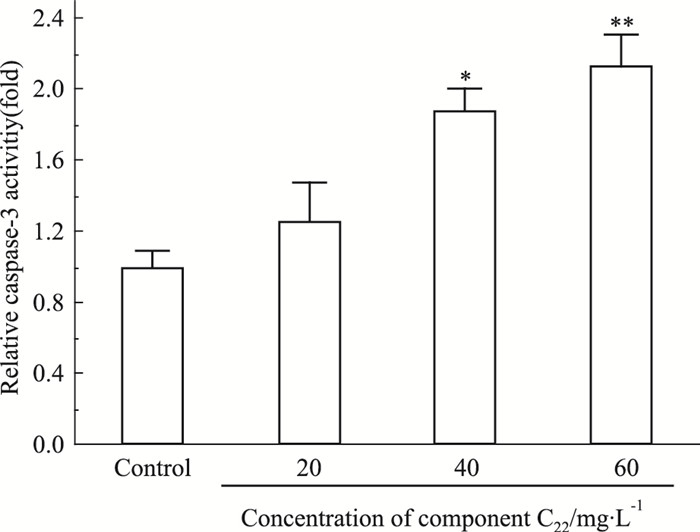
Caspase-3酶活性的上升是细胞凋亡进程中的重要事件,能反映细胞的凋亡状态[7],本研究分析了C22对HeLa细胞caspase-3总酶活性的影响。如Fig 6所示,与阴性对照组比较,随组分浓度的逐渐增大,caspase-3酶活性逐渐升高,C22 40、60 mg·L-1时,总酶活性分别是阴性对照组的1.8倍和2.1倍,差异有显著性。表明组分C22可能是通过caspase-3依赖途径,诱导HeLa细胞发生凋亡。
|
| Fig 6 The relative caspase-3 activity in HeLa cells treated with C22 *P < 0.05, **P < 0.01 vs control |
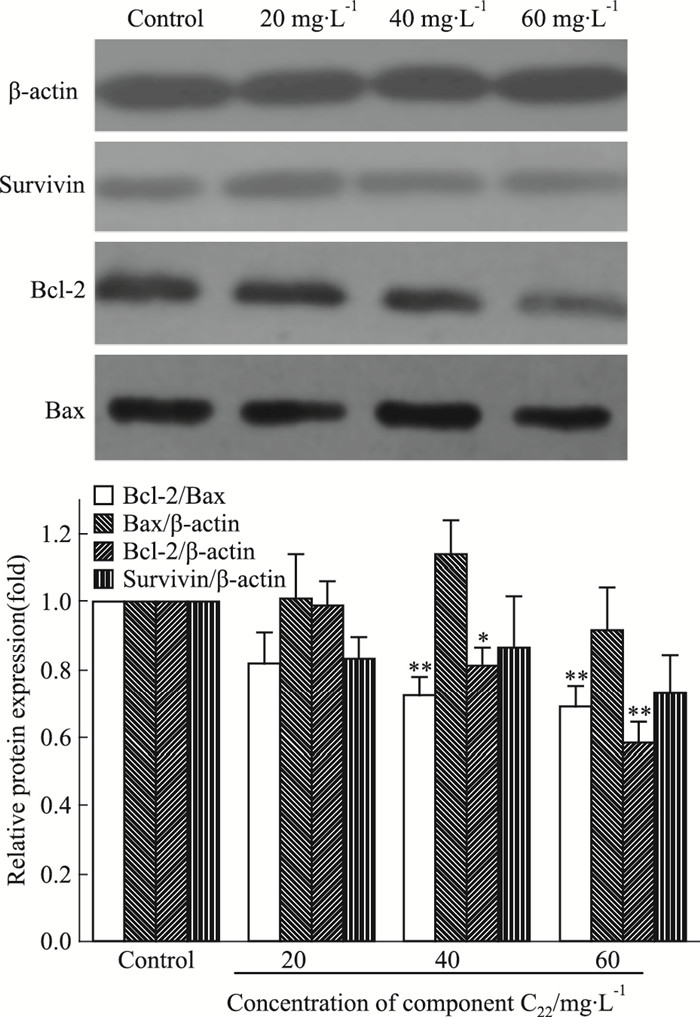
通过Western blot法分析了C22处理对于细胞凋亡进程中重要蛋白Survivin、Bcl-2、Bax表达的影响。如Fig 7所示,随着组分C22浓度的升高,Bcl-2蛋白含量明显降低,而Survivin蛋白含量降低不明显,Bax蛋白含量无明显变化,但Bcl-2/Bax比例明显降低。提示C22作用于HeLa细胞后,能通过抑制Bcl-2基因的表达,促进细胞凋亡。
|
| Fig 7 Effects of C22 on expression of Survivin, Bcl-2 and Bax proteins in HeLa cells *P < 0.05, **P < 0.01 vs contro |
本研究以海蛾药材为原料,采用生物活性追踪法,经乙醇浸提、硅胶树脂柱层析、Sephadex LH-20柱层析等分离手段,得到了一个对HeLa细胞具有较强抑制活性和诱导凋亡作用的组分C22。经AO/EB染色荧光分析细胞形态、PI染色流式细胞术分析细胞周期分布、Annexin V-FITC/PI染色流式细胞术分析细胞凋亡等实验,确认了C22组分对HeLa细胞的诱导凋亡作用,且具有剂量依赖性。
诱导细胞产生凋亡有多种机制,凋亡信号的传导途径有线粒体途径、死亡受体途径、内质网途径等[8-10],其中以线粒体途径和死亡受体途径为主,对其研究也最多[7]。Bcl家族蛋白是一类凋亡进程的重要调节因子,可调控释放细胞色素C,启动caspase级联反应,最终导致凋亡的发生。Bcl-2蛋白作为细胞凋亡的抑制基因,在caspase级联放大与线粒体之间扮演着“桥梁”的作用[7, 11]。在多种人源肿瘤细胞株可观察到Bcl-2过度表达[7, 12],而在分化细胞或将凋亡细胞中表达量很低或不表达。Caspase-3是caspase级联反应中的关键执行分子,其功能涉及细胞DNA碎片、染色质凝聚和凋亡小体的形成[13-14]。在细胞发生凋亡阶段,caspase-3被激活,裂解相应的胞内底物,最终导致细胞凋亡发生[15]。故caspase-3总酶活力的提高是细胞凋亡中的重要事件,对于鉴定药物的诱导凋亡作用具有重要的意义。本研究通过分析肿瘤细胞caspase-3酶活性、凋亡相关控制基因的蛋白表达水平,对C22诱导HeLa细胞凋亡机制进行了初步探讨。结果表明,C22处理细胞能明显提高肿瘤细胞的caspase-3酶活性,降低凋亡抑制基因Bcl-2的表达水平及胞内Bcl-2/Bax比例,促进细胞凋亡,与剂量呈正相关。
综上所述,本研究采用生物活性追踪法,从海蛾中分离得到一个对人宫颈癌HeLa细胞增殖具有较强抑制作用的组分C22,其得率为0.73‰,IC50为45.3 mg·L-1。C22可能通过Bcl-2/caspase途径诱导HeLa细胞产生凋亡。
( 致谢: 本实验在福州大学药物生物技术与工程研究所实验室完成,感谢郭养浩教授和在本课题研究中给予帮助的老师和同学。)
| [1] | 李明德. 鱼类分类学[M]. 青岛: 海洋出版社, 1998: 158-9. Li M D. Fish taxonomy[M]. Qingdao: China Ocean Press, 1998: 158-9. |
| [2] | 李瑞声, 陈卓亮, 龙康侯, 等. 海洋药物海蛾化学成分的研究[J]. 中山大学学报(自然科学版), 1993, 32(3): 132-3. Li R S, Chen Z L, Long K H, et al. Studies on the chemical constituents of the Chinese Pegasus laternarius Cuvier[J]. Acta Sci Nat Univ Sunyatsen, 1993, 32(3): 132-3. |
| [3] | 许实波, 周军, 李瑞声. 海蛾提取物的抗血栓作用研究[J]. 中山大学学报论丛, 1994(6): 23-7. Xu S B, Zhou J, Li R S. Study on antithrombotic effect of extract from Pegasus laternarius Cuvier[J]. J Sun Yatsen Univ, 1994(6): 23-7. |
| [4] | 唐孝礼, 颜光美, 许实波. 海蛾提取物对小鼠免疫器官重量和抗应激能力的影响[J]. 中药材, 1999, 6(22): 300-3. Tang X L, Yan G M, Xu S B. Effects of extracts from Pegasus laternarius on the weight of immune organs and the antistress in mice[J]. Chin Tradit Herb Drug, 1999, 6(22): 300-3. |
| [5] | Li M, Chen M, Huang H, et al. Neuroprotective effects of active ingredients isolated from Pegasus laternarius on cultured cerebral neurons[J]. Cell Mol Neurobiol, 2011, 31(1): 73-82. doi:10.1007/s10571-010-9555-3 |
| [6] | 上海医药工业研究院. 中国药用海洋生物[M]. 上海: 上海人民出版社, 1977: 144-5. Shanghai Institute of Pharmaceutical Industry. Chinese medicinal marine organisms[M]. Shanghai: Shanghai People Press, 1977: 144-5. |
| [7] | Mohan C. Signal Transduction:A Short Overview of Its Role in Health and Disease[M]. Merck/EMD Biosciences, 2010: 67-72. |
| [8] | Buja L M, Eigenbrodt M L, Eigenbrodt E H. Apoptosis and necrosis, basic types and mechanisms of cell death[J]. Arch Pathol Lab Med, 1993, 117(12): 1208-14. |
| [9] | Brojatsch J, Naughton J, Rolls M M, et al. CARl, a TNFR-related protein is a cellular receptor for cytopathic avian leucosis-sarcoma viruses and mediates apoptosis[J]. Cell, 1996, 87(5): 845-52. doi:10.1016/S0092-8674(00)81992-3 |
| [10] | 宋金莲, 马中良, 迟晓伟, 等. 天然活性分子isatin经p53介导的线粒体途径诱导乳腺癌细胞MCF-7凋亡[J]. 中国药理学通报, 2016, 32(6): 773-8. Song J L, Ma Z L, Chi X W, et al. The endogenous oxindole isatin induces apoptosis of MCF-7 breast cancer cells through a p53-mediated mitochondrial pathway[J]. Chin Pharmacol Bull, 2016, 32(6): 773-8. |
| [11] | 孙秀玉, 刘立亚, 吴宥熹, 等. Bcl-2家族对线粒体质量控制的调控研究[J]. 中国药理学通报, 2015, 31(12): 1633-6. Sun X Y, Liu L Y, Wu Y X, et al. On mitochondrial quality control regulated by Bcl-2 family[J]. Chin Pharmacol Bull, 2015, 31(12): 1633-6. doi:10.3969/j.issn.1001-1978.2015.12.002 |
| [12] | 谯敏, 向廷秀, 王丕龙, 等. 靶向COX-2的siRNA抑制三种不同分化程度胃癌细胞生长及作用机制[J]. 第四军医大学学报, 2006, 27(14): 1318-21. Qiao M, Xiang T X, Wang P L, et al. Inhibitory effect of siRNA targeting COX-2 on the growth of gastric carcinoma cells of well, moderate or poor differentiation and its mechanism[J]. J Fourth Mil Med Univ, 2006, 27(14): 1318-21. doi:10.3321/j.issn:1000-2790.2006.14.022 |
| [13] | Kerr J F, Wyllie A H, Currie A R. Apoptosis a basic biological phenomenon with wide-ranging implications in tissue kinetics[J]. Brit J Cancer, 1972, 26(4): 239-57. doi:10.1038/bjc.1972.33 |
| [14] | Garrido C, Galluzi L, Brunet M, et al. Mechanism of cytochrome C release from mitochondria[J]. Cell Death Differ, 2006, 13(9): 1423-6. doi:10.1038/sj.cdd.4401950 |
| [15] | Cain K, Brown D G, Langlais C, et al. Caspase activation involves the formation of the aposome, a large(approximately 700kd) caspase-activating complex[J]. J Biol Chem, 1999, 274(32): 22686-92. doi:10.1074/jbc.274.32.22686 |

