


糖尿病(diabetes mellitus,DM)是一种以高血糖为主要特征的慢性代谢性疾病,其发病率逐年增高[2],并伴有多种并发症,涉及心脏、眼、肾脏、神经系统等[1]。有关DM中枢神经病变及其与血管病变的关系,近年正逐渐引起重视。文献报道,DM患者及DM动物模型中常伴有脑血流量(cerebral blood flow,CBF)减少的现象[2-3]。同时,有报道称临床DM患者脑血流量下降多出现在DM早期[4-5]。那么,DM大鼠脑血流下降发生在何时,呈现什么样的变化趋势,是否与糖尿病认知障碍发生发展有关,机制如何?为此,本论文采用链脲佐菌素(streptozocin,STZ)复制DM大鼠模型,在明确DM认知障碍大鼠脑血流量变化的基础上,动态监测DM大鼠模型建立后,额叶皮层血流量的连续变化,分析变化趋势,并初步探讨其变化的机制。
1 材料与方法 1.1 实验动物♂Wistar大鼠,SPF级,购自长春市亿斯实验动物技术有限责任公司。许可证号:SCXK(吉)-2011-0004,合格证号:201600012587。控制室温在(23±2)℃的范围内,相对湿度45%~55%,动物自由饮水摄食。
1.2 试剂与仪器链脲佐菌素(美国Sigma公司);水合氯醛(天津市光复精细化工研究所);内皮素-1(endothelin 1,ET-1) 试剂盒(上海酶联生物科技有限公司);一氧化氮合酶(nitric oxide synthase,NOS)试剂盒(南京建成生物科技有限公司);葡萄糖测定试剂盒(上海荣盛生物药业有限公司)。moorVMS双通道激光多普勒监测仪(英国Moor instruments公司);Stoelting标准型单臂脑立体定位仪(美国Stoelting公司);RT-6000酶标分析仪(RAYTO公司);T6紫外分光光度计(北京普析通用仪器有限责任公司);血糖仪(测利得雅思血糖仪公司)。
1.3 实验动物头颅预处理实验前1周,所有大鼠麻醉后俯卧,放置于脑立体定位仪上,固定头部,采取平颅固定法进行大鼠头颅的立体定位。之后头部剃毛,剪开头部皮肤2 cm,用过氧化氢擦拭清除软组织,暴露出颅骨。参照Paxions-Watson大鼠脑立体定位图谱(第6版)[6],确定额叶(FrA)位置(中心点为前囟前5 mm,矢状缝右侧旁开2 mm),为后期正式实验做准备。
1.4 麻醉、生物节律对脑血流量变化的影响 1.4.1 麻醉时间对脑血流量变化的研究取♂Wistar大鼠8只,体质量180~220 g,适应性喂养1周后,腹腔注射10%水合氯醛0.3 g·kg-1麻醉,用moorVMS激光多普勒血流检测仪(LDF)进行数据收集和处理,将多普勒光纤探头固定至额叶处,记录麻醉10、20、30、40、50 min后脑血流量,并在不同时间点均连续观测10 min,通过软件分析每10 min的平均脑血流量(Flux)、红细胞浓度(Conc)、红细胞运动速度(Speed)、回光强度(DC)。
1.4.2 生物节律对大鼠脑血流量变化的影响动物适应性喂养1周后,取♂Wistar大鼠9只,体质量180~220 g,在8 :00测定脑血流,连续测定3 d,随后在12 :00测定脑血流,连续测定3 d,最后在16 :00测定脑血流,连续测定3 d,观察日间不同时间点的Flux、Conc、Speed、DC变化。另取♂Wistar大鼠9只,分别在同一天8 :00、12 :00、16 :00 3个时间段测定Flux、Conc、Speed、DC,测定方法与“1.4.1”中步骤相同。
1.5 DM认知障碍大鼠脑额叶皮层血流量变化研究 1.5.1 动物模型建立34只♂ Wistar大鼠,体质量180~220 g。适应性喂养1周后,随机分为对照组(n=10)、DM模型组(n=24)。禁食不禁水16 h,以冰浴的柠檬酸-柠檬酸钠缓冲液将STZ粉末溶解,冰浴避光操作,新鲜配制1%的STZ溶液。模型组按照给药剂量60 mg·kg-1腹腔注射,冰上避光操作,10 min内注射完毕,避免STZ溶液失效。对照组腹腔注射相同剂量柠檬酸-柠檬酸钠缓冲液。
1.5.2 血糖水平连续测定STZ腹腔注射72 h后,测空腹血糖,实验前1 d更换垫料,禁食12 h,自由饮水。采用肝素化的毛细管,眼底静脉丛取血0.5 mL,3 500 r·min-1离心10 min,分离血浆,采用葡萄糖氧化酶法测定血糖,具体操作按试剂盒说明书进行。选择空腹血糖≥16.7 mmol·L-1动物纳入实验[7-8]。造模后d 30、45、60、80用血糖仪测定空腹血糖(fast blood glucose,FBG)。血糖恢复的动物剔除。
1.5.3 Morris水迷宫实验造模d 80对各组大鼠进行水迷宫实验,所有大鼠在正式实验前1 d,在不放平台及标记物的水迷宫中自由游泳2 min,以适应水中环境,避免大鼠应激反应。Morris水迷宫为直径150 cm、高50 cm的圆形水池,水池内壁被漆为黑色,水池被4个等距点分为4个象限,分别在4个象限池壁的中心贴上不同标记物,为三角形、正方形、圆形和五角星白色纸片。平台放入其中1个象限的中心,低于水面2 cm,控制水温在(23.0±2.0)℃。对大鼠进行Morris水迷宫学习训练,实验时将大鼠在除目标象限(平台所在象限)之外的3个象限随机面对池壁放入水中,记录大鼠的登台时间(逃避潜伏期,以下统称潜伏期)作为评价学习成绩的指标,潜伏期下降即学习成绩提高。大鼠在90 s内找到平台后,允许大鼠在平台上停留10 s,潜伏期为大鼠找到平台的时间;如果大鼠在90 s内未找到平台,则潜伏期记为90 s,然后将大鼠引导登上平台,允许其在平台上停留10 s,让其根据4个象限的参照物进行空间学习记忆,并减少大鼠紧张。每次训练完成后将大鼠取出擦干,以防止低体温造成的应激。
1.5.4 DM认知障碍大鼠脑额叶皮层血流量测定在模型建立d 90,大鼠腹腔注射10%水合氯醛0.3 g·kg-1麻醉,用moorVMS激光多普勒血流检测仪(LDF)进行数据收集和处理,将多普勒光纤探头固定至额叶处,麻醉20 min后,连续观测10 min,通过软件分析每10 min的平均Flux,并计算Flux/100 g=Flux÷大鼠体质量×100 g。
1.6 DM大鼠脑额叶皮层血流量的动态测定 1.6.1 DM模型建立另取34只♂Wistar大鼠,体质量180~220 g。适应性喂养1周后,随机分为对照组(n=10)、DM模型组(n=24)。造模方法见“1.5.1”。
1.6.2 血糖测定水平连续测定测定方法与“1.5.2”操作步骤相同。分别在造模后d 3、18、32、46、60、73用血糖仪测定FBG,造模后d 11、25、39、53、67用血糖仪测定随机血糖(random blood glucose,RBG)。
1.6.3 大鼠脑额叶皮层血流量的动态测定测定方法与“1.5.4”操作步骤相同。分别在造模d 0、7、14、21、28、35、42、56、75测定大鼠脑血流量,并计算Flux/100 g=Flux÷大鼠体质量×100 g。
1.7 大鼠脑脊液中NOS和ET-1的测定大鼠采用10%水合氯醛0.3 g·kg-1腹腔注射麻醉。将大鼠固定于脑立体定位仪上,保证操作台水平,两侧耳杆在同一直线,门齿杆较耳杆低0.33 cm。以食指摸后脑的三角区域,在三角区域上方插入已磨至2~3 mm的头皮针,末端连接1 mL注射器,慢慢抽取脑脊液。若未见脑脊液流出,可轻微旋转针体。采集脑脊液后,用ELISA法检测结构型一氧化氮合酶(constitutive nitric oxide synthasec,NOS)=神经型(neuronal nitric oxide synthase,nNOS)+内皮型(endothelial nitric oxide synthase,eNOS)、诱导型一氧化氮合酶(induced nitric oxide synthase,iNOS)和ET-1的浓度,各项指标测定严格参照试剂盒说明书操作。
1.8 统计学分析应用SPSS 21.0统计软件中方差分析进行数据资料处理,结果用x±s表示,当符合正态分布时,两组之间比较采用独立样本T检验,多组之间比较采用单因素方差分析检验;不符合正态分布时,组间比较则采用秩和检验。
2 结果 2.1 麻醉、生物节律对大鼠脑血流量的影响 2.1.1 麻醉后不同时间对大鼠脑血流量的影响大鼠在麻醉后10、20、30、40、50 min分别使用多普勒血流仪检测,由Tab 1可见,Flux、Conc、Speed、DC均没有明显变化(P>0.05),即在麻醉后10~50 min内选择任意时间开始检测脑血流均可。本研究在后续实验中,每只大鼠均在腹腔注射水合氯醛后20 min开始测脑血流量。
| Time | Flux/PU | Conc/AU | Speed/AU | DC/AU |
| 10 min | 148.03±24.08 | 178.83±21.73 | 44.34±4.56 | 77.79±12.02 |
| 20 min | 148.14±18.47 | 173.70±20.57 | 45.73±5.08 | 74.34±5.41 |
| 30 min | 150.41±17.80 | 181.09±28.49 | 44.69±4.24 | 73.64±6.22 |
| 40 min | 151.16±24.86 | 175.96±24.82 | 45.87±4.96 | 75.53±5.40 |
| 50 min | 146.27±29.16 | 167.26±25.75 | 46.37±7.17 | 77.26±6.23 |
Tab 2~4结果显示,大鼠日间、日内Flux、Conc、Speed、DC均没有明显变化(P>0.05)。生物节律对大鼠脑血流量的测定没有影响。
| Time | 8 :00 | 12 :00 | |||||||
| Flux/PU | Conc/AU | Speed/AU | DC/AU | Flux/PU | Conc/AU | Speed/AU | DC/AU | ||
| d 1 | 121.91±39.59 | 114.04±44.53 | 58.97±12.01 | 66.84±14.82 | 112.09±48.84 | 92.06±35.22 | 63.34±7.37 | 73.14±10.28 | |
| d 2 | 119.41±34.01 | 116.93±40.14 | 56.14±11.51 | 76.91±12.75 | 127.40±98.80 | 98.00±75.79 | 61.10±6.23 | 70.58±18.26 | |
| d 3 | 127.05±42.56 | 126.52±45.48 | 55.37±9.05 | 68.92±8.79 | 135.40±39.32 | 114.20±47.57 | 64.42±13.33 | 66.80±12.40 | |
| Time | Flux/PU | Conc/AU | Speed/AU | DC/AU |
| d 1 | 128.25±53.58 | 118.63±49.63 | 58.90±11.38 | 74.36±12.36 |
| d 2 | 133.81±36.28 | 112.61±45.38 | 65.21±12.89 | 68.81±12.25 |
| d 3 | 137.10±28.64 | 135.87±17.46 | 57.30±3.97 | 68.47±9.92 |
| Time | Flux/PU | Conc/AU | Speed/AU | DC/AU |
| 8 :00 | 134.78±56.96 | 99.00±17.46 | 71.32±23.65 | 70.12±7.30 |
| 12 :00 | 124.68±45.66 | 92.28±25.27 | 70.34±16.17 | 70.94±10.99 |
| 16 :00 | 130.52±49.42 | 109.80±33.35 | 63.42±6.91 | 71.06±7.85 |
本次实验以注射STZ 72 h后,空腹血糖≥16.7 mmol·L-1为成模标准,24只模型组大鼠,成模19只,成模率为79.2%。整个实验期间死亡8只,死亡率为42.1%。
2.2.2 DM大鼠空腹血糖变化如Fig 1所示,造模d 3、30、45、60、80,模型组大鼠的血糖明显高于对照组(P < 0.01),一直维持高血糖状态。
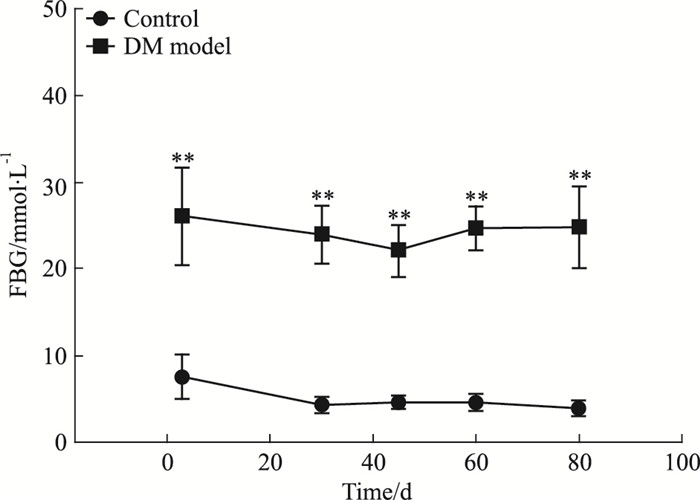
|
| Fig 1 Fast blood glucose level(x±s) **P < 0.01 vs control |
Tab 5水迷宫实验结果显示,DM大鼠从训练第6次开始,与对照组相比潜伏期明显延长(P < 0.01),并持续至训练第10次。DM大鼠在行为学上出现认知障碍表现。
| Group | n | Sixth | Seventh | Eighth | Ninth | Tenth |
| Control | 10 | 23.60±18.36 | 34.52±23.90 | 29.57±31.60 | 25.86±28.15 | 27.14±29.23 |
| DM | 11 | 69.03±29.88** | 69.32±30.64** | 60.12±32.95* | 67.02±31.48** | 71.44±19.22** |
| *P<0.05, **P<0.01 vs control | ||||||
DM认知障碍大鼠在造模d 90测定脑血流量变化,如Fig 2所示,与对照组相比,DM模型鼠脑血流量明显降低(P < 0.05)。
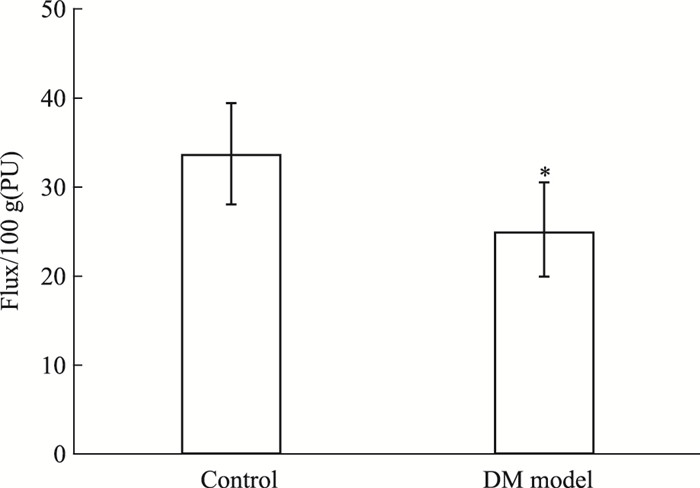
|
| Fig 2 Cerebral blood flow changes(x±s) *P < 0.05 vs control |
24只模型组大鼠,成模20只,成模率为83.3%,整个实验期间死亡6只,死亡率为30%。模型组的食量、水量,在造模的d 8、15、22、29、36、43、50、57、64均明显高于对照组。模型组体质量从造模d 15开始,与对照组相比差异有显著性,且模型组体质量在50 d内一直维持恒定(Tab 6)。
| Days | Food intake/g | Body weight/g | Water intake/mL | |||||
| Control(n=10) | DM(n=20) | Control(n=10) | DM(n=20) | Control(n=10) | DM(n=20) | |||
| d 0 | 25.37±2.89 | 23.61±4.22 | 246.86±19.64 | 248.79±23.43 | 36.13±10.10 | 38.97±11.52 | ||
| d 8 | 27.87±3.27 | 40.47±4.78** | 269.14±24.38 | 255.31±21.31 | 41.76±7.86 | 194.21±44.41** | ||
| d 15 | 31.24±3.45 | 42.42±4.61** | 312.86±17.83 | 259.50±25.63** | 48.13±4.03 | 195.24±38.36** | ||
| d 22 | 27.18±5.97 | 45.22±2.99** | 332.88±25.70 | 260.64±30.27** | 35.83±9.88 | 196.57±43.43** | ||
| d 29 | 22.91±1.55 | 43.67±3.40** | 353.14±39.23 | 264.86±27.55** | 38.00±10.59 | 219.27±54.63** | ||
| d 36 | 24.12±2.24 | 41.01±5.26** | 360.00±61.25 | 271.14±30.56** | 35.57±20.23 | 204.16±47.08** | ||
| d 43 | 26.45±4.42 | 42.76±9.32** | 388.20±33.71 | 270.36±33.03** | 59.40±13.14 | 192.44±46.20** | ||
| d 50 | 31.24±2.12 | 45.36±7.66** | 395.40±40.00 | 264.43±36.10** | 44.00±8.22 | 190.33±54.60** | ||
| d 57 | 26.90±0.51 | 44.15±7.00** | 408.40±41.27 | 267.61±37.73** | 47.00±6.39 | 187.00±49.55** | ||
| d 63 | 27.79±0.96 | 44.50±2.12** | 425.00±31.22 | 261.86±38.92** | 49.00±8.47 | 192.14±19.86** | ||
| d 74 | 26.38±2.70 | 44.17±3.37** | 423.75±26.44 | 266.86±39.52** | 52.50±8.66 | 215.71±60.94** | ||
| **P<0.01 vs control | ||||||||
模型组的FBG在造模的第72 h(注射STZ的d 4)、d 18、32、46、60、73均明显高于对照组(P < 0.01);模型组的RBG在造模的d 11、25、39、53、67均明显高于对照组(P < 0.01),见Fig 3、4。
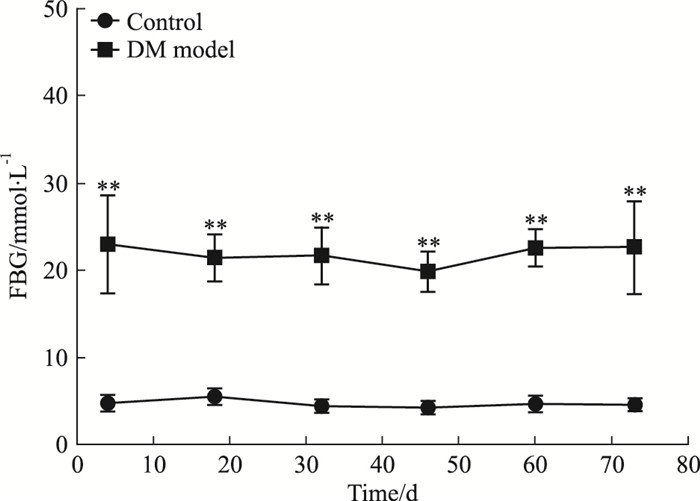
|
| Fig 3 Changes in fast blood glucose level(x±s) **P < 0.01 vs control |
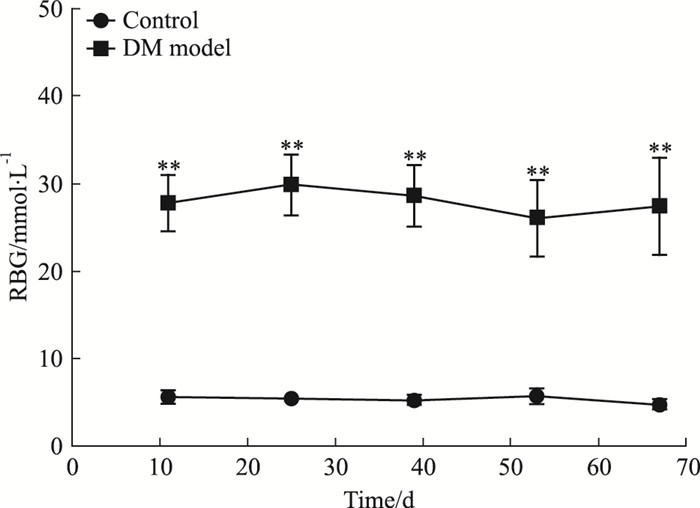
|
| Fig 4 Changes in random blood glucose level(x±s) **P < 0.01 vs control |
实验期间,对照组大鼠体质量有明显变化,为避免体质量对脑血流量的影响,脑血流量各指标均采用每100 g体重值比较(Tab 7)。DM模型建立75 d内,对照组Flux/100 g没有明显变化(P>0.05),模型组Flux/100 g在造模d 21自身比较有明显降低(P < 0.05),并持续至d 75。
| Group | n | d 0 | d 7 | d 14 | d 21 | d 28 | d 35 | d 42 | d 56 | d 75 |
| Control | 10 | 54.65±6.72 | 58.60±10.69 | 53.78±10.93 | 48.34±7.78 | 48.82±8.91 | 49.74±11.84 | 47.58±7.95 | 47.07±12.62 | 44.26±9.98 |
| DM model | 20 | 55.40±9.82 | 64.61±15.86 | 55.81±24.19 | 48.16±11.31* | 47.52±16.52* | 46.25±10.68* | 43.36±18.94** | 41.16±13.43** | 40.84±15.03** |
| *P<0.05, **P<0.01 vs d 7 | ||||||||||
如Tab 8所示,DM造模d 75,与对照组相比,模型组大鼠脑脊液中iNOS和cNOS明显升高(P < 0.05),ET-1明显下降(P < 0.01)。提示DM脑血流量的降低引发机体脑内发生自我保护反应。
| Group | n | iNOS/kU·L-1 | cNOS/kU·L-1 | ET-1/ng·L-1 |
| Control | 10 | 3.06±1.32 | 1.46±1.00 | 0.97±0.04 |
| DM | 20 | 6.02±2.85* | 7.65±5.31** | 0.87±0.04** |
| *P<0.05, **P<0.01 vs control | ||||
经颅多普勒较常用于大鼠脑血流量的检测,但是在实验过程中变化因素较多,麻醉时间、生物节律等是否会对大鼠脑血流量产生影响,尚不明确。为了客观描述这些因素对实验结果的干扰,本实验首先对以上两个方面对大鼠脑血流量的影响进行研究。结果发现,麻醉后10~50 min内,各时间点之间大鼠脑血流量没有明显变化,选择其中任意一个时间点开始检测脑血流量均可,在后期实验研究中选择注射水合氯醛20 min后开始检测脑血流量。人和动物都存在有规律的循环往复的周期性运动,即“生物节律”。本研究发现,在8 :00、12 :00、16 :00大鼠脑血流量无论是日间还是日内均没有明显变化。因此,生物节律对脑血流量的变化无影响,且麻醉次数对脑血流量也没有影响,日间每天麻醉1次、连续麻醉3 d、日内1 d麻醉3次,对脑血流量均没有影响。排除生物节律对脑血流量的影响后,为了进一步防止时间顺序可能造成的影响,在实验中又采用随机数字表抽取实验动物。
本实验采用STZ 60 mg·kg-1一次性大剂量注射复制DM大鼠模型,与对照组大鼠相比,DM大鼠在90 d内血糖升高并维持稳定,体质量下降,食量、水量均明显增多,符合DM大鼠模型特征[9-10]。通过经典的Morris水迷宫方法对两组大鼠进行学习和记忆能力的行为学评价,发现STZ诱导的DM模型大鼠较对照组大鼠潜伏期延长,出现学习记忆能力下降的表现。
脑血流量的变化是很多脑血管疾病的病理生理基础之一。DM患者和动物中多伴有脑血流量减少的现象[2-3],但DM认知障碍大鼠是否也有脑血流量的异常变化,未见报道。因此,本实验首先对DM认知障碍大鼠在模型建立d 90测定脑额叶皮层血流量,发现认知障碍大鼠脑额叶皮层血流量明显降低。但DM发生认知障碍前,大鼠脑血流量的动态变化轨迹以及何时出现脑血流量减少?实验进一步研究发现,DM大鼠在造模d 21 Flux/100 g开始出现明显减少,并持续至d 75,说明DM在发生认知障碍前脑血流量就出现明显降低,提示脑血流量的减少可能是导致DM发生认知障碍的因素之一。与临床中DM患者脑血流量下降出现在DM早期的结果相符[4-5]。脑血流指标均采用每100 g体重值比较,实验期间对照组大鼠体质量出现明显增多,为更科学地比较脑血流量变化,对照组与模型组均用Flux/100 g比较。
DM认知障碍大鼠脑血流量下降的原因尚不明确,脑缺血可以引发严重的神经损伤,影响病人的神经功能恢复和预后[11]。iNOS、cNOS和ET-1作为血管活性物质,检测其在脑脊液中的浓度发现,与对照组相比,DM大鼠cNOS、iNOS浓度明显升高,ET-1浓度明显下降,其原因可能是脑血流量的减少引发机体本身发生自我保护作用(即自身调节功能)所致;而DM脑脊液内cNOS、iNOS浓度升高,ET-1浓度下降,也可能是DM后期脑血流量不再持续下降的原因之一。iNOS作为病理性的一氧化氮合酶,其浓度增加可能使NO生成增多,NO作为活性氧,诱发氧化应激反应,脑内出现氧化损伤,进而造成脑组织的氧化损伤,这也可能是造成认知障碍的因素之一。脑血流量下降的原因可能是:① DM患者长期高血糖引起毛细血管基底膜增厚,患者中枢神经系统和外周神经纤维出现神经元退行性病变,神经元功能减退,葡萄糖利用减少而导致脑局部供血量不足[4-5];② DM患者常伴随脂质代谢紊乱,造成血液黏稠度升高,血流缓慢,基底膜糖类沉积,脂肪样和透明样变性,微小血管内皮细胞功能失调,长期DM患者的脑血流自动调节受损,导致脑血流减少[12];③ 患有DM时,有血内韦氏因子和血小板黏附力增加,对二磷酸腺苷、肾上腺素、胶原纤维、花生四烯酸的敏感性增加,血管收缩强烈,可明显增加血流阻力,使脑缺血程度明显加重,脑缺血时间明显延长。实验室将在后续实验中进一步对其下降机制进行研究。
| [1] | WHO. About diabetes[C]. Geneva, Switzerland:World Health Organization, 2014. |
| [2] | Kelly-Cobbs A I, Prakash R, Coucha M, et al. Cerebral myogenic reactivity and blood flow in type 2 diabetic rats:role of peroxynitrite in hypoxia-mediated loss of myogenic tone[J]. J Pharmacol Exp Ther, 2012, 342(2): 407-15. doi:10.1124/jpet.111.191296 |
| [3] | Duckrow R B, Beard D C, Brennan R W. Regional cerebral blood flow decreases during chronic and acute hyperglycemia[J]. Stroke, 1987, 18: 52-8. doi:10.1161/01.STR.18.1.52 |
| [4] | 张人玲, 关乐, 孙素花, 等. 糖尿病患者及糖尿病大鼠脑血流灌注的临床特点[J]. 中国医学影像技术, 2002, 18(1): 9-11. Zhang R L, Guang Y, Sun S H, et al. Clinical characteristics of 2DM patients and cerebral blood perfusion of diabetic rats[J]. Chin J Med Imaging Technol, 2002, 18(1): 9-11. |
| [5] | 齐颖, 张人玲. 糖尿病患者脑血流灌注及糖代谢的临床特点[J]. 中华糖尿病杂志, 2005, 13(4): 272-3. Qi Y, Zhang R L. Clinical characteristics of cerebral blood perfusion and metabolism of galactoside in type 2 diabetic patients[J]. Chin J Diabetes, 2005, 13(4): 272-3. |
| [6] | PaxinosG, WatsonC. 大鼠脑立体定位图谱(第6版)[M]. 北京: 人民卫生出版社, 2010. Paxinos G, Watson C. The rat brain in stereotaxic coordinates(6th edition)[M]. Beijing: People's Medical Publishing House, 2010. |
| [7] | 卢俞任, 刘义. 小剂量阿司匹林对糖尿病大鼠肾脏保护作用研究[J]. 中国动脉硬化杂志, 2013, 21(5): 419-23. Lu Y R, Liu Y. Renal protection research of low-dose aspirin in diabetic rats[J]. Chin J Arterioscler, 2013, 21(5): 419-23. |
| [8] | 赵圆宇, 王艺蓉, 徐彩婷, 等. 性别差异对1型糖尿病大鼠造模的影响[J]. 川北医学院学报, 2014, 29(5): 421-4. Zhao Y Y, Wang Y R, Xu C T, et al. Impact of gender difference in type 1 diabetic rats modeling[J]. J North Sichuan Med Coll, 2014, 29(5): 421-4. |
| [9] | 刘月婷, 杨明艳, 张爽, 等. STZ诱导的1型糖尿病大鼠模型稳定性及中医外观表征变化[J]. 中医药学报, 2016, 44(2): 43-5. Liu Y T, Yang M Y, Zhang S, et al. STZ-induced stability of type 1 diabetic rats and changes of TCM appearance[J]. Acta Chin Med Pharmacol, 2016, 44(2): 43-5. |
| [10] | 苏力担卡扎·仇曼, 何铁英, 林海, 等. 链脲佐菌素建立1型糖尿病大鼠模型的最优剂量研究[J]. 中国普外基础与临床杂志, 2016, 32(10): 1433-41. Xu S H, Kang C, Chen M L, et al. Dynamic expression of AQP4 in early stageof ischemia/reperfusion rats and cerebral edema[J]. Chin Pharmacol Bull, 2016, 32(10): 1433-41. |
| [11] | 许淑红, 康辰, 陈美灵, 等. 大鼠脑缺血/再灌注后早期AQP4的动态表达及其与脑水肿关系的研究[J]. 中国药理学通报, 2016, 31(2): 138-40. Sun Q, Yu Y, Hu Y C, et al. Advances in fMRI of brain changes in type 2 diabetic patients[J]. Radiol Pract, 2016, 31(2): 138-40. |
| [12] | 孙倩, 于瀛, 胡玉川, 等. 2型糖尿病脑改变的fMRI研究进展[J]. 放射学实践, 2016, 31(2): 138-40. |

