


2. 浙江大学医学院,浙江 杭州 310058
2. School of Medicine, Zhejiang University, Hangzhou 310058, China
急性肺损伤(acute lung injury,ALI)是心源性以外的各种肺内外致病因素导致的急性、进行性缺氧性呼吸衰竭,目前认为是由多种效应细胞如中性粒细胞、肺泡巨噬细胞和肺泡毛细血管内皮细胞等的活化,及其释放的细胞因子和多种炎症介质在肺内形成的网络作用所致[1]。探索新的减轻ALI的药物是ALI防治研究的活跃领域。环磷酸腺苷(cyclic AMP, cAMP)是细胞内的第二信使,cAMP对细胞代谢的调节是通过调节酶的活性来实现的,从而影响细胞、组织、器官的功能改变,本实验旨在探讨腺苷酸环化酶抑制剂和激动剂对脂多糖(lipopolysaccharide, LPS)诱导的小鼠急性肺损伤中的影响,并初步探讨其可能作用机制,为临床治疗ALI提供实验依据。
1 材料 1.1 动物ICR小鼠,♂,体质量19~21 g,清洁级,浙江大学医学院实验中心提供,合格证号:(SCXK2013-0016)。所有操作和实验流程均遵守《实验动物管理条例》。实验环境:恒温(22±2)℃,湿度60%~70%,自由饮水和进食。
1.2 试剂与仪器LPS(Escherichia coli LPS O55:B5,L2880);SQ22536(Sigma, S153);Forskolin(Tocris, No:1099);髓过氧化物酶(myeloperoxidase,MPO)试剂盒(南京建成生物技术有限公司,A044);TNF-α、IL-1β和IL-6 ELISA试剂盒购自R & D Systems(R & D Systems, Mineapolis, MN, USA,DY410,DY401,DY406);蛋白测定试剂盒(Bio-Rad Laboratories, Hercules, CA,500-0120);cAMP ELISA试剂盒(R & D Systems, Mineapolis, MN, 128 USA)。GF-1型控时调速式高速分散器:江苏海门麒麟医用仪器厂;ELX800UV型酶标仪:美国Bio-Tek仪器公司;DHG-9145A型电热恒温鼓风干燥箱:上海一恒科技有限公司。
2 方法 2.1 模型制备及给药应用气道内滴入LPS的方法制备小鼠ALI模型,将小鼠随机分为生理盐水对照组、模型组、地塞米松组(DXM 5 mg·kg-1)、腺苷酸环化酶抑制剂组(SQ组3.2 mg·kg-1)和腺苷酸环化酶激动剂组(F组6.6 mg·kg-1),每组12只。小鼠按280 mg·kg-1腹腔注射100 g·L-1水合氯醛麻醉,钝性分离气管,除生理盐水组外,其余各组小鼠气道内滴入LPS(2 mg·kg-1),生理盐水组给予等体积生理盐水。10 min后给药组分别一次性腹腔注射相应剂量药物,生理盐水组和模型组腹腔注射等体积生理盐水。37℃放置,6 h后处死,左肺行支气管肺泡灌洗,右肺收集保存。
2.2 支气管肺泡灌洗液中白细胞计数和分类造模6 h后将小鼠麻醉,股动脉放血处死,结扎右肺后,暴露气管行气管插管,用PBS液1.5 mL分3次进行支气管肺泡灌洗,支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)回收率达90%,冰浴保存,取部分BALF混匀后细胞计数,进行总白细胞(WBC)计数,剩余BALF于4℃,250×g离心10 min,取细胞沉淀涂片,晾干后吉姆萨染色,进行细胞分类计数,包括巨噬细胞、中性粒细胞和淋巴细胞,离心后取上清留取上清液,储存于-80℃。
2.3 支气管肺泡灌洗液中相关细胞因子和蛋白含量测定采用双抗体夹心ELISA法,按照试剂盒说明书要求,测定BALF中TNF-α、IL-6和IL-1β相关细胞因子,利用Bio-Rad蛋白测定试剂盒测定BALF中总蛋白含量。
2.4 肺组织中MPO活性及cAMP含量的测定准确称取右肺下叶组织,按试剂盒要求用生理盐水制备成100 g·L-1的组织匀浆,4℃、12 000×g离心10 min,收集上清,利用cAMP ELISA试剂盒,按步骤测定组织匀浆里的cAMP含量,MPO活性测定采用酶学动力方法测定。
2.5 肺组织病理学检查左肺下叶于福尔马林中固定24 h,固定后进行脱水、透明、石蜡包埋后切片,进行苏木精-伊红(HE)染色,高倍显微镜观察肺水肿及炎症细胞浸润,观察肺组织病理学改变。
2.6 统计学处理采用SPSS 13.0软件进行统计学处理。各组数据先行方差齐性检验,样本均数比较采用方差分析和Dunnett t检验。
3 结果 3.1 SQ22536和Forskolin对ALI小鼠肺泡灌洗液中白细胞数、中性粒细胞数和蛋白含量的影响小鼠气道内滴入LPS 6 h后,与生理盐水对照组(N组)相比,模型组(L组)BALF中白细胞总数和中性粒细胞百分数增多(P<0.01),给予SQ22536(SQ组)和Forskolin(F组)处理后,F组可降低LPS引起的白细胞总数增高和中性粒细胞百分数(P<0.01),作用强度与地塞米松相当,而SQ组对LPS引起的白细胞数和中性粒细胞增多无明显影响(P>0.05);LPS组小鼠BALF中的蛋白含量较N组明显升高(P<0.01),给予Forskolin和DXM处理后,可使BALF中的蛋白含量降低(P<0.05),差异具有统计学意义(Tab 1)。
| Group | WBC/×109·L-1 | Neutrophil/% | Albumin/pmol·L-1 |
| N | 15.14±3.45 | 2.71±1.48 | 282.16±14.66 |
| L | 214.78±70.55** | 77.62±10.65** | 308.97±16.65** |
| D | 85.00±29.83## | 52.80±18.09## | 287.57±13.66# |
| F | 73.67±29.22## | 57.5±12.82## | 269.34±26.56# |
| SQ | 252.75±70.33 | 69.40±1.57 | 303.99±29.57 |
| N:Normal saline; L: LPS; D: LPS+Dexamethason; F:LPS+Forskolin; SQ: LPS+SQ22536. #P<0.05, ##P<0.01 vs LPS alone; **P<0.01 vs N alone | |||
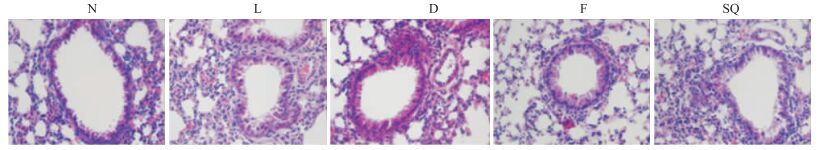
光镜下见生理盐水对照组肺组织结构清晰,肺泡腔及支气管腔未见炎症细胞及渗出物。模型组可见点、片状出血,大量中性粒细胞浸润,肺泡间隙边缘有轻度的透明膜存在,显示明显的炎症和轻度的肺水肿现象,肺泡间隔明显增厚,肺泡腔变窄。Forskolin组及地塞米松组上述病理变化明显改善,SQ组无明显改善(Fig 1)。
|
| Fig 1 Effect of SQ22536 and forskolin on lung histopathological changes of LPS-induced acute lung injury mice(HE staining, ×400) N:Normal saline; L: LPS; D: LPS+Dexamethason; F:LPS+Forskolin; SQ: LPS+SQ22536. |
模型组小鼠肺组织中MPO活性较生理盐水对照组明显升高(P<0.01),给药处理后,F组中MPO活性明显降低(P<0.05),而D组和SQ组有所降低,但差异无显著性(P>0.05);与N相比,M组BALF中TNF-α、IL-1β、IL-6的含量均明显升高(P<0.01),地塞米松能明显降低三者的含量,Forskolin能明显降低TNF-α的含量(P<0.01),对IL-1β和IL-6的影响不明显(P>0.05),而SQ22536则对三者均无明显影响(P>0.05)。见Tab 2。
| Group | MPO/g Pro·L-1 | TNF-α/pg·L-1 | IL-1β/pg·L-1 | IL-6/pg·L-1 |
| N | 22.82±1.09 | 102.33±6.69 | 96.71±6.29 | 76.41±5.03 |
| L | 52.92±1.90** | 211.60±76.93** | 107.11±6.37** | 134.75±36.40** |
| D | 43.43±1.39 | 183.40±36.43## | 98.33±4.72## | 91.60±12.13## |
| F | 30.94±1.32# | 136.30±18.58## | 104.5±5.80 | 152.60±32.53 |
| SQ | 38.48±1.36 | 272.86±55.34 | 115.20±9.65 | 145.60±55.27 |
| N:Normal saline; L: LPS; D: LPS+Dexamethason; F:LPS+Forskolin; SQ: LPS+SQ22536. #P<0.05, ##P<0.01 vs LPS alone; **P<0.01 vs N alone | ||||
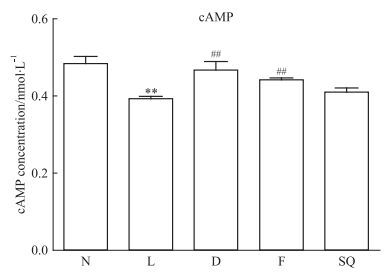
L组与N组相比,肺组织cAMP含量明显降低(P<0.01),与模型组相比,地塞米松和Forskolin能明显升高肺组织中cAMP含量(P<0.01),SQ22536 LPS性小鼠肺组织中cAMP含量无明显影响(P>0.05),见Fig 2。
|
| Fig 2 Effects of SQ22536 and forskolin on cAMP concentration in lung histopathologieal changes of LPS-induced acute lung injury mice(x ± s, n=8~12) N:Normal saline; L: LPS; D: LPS+Dexamethason; F:LPS+Forskolin; SQ: LPS+SQ22536. ##P < 0.01 vs LPS alone; **P < 0.01 vs N alone |
革兰阴性菌所致败血症是引起ALI并最终导致患者死亡的重要原因之一,LPS是革兰阴性菌的主要致病成分[2]。ALI发病机制复杂,目前尚未完全阐明[3]。有研究表明,中性粒细胞在肺内黏附、聚集和激活是ALI发病的重要病理基础,而中性粒细胞通过“呼吸爆发”释放多种炎症介质、蛋白酶和氧自由基等对ALI发生起重要作用。大量实验表明,在ALI发生发展过程中,肺组织局部产生大量促炎因子,如TNF-α、IL-1、IL-6、巨噬细胞炎性蛋白lα等[4],它们之间形成的复杂细胞因子网络互相激活和互相作用,使炎症反应级联放大。TNF-α可诱导循环中性粒细胞黏附于血管内皮,促进中性粒细胞迁移并浸入支气管肺泡腔,使其激活和脱颗粒,产生氧自由基,释放颗粒酶,包括MPO[5]。MPO是一种中性粒细胞释放的蛋白酶,MPO活性可反映中性粒细胞浸润,与TNF-α的变化趋势相似,与肺部炎症密切相关。临床观察和动物研究均发现,升高细胞内的cAMP水平,能明显改善肺水肿等各种病理情况[6-7],在急性肺损伤,有研究表明cAMP在各种动物模型中都有保护作用,如大肠杆菌引起的急性肺损伤猪损伤[8-9]、鱼精蛋白诱导的大鼠离体肺急性损伤[10]、内毒素致大鼠肺损伤[11]等。
SQ22536是腺苷酸环化酶的抑制剂,可在完整人类血小板中抑制PGE-1刺激cAMP水平升高。Forskolin存在于各种干细胞类型中,是一种普遍存在的真核细胞腺苷酸环化酶(AC)激活剂,在细胞生理学研究中,通常用来提高cAMP水平。本研究表明,给小鼠气道滴入LPS制备ALI模型,病理检查结果显示,模型组小鼠肺组织水肿和出血,有大量炎症细胞浸润,表明造模成功。Forskolin可明显减少LPS引起的小鼠BALF中的蛋白漏出以及肺组织中白细胞和中性粒细胞的浸润,降低肺组织中MPO活性和TNF-α炎症因子的含量,但对IL-6和IL-1β相关细胞因子无明显影响,Forskolin同时也能明显升高肺组织中cAMP含量,而SQ22536在LPS性急性肺损伤小鼠中无明显作用。本实验证明,Forskolin能减轻LPS性肺组织损伤,抑制LPS诱导的肺水肿、蛋白渗出,减少相关炎症因子释放,具有抗LPS急性肺损伤的保护作用。
Forskolin的抗LPS急性肺损伤的保护作用研究甚少,保护机制尚不清楚。中性粒细胞在肺内大量浸润是ALI的重要发病环节[12],而TNF-α作为早期炎性因子在ALI中具有启动和介导炎症反应的重要作用[13-14],TNF-α能激活巨噬细胞和中性粒细胞,促进中性粒细胞的渗出、吞噬、呼吸爆发和氧自由基得释放[15]。本研究中Forskolin可有效抑制LPS所致BALF白细胞计数的增多,降低肺组织内MPO活性,抑制BALF中TNF-α水平升高,升高肺组织中cAMP含量。因此,笔者推测,Forskolin减轻LPS引起的急性肺损伤的机制可能与升高cAMP含量、抑制TNF-α的产生,进而减轻中性粒细胞的肺部浸润及炎症因子的释放有关。因此,腺苷酸环化酶激动剂在治疗ALI方面具有研究开发价值。
( 致谢: 本实验是在浙江大学医学院药理实验室完成,感谢对本研究提供指导和帮助的老师和同学,特别感谢浙江大学药理实验室和动物中心为本研究提供的良好实验环境!)
| [1] | Robb C T, Regan K H, Dorward D A, et al. Key mechanisms governing resolution of lung inflammation[J]. Semin Immunopathol, 2016, 38(4): 425-48. doi:10.1007/s00281-016-0560-6 |
| [2] | Chen H, Bai C, Wang X. The value of the lipopolysaccharide-induced acute lung419 injury model in respiratory medicine[J]. Expert Rev Respir Med, 2010, 4(6): 773-83. doi:10.1586/ers.10.71 |
| [3] | 马李杰, 李王平, 金发光. 急性肺损伤/急性呼吸窘迫综合征发病机制的研究进展[J]. 中华肺部疾病杂志, 2013, 6(1): 49-52. Ma L J, Li W P, Jin G F. Research progress of pathogenesis of acute lung injury and acute respiratory distress syndrome[J]. Chin J Lung Dis, 2013, 6(1): 49-52. |
| [4] | 郭静, 李敏, 杨付梅, 等. 补体旁路激活致小鼠急性肺损伤的炎症病理机制研究[J]. 中国药理学通报, 2016, 32(11): 1521-6. Guo J, Li M, Yang F M, et al. Inflammatory mechanism of acute lung injury in mice induced by activation of complement alternative pathway[J]. Chin Pharmacol Bull, 2016, 32(11): 1521-6. doi:10.3969/j.issn.1001-1978.2016.11.009 |
| [5] | Matthay M A, Zimmerman G A. Acute lung injury and the acute respiratory distress syndrome: four decades of inquiry into pathogenesis and rational management[J]. Am J Respir Cell Mol Biol, 2005, 33(4): 319-27. doi:10.1165/rcmb.F305 |
| [6] | Matthay M A. Resolution of pulmonary edema. Thirty years of progress[J]. Am J Respir Crit Care Med, 2014, 189(11): 1301-8. doi:10.1164/rccm.201403-0535OE |
| [7] | Nickols J, Obiako B, Ramila K C, et al. Lipopolysaccharide-induced pulmonary endothelial barrier disruption and lung edema: critical role for bicarbonate stimulation of AC10[J]. Am J Physiol Lung Cell Mol Physiol, 2015, 309(12): L1430-7. doi:10.1152/ajplung.00067.2015 |
| [8] | Hoffmann H, Hatherill J R, Crowley J, et al. Early post-treatment with pentoxifylline or dibutyryl cAMP attenuates Escherichia coli-induced acute lung injury in guinea pigs[J]. Am Rev Respir Dis, 1991, 143(2): 289-93. doi:10.1164/ajrccm/143.2.289 |
| [9] | Ishizaka A, Wu Z H, Stephens K E, et al. Attenuation of acute lung injury in septic guinea pigs by pentoxifylline[J]. Am Rev Respir Dis, 1988, 138(2): 376-82. doi:10.1164/ajrccm/138.2.376 |
| [10] | Hsu K, Wang D, Shen C Y, et al. Protamine-induced acute lung injury and the protective effect of agents that increase cAMP[J]. Proc Natl Sci Counc Repub China B, 1993, 17(2): 57-61. |
| [11] | Chang S W, Sakai A, Voelkel N F. Dibutyryl-cAMP blocks endotoxin-induced lung injury in rats[J]. Am Rev Respir Dis, 1989, 140(6): 1814-7. doi:10.1164/ajrccm/140.6.1814 |
| [12] | Tsai Y F, Chu T C, Chang W Y, et al. 6-Hydroxy-5, 7-dimethoxy-flavone suppresses the neutrophil respiratory burst via selective PDE4 inhibition to ameliorate acute lung injury[J]. Free Radic Biol Med, 2017, 106: 379-92. doi:10.1016/j.freeradbiomed.2017.03.002 |
| [13] | 姚红伊, 陈季强, 杜晓刚, 等. 隐孔菌多糖对小鼠内毒素性肺损伤的保护作用[J]. 中国药理学通报, 2008, 24(3): 408-12. Yao H Y, Chen J Q, Du X G, et al. Protective effects of cryptoporus polysaccharide on lipopolysaccharide induced lung injuries in mice[J]. Chin Pharmacol Bull, 2008, 24(3): 408-12. |
| [14] | Wilson M R, Wakabayashi K, Bertok S, et al. Inhibition of TNF receptor p55 by a domain antibody attenuates the initial phase of acid-induced lung injury in mice[J]. Front Immunol, 2017, 13(8): 128. |
| [15] | Banerjee A, Moore E E, McLaughlin N J, et al. Hyperosmolarity attenuates TNF-α-mediated proinflammatory activation of human pulmonary microvascular endothelial cells[J]. Shock, 2013, 39(4): 366-72. doi:10.1097/SHK.0b013e3182894016 |

