


2. 广西医科大学研究生院,广西 南宁 530021;
3. 广西中药药效筛选重点实验室,广西 南宁 530200;
4. 长寿与老年相关疾病教育部重点实验室,广西 南宁 530021;
5. 广西医科大学药学院,广西 南宁 530021
2. Graduate School, Guangxi Medical University, Nanning 530021, China;
3. Guangxi Key Lab of Pharmacodynamic Studies of Traditional Chinese Medicine, Nanning 530200, China;
4. Key Lab of Longevity and Aging-related Disease, Chinese Ministry of Education, Nanning 530021, China;
5. College of Pharmacy, Guangxi Medical University, Nanning 530021, China
芒果苷(mangiferin)是芒果叶中的主要活性成分,具有抗炎、镇痛、抗氧化、抗肿瘤、保肝、免疫调节等多种药理活性[1-2]。课题组前期研究发现,芒果苷可抑制哮喘小鼠气道炎症,其平喘机制主要与扭转Th1/Th2失衡有关[3]。麻黄碱(ephedrine)是中药麻黄的主要成分,对哮喘有明显的治疗作用,但长期大量使用可引起心悸、多汗、眩晕、震颤、烦躁焦虑、失眠等不良反应[4]。因此,在临床用药中,麻黄碱往往与其他药物联合应用,如甘草酸、黄芩苷以及桂枝、桔梗、桑白皮、百部提取物等,不仅提高了平喘的效果,而且可减少麻黄碱的副作用[5]。芒果苷与麻黄碱均可以治疗哮喘,但作用机制不同,在前期研究中我们发现单一使用芒果苷很难达到很好的治疗效果。因此,在本研究中我们将芒果苷与麻黄碱联合应用,观察其是否能够发挥多机制的联合治疗作用,提高芒果苷的平喘效果,同时降低单用麻黄碱所引起的不良反应,为芒果苷与麻黄碱联合用药治疗过敏性哮喘提供前期理论基础。
1 材料 1.1 实验动物SPF级♀ BALB/c小鼠,4~5周龄,体质量(18±2) g,由湖南斯莱克景达实验动物有限公司提供,许可证号SCXK(湘)2009-0004。
1.2 药物与试剂芒果苷,由广西中药药效筛选重点实验室提供,纯度达98.39%以上;盐酸麻黄碱注射液,购自东北制药集团沈阳第一制药有限公司,规格:30 g·L-1,批号:110902-2;地塞米松,购自浙江仙琚制药股份有限公司,规格:0.75 mg/片,批号:120252。鸡卵白蛋白(ovalbumin, OVA)(grade Ⅴ)、Al(OH)3凝胶(13 g·L-1),购自Sigma公司;Anti-OVA-sIgE ELISA Kit,购自美国Cayman Chemical公司;环化腺核苷一磷酸(cyclic adenosine monophosphate, cAMP)定量分析试剂盒,购自美国HCB公司;动物组织总RNA提取试剂盒、cDNA第一链合成试剂盒、2×Taq PCR MasterMix,购自北京天根生化科技有限公司;其余试剂均为分析纯。
1.3 仪器5810R型低温超速离心机(德国Eppendorf公司);Milli-Q Advantage A10超纯水系统(美国Millipore公司);PARI BOY N(085G1005) 型空气压缩雾化器(470 mg·min-1)(德国百瑞公司);Elx800型全自动酶标仪(奥地利DIALAB公司);YLS多功能小鼠自主活动记录仪(山东省医学科学院设备供应维修站);UV-1700紫外分光光度计(日本岛津公司);DYY-6C型电泳仪(北京市六一仪器厂);Carestream 212 PRO型凝胶成像系统(美国伯乐公司)。
2 方法 2.1 动物分组♀ BALB/c小鼠60只,随机分为6组,分别为正常组(normal)、模型组(model)、地塞米松阳性对照组(dexamethasone, 1.25 mg·kg-1)、芒果苷组(mangiferin, 200 mg·kg-1)、麻黄碱组(ephedrine, 100 mg·kg-1)、芒果苷(200 mg·kg-1)与麻黄碱(100 mg·kg-1)联合组(combination),每组10只。
2.2 模型制备与给药 2.2.1 致敏于实验d 1(实验开始当天)、d 8、d 15分别致敏,共3次。除正常组外,其余各组小鼠腹腔注射OVA致敏液(含OVA 20 μg+氢氧化铝佐剂150 μL),每只0.2 mL。正常组用PBS液代替OVA致敏液,方法同其余各组。
2.2.2 激发于实验d 25~29激发,连续5 d。除正常组外,其余各组小鼠置于自制的密闭玻璃容器中(25 cm×30 cm×40 cm),以1% OVA进行雾化吸入激发(雾化颗粒平均直径为3.7 μm),每次20 min,1次/日,以激发哮喘。正常组采用PBS液代替OVA激发,方法同其余各组。
2.2.3 药物干预各组于实验d 16~29灌胃给药,药物剂量的选择参照预实验结果和前期研究[3],灌胃体积为20 mL·kg-1,1次/日,连续14 d,联合用药组隔天给药。正常组和模型组给予等量生理盐水。
2.3 标本采集各组于末次激发24 h后,眼球取血,静置后,4℃离心(3 000 r·min-1×10 min),取血清,-80℃保存备用。取血后,小鼠取仰卧位固定,沿腹中线剖至口及胸膈以下,取右肺中叶,放入去酶EP管中。再取左肺,放入装有4%多聚甲醛的EP管中。
2.4 指标观察 2.4.1 给药后小鼠自主活动力的变化各组小鼠分别于给药前及给药后1 h放入多功能小鼠自主活动记录仪,测其自主活动力,主要记录小鼠在一定区域、一定时间内的自主活动量。初步判断药物对小鼠的兴奋或抑制情况。将小鼠依次单只放入仪器的分隔中,先平衡5 min,使其适应环境,再通过光敏监控小鼠在2 h内的活动次数,连续观察14 d。
2.4.2 芒果苷对小鼠哮喘发作症状的影响激发时,观察小鼠是否有头面部瘙痒、喷嚏或呛咳、呼吸急促、躁动不安、紫绀、腹式呼吸、俯卧不动、大小便失禁、毛色等变化。并对小鼠哮喘的发作程度进行评分。
2.4.3 全血中白细胞计数及分类从抗凝管中取小鼠全血0.02 mL于血细胞计数板,加入0.38 mL红细胞稀释液,测定白细胞总数。再取5 μL做细胞涂片,瑞氏-姬姆萨染色,计数300个细胞作细胞分类计数。
2.4.4 小鼠肺组织病理观察HE染色,光学显微镜下观察组织形态、气道上皮损伤、气管及血管周围EOS浸润情况,根据Underwood等[6]提出的标准进行评分。
2.4.5 血清中OVA-sIgE和cAMP的含量测定采用ELISA法检测血清中OVA-sIgE和cAMP的含量,操作按照试剂盒说明书进行。
2.4.6 RT-PCR法检测小鼠肺组织中Th1型细胞因子IFN-γ和Th2型细胞因子IL-4、IL-5的mRNA表达水平小鼠肺组织总RNA提取及鉴定,逆转录合成cDNA(按照试剂盒说明书进行),根据引物(Tab 1)进行PCR扩增。反应条件为:94℃预变性3 min,94℃变性30 s,61℃退火30 s,75℃延伸60 s,35个循环后,72℃反应5 min。其中,白细胞介素4(interleukin 4, IL-4) 退火温度为64℃,白细胞介素5(interleukin 5, IL-5) 退火温度为62℃,γ-干扰素(interferon-γ, IFN-γ)为59℃。PCR产物置1.5%琼脂糖凝胶中电泳,在凝胶成像分析系统中观察电泳结果,标记并保存图像。
| Gene | Primer | Sequences(5′ to 3′) | Amplified fragment size/bp |
| β-actin | Forward | TGGAATCCTGTGGCATCCATGAAAC | 349 |
| Reverse | TAAAACGCAGCTCAGTAACAGTCCG | ||
| IL-4 | Forward | CCTGCTCTTCTTTCTCGAATGT | 165 |
| Reverse | CTCTCTGTGGTGTTCTTCGTTG | ||
| IL-5 | Forward | TCAGCTGTGTCTGGGCCACT | 133 |
| Reverse | TTATGAGTAGGGACAGGAAGCCTCA | ||
| IFN-γ | Forward | GGGACAGCCAAGCGGCTGAC | 98 |
| Reverse | CACCTCCCGGGGTCACTGCA |
采用SPSS 17.0统计软件进行分析,所有数据结果以x±s表示,多组资料之间比较,采用单因素方差分析(One-Way ANOVA)。Homogeneity检验方差齐性,如果方差齐时采用最小显著法(LSD)检验;如果方差不齐时采用Dunnett′s T3检验。
3 结果 3.1 给药后小鼠自主活动力的变化由Fig 1A可看出,与正常组相比,麻黄碱组在给药1 h后小鼠的自主活动力明显增强(P<0.01);与麻黄碱组相比,芒果苷组和联合用药组小鼠自主活动力均有所下降(P<0.01)。
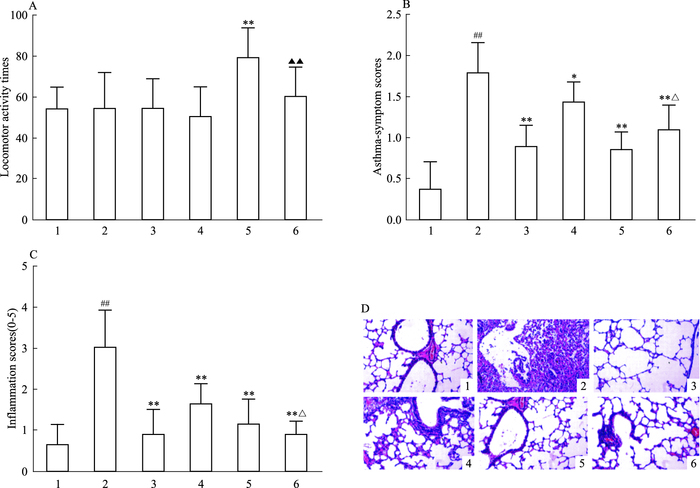
|
| Fig 1 Locomotor activities, OVA-induced asthmatic symptom and lung histological changes in experimental mice(x±s, n =8) A: Mice locomotor activity times were counted by multi-function autonomous activity recorder after 1h treated by drugs; B: Asthmatic symptom was observed during the OVA-challenge; C: Qualitative analysis of anti-inflammatory effects based on inflammation scores as described; D: HE staining(×200), only a representative picture is shown for each group. 1: Normal; 2: Model; 3: Dexamethasone; 4: Mangiferin; 5: Ephedrine; 6: Combination.##P < 0.01 vs normal group; *P < 0.05, **P < 0.01 vs model group; △P < 0.05 vs mangiferin group; ▲▲P < 0.01 vs ephedrine group |
实验前各组动物的外观、行为及对刺激的反应、活动、体重均无明显差异。致敏阶段,各组小鼠的腹腔注射部位无红肿、溃烂。激发时,正常组小鼠呼吸相对平稳,偶尔出现轻微的抓耳挠腮、喷嚏或呛咳现象,毛色和二便正常。与正常组相比,模型组小鼠哮喘发作症状明显(P<0.05, P<0.01),出现烦躁不安、抓耳挠腮、喷嚏或呛咳、呼吸急促,收腹明显,并随着激发次数的增加不断加重,口鼻、耳朵及脚趾部紫绀明显,粪便增多稀溏,部分小鼠激发时弓背或俯卧不动,反应迟钝,毛色较差且无光泽。各给药组小鼠亦出现抓耳挠腮、喷嚏或呛咳、呼吸急促,呼吸幅度加深等症状,但与模型组相比症状明显减轻(P<0.01)。联合给药组的哮喘发作症状明显轻于芒果苷组(P<0.05)。见Fig 1B。
3.3 哮喘小鼠肺组织病理学改变HE染色结果显示,模型组支气管壁增厚,气道黏膜皱缩增多,上皮细胞肿胀脱落。肺泡壁明显增厚充血、水肿及炎症细胞浸润。血管和支气管周围组织有大量以EOS为主的炎症细胞浸润。与模型组比较,各治疗组肺组织上述病变均有减轻,肺组织结构尚好,其中联合给药组作用效果尤为明显。与芒果苷组相比,联合组肺部炎性病变改善明显(P<0.05)。见Fig 1C、1D。
3.4 芒果苷联合麻黄碱对哮喘小鼠全血中白细胞总数及分类的影响由Fig 2A、2B可以看出,与正常组相比,模型组小鼠全血中白细胞总数和EOS比例均升高(P<0.01)。与模型组相比,各治疗组白细胞总数和EOS比例均明显降低(P<0.05,P<0.01)。
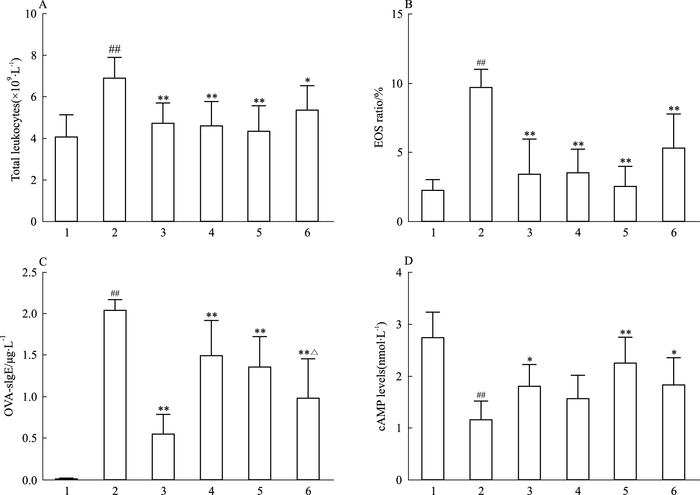
|
| Fig 2 OVA-induced total leukocytes, eosinophil infiltration, and levels of IgE and cAMP in serum(x±s, n =8) Peripheral blood and serum were collected 24h after the last OVA challenge. The total leukocytes(A) and eosinophil cells(B) in peripheral were counted. The levels of OVA-specific IgE(C) and cAMP(D) in serum were measured by ELISA.1: Normal; 2: Model; 3: Dexamethasone; 4: Mangiferin; 5: Ephedrine; 6: Combination.##P < 0.01 vs normal group; *P < 0.05, **P < 0.01 vs model group; △P < 0.05 vs mangiferin group |
与模型组相比,各治疗组均明显减少了小鼠血清中OVA-sIgE的含量(P<0.01);联合组与芒果苷组相比,差异有显著性(P<0.05)。与模型组相比,麻黄碱组和联合给药组小鼠血清中cAMP含量均有升高(P<0.05,P<0.01)。见Fig 2C、2D。
3.6 芒果苷联合麻黄碱对哮喘小鼠肺组织中Th1/Th2型细胞因子mRNA表达影响从Fig 3可以看出,模型组IL-4和IL-5 mRNA表达水平与正常组相比明显增高(P<0.05,P<0.01),IFN-γ mRNA表达水平明显降低(P<0.01)。与模型组比较,联合给药组可降低肺组织中Th2型细胞因子IL-4和IL-5 mRNA表达水平(P<0.05,P<0.01),同时上调Th1型细胞因子IFN-γ mRNA表达水平(P<0.01)。同模型组相比,芒果苷组可下调IL-5、上调IFN-γ的mRNA表达水平(P<0.05,P<0.01)。麻黄碱组可降低IL-4和IL-5的mRNA水平(P<0.01)。
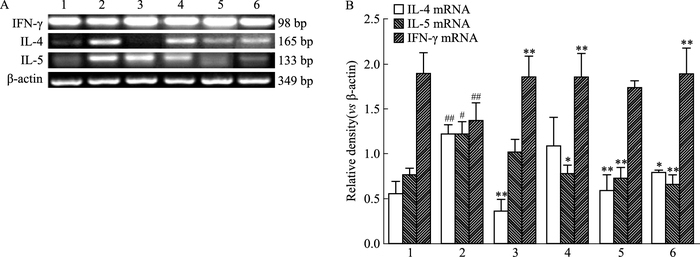
|
| Fig 3 Effect on mRNA levels of Th1 and Th2 cytokines in the lung tissues(x±s, n =6) Total RNA was extracted from each lung, and the mRNA expression of Th1 cytokines(IFN-γ) and Th2 cytokines(IL-4 and IL-5) were determined by RT-PCR. β-actin was used as an internal control for each PCR reaction.A: Representative RT-PCR profile was shown. B: Bar graph of relative mRNA expression.1: Normal; 2: Model; 3: Dexamethasone; 4: Mangiferin; 5: Ephedrine; 6: Combination.#P < 0.05, ##P < 0.01 vs normal group; *P < 0.05, **P < 0.01 vs model group |
现代医学表明,哮喘的发生是一个涉及体内多种细胞和炎症因子参与的过程[7]。从抗原初次进入机体,机体Th细胞亚群失衡,导致B细胞活化分化成浆细胞,产生IgE类型的抗体的致敏阶段;到抗原再次进入机体,肥大细胞活化释放炎症介质激发阶段;以及炎症介质作用到靶器官的效应阶段。每个阶段的干预都可以阻止哮喘的发生,所以治疗药物有多种,作用在哮喘发生的不同阶段。芒果苷与麻黄碱均可以治疗哮喘,但作用机制不同。
本课题组前期研究结果表明,芒果苷主要是通过抑制患者体内失衡的Th1/Th2细胞亚群,调控炎症因子的释放,达到平喘的效应[3]。而麻黄碱可直接兴奋支气管平滑肌β受体,激活肥大细胞内的腺苷酸环化酶,使cAMP水平升高,平滑肌松弛,哮喘平息[8]。但长期大量使用可引起心悸、多汗、眩晕、震颤、烦躁焦虑、失眠等不良反应。本实验将二者联合应用,既想调节患者机体失衡的免疫系统,又想快速平息支气管平滑肌的痉挛达到平喘效果,标本兼治,发挥多机制的联合治疗作用。在给药方法上,二者联合应用时或者剂量减半,或者隔天给药。我们在前期预实验中发现,隔天给药组的效果优于剂量减半组,且不良反应较小,因此,在本研究中选择了隔天给药的方式。实验结果也表明,相对于芒果苷单用组,联合给药组在减轻小鼠哮喘发作表现、改善肺组织的病理学改变、减轻气道炎症等方面显示出一定优势,同时联合用药可降低由麻黄碱所致小鼠亢奋、活动次数增加等不良表现。在作用机制方面,联合给药组可降低小鼠肺组织中Th2型细胞因子IL-4和IL-5 mRNA表达水平,同时上调Th1型细胞因子IFN-γ mRNA表达水平。因此,二者联合用药的分子机制可能是通过调节Th1/Th2型细胞因子的失衡,从而降低哮喘小鼠体内EOS浸润及OVA-sIgE含量。同时,升高cAMP含量,缓解支气管平滑肌的痉挛,减轻气道炎症。
( 致谢: 本实验主要在广西中药药效筛选重点实验室和长寿与老年相关疾病教育部重点实验室完成, 在此对实验室的各位老师及同学的帮助致以衷心的感谢!)
| [1] | Jyotshna, Khare P, Shanker K. Mangiferin: a review of sources and interventions for biological activities[J]. Biofactors, 2016, 42(5): 504-14. doi:10.1002/biof.v42.5 |
| [2] | 杨海光, 方莲花, 杜冠华. 芒果苷的药理作用研究进展[J]. 中国药理学通报, 2016, 32(1): 5-8. Yang H G, Fang L H, Du G H. Research progress of pharmacological effects of mangiferin[J]. Chin Pharmacol Bull, 2016, 32(1): 5-8. |
| [3] | Guo H W, Yun C X, Hou G H, et al. Mangiferin attenuates Th1/Th2 cytokine imbalance in an ovalbumin-induced asthmatic mouse model[J]. PLoS One, 2014, 10(6): e100394. |
| [4] | Oshima N, Yamashita T, Hyuga S, et al. Efficiently prepared ephedrine alkaloids-free Ephedra Herb extract: a putative marker and antiproliferative effects[J]. J Nat Med, 2016, 70(3): 554-62. doi:10.1007/s11418-016-0977-1 |
| [5] | Zheng F H, Wei P, Huo H L, et al. Neuroprotective effect of gui zhi(ramulus cinnamomi) on ma huang-(herb ephedra-) induced toxicity in rats treated with a ma huang-gui zhi herb pair[J]. Evid Based Complement Alternat Med, 2015, 2015: 913461. |
| [6] | Underwood S, Foster M, Raeburn D, et al. Time-course of antigen-induced airway inflammation in the guinea-pig and its relationship to airway hyperresponsiveness[J]. Eur Respir J, 1995, 8(12): 2104-13. doi:10.1183/109031936.95.08122104 |
| [7] | 陶羽, 刘兆国, 季律, 等. E-钙粘蛋白异常表达与支气管哮喘研究进展[J]. 中国药理学通报, 2015, 31(10): 1333-6. Tao Y, Liu Z G, Ji L, et al. Advances on abnormal expression of E-cadherin with bronchial asthma[J]. Chin Pharmacol Bull, 2015, 31(10): 1333-6. doi:10.3969/j.issn.1001-1978.2015.10.001 |
| [8] | Jia J J, Zeng X S, Li Y, et al. Ephedrine induced thioredoxin-1 expression through β-adrenergic receptor/cyclic AMP/protein kinase A/dopamine-and cyclic AMP-regulated phosphoprotein signaling pathway[J]. Cell Signal, 2013, 25(5): 1194-201. doi:10.1016/j.cellsig.2013.02.007 |

