


2. 桂林医学院 药学院 广西 桂林 541004;
3. 桂林医学院 广西肝脏损伤与修复分子医学重点实验室,广西 桂林 541004
2. College of Pharmac, Guilin Medical University, Guilin Guangxi 541004, China;
3. Key Laboratory of Liver Injury and Repair Molecular Medicine of Guangxi, Guilin Guangxi 541004, China
我国是肝癌大国,拥有全世界一半以上的新发和肝癌死亡患者。由于肝癌发病的特殊性,临床所发现的多为中晚期肝癌,传统的外科手术已不能使患者得到最大化效果的治疗,使用药物进行抗癌治疗显得愈来愈有意义。白藜芦醇是来源于葡萄等植物内的多酚类化合物,其抗肿瘤的作用已经得到确认,但对肝癌的抑癌机制尚未完全明确,因此,本实验使用不同浓度白藜芦醇环境下培养肝癌SMMC-7721细胞,检测其对细胞的增殖和阻滞细胞周期的影响,检测mTOR蛋白表达及其磷酸化水平。
1 材料与方法 1.1 材料人肝癌SMMC-7721细胞株购自中国科学院上海生科院细胞资源中心;白藜芦醇(resveratrol,Res)(上海西格玛奥里奇上海贸易有限公司,R5010),溶于二甲基亚砜(DMSO)制备成浓度为100 mmol·L-1存储液,经0.22 μm微孔过滤器除菌,避光4℃保存;胎牛血清FBS(Corille公司,C1015-05);DMEM高糖培养基(Gibco公司, C11995500BT);Cell Counting Kit-8(上海同仁化学研究所,CK04); mTOR抗体(Ser2448)(#5536,兔源性)、Phospho-mTOR抗体(Ser2448)(#5536,兔源性)均购自Cell Signaling Technology;β-actin抗体(SC-47778,鼠源性)以及二抗(羊抗兔、羊抗鼠)均购自Santa Cruz公司;Annexin V-FITC/PI(东仁化学科技有限公司,AD10)。
1.2 方法 1.2.1 细胞培养人肝癌细胞SMMC-7721接种在含双抗和10% FBS的DMEM培养基内,在37℃、5% CO2饱和湿度培养箱内培养,0.25%胰蛋白酶常规消化传代培养,取对数生长期细胞进行实验。
1.2.2 细胞抑制实验① 半数抑制率(inhibitory concentration,IC50):取对数生长期细胞接种于96孔板内,每孔细胞数1 000个,24 h后细胞完全贴壁,稀释浓度白藜芦醇为不同浓度,使不同分组培养基含药物最终浓度0.78、1.56、3.12、6.25、12.5、25、50、100、200、400 μmol·L-1,每个药物浓度设3个复孔,对照组加等体积的DMSO,48 h后采用CCK-8试剂检测,使用连续波长酶标仪(infinte M200 PRO)记录波长450 nm处吸光(A)值,计算白藜芦醇干预48 h后的IC50;② 细胞生长曲线实验:取对数生长期细胞,以800个每孔接种于96孔板,24 h细胞贴壁后加白藜芦醇,使其最终浓度为3.125、6.25、12.5、25、50、100 μmol·L-1,对照组设置DMSO浓度为3.125、100 μmol·L-1,每个药物浓度设置3个复孔,使用CCK-8试剂、连续波长酶标仪,分别检测2 h、2 d、4 d、6 d 4个时间点A450 nm波长处吸光度(A)值。以上实验重复3次,计算出白藜芦醇干预4 d的抑制率。细胞抑制率/%=(DMSO对照组A450值-白藜芦醇组A450值)/DMSO对照组A450值×100%。
1.2.3 克隆形成实验取对数期细胞常规消化计数,以2 000个每孔接种于6孔板,放置在细胞培养箱内孵育5 d后加药,使Res浓度分别为3.125、6.25、12.5、25、50、100 μmol·L-1,对照组DMSO浓度为3.125、100 μmol·L-1,放置在细胞培养箱,4d后弃去上清培养基,用PBS(含Mg2+)浸洗1次,加4%多聚甲醛2 mL固定15 min,弃去多聚甲醛,PBS(含Mg2+)浸洗1次,加0.1%结晶紫2 mL染色15 min, 清水洗脱结晶紫染液,室温自然风干后扫描拍照。每孔内加入10%冰醋酸溶液2 mL,放置在摇床上,待孔内结晶紫彻底溶解后充分混匀,取100 μL加入96孔板,使用连续波长酶标仪测定560 nm波长处吸光度值,计算克隆抑制率。克隆抑制率/%=(DMSO)对照组A560值-Res组A560值)/DMSO对照组A560值×100%。
1.2.4 细胞周期检测Res组以细胞数为0.6×106、0.6×106、0.7×106、0.8×106、0.9×106、1.0×106个接种于10 cm培养皿中,DMSO对照组以0.5×106、0.5×106个接种于10 cm培养皿中,24 h后依次加药,使Res最终浓度依次为3.125、6.25、12.5、25、100 μmol·L-1,对照组DMSO最终浓度为3.125、100 μmol·L-1, 每个药物浓度重复3皿,48 h后收集细胞并用冰冻无水乙醇固定,-20℃保存。上机检测前,用PBS洗去无水乙醇,每管内加染液0.5 mL(PI含量为50 mg·L-1,RNaseA含量为100 mg·L-1),室温条件下避光30 min,经300目筛网过滤,使用流式细胞仪(BD FACSAriaⅢ)检测, 经Multicycle DNA软件分析结果。
1.2.5 Western blot检测细胞接种在10 cm培养皿内,24 h后加药,Res组终浓度为3.9、7.8、15.6、31.2、62.5、125 μmol·L-1, 对照组DMSO最终浓度为3.9、125 μmol·L-1, 48 h后,收集细胞并用细胞裂解液提取细胞总蛋白,经蛋白定量调整蛋白浓度,制备蛋白样品,并于-20℃储存。采用聚丙烯酰胺凝胶法(7.5%分离胶+5%浓缩胶, 10%分离胶+5%浓缩胶)电泳,转移至NC膜上,5%脱脂奶粉封闭1 h,TBST洗膜,4℃条件下一抗孵育过夜,TBST洗膜,室温下二抗孵育1.5 h, TBST洗膜, 滴加免疫印迹化学发光剂(ECL)反应,X线胶片压片,使用GEL-Pro Analyzer图像分析系统分析胶片吸光度值,分别以mTOR与β-actin的比值作为mTOR的蛋白表达强度,p-mTOR与mTOR的比值作为mTOR磷酸化水平变化。
1.3 统计学处理所有数据使用SPSS18.0软件处理,结果用x±s表示,重复样本均数采用单因素方差分析,组间多重比较采用t检验。
2 结果 2.1 白藜芦醇可抑制人SMMC-7721细胞增殖白藜芦醇干预SMMC-7721细胞48 h,CCK-8法检测A450波长处吸光度(A)值如Fig 1A, 在一定药物浓度范围内,白藜芦醇对SMMC-7721细胞抑制有剂量依赖关系,其抑制率如Fig 1B分别为9.55%±7.33%、8.96%±6.97%、12.61%±10.52%、17.18%±10.42%、16.11%±1.51%、20.12%±7.73%、21.56%±6.62%、32.23%±3.36%、55.73%±0.37%、56.53%±0.11%, 且差异具有统计学意义(F=21.067, P<0.01)。计算得出白藜芦醇对SMMC-7721细胞48 h的IC50为303.810 μmol·L-1,生长曲线实验如Tab 1,在一定药物浓度范围内,白藜芦醇对SMMC-7721细胞抑制有时间依赖关系,白藜芦醇干预SMMC-7721细胞2 h与DMSO对照组相比,差异无统计学意义(F=12.817, P>0.05),而干预2、4、6 d后,白藜芦醇组与DMSO对照组相比均有统计学差异(F=11.860、257.439、181.780, P<0.01);其中不同浓度的白藜芦醇干预SMMC-7721细胞4 d的抑制率分别6.76%±5.30%、12.30%±7.01%、26.59%±3.66%、42.97%±4.52%、61.65%±2.35%、67.88%±1.36%,差异具有统计学意义(F=195.978, P<0.01)。
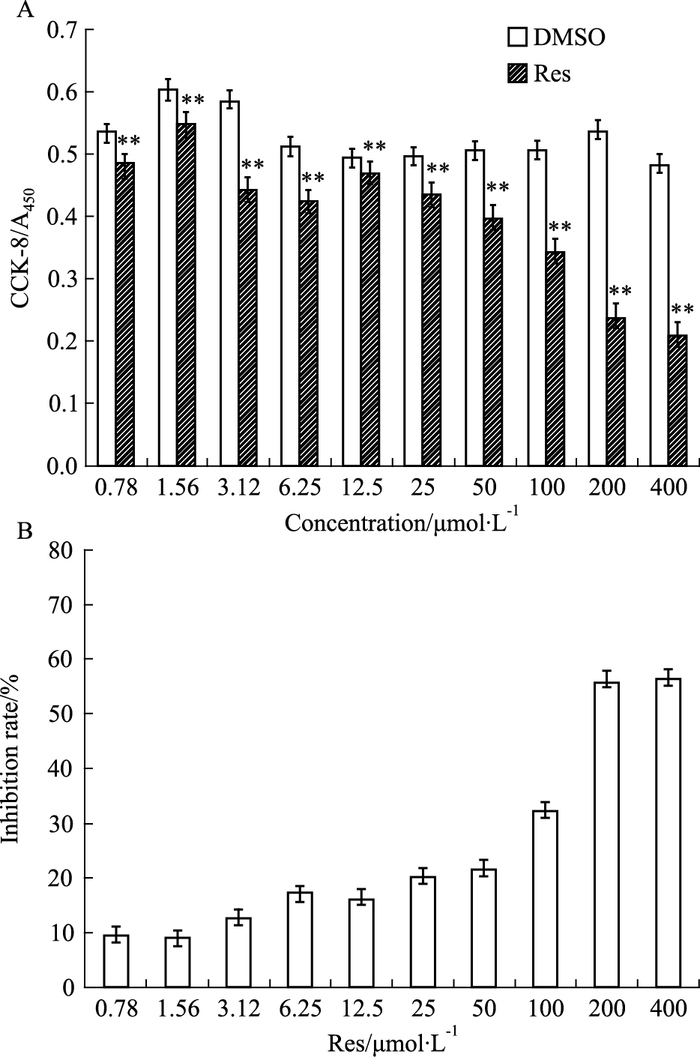
|
| Fig 1 Resveratrol inhibits human SMMC-7721 cell proliferation A:Different concentrations of resveratrol on SMMC-7721 cells proliferation, **P < 0.01 vs control group; B:Comparison of different concentrations of resveratrol on SMMC-7721 cell inhibition rate |
| Time | DMSO/μmol·L-1(n=4) | Resveratrol group/μmol·L-1(n=6) | ||||||
| 3.125 | 100 | 3.125 | 6.25 | 12.5 | 25 | 50 | 100 | |
| 2 h | 0.20±0.00 | 0.21±0.00 | 0.22±0.00 | 0.22±0.00 | 0.21±0.00 | 0.22±0.00 | 0.22±0.00 | 0.23±0.01 |
| 2 d | 0.36±0.03 | 0.38±0.01 | 0.39±0.01 | 0.39±0.01 | 0.38±0.00 | 0.38±0.01 | 0.37±0.02 | 0.34±0.01** |
| 4 d | 1.05±0.06 | 1.08±0.03 | 1.00±0.06* | 0.94±0.08** | 0.79±0.04** | 0.61±0.05** | 0.41±0.03** | 0.35±0.01** |
| 6 d | 2.22±0.13 | 2.36±0.02 | 2.31±0.27 | 2.31±0.17 | 1.97±0.22** | 1.14±0.14** | 0.39±0.04** | 0.38±0.03** |
| Resveratrol inhibited the proliferation of SMMC-7721 cells in a time-dependent and dose-dependent relationship. *P<0.05, **P<0.01 vs 100μmol·L-1 DMSO group | ||||||||
DMSO对照组2个浓度之间无显著性差异,白藜芦醇组明显抑制SMMC-7721细胞克隆增殖,如Fig 2所示,随着药物浓度增大,细胞被抑制越明显,与DMSO对照组相比,A560值差异有统计学意义(F=626.473, P<0.01)。不同浓度白藜芦醇干预SMMC-7721细胞4 d后,克隆抑制率分别为26.28%±2.37%、27.62±8.62%、45.42%±6.23%、55.05%±5.63%、69.36%±3.75%、72.75%±4.10%,差异具有统计学意义(F=26.437, P<0.01)。

|
| Fig 2 Resveratrol inhibits human SMMC-7721 cell clonal proliferation A:Different concentrations of resveratrol inhibited the clonal proliferation of SMMC-7721 cells; B:Comparison of different concentrations of resveratrol on SMMC-7721 cells clone formation assay, **P < 0.01 vs 100 μmol·L-1 DMSO group |
与对照组相比,随着白藜芦醇组白藜芦醇浓度增加,G0/G1期细胞比例增加,S期、G2期减少,如Fig 3和Tab 2所示,G0/G1期细胞比例为对照组:60.22%±105.22%、60.39%±64.49%, 白藜芦醇组:61.14%±36.29%、60.47%±35.7%、45.85%±109.04%、48.15%±138.02%、90.13%±95.41%、76.01%±35.23%, 其中Res 50、100 μmol·L-1阻滞细胞在G0/G1期作用最明显(F=1894.538, P<0.01),呈剂量相关关系。
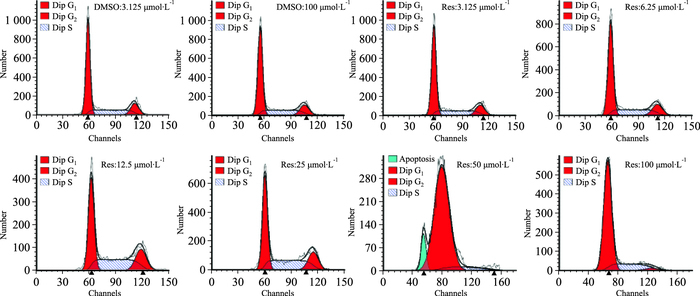
|
| Fig 3 Resveratrol blocks human SMMC-7721 cells in G0/G1 phase Comparison of different concentrations of resveratrol on SMMC-7721 cell cycle, ratio distribution of different cycle of cells. |
| Cell cycle/% | DMSO/μmol·L-1 | Resveratrol group/μmol·L-1 | ||||||
| 3.125 | 100 | 3.125 | 12.5 | 12.5 | 25 | 50 | 100 | |
| G0/G1 | 60.22±1.05 | 60.39±0.64 | 61.14±0.36 | 60.47±0.36 | 45.86±1.09** | 48.15±1.38** | 75.86±0.56** | 90.13±0.95** |
| S | 26.29±1.39 | 26.19±0.64 | 25.25±0.27 | 25.75±0.61 | 35.93±0.26** | 34.06±0.91** | 21.77±1.11** | 9.53±1.43** |
| G2 | 13.48±0.52 | 13.41±1.23 | 13.62±0.15 | 13.77±0.29 | 18.21±0.84** | 17.79±1.13** | 2.37±0.58** | 0.34±0.58** |
| Resveratrol group block SMMC-7721 cells in G0/G1 phase. **P<0.01 vs 100 μmol·L-1 DMSO group | ||||||||
如Fig 4所示,白藜芦醇干预人SMMC-7721细胞48 h后,DMSO对照组之间差异无统计学意义;与DMSO对照组相比,mTOR与β-actin的比值无显著性差异(F=1.859, P>0.05), 随药物浓度增加,mTOR磷酸化水平降低,差异具有统计学意义(F=584.387, P<0.01)。
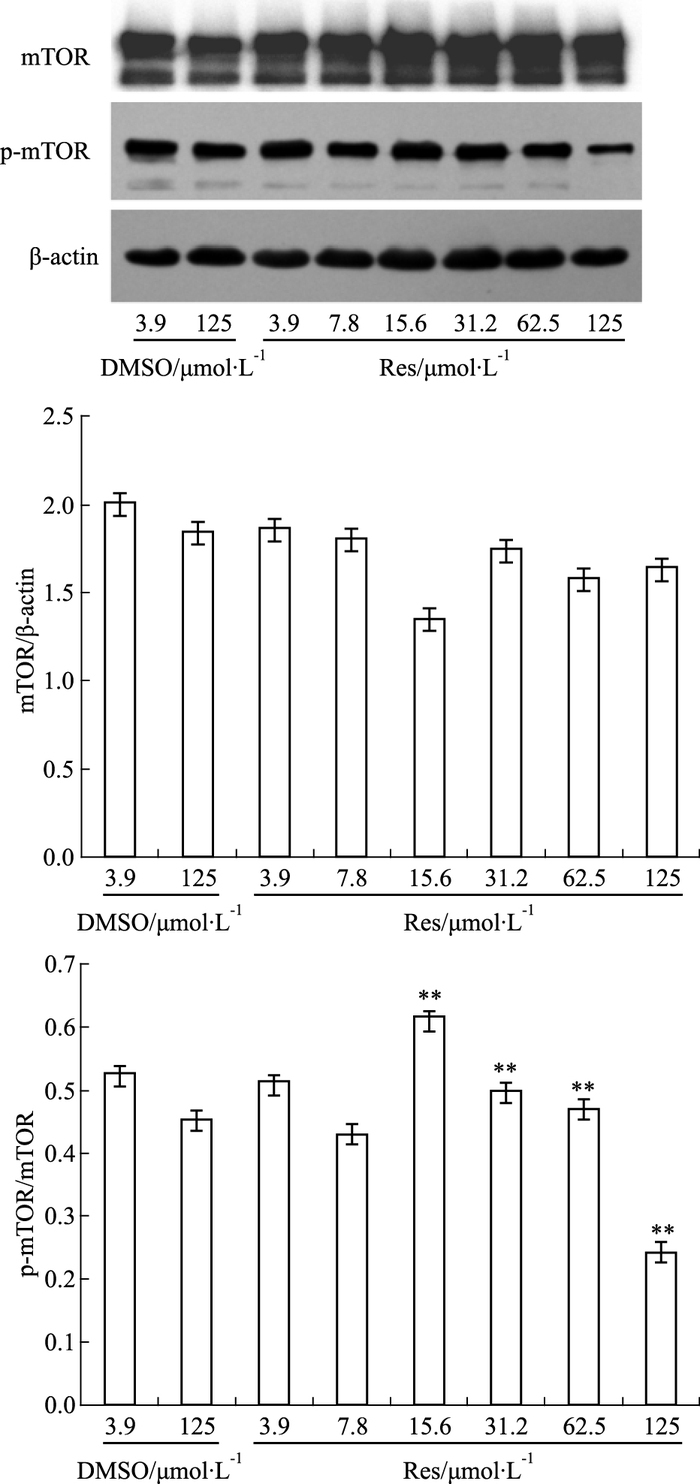
|
| Fig 4 Resveratrol reduces mTOR phosphorylation level Resveratrol had no effect on expression of mTOR protein, but reduced the mTOR phosphorylation level. **P < 0.01 vs 125 μmol·L-1 DMSO control group. |
Res是一种多酚类化学物,在虎杖、花生、葡萄等植物内含量较高。相关研究证实其具有抗血小板聚集、抗炎、清除自由基、抗氧化、心血管保护、雌激素样活性、生长抑制活性、免疫调节以及化学预防作用、诱导肿瘤细胞凋亡及抗肿瘤增殖活性等生物学作用[1-2]。1988年Clement等[3]首次发现白藜芦醇对人乳腺癌细胞有抑制作用,由于白藜芦醇毒副作用小的特点,近来对白藜芦醇抗肿瘤的研究较多,目前关于白藜芦醇抗肿瘤的研究在肝癌、前列腺癌、卵巢癌、胶质母细胞瘤、结肠癌等方面已取得了一定的成果[4-5]。白藜芦醇是一个具有多种功能,可作用于多个信号通路位点的生物学药物,由于肿瘤病变程度不同,白藜芦醇对相应时期的信号通路调控也不同。研究证实白藜芦醇可抑制PGC-1α的活性,从而下调PPARγ的表达,抑制AMPK的活化,抑制肝细胞脂肪变性,对肝细胞癌前病变具有一定的保护作用[6-8]。分子实验也证实白藜芦醇可通过对Bcl-2/Bax、Akt/mTOR等信号通路的调控发挥抑癌作用[9-10],从而抑制肝癌的发生和生长。
根据本实验对人SMMC-7721细胞生长曲线和克隆形成实验结果显示:与对照组相比,Res组细胞数量明显减少,提示白藜芦醇对人SMMC-7721细胞增殖具有明显的抑制作用,而且随着时间延长,抑制效果更明显,随着Res药物浓度的增大,抑制率也越大,呈剂量-效应和时间-效应相关关系(P<0.01)。细胞周期是细胞正常生长增殖过程中所经历的不同时期,完整的细胞周期是细胞增殖的必要条件。实验证实,与对照组相比,在一定药物浓度范围内,Res组G1期细胞增多,S期与G2期细胞群比例减少,说明白藜芦醇对人SMMC-7721的周期抑制作用点在G0/G1期,白藜芦醇干预肝癌细胞的物质代谢,抑制RNA和能量合成,从而阻止细胞进入S期,使细胞停滞在G1期,达到对癌细胞的增殖起到抑制作用。
雷帕霉素靶蛋白mTOR(mammalian target of rapamycin),是PI3K/Akt/mTOR通路的核心基因,其表达与细胞周期和能量代谢机制相关,对细胞具有调节生长增殖、调节代谢机制、调控免疫反应和调控细胞凋亡自噬等作用[11-12]。mTOR的异常激活能促进细胞异常增殖,并向肿瘤转化,在胃癌、肝癌、肺癌等多种肿瘤细胞发现mTOR的异常活化,而抑制mTOR激活可诱导自噬,导致细胞衰老和细胞周期阻滞,抑制癌细胞的增殖,说明mTOR的表达与肿瘤细胞增殖有重要关联[13]。谢松强等[14]证实抑制mTOR激活导致肝癌细胞凋亡。实验结果显示,白藜芦醇对人SMMC-7721细胞mTOR表达无明显影响,但降低mTOR磷酸化水平(P<0.01),说明mTOR蛋白的激活受阻,提示白藜芦醇可以抑制mTOR的活化。由此推测,白藜芦醇抑制人SMMC-7721细胞增殖、阻滞细胞于G1期的机制可能与降低mTOR磷酸化水平有关。
综上可知,白藜芦醇对体外人肝癌细胞SMMC-7721具明显的抑制作用,其作用机制可能与白藜芦醇阻滞细胞于G1期,降低mTOR磷酸化水平有关,证实中药提取物具有明显的抑癌效果,为中药抑癌提供参考。
( 致谢: 本实验在桂林医学院科学实验中心广西肝脏损伤与修复分子医学重点实验室完成,对实验参与人员表示感谢。)
| [1] | Fang L, Gao H, Zhang W, et al. Resveratrol alleviates nerve injury after cerebral ischemia and reperfusion in mice by inhibiting inflammation and apoptosis[J]. Int J Clin Exp Med, 2015, 8(3): 3219-26. |
| [2] | Rahal K, Schmiedlin-Ren P, Adler J, et al. Resveratrol has antiinflammatory and antifibrotic effects in the peptidoglycan-polysaecharide rat model of Crohn′s disease[J]. Inflamm Bowel Dis, 2012, 18(4): 613-23. doi:10.1002/ibd.21843 |
| [3] | Clément M V, Hirpara J L, Chawdhury S H, et al. Chemopreventive agent resveratrol, a natural product derived from grapes, triggers CD95 signaling-dependent apoptosis in human tumor cells[J]. Blood, 1998, 92(3): 996-1002. |
| [4] | Wang Z, Wu L X, Tong S Y, et al. Resveratrol suppresses the epithelial-to-mesenchymal transition in PC-3 cells by down-regulating the PI3K/AKT signaling pathway[J]. Animal Cells Systems, 2016, 20(2): 77-85. doi:10.1080/19768354.2016.1150344 |
| [5] | 曾于桦, 邵英, 李洋, 等. 白藜芦醇抑制人结肠癌细胞增殖的作用与促进骨形态蛋白9及其受体表达的关系研究[J]. 中国药理学通报, 2016, 32(12): 1705-11. Zeng Y H, Shao Y, Li Y, et al. Study on relation between anti-proliferation effect of reveratrol and resveratrol-induced bone morphogenetic protein 9 and its receptors in colon cancer cells[J]. Chin Pharmacol Bull, 2016, 32(12): 1705-11. doi:10.3969/j.issn.1001-1978.2016.12.014 |
| [6] | Xiong W, Yin A, Mao X, et al. Resveratrol suppresses human glioblastoma cell migration and invasion via activation of RhoA/ROCK signaling pathway[J]. Oncol Lett, 2016, 11(1): 484-90. |
| [7] | Faghihzadeh F, Adibi P, Rafiei R, et al. Resveratrol supplementation improves inflammatory biomarkers in patients with nonalcoholic fatty liver disease[J]. Nutr Res, 2014, 34(10): 837-43. doi:10.1016/j.nutres.2014.09.005 |
| [8] | Heebøll S, Thomsen K L, Pedersen S B, et al. Effects of resveratrol in experimental and clinical non-alcoholic fatty liver disease[J]. World J Hepatol, 2014, 6(4): 188-98. doi:10.4254/wjh.v6.i4.188 |
| [9] | Wang X, Wang D, Zhao Y. Effect and mechanism of resveratrol on the apoptosis of lung adenocarcinoma cell line A549[J]. Cell Biochem Biophys, 2015, 73(2): 527-31. doi:10.1007/s12013-015-0696-3 |
| [10] | 卢乙众, 刘小红, 路平, 等. 白藜芦醇对大鼠肝癌细胞CBRH7 919凋亡的诱导作用研究[J]. 中国临床药理学杂志, 2016, 32(9): 821-3. Lu Y Z, Liu X H, Lu P, et al. Effect of resveratrol on apoptosis of hepatoma cells CBRH7929 in rat[J]. Chin J Clin Pharmacol, 2016, 32(9): 821-3. |
| [11] | Chi H. Regulation and function of mTOR signalling in T cell fate decisions[J]. Nat Rev Immunol, 2012, 12(5): 325-38. |
| [12] | 肖昊, 谭碧娥, 吴苗苗, 等. mTOR信号通路调节细胞能量代谢的机制[J]. 中国科学:生命科学, 2015, 45(11): 1124-31. Xiao H, Tan B E, Wu M M, et al. Regulatory mechanism of mTOR signaling pathway on cell energy metabolism[J]. Sci China: Life Sci, 2015, 45(11): 1124-31. |
| [13] | Carver B S, Chapinski C, Wongvipat J, et al. Reciprocal feedback regulation of PI3K and androgen receptor signaling in PTEN-deficient prostate cancer[J]. Cancer Cell, 2011, 19(5): 575-86. doi:10.1016/j.ccr.2011.04.008 |
| [14] | 谢松强, 李骞, 张亚宏, 等. 萘酰亚胺-多胺缀合物NNINspm通过PI3K/Akt信号通路诱导肝癌细胞凋亡[J]. 中国药理学通报, 2010, 26(2): 169-74. Xie S Q, Li Q, Zhang Y H, et al. NNIN spm, naphtha ide-polyam ine conjugate, induces hepatoma HepG2 cell apoptosis via PI3K/Akt pathways[J]. Chin Pharmacol Bull, 2010, 26(2): 169-74. |

