


2. 中国科学院西北高原生物研究所,青海 西宁 810001
2. Key Lab of Tibetan Medicine Research, Northwest Institute of Plateau Biology, Chinese Academy of Sciences, Xining 810001, China
脂肪组织是胰岛素作用的主要靶器官之一,脂肪细胞增殖分化失常,会导致脂肪过度堆积、脂肪细胞内分泌功能紊乱,继而引起肥胖症和胰岛素抵抗。处于胰岛素抵抗状态的器官或组织,对胰岛素的反应敏感性会下降。当脂肪组织出现胰岛素抵抗时,细胞的葡萄糖摄取能力下降,而肝糖原的合成减少,并且加速肝糖原的分解和释放,致使血糖升高。此外,异常分化的脂肪细胞会分泌大量脂肪细胞因子,进一步诱导肝脏和骨骼肌等组织发生胰岛素抵抗,最终引发全身性糖脂代谢的紊乱,进而引起II型糖尿病的发生[1-2]。所以,胰岛素抵抗被认为是肥胖引发2型糖尿病的枢纽。因此,研究调控脂肪细胞胰岛素抵抗发生和发展的分子机制,寻找能抑制前体脂肪细胞分化和改善胰岛素抵抗的药物,对于治疗肥胖和糖尿病有重要的意义。
胡芦巴(Trigonella foenum-graecum L.)是豆科胡芦巴属的一年生草本植物,其种子又名胡芦巴。黄酮类化合物是胡芦巴的主要活性成分之一,已有研究发现其具有抗氧化、调血脂、增强免疫力等药理作用[3]。荭草素(orientin)是胡芦巴黄酮类化合物的主要成分之一,具有抗炎、抗凝血、抗氧化、保护心脏等活性[4-5]。Kim等[6]发现,荭草素对3T3-L1脂肪细胞中脂质的积累具有一定的抑制作用。然而,有关荭草素抑制3T3-L1前脂肪细胞分化,改善胰岛素抵抗作用机制的研究报道较少。本研究以3T3-L1前脂肪细胞和分化成熟的3T3-L1脂肪细胞为靶细胞,分别考察荭草素对3T3-L1前脂肪细胞活力和分化的影响,以及荭草素对胰岛素抵抗3T3-L1脂肪细胞糖脂代谢的影响,探讨荭草素改善胰岛素抵抗的作用及其分子机制。
1 材料与方法 1.1 细胞与试剂3T3-L1前脂肪细胞,购自中国典型培养物保藏中心。荭草素(纯度>96%),本实验室自制;DMEM高糖培养基、胎牛血清,Gibco公司;MTT、DMSO、3-异丁基-1-甲基黄嘌呤(IBMX)、地塞米松、胰蛋白酶、油红O,Sigma公司;荧光标记2-脱氧葡萄糖(2-[N-(7-nitrobenz-2-oxa-1, 3-diaxol-4-yl)amino]-2-deoxyglucose, 2-NBDG),Invitrogen公司;BCA蛋白测定试剂盒、甘油三酯测定试剂盒,北京普利莱基因技术有限公司;腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase, AMPK)、乙酰辅酶A羧化酶(acetyl CoA carboxylase, ACC)、葡萄糖转运体4(glucose transporter type 4, GLUT4) 等抗体,Santa Cruz公司;其他试剂为国产分析纯。
1.2 仪器与设备SpectraMax Paradigm型多功能酶标仪,美国美谷分子仪器有限公司;DYCZ-24DN型电泳槽电泳仪,北京六一仪器厂;HC-3018R型高速冷冻离心机,安徽中科中佳科学仪器有限公司;Tanon 5200凝胶成像系统,上海天能公司;激光共聚焦显微镜,Olympus公司。
1.3 方法 1.3.1 荭草素储备液的制备荭草素溶液采用DMSO溶解,配置成200 mmol·L-1的储备液,0.22 μm滤膜过滤除菌,使用时采用DMEM细胞培养基稀释至所需浓度。
1.3.2 3T3-L1前脂肪细胞的培养及诱导分化前脂肪细胞使用DMEM完全培养基,于37℃、5% CO2、饱和湿度的培养箱中培养。待生长至对数期,胰酶消化,接种于6孔板。待细胞发生接触抑制后2 d,即为d 0,换诱导液Ⅰ(含0.5 mmol·L-1 IBMX、1 μmol·L-1地塞米松、10 mg·L-1胰岛素的完全培养基);继续培养2 d后,换诱导液Ⅱ(含10 mg·L-1胰岛素的DMEM完全培养基);继续培养2 d,换DMEM培养基,隔2 d换液1次,至90%以上3T3-L1细胞呈现脂肪细胞表型。
1.3.3 MTT法测定细胞活力取对数生长期的前脂肪细胞,接种于96孔板中,孵育12 h,换以含不同浓度荭草素(5、10、25、50 μmol·L-1)的完全培养基,另设诱导组(Induce,不加荭草素),继续培养48 h。于实验结束前4 h,加20 μL新鲜配制的MTT溶液,4 h后弃培养基,每孔加入150 μL DMSO充分溶解结晶物。测定570 nm波长下的吸光度A。细胞活力/%(A处理/A对照)×100%。
1.3.4 油红O染色及甘油三酯(triglyceride, TG)含量检测诱导分化的同时,于培养基中加入不同浓度的荭草素,连续处理8 d后,4%多聚甲醛固定30 min,加油红O染液孵育1 h,吸弃染液,70%乙醇浸洗,显微镜下观察脂滴形成情况并拍照。每孔加入150 μL异丙醇,溶解油红O染料,于酶标仪上测定490 nm波长处的吸光度A,以(A处理/A对照)×100%评价细胞脂质积累。同时,采用TG酶法测定试剂盒,裂解收集细胞,测定细胞内TG含量,BCA法测定蛋白浓度,以mmol·g-1 Pro校正细胞内TG含量。
1.3.5 建立3T3-L1脂肪细胞胰岛素抵抗模型参考文献[7]方法,取诱导分化成熟的3T3-L1脂肪细胞,分为诱导组(Induce)和模型组(Model)。诱导组用10%胎牛血清DMEM高糖培养基,模型组用含1 μmol·L-1地塞米松、10%胎牛血清的DMEM高糖培养基处理4 d,动态测定2-NBDG摄取,确定建模成功后,分组处理。
1.3.6 细胞2-NBDG摄取的测定参考文献[8]的方法,将胰岛素抵抗状态的3T3-L1脂肪细胞(简称IR脂肪细胞,下同)接种于96孔荧光板,在无血清、低糖培养基中孵育12 h,然后设模型组和不同浓度荭草素组,处理24 h,用含20 μmol·L-1 2-NBDG、100 nmol·L-1胰岛素避光孵育1 h。弃去培养基,PBS漂洗2次,在激发波长488 nm,发射波长520 nm条件下测定,通过检测细胞荧光强度来评估脂肪细胞葡萄糖摄取量。
1.3.7 Western blot法检测蛋白表达IR脂肪细胞加药处理48 h,按照试剂盒说明书抽提细胞膜蛋白和总蛋白,BCA法测定蛋白浓度。样品蛋白进行变性处理后,用10%的SDS-PAGE分离胶、5%的浓缩胶分离蛋白,转膜,5% BSA封闭,用1 :1 000稀释的兔抗p-AMPK、t-AMPK、p-ACC、t-ACC、GLUT4一抗在4℃条件下孵育过夜,TBST洗3次,再用1 :5 000稀释的辣根过氧化物酶标记的二抗室温孵育2 h,TBST洗3次,显影后拍照,并分析蛋白产物条带的相对光密度值。
1.3.8 免疫荧光法检测GLUT4的表达将细胞接种于预置盖玻片的24孔板内,不同浓度的荭草素处理48 h后,用PBS漂洗3次,4%多聚甲醛固定20 min,5% BSA封闭60 min,加入兔抗鼠GLUT4(1 :1 000稀释),4℃湿盒过夜;次日,用PBS漂洗3次;加入FITC标记的羊抗兔IgG二抗(1 :500稀释),室温孵育2 h,PBS漂洗3次,10 mg·L-1 DAPI染色3 min后,激光共聚焦显微镜下观察并成像。
1.4 统计学处理实验数据用x±s表示,用SPSS 22.0统计学分析软件进行数据统计分析,以F检验进行组间统计学差异比较。
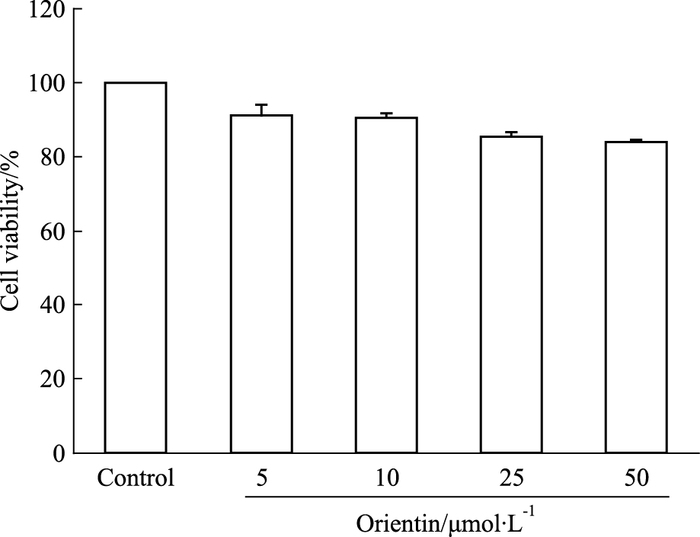
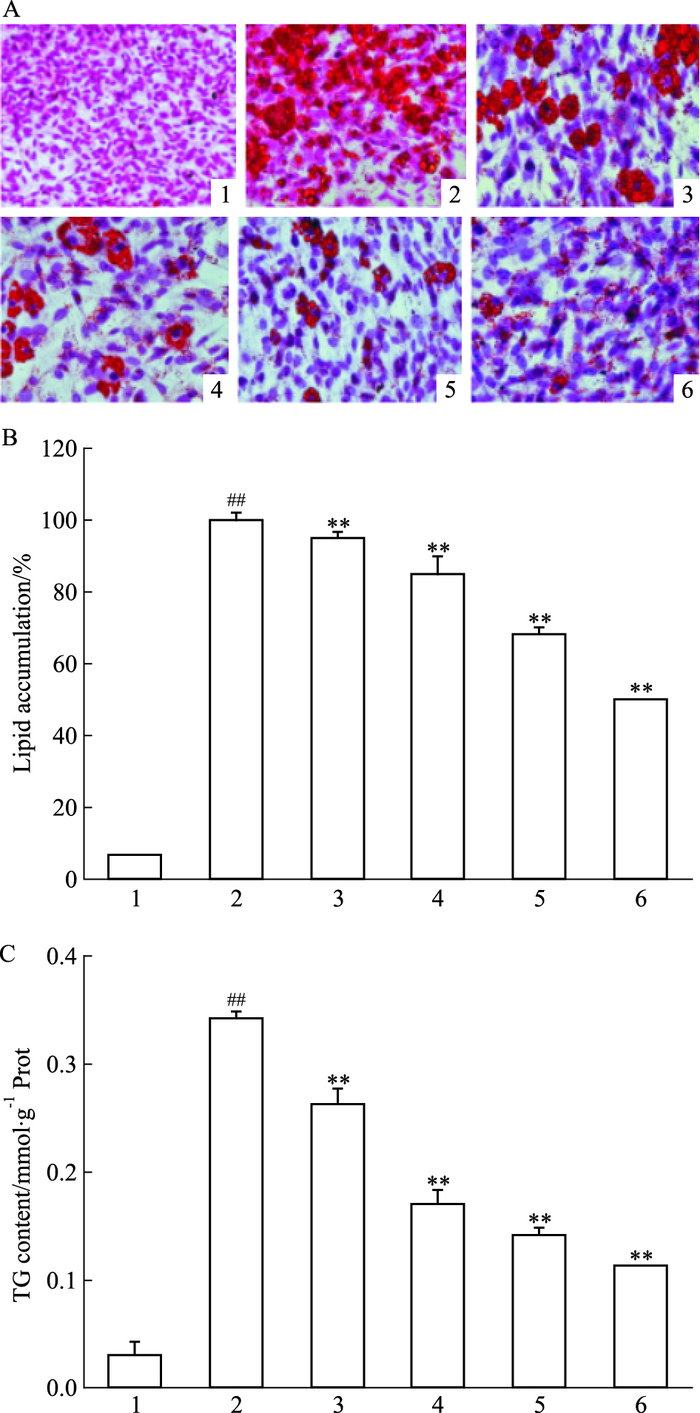
2 结果 2.1 荭草素对脂肪细胞活力及分化的影响荭草素5~50 μmol·L-1范围内,对3T3-L1前脂肪细胞增殖活力无影响(P>0.05),见Fig 1。与对照组相比,诱导组细胞内形成较大脂滴,且呈戒环样结构,表明3T3-L1细胞已分化成熟。荭草素干预后,细胞内脂滴数量明显减少(Fig 2A);与诱导组相比较,荭草素能降低细胞脂质积累(P<0.01),同时浓度依赖性地减少了前脂肪细胞内TG含量(P<0.01),见Fig 2B、2C。
|
| Fig 1 Effect of orientin on cell viability of 3T3-L1 preadipocytes |
|
| Fig 2 Effect of orientin on(A) formation of lipid droplets(oil red O and hematoxylin staining, 200×), (B) lipid accumulation, and (C) intracellular TG content in 3T3-L1 pre-adipocytes(x±s, n=3) 1:Control; 2:Induce; 3:Orientin 5 μmol·L-1; 4:Orientin 10 μmol·L-1; 5:Orientin 25 μmol·L-1; 6:Orientin 50 μmol·L-1; Control: Undifferentiated 3T3-L1 pre-adipocytes; Induce: Differentiated mature 3T3-L1 adipocytes.##P < 0.01 vs control; **P < 0.01 vs induce |
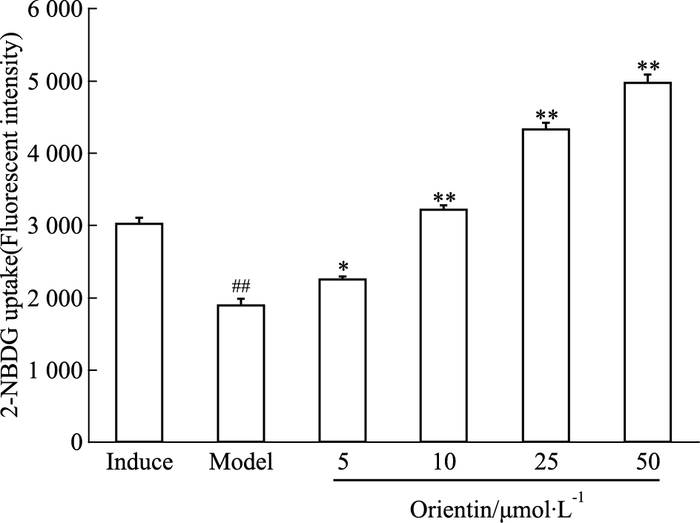
由Fig 3可见,采用1 μmol·L-1地塞米松诱导处理4 d,相对于诱导组,模型组的2-NBDG摄取能力下降(P<0.01),确定IR建模成功。与模型组相比较,荭草素各浓度组不同程度促进了IR脂肪细胞对葡萄糖的摄取利用,2-NBDG摄取量较对照组明显增加(P<0.05,P<0.01)。
|
| Fig 3 Effects of orientin on glucose uptake in insulin-resistant 3T3-L1 adipocytes(x±s, n=3) Induce: Differentiated mature 3T3-L1 adipocytes; Model: Dexamethasone induced insulin-resistant mature adipocytes.##P < 0.01 vs induce; *P < 0.05, **P < 0.01 vs model |
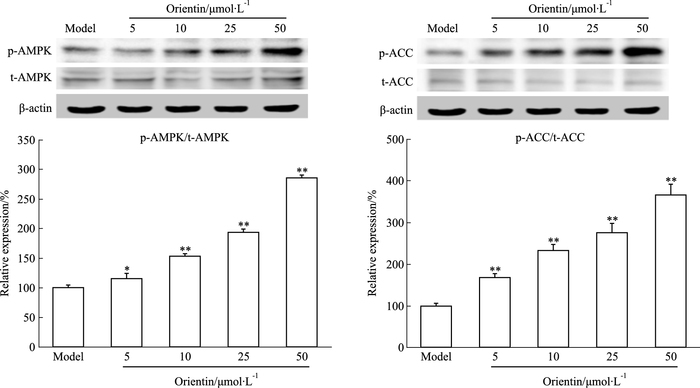
采用Western blot检测IR脂肪细胞内AMPK、ACC的磷酸化水平。如Fig 4所示,与模型组相比较,荭草素能明显上调AMPK、ACC的磷酸化水平(P<0.05,P<0.01)。
|
| Fig 4 Orientin up-regulates AMPK and ACC phosphorylation in insulin-resistant adipocytes(x±s, n=3) *P < 0.05, **P < 0.01 vs model |
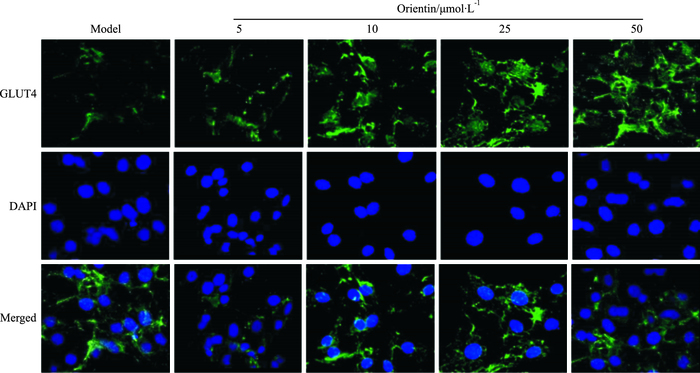
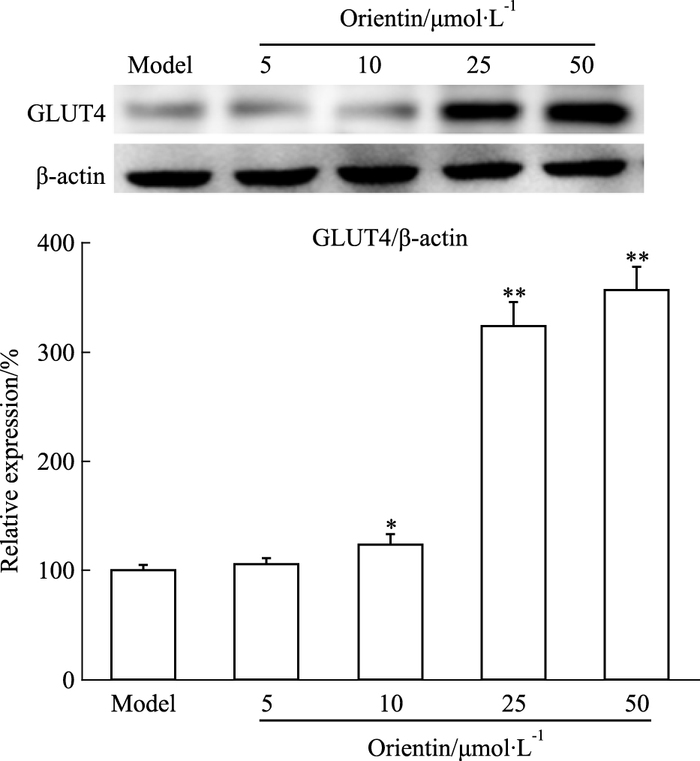
Fig 5免疫荧光检测结果显示,荭草素能增强细胞质及细胞膜GLUT4表达,细胞核内未见表达。与模型组相比较,荭草素浓度在10~50 μmol·L-1范围内,能上调细胞膜上GLUT4的蛋白表达水平(Fig 6),与免疫荧光检测结果相符。
|
| Fig 5 Orientin enhances translocation of GULT4 to cell membranes in insulin-resistant 3T3-L1 adipocytes The GLUT4 expression was observed by confocal laser-scanning microscope after fluorescent immunocytochemical staining(400×) FITC labeled GLUT4 protein appeared on the cell membrane(green) and DAPI dye for fluorescent staining of DNA(blue) |
|
| Fig 6 Protein expression of cell surface GLUT4 in insulin-resistant 3T3-L1 adipocytes treated with orientin(x±s, n=3) *P < 0.05, **P < 0.01 vs model |
3T3-L1前脂肪细胞目前在国内外被广泛应用于脂肪细胞功能及糖脂代谢障碍的病理生理学研究。研究结果发现,荭草素能浓度依赖性地抑制3T3-L1细胞的分化,减少脂肪细胞TG含量,且对细胞增殖活力没有影响,表明荭草素具有潜在的减肥降脂功效。
建立IR模型可以在细胞及分子水平深入研究IR的发生机制、体外筛选改善IR的药物[9]。采用1 μmol·L-1地塞米松诱导成熟的脂肪细胞4 d后,细胞对2-NBDG摄取能力降到最低,即IR状态达到最佳。然后,考察荭草素对IR脂肪细胞葡萄糖摄取的影响。结果发现,荭草素增加了细胞对2-NBDG的摄取能力,并呈现剂量依赖性,表明荭草素对IR脂肪细胞糖代谢具有改善作用。
AMPK是细胞糖脂代谢的关键调控因子,其活化可增强各组织的胰岛素敏感性。ACC是脂肪酸合成的关键酶,活化的AMPK可以使ACC磷酸化,从而抑制脂肪酸的合成,促进脂肪酸氧化[10-11]。在胰岛素刺激下,GLUT4从囊泡转位至细胞膜,将细胞外的葡萄糖摄取进入细胞。GLUT4表达数量的减少或转位受阻皆有可能引起胰岛素抵抗[12]。AMPK可诱导GLUT4向质膜转移,并通过磷酸化转录因子开启GLUT4基因的表达,促进外周组织的葡萄糖摄取,从而对胰岛素抵抗和糖尿病等起到治疗作用。在药效研究基础上,进一步考察了荭草素对IR脂肪细胞调控糖脂代谢相关蛋白表达水平及对GLUT4向膜转位的影响。结果发现,荭草素能明显上调AMPK和ACC的磷酸化水平,同时促进了GLUT4向膜转位及其蛋白表达水平。表明荭草素可能通过上调AMPK/GLUT4信号途径相关蛋白的表达,促进了细胞对葡萄糖的摄取,从而改善脂肪细胞的IR。
综上所述,荭草素可抑制前脂肪细胞的分化,降低细胞内TG的含量;同时,荭草素能激活AMPK、ACC的磷酸化水平,进而促进GLUT4的表达和向膜转位,从而促进了IR脂肪细胞的葡萄糖摄取,改善了脂肪细胞IR。
( 致谢: 本实验在烟台大学生命科学学院,线粒体与健康衰老研究中心完成,衷心感谢实验室全体教师的指导和同学的帮助! )
| [1] | 涂珺, 罗新新, 李冰涛, 等. 小檗碱对脂肪胰岛素抵抗细胞PPARγ及脂肪分泌因子表达的影响[J]. 中国中药杂志, 2016, 41(11): 1983-9. Tu J, Luo X X, Li B T, et al. Effects of berberine on mRNA expression levels of PPARγ and adipocytokines in insulin-resistant adipocytes[J]. Chin J Chin Mater Med, 2016, 41(11): 1983-9. |
| [2] | 刘庆丰, 刘毅, 焦正, 等. 三黄汤对3T3-L1脂肪细胞糖脂代谢的影响[J]. 中国药理学通报, 2016, 32(6): 868-73. Liu Q F, Liu Y, Jiao Z, et al. Effect of Sanhuang decoction on glucose and lipid metabolism in 3T3-L1 adipocytes[J]. Chin Pharmacol Bull, 2016, 32(6): 868-73. |
| [3] | Rayyan S, Fossen T, Andersen ØM. Flavone C-glycosides from seeds of fenugreek, Trigonella foenum-graecum L[J]. J Agr Food Chem, 2010, 58(12): 7211-7. doi:10.1021/jf100848c |
| [4] | Ying L K, Ling A P K, Yian K R, et al. A review on medicinal poperties of orientin[J]. Adv Pharmacol Sci, 2016, 2016(4): 1-9. |
| [5] | Yadav U C, Baquer N Z. Pharmacological effects of Trigonella foenum-graecum L. in health and disease[J]. Pharm Biol, 2014, 52(2): 243. doi:10.3109/13880209.2013.826247 |
| [6] | Kim J, Lee I, Seo J, et al. Vitexin, orientin and other flavonoids from Spirodela polyrhiza inhibit adipogenesis in 3T3-L1 cells[J]. Phytother Res Ptr, 2010, 24(10): 1543-8. doi:10.1002/ptr.v24:10 |
| [7] | 张汝学, 贾正平, 李茂星, 等. 体外胰岛素抵抗细胞模型的建立及在药物筛选中的应用[J]. 中国药理学通报, 2008, 24(7): 971-6. Zhang R X, Jia Z P, Li M X, et al. The establishment of insulin resistant model in vitro and preliminary application for screening drugs[J]. Chin Pharmacol Bull, 2008, 24(7): 971-6. |
| [8] | Manaharan T, Ming C H, Palanisamy U D. Syzygium aqueum leaf extract and its bioactive compounds enhances pre-adipocyte differentiation and 2-NBDG uptake in 3T3-L1 cells[J]. Food Chem, 2013, 136(2): 354-63. doi:10.1016/j.foodchem.2012.08.056 |
| [9] | Sakoda H, Ogihara T, Anai M, et al. Dexamethasone-induced insulin resistance in 3T3-L1 adipocytes is due to inhibition of glucose transport rather than insulin signal transduction[J]. Diabetes, 2000, 49(10): 1700-8. doi:10.2337/diabetes.49.10.1700 |
| [10] | Peng I C, Chen Z, Sun W, et al. Glucagon regulates ACC activity in adipocytes through the CAMKKβ/AMPK pathway[J]. Am J Physiol Endocrinol Metab, 2012, 302(12): 1560-8. doi:10.1152/ajpendo.00504.2011 |
| [11] | 秦佑, 杨瑞仪, 陈梅果, 等. 树豆酮酸A抑制3T3-L1细胞脂肪合成与分解的作用研究[J]. 中国药理学通报, 2016, 32(2): 189-93. Qin Y, Yang R Y, Chen M G, et al. Inhibitory effect of cajanonic acid A on lipogenesis and lipolysis in 3T3-L1 adipocytes[J]. Chin Pharmacol Bull, 2016, 32(2): 189-93. |
| [12] | 洪海棉, 谢秀利, 洪桂祝, 等. 大黄素激活AMPK、PPARγ对3T3-L1脂肪细胞葡萄糖摄取的影响[J]. 中国药理学通报, 2015, 31(11): 1569-75. Hong H M, Xie X L, Hong G Z, et al. Activation of AMPK and PPARγ by emodin influences glucose uptake in 3T3-L1 adipocytes[J]. Chin Pharmacol Bull, 2015, 31(11): 1569-75. doi:10.3969/j.issn.1001-1978.2015.11.018 |

