


肝纤维化是慢性肝病所共有的病理变化,其主要表现为细胞外基质(extracellular matrix, ECM)异常过度地沉积,进而影响肝脏的功能,肝纤维化可发展为肝硬化甚至肝癌,已有研究表明,若去除损伤因子肝纤维化能够发生逆转[1]。但其发生机制还不明确,肝星状细胞(hepatic stellate cell,HSC)活化增殖是肝纤维化的中心事件,抑制HSC增殖是促进肝纤维化逆转的关键。研究表明,HSC的活化、增殖能够导致ECM过度沉积,而HSC作为肝纤维化发生发展中的重要效应细胞一直以来都是肝脏相关疾病的研究热点。细胞信号转导抑制因子(supperssor of cytokine signaling,SOCS)蛋白家族,尤其是SOCS3能够对信号转导通路进行负性调控,参与炎症等相关疾病的发生发展,SOCS3蛋白在肝脏的慢性炎症过程中同样也起着重要的作用[2]。转化生长因子β1(tansforming growth factor beta1, TGF-β1) 作为一种强的促纤维化因子,能够激活HSC,促进ECM大量沉积,而HSC的激活、增殖和ECM大量过度沉积是导致肝脏纤维化发生发展的重要环节[3]。SOCS3对肝脏纤维化及TGF-β1的研究已有报道,但对于逆转过程却少有研究,本研究通过建立小鼠肝纤维化进展和逆转模型和HSC-T6的正常、模型、逆转(TGF-β1+MDI)[4],通过SOCS3过表达质粒作用于体外细胞逆转过程,观察过表达SOCS3对逆转过程的影响及可能的作用机制。
1 材料 1.1 试剂细胞因子信号传导抑制蛋白-3(SOCS3,ESAP10752)、TGF-β1(ESAP10795)、β-肌动蛋白(β-actin,ENM0214)、α-平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA,EBP20140)、Ⅰ型胶原(collagen Ⅰ, colla-1,EPP11729) 均购自武汉伊莱瑞特生物科技有限公司(Elabscience);FITC标记的抗兔荧光二抗(ab6717) 和TRITC标记的抗鼠荧光二抗(ab6786) 购自英国Abcam公司;辣根过氧化酶标记的山羊抗兔IgG购买自北京博奥森公司(ZB-2301);LV3-SOCS3-mus-1225质粒购自上海吉玛公司(BW-12389);DMEM高糖培养基购自凯基生物有限公司(BW-05137);3-异丁基-1-甲基黄嘌呤(1-Methyl-3-isobutylxanthine,IBMX,17018)、地塞米松(D4902)、胰岛素(15500) 均购自Sigma公司;TGF-β1(BW-06286) 购自PeproTech公司。
1.2 实验动物清洁级C57BL/6,♂,小鼠100只,7周龄体质量为18 g~22 g,由安徽医科大学实验动物中心提供,饲养环境模拟自然昼夜条件,期间为温度(25±2)℃,湿度40%~45%,自由饮水。
1.3 仪器IX83P2ZF荧光倒置显微镜,日本Olympus公司产品;CM1950冰冻切片机、TP1020组织脱水机,德国Leica公司产品;ChemiQ4500化学发光成像系统,上海欧翔科学仪器有限公司产品;DW-25L262-25度低温保存箱,青岛海尔集团产品;ND2000超微量核酸蛋白测定仪,美国热电公司产品;5424R冷冻离心机,德国Eppendorf公司产品; XB70制冰机,美国Grant公司产品;BCD-186 KB冰箱,青岛海尔集团产品。
2 方法 2.1 动物造模与实验分组 2.1.1 造模体质量18 g~22 g (7周龄左右), ♂, C57BL/6皮下注射31.90 g·L-1四氯化碳(橄榄油稀释),每次0.15 mL,每周2次,首剂加倍,连续注射1个月。纤维化模型完成后,正常饮食1个月成逆转模型。
2.1.2 动物实验分组建立小鼠肝脏纤维化模型和纤维化逆转模型,将C57BL/6,♂,小鼠100只,随机分为对照组(Control, 20只),纤维化模型组(Model, 40只),纤维化逆转组(Recovery, 40只),其中纤维化模型组分为4组:纤维化进展1周(Fibrosis 1 week,F1W)、纤维化进展2周(Fibrosis 2 weeks,F2W)、纤维化进展3周(Fibrosis 3 weeks,F3W)、纤维化进展4周(Fibrosis 4 weeks,F4W, Model), 每组10只。逆转组分为4组:纤维化逆转1周(Recovery 1 week,R1W)、纤维化逆转2周(Recovery 2 weeks,R2W)、纤维化逆转3周(Recovery 3 weeks,R3W)、纤维化逆转4周(Recovery 4 weeks,R4W, Recovery),每组10只。
2.1.3 细胞实验分组体外HSC-T6细胞株使用凯基高糖培养基进行培养,用TGF-β1刺激细胞成纤维化状态(TGF-β1组),加MDI逆转培养基作用48 h后纤维化逆转,形成逆转组(TGF-β1+MDI组),过表达SOCS3质粒观察对逆转过程的影响,形成过表达逆转组(pEGFP-N1-SOCS3组)。
2.2 HSC-T6细胞的培养和转染 2.2.1 HSC-T6细胞的培养使用含10%胎牛血清的凯基高糖DMEM培养基,在37℃、5% CO2条件下进行细胞培养,待细胞长至70%~80%密度时进行细胞传代。
2.2.2 HSC-T6细胞的转染细胞培养及pEGFP-N1-SOCS3转染HSC-T6细胞培养于含10%胎牛血清的凯基高糖DMEM培养基,37 ℃、5% CO2培养。转染24 h前,将细胞接种于6孔培养板,每孔2×105细胞。实验分模型组、逆转组、阴性对照组和pEGFP-N1-SOCS3实验组。正常组不做任何处理;模型组加入TGF-β1;阴性对照组转染阴性对照pEGFP-N1-Control并加入TGF-β1及MDI逆转培养基;实验组转染pEGFP-N1-SOCS3并加入TGF-β1及MDI逆转培养基。用Opti-MEM和脂质体作为转染试剂进行转染,转染后于37℃、5% CO2培养箱继续培养,6 h后,换液,每孔加入完全培养基,继续培养48 h,收集细胞。
2.3 组织学检查取肝脏组织,固定,脱水,石蜡包埋,二甲苯和梯度酒精脱蜡,进行苏木精-伊红染色(hematoxylin and eosin, HE)和Masson染色;免疫组织化学(immunohistochemistry,IHC)检测中,柠檬酸盐进行抗原修复,0.3% H2O2阻断内源性过氧化氢酶,孵育一抗α-SMA(1 :200)、Colla-1(1 :200)、SOCS3(1 :100)、TGF-β1(1 :100)4℃冰箱过夜,一抗孵育后PBS清洗3次×5 min,通用型二抗室温孵育60 min,PBS清洗3次×5 min,二氨基联苯胺盐酸盐(3, 3′-diaminobenzidine tetrahydrochloride,DAB)显色,苏木精进行复染,观察相应组织学指标的变化。
2.4 Western blot分析组织蛋白匀浆和细胞蛋白均使用蛋白裂解液RIPA和PMSF(100 :1) 将蛋白放置于冰上摇晃充分裂解30 min,进行蛋白提取,提取后使用NanoDrop2000蛋白定量仪对提取蛋白进行定量,最后加入5×蛋白上样缓冲液于100℃沸水中煮沸10 min,使蛋白充分变性。变性后的蛋白使用SDS-PAGE凝胶电泳,湿法转膜将内参、Colla-1、SOCS3、α-SMA、TGF-β1转至0.45 μm的PVDF膜上,TBST稀释的5%脱脂奶粉封闭3 h,TBST 5 min/次,3遍后将膜放于相应的一抗中,放置4℃冰箱过夜,使用辣根过氧化物酶标记的二抗对相应的膜上蛋白进行检测,最后通过ECL发光试剂盒进行曝光成像,使用Image-Pro Plus对所得图像结果进行处理分析。
2.5 肝脏组织免疫荧光双染(immunofluorescence,IF)新鲜肝脏大叶组织用多聚甲醛固定24 h,用蔗糖水对固定后的肝脏组织清洗,每12 h换1次液,重复3次,清洗后的肝脏组织用冰冻包埋液将其包埋于相应的模具中,放置-20℃冰箱中冻存,用Leica冰冻切片机进行切片,为了观察SOCS3和肝脏星状细胞的共定位情况,使用肝脏星状细胞的标志物α-SMA鼠抗(1 :100) 同SOCS3兔抗(1 :100) 进行双染,DAPI染细胞核,使用TRITC共轭标记的荧光二抗(鼠抗)和FITC共轭标记的荧光二抗(兔抗)进行标定,使用荧光倒置显微镜对正常、模型和逆转冰冻切片进行观察,细胞核呈蓝色,肝星状细胞呈红色,SOCS3呈翠绿色。
2.6 MDI逆转培养基的配置IBMX加450 μL DMSO溶解,分装成50 μL 1管;地塞米松:规格100 mg,18.6 mg地塞米松+4.739 mL DMSO溶解,浓度为10 mmol·L-1,过滤,-20℃保存;胰岛素:取浓盐酸200 μL加入66.2 mL ddH2O2水中,调节pH值为2~3,5 mg胰岛素+25 mL上述溶液进行溶解,分装后,-20℃保存;100 mL培养基中加入溶解的IBMX 50 μL+地塞米松10 μL+胰岛素576.7 μL。
2.7 统计学分析采用SPSS17.0软件进行分析,先将各组数据进行方差齐性检验,单因素方差分析定量, 两组组间比较采用student t-test检验。
3 结果 3.1 动物模型建立情况7周左右C57BL/6 ♂小鼠,正常饮食1周后实验,对照组正常饮食,无死亡,模型组皮下注射四氯化碳随时间延长小鼠无死亡,逆转组精神状况较好,亦无死亡,正常组给予等量的橄榄油注射,正常组小鼠体重增加,模型组小鼠较正常组体重轻,逆转组小鼠体重较模型组体重增加。
3.2 肝脏组织的病理学变化如Fig 1A所示,伴随小鼠纤维化模型的建立小鼠肝脏表面由鲜红变为暗红色,边缘苍白且光泽度变暗,表面呈颗粒状突起,逆转过程中,小鼠肝脏颜色逐渐恢复正常光泽度较好,表面变得光滑;Fig 1B HE染色显示,对照组小鼠肝脏组织核大小正常呈蓝染,胞质呈淡红色染色,结构清楚,汇管区无炎症浸润,随着纤维化模型的建立,从F1W到F4W开始产生炎性细胞浸润,出现点状坏死,随着逆转过程中肝脏组织的恢复,结构趋于正常;Fig 1C、1D的IHC显示,α-SMA和Colla-1在对照组中表达较少或几乎不表达,随着模型加重棕黄色阳性反应表达明显增多,随着逆转的进行,α-SMA和Colla-1的表达逐渐减少,提示纤维减轻;Fig 1E Masson染色显示,纤维化模型过程中蓝色胶原纤维表达逐渐增多,逆转过程中蓝色胶原纤维表达逐渐减少。上述结果提示小鼠肝脏肝纤维化模型的和逆转模型建立成功。
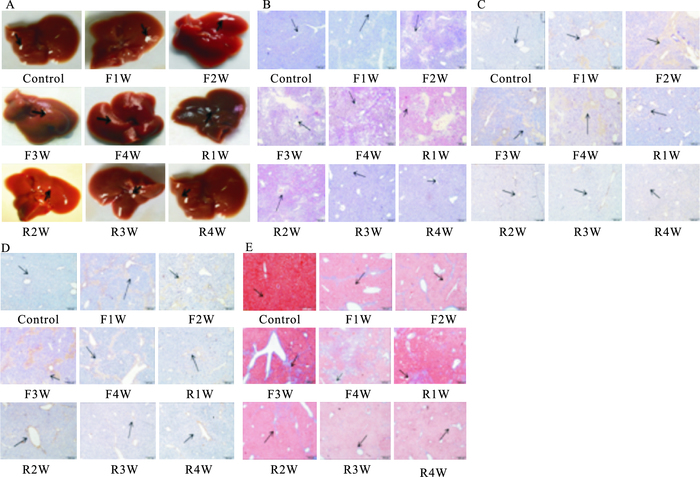
|
| Fig 1 Histological changes of animal model A:Pictures of liver; B:HE staining(×200);C:Colla-1(IHC×200);D:α-SMA(IHC×200);E:Masson staining(×200) |
如Fig 2A的IF显示,相比对照组(Control),模型组(Model)α-SMA红色荧光表达明显增多,SOCS3的绿色荧光表达也明显增多,逆转组(Recovery)中相对于模型组两者则明显减少。合并(merge)图中显示,SOCS3在肝脏星状细胞中表达。Fig 2B SOCS3的IHC显示,SOCS3的阳性表达随着时间延长而增加,随着逆转的进行棕黄色阳性表达逐渐减少;Fig 2C TGF-β1的IHC显示其阳性表达随着肝脏纤维化模型加重而增加,随着纤维化的逆转而减少。以上结果提示,肝脏纤维化过程中SOCS3和TGF-β1参与小鼠肝脏纤维化进展和逆转过程,并且可能起着重要的作用。Fig 2D显示,取建立4周模型和模型成功后逆转4周的实验小鼠肝脏,提取组织蛋白,Western blot显示,与对照组相比,模型组小鼠α-SMA和Colla-1表达明显增加(P<0.01), 与模型组相比,逆转组小鼠α-SMA和Colla-1表达减少(P<0.05);SOCS3的蛋白表达相对于对照组,模型组小鼠表达明显增加(P<0.01),相对于模型组,逆转组SOCS3表达明显降低(P<0.01);TGF-β1蛋白表达相比于对照组,模型组明显增加(P<0.05),相对于模型组,逆转组TGF-β1明显减少(P<0.01),提示动物试验中相关蛋白表达和对应模型成立。
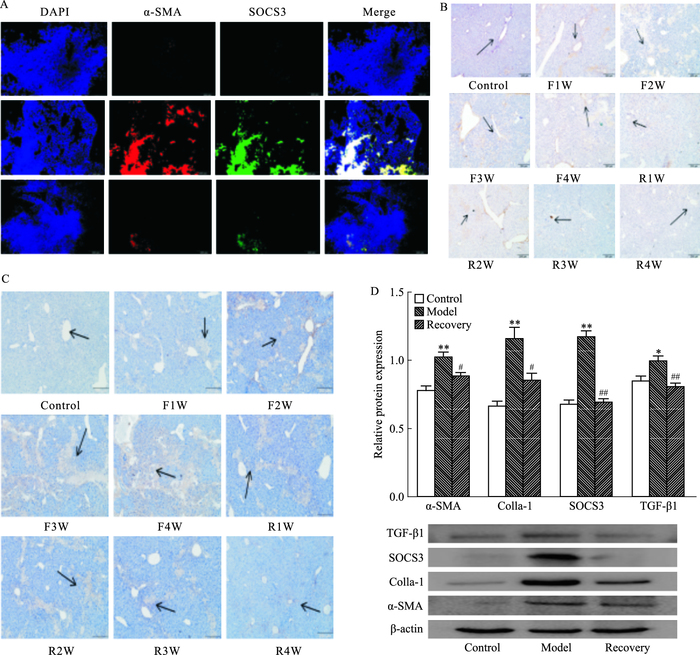
|
| Fig 2 Protein of liver tissues A:IF staining(×200);B:SOCS3 IHC conducted and examined under microscopy(×200);C:TGF-β1 IHC conducted and examined under microscopy(×200);D:Protein of liver tissues.*P < 0.05, **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs model |
提取细胞蛋白,Fig 3 Western blot结果显示,与对照组相(Control)比,模型组(TGF-β1) 的α-SMA和Colla-1表达明显增加(P<0.05,P<0.01);与模型组相比,逆转组(TGF-β1+MDI)α-SMA和Colla-1表达减少(P<0.05);SOCS3的蛋白表达相对于对照组,模型组表达明显增加(P<0.01);相对于模型组,逆转组SOCS3表达明显降低(P<0.01);强促纤维化因子TGF-β1蛋白表达相比于对照组,模型组明显增加(P<0.01);相对于模型组,逆转组TGF-β1明显减少(P<0.01),提示体外HSC-T6细胞模型和逆转建立成功。
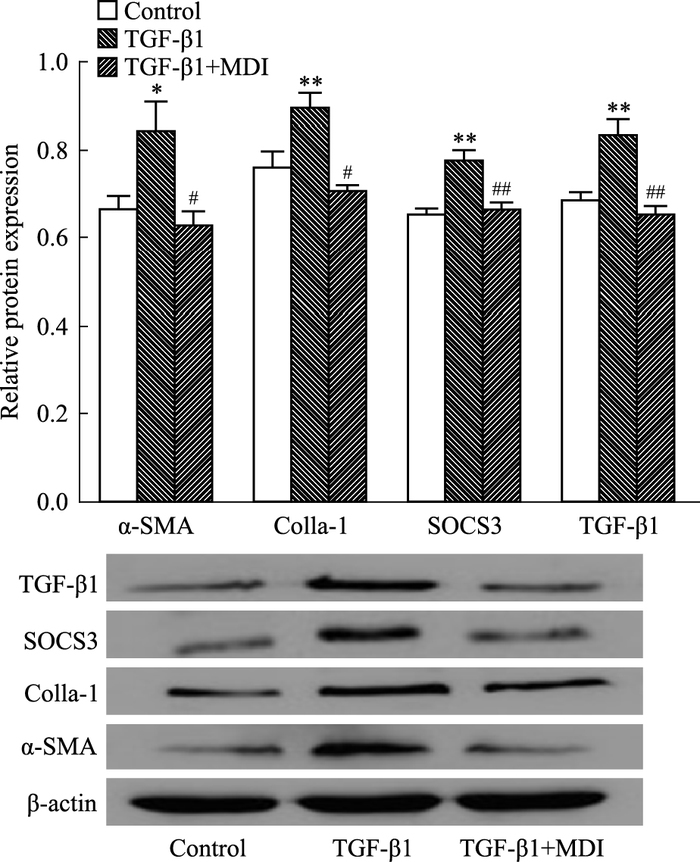
|
| Fig 3 HSC-T6 cells related protein expression resulted from TGF-β1 and MDI(x±s) *P < 0.05, **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs TGF-β1 |
Fig 4A显示,过表达质粒SOCS3,相对于空载质粒,SOCS3蛋白表达量明显增加(P<0.01), 提示SOCS3过表达质粒成功;Fig 4B显示,相对于模型组(TGF-β1),逆转组(TGF-β1+MDI)α-SMA和Colla-1表达明显减少(P<0.01,P<0.05),提示体外细胞实验逆转成功;针对于逆转组,过表达SOCS3空载体(TGF-β1+MDI+pEGFP-N1-Control)和质粒(TGF-β1+MDI+pEGFP-N1-SOCS3) 后, 过表达SOCS3质粒组α-SMA和Colla-1表达明显降低(P<0.05,P<0.01),提示过表达SOCS3后减少纤维化指标的表达,可能有利于纤维化逆转过程的进行;同时TGF-β1的表达相对于逆转过程中加入质粒空载体组(TGF-β1+MDI+pEGFP-N1-Control), 质粒组(TGF-β1+MDI+pEGFP-N1-SOCS3) TGF-β1表达明显降低(P<0.01),提示过表达SOCS3减少强促纤维化因子TGF-β1的产生,同时减少相关纤维化指标的生成,有利于纤维化逆转过程的进行。

|
| Fig 4 Overexpression SOCS3 in HSC-T6 cells to observe change of fibrosis index A:Overexpression SOCS3 to observe the efficiency.**P < 0.01 vs pEGFP-N1-Control; B:The expression of protein.*P < 0.05, **P < 0.01 vs TGF-β1;#P < 0.05, ##P < 0.01 vs TGF-β1+MDI+pEGFP-N1-SOCS3 |
目前,肝纤维化的发病率越来越高, 多种因素导致肝脏损伤,如酒精、高脂等[5-6],已经严重威胁着人类的健康,模拟建立人类肝脏纤维化动物模型现已比较成熟,对更好的研究肝纤维化疾病的发生发展起着很大的作用,本研究中使用经典的四氯化碳建立肝纤维化模型,四氯化碳是一种选择性的具有肝毒性物质,能够直接损伤肝细胞,该研究中我们使用四氯化碳对小鼠进行造模,在模型进展1、2、3、4周和逆转1、2、3、4周观察小鼠肝脏的形态和组织病理学变化以及相应的蛋白变化,结果显示CCl4对小鼠肝脏纤维化模型建立的成功以及肝纤维化逆转的存在。
由于肝脏纤维化存在着逆转过程,那么我们将研究重点放在如何有助于肝脏纤维化的逆转过程上,将有助于我们更好的研究肝纤维化的治疗。SOCS3在肝脏疾病的研究已有报道,在慢性肝损伤的过程中,随着肝损伤过程的加重,SOCS3表达增加[7],本实验建立肝纤维化正常模型和逆转实验小鼠,研究显示随着对小鼠皮下注射四氯化碳造模时间的延长,纤维化程度加重,模型建立成功,SOCS3的表达逐渐增多, 随着逆转过程中的进行,肝纤维化小鼠的肝脏损伤程度逐渐降低,SOCS3的表达逐渐减少。SOCS3在肝纤维化中表达明显升高,故减少或敲除SOCS3对于肝纤维化的治疗是否具有治疗作用,Hisanohu等[8]在研究中证明,缺乏SOCS3能够促进肝纤维化的发生发展, 故本研究针对纤维化逆转过程中SOCS3的表达量减少进行干预,转染质粒后发现过表达SOCS3能够较好的增强纤维化逆转的过程。同样,Ogata等[9]研究发现,在肝脏中特异性的敲除SOCS3,使STAT3活性增强,TGF-β1表达增加,从而加重纤维化的发生发展。TGF-β1作为一种强促纤维化因子,可促进HSC分泌Ⅰ型胶原,加速其由静止向激活的转化,本研究同样显示在肝纤维化模型期中TGF-β1高表达,并且相关研究已显示,减少TGF-β1基因的表达能有效的减轻肝脏纤维化的发生发展,可能是通过减少HSC的激活、增殖和减少胶原的产生,同样在转染SOCS3质粒后逆转组的TGF-β1表达量也相应降低,从而减轻ECM的过度沉积,进而减轻肝纤维化的病理生理状况[10-11]。本研究中通过过表达SOCS3在活化的HSC-T6细胞逆转过程中发现,过表达SOCS3后有利于逆转过程的进行,相关纤维化指标降低,TGF-β1表达也明显降低。因此,深入研究探讨SOCS3和TGF-β1对肝纤维化发生发展过程相关机制将对保护肝脏损伤和肝纤维化的治疗提供更加广泛的思路。
| [1] | Sun M, Kisseleva T. Reversibility of liver fibrosis[J]. Clin Res Hepatol Gastroenterol, 2015, 39(Suppl 1): S60-3. |
| [2] | 张自力, 赵士峰, 许文萱, 等. 细胞因子信号转导抑制分子-3在肝纤维化中的作用及研究进展[J]. 中国药理学通报, 2015, 31(12): 1645-51. Zhang Z L, Zhao S F, Xu W X, et al. The rearch progress of cytokine signaling inhibition of protein-3(SOCS-3)[J]. Chin Pharmacol Bull, 2015, 31(12): 1645-51. |
| [3] | 李志庆, 苏长青, 杨家和. 转化生长因子β1在肝纤维化发生发展中的作用及其靶向干预策略[J]. 诊断学理论与实践, 2011, 10(4): 375-9. Li Z Q, Su C Q, Yang J H. The role of transforming growth β1 in the development of liver fibrosis and its targeted intervention strategy[J]. J Diagn Concepts Pract, 2011, 10(4): 375-9. |
| [4] | She H, Xiong S, Hazra S, et al. Adipogenic transcriptional regulation of hepatic stellate cells[J]. J Biol Chem, 2005, 280(6): 4959-67. doi:10.1074/jbc.M410078200 |
| [5] | 梁惠, 吕锐, 傅泳, 等. 益生菌对大鼠酒精性肝损伤的保护作用及机制研究[J]. 中国药理学通报, 2016, 32(7): 991-7. Liang H, Lyu R, Fu Y, et al. Effects of probiotics on alcoholic liver injury in rats and its mechanisms[J]. Chin Pharmacol Bull, 2016, 32(7): 991-7. |
| [6] | 王杏, 王超, 宋光耀, 等. 氧化苦参碱对高脂诱导胰岛素抵抗Apo E-/-小鼠肝脏脂代谢相关基因的影响[J]. 中国药理学通报, 2015, 31(12): 1688-92. Wang X, Wang C, Song G Y, et al. Effect of oxymatrine on lipid metabolism regulated genes in liver of fat-induced insulin resistance in ApoE-/- mice[J]. Chin Pharmacol Bull, 2015, 31(12): 1688-92. doi:10.3969/j.issn.1001-1978.2015.12.012 |
| [7] | 张千, 邓存良. SOCS-3在大鼠慢性肝损伤中的表达研究[J]. 四川医学, 2014, 35(9): 1126-8. Zhang Q, Deng C L. The Expression of SOCS-3 in hepatic tissue of rat with chronic liver injury[J]. Sichuan Med J, 2014, 35(9): 1126-8. |
| [8] | Ogata H, Kobayashi T, Chinen T, et al. Deletion of the SOCS3 Gene in liver parenchymal cells promotes hepatitis-induced hepatocarcinogenesis[J]. Gastroenterology, 2006, 131(1): 179-93. doi:10.1053/j.gastro.2006.04.025 |
| [9] | Ogata H, Chinen T, Yoshida T, et al. Loss of SOCS3 in the liver promotes fibrosis by enhancing STAT3-mediated TGF-beta1 production[J]. Oncogene, 2006, 25(17): 2520-30. doi:10.1038/sj.onc.1209281 |
| [10] | Cheng K, Yang N G, Mahato R I. TGF-betal gene silencing for treating liver fibrosis[J]. Mol Pharm, 2009, 6(3): 772-9. doi:10.1021/mp9000469 |
| [11] | Lang Q, Liu Q, Xu N, et al. The antifibrotic effects of TGF-β1 siRNA on hepatic fibrosis in rats[J]. Biochem Biophys Res Commun, 2011, 409(3): 448-53. doi:10.1016/j.bbrc.2011.05.023 |

