


2. 重庆市人民医院药剂科,重庆 400039
2. Dept of Pharmacy, Chongqing People's Hospital, Chongqing 400039, China
近年来[1-2],高尿酸血症(hyperuricemia,HPA)的发病率呈迅速上升趋势,且随年龄的增长呈增加的趋势,这可能与人们摄入高嘌呤、高蛋白等食物有关。HPA是嘌呤代谢紊乱导致尿酸生成过多或肾脏排泄障碍所致。HPA与痛风、肿瘤综合征、肾脏疾病、心脏疾病等密切相关,还是导致白血病和肺炎等疾病的一个重要因素[3]。HPA和痛风的患者为了避免关节炎反复发作和肾脏病变,需要长期服用具降低血尿酸作用的药物,但目前安全、有效、经济的降血尿酸药物较少。
尿酸酶(uricase,UAE)可以将尿酸分解为尿囊素和过氧化氢(H2O2)[4],从而降低尿酸浓度。但是人体内缺乏UAE,使尿酸成为人体内嘌呤代谢的终产物,血液中尿酸累积过量就会形成HPA,所以需要运用外源性的UAE来治疗HPA。但是UAE分解尿酸过程中产生的过氧化氢具有细胞毒性,能促进细胞凋亡[5]。而过氧化氢酶(catalase,CA)可促使H2O2分解为氧分子和水,清除体内蓄积的过氧化氢。为了更有效地提高UAE的治疗效果和降低中间产物过氧化氢的毒副作用,本实验制备了尿酸酶-过氧化氢酶复合脂质体(uricase and catalase liposome, UCALP),目前国内外少见将UAE和CA联合用于治疗HPA的报道。本实验重点研究了UCALP对HPA小鼠的治疗作用,以便为UCALP在临床运用提供新依据。
1 材料与方法 1.1 实验动物24只SPF级昆明种小鼠,♀♂各半,体质量(21±2) g,由重庆医科大学实验动物中心提供,许可证号:SCXK渝2012-0001。
1.2 药品与试剂UAE和CA,Sigma-Aldrich公司;尿酸,英国Alfa Aesar公司;大豆卵磷脂,德国Lucas Meyer公司;胆固醇,广州天马精细化工厂;羧甲基纤维素钠,中国医药集团上海化学试剂公司;N, N-二羟乙基甘氨酸(Bicine),美国Amresco公司;氢氧化钠、乙醚和氯仿,重庆川东化工集团有限公司。
1.3 仪器UV-7504 PC紫外分光光度计,上海欣茂仪器有限公司;AG-135型电子分析天平,梅特勒-托利多仪器上海有限公司;RE-52AA型旋转蒸发器,上海亚荣生化仪器厂;SHZ-D(Ⅲ)型循环水式真空泵,巩义市予华仪器有限责任公司;KQ-2200B型水浴型超声仪,江苏昆山市超声仪器有限责任公司;尿酸、过氧化氢测试盒,南京建成生物工程研究所。
2 方法 2.1 UCALP的制备本文采用逆向蒸发法制备了UAE和CA复合脂质体[6-7]。按摩尔比1 :1称取卵磷脂和胆固醇溶于30 mL氯仿中,在旋转蒸发仪上挥干氯仿,瓶底形成均匀薄膜,然后加入30 mL乙醚再分散和20 mL含有2 mg UAE和2 mg CA的pH 8.5的Bicine-NaOH缓冲液[6],在水浴型超声仪上超声至形成带有乳光的均匀分散体系。将此体系再旋转蒸发掉乙醚,即得UCALP。
2.2 UAE和UCALP最适温度的测定分别在20℃~70℃的水浴条件下测定UAE和UCALP中UAE的活性,并确定各组UAE的最适温度。
2.3 UAE和UCALP最适pH值的测定在酶的最适反应温度下,分别于pH 6.5~9.5的硼酸-硼砂缓冲体系中,测定UAE和UCALP中UAE的活性,并确定各组UAE的最适pH值。
2.4 UAE活性测定方法以pH 8.5的50 mmol·L-1硼酸-硼砂缓冲液配制的75 μmol·L-1尿酸溶液作为测定UAE活性的底物。参照文献[8-9]的方法测定UCALP和游离UAE中UAE的活性。
2.5 尿酸混悬液的制备称取1 g尿酸,用0.5%的羧甲基纤维素钠(carboxymethylcellulose sodium, CMC-Na)分散,然后转移到100 mL的容量瓶中,用0.5%的CMC-Na定容。
2.6 HPA小鼠模型的建立与给药24只昆明小鼠,♂♀各半,随机分为4组,分别是正常对照组、高尿酸模型组、UCALP治疗组和UAE治疗组,每组6只小鼠。除正常对照组外,其余3组均腹腔注射10 g·L-1用0.5%的CMC-Na助溶的尿酸混悬液造模[10],每只小鼠腹腔注射尿酸量为250 mg·kg-1[11]。UCALP治疗组和UAE治疗组的小鼠分别在造模后5 min尾静脉注射1 mL含2 U·kg-1尿酸酶的UCALP和UAE。
2.7 血清样品的采集和处理高尿酸模型组、UCALP治疗组和UAE治疗组均于造模后10、30、60、90 min摘除小鼠眼球取血;正常对照组在对应的时间直接摘除眼球取血。血样立即以3 000 r·min-1离心10 min,分离血清,分别用尿酸测试盒和过氧化氢测试盒测定各组血清中尿酸浓度和过氧化氢浓度。
2.8 统计学分析所有数据应用SPSS 17.0统计软件作方差分析,数据以x±s表示。
3 结果 3.1 UAE和UCALP制备的最适温度如Fig 1所示,UCALP和UAE中尿酸酶的最适温度均为40℃。从20℃~70℃,UCALP和UAE中尿酸酶活性变化的整体趋势是一样的,但UCALP中UAE的相对活性比游离UAE高30%左右。在20℃~40℃之间,两者活性均随温度的升高而增加;到了40℃时,两者活性均达最高值;而40℃~70℃时,活性反而随温度的升高而降低。
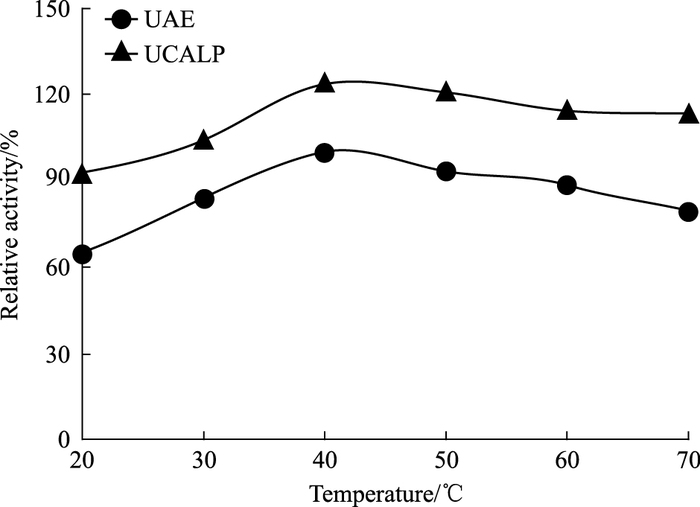
|
| Fig 1 Activities of UCALP and UAE at different temperature |
如Fig 2所示,UCALP和UAE中尿酸酶的最适pH值分别为8.0和8.5。两者在pH 8.5时的活性较为接近。从pH 6.5~pH 8.0,UCALP中尿酸酶的活性较游离UAE的活性高,且两者活性均随pH值的增加而增加;而pH 8.5~pH 9.5之间,UAE的活性较UCALP中的UAE高,两者活性均随pH值的增加而降低。
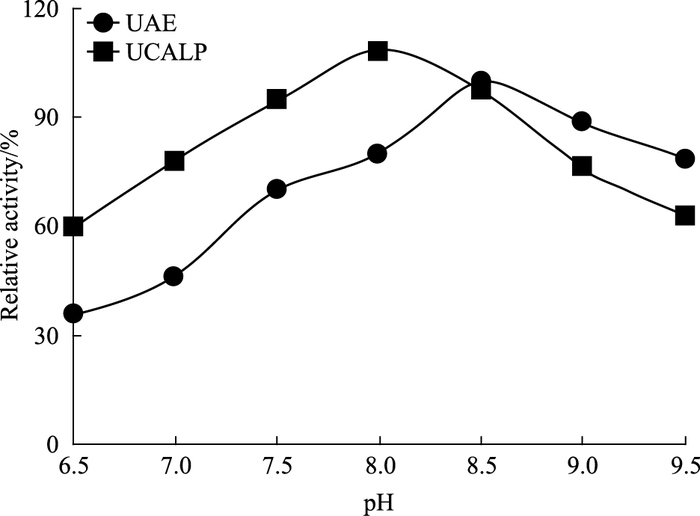
|
| Fig 2 Activities of UCALP and UAE at different pH values |
如Tab 1所示,小鼠腹腔注射250 mg·kg-1的尿酸造模后,在10 min时体内尿酸浓度均达峰值。此时,UCALP治疗组和UAE治疗组小鼠尿酸浓度均比高尿酸模型组小鼠的尿酸浓度低,说明UCALP治疗组和UAE治疗组均在一定程度上降低了尿酸水平。UCALP治疗组的小鼠在60 min时,体内尿酸浓度已降到正常对照组小鼠的尿酸水平以下;UAE治疗组小鼠在90 min时的尿酸浓度才降下来;而高尿酸模型组小鼠在90 min时的尿酸水平仍高于正常对照组。统计学分析结果表明,高尿酸模型组尿酸水平比正常对照组明显偏高,差异有显著性(P<0.01),说明建模成功;与高尿酸模型组对比,UAE治疗组差异有显著性(P<0.05),UCALP治疗组差异有显著性(P<0.01);而UAE治疗组与UCALP治疗组比较,二者差异也有显著性(P<0.05)。
| Group | Time/min | |||
| 10 | 30 | 60 | 90 | |
| Control | 167.65±16.95 | 181.62±17.95 | 186.67±15.95 | 161.61±14.95 |
| Model | 479.68±10.97** | 318.51±26.42* | 206.58±13.32 | 195.71±16.96 |
| UAE | 417.32±20.35# | 300.28±12.21 | 187.07±17.64 | 145.82±2.71 |
| UCALP | 380.86±8.63##△ | 209.14±17.27##△ | 110.01±19.59##△ | 83.14±14.13##△ |
| *P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs model;△P<0.05 vs UAE | ||||
如Tab 2所示,小鼠建立HPA模型后不给予药物治疗,血清中过氧化氢浓度在10、30 min时高于正常组,而60、90 min时却低于正常组;分别给予UCALP和UAE治疗后,最初过氧化氢浓度升高,高于正常组的2倍左右,但是UCALP治疗组比UAE治疗组过氧化氢浓度要低一些;90 min时,UCALP治疗组的小鼠体内过氧化氢已趋于正常水平,而UAE治疗组小鼠的过氧化氢水平仍高于正常对照组。统计学分析结果表明,与高尿酸模型组对比,UAE治疗组和UCALP治疗组差异均有显著性(P<0.01);而UAE治疗组和UCALP治疗组比较,二者差异无显著性(P>0.05)。
| Group | Time/min | |||
| 10 | 30 | 60 | 90 | |
| Control | 25.75±0.36 | 21.63±1.36 | 22.15±0.56 | 20.06±0.86 |
| Model | 29.87±1.26 | 25.75±0.42 | 18.37±1.32 | 15.45±0.24 |
| UAE | 60.51±4.01** | 48.67±2.55 | 37.08±1.46 | 27.81±2.18 |
| UCALP | 61.80±1.73** | 42.49±2.53 | 30.90±1.12 | 22.83±1.91 |
| **P<0.01 vs model | ||||
酶在最适温度和最适pH时,活性最高,酶促反应速度最快。本实验结果表明,UAE在制备成UCALP后,最适温度不变,而最适pH从8.5降到了8.0;UCALP的体外活性比UAE略高。UCALP中尿酸酶的最适pH和活性发生变化的原因可能是UAE与CA或者脂质体相互作用,使UAE的构象等发生变化,活性中心暴露,最后导致UAE的最适pH和活性发生变化;也可能是CA的存在降低了中间产物过氧化氢的浓度,使尿酸分解反应平衡向右进行,尿酸被分解。
高尿酸模型组和正常对照组中尿酸水平的统计学结果表明,两者差异有显著性,说明采用腹腔注射较大剂量尿酸成功建立了小鼠HPA模型。此方法简便易行可靠,适用于实验室验证性实验。本实验用此法建模后,进行UCALP的体内药效学初步研究。实验结果表明,各组小鼠在10 min时体内尿酸浓度均达最大值。若以正常对照组尿酸水平(174.61 μmol·L-1)为标准,高尿酸对照组需要147 min才能降到正常对照组尿酸水平,UAE组需要69 min,而UCALP组仅需41 min就能降到正常对照组尿酸水平。UCALP的体内药效学研究结果表明,UCALP比游离UAE体内降尿酸的能力提高了68.29%。
从HPA小鼠在给予UCALP和UAE治疗后,体内过氧化氢水平升高可以看出,UAE分解尿酸的同时的确有过氧化氢产生。由于CA的加入,UCALP治疗组小鼠体内的过氧化氢水平较UAE治疗组略低,即UAE治疗组和UCALP治疗组间过氧化氢水平差异没有显著性(P>0.05),可能是UCALP治疗组小鼠体内的UAE活性高,导致产生的过氧化氢的浓度比UAE治疗组多,所以UCALP组降低过氧化氢效果不是很明显。
综上所述,本实验首次制备了尿酸酶-过氧化氢酶复合脂质体,并将UCALP用于治疗HPA。研究发现,UCALP不仅提高了UAE体内降尿酸能力,而且降低了有毒产物过氧化氢的浓度,为HPA相关性疾病的治疗提供新手段。
( 致谢: 本实验在重庆医科大学重庆高校药物工程研究中心完成,在此真诚感谢实验室的所有老师和同学。)
| [1] | 陈刚, 谭明亮. 茶多酚对高尿酸血症小鼠尿酸产生与排泄的影响及机制研究[J]. 中国药理学通报, 2017, 33(2): 218-22. Chen G, Tan M L. Effects of green tea polyphenols on uric acid level in potassium oxonate-induced hyperuricemic mice and mechanism[J]. Chin Pharmacol Bull, 2017, 33(2): 218-22. |
| [2] | Kuwabara M. Hyperuricemia, cardiovascular disease, and hypertension[J]. Pulse(Basel), 2016, 3(3-4): 242-52. |
| [3] | Phaugat K, Bhambi M, Re nu, et al. Polyethylene terephthalate membrane as a support for covalent immobilization of uricase and its application in serum urate determination[J]. J Mol Catal B Enzym, 2010, 62(1): 27-31. doi:10.1016/j.molcatb.2009.08.012 |
| [4] | Freitas Dda S, Spencer P J, Vassão R C, et al. Biochemical and biopharmaceutical properties of PEGylated uricase[J]. Int J Pharm, 2010, 387(1-2): 215-22. doi:10.1016/j.ijpharm.2009.11.034 |
| [5] | Halliwell B, Clement M V, Long L H. Hydrogen peroxide in the human body[J]. FEBS Lett, 2000, 486(1): 10-3. doi:10.1016/S0014-5793(00)02197-9 |
| [6] | 邓雪, 周云莉, 何丹, 等. N, N-二羟乙基甘氨酸-氢氧化钠缓冲液制备的过氧化氢酶复合纳米脂质体的特性分析及过氧化氢酶的药效学初步研究[J]. 中国医院药学杂志, 2015, 35(17): 1551-4. Deng X, Zhou Y L, He D, et al. Preliminary study on property and pharmacodynamics of nanoliposomes containing catalase and uricase prepared in bicine-sodium hydroxide buffer[J]. China J Hosp Pharm, 2015, 35(17): 1551-4. |
| [7] | Tan Q Y, Wang N, Yang H, et al. Characterization, stabilization and activity of uricase loaded in lipid vesicles[J]. Int J Pharm, 2010, 384(1-2): 165-72. doi:10.1016/j.ijpharm.2009.09.036 |
| [8] | 王娜, 赵春景, 黄开顺, 等. 产朊假丝酵母尿酸酶脂质纳米粒的制备及其药效学特性分析[J]. 中国生物制品学杂志, 2013, 26(8): 1147-50. Wang N, Zhao C J, Huang K S, et al. Preparation and pharmacodynamics of lipid nanoparticles containing uricase from Candida utilis[J]. Chin J Biotechnol, 2013, 26(8): 1147-50. |
| [9] | Feng J, Liu H B, Yang X L, et al. Comparison of activity indexes for recognizing enzyme mutants of higher activity with uricase as model[J]. Chem Cent J, 2013, 7(1): 69. doi:10.1186/1752-153X-7-69 |
| [10] | 陈光亮, 孙秀霞, 王钦茂, 等. 小鼠高尿酸血症模型的研究[J]. 中国药理学通报, 2001, 17(3): 350-2. Chen G L, Sun X X, Wang Q M, et al. Study on mice hyperuricemia model[J]. Chin Pharmacol Bull, 2001, 17(3): 350-2. |
| [11] | 刘淑芬, 曾学军. 高尿酸血症动物模型研究进展[J]. 基础医学与临床, 2011, 31(3): 344-7. Liu S F, Zeng X J. Research progress of hyperuricemia animal model[J]. Basic Clin Med, 2011, 31(3): 344-7. |

