


2. 南京中医药大学 江苏省中医药防治肿瘤协同创新中心,江苏 南京 210023
 ,
ZHONG Jin-qiu1,
CAO Yu-zhu1,
WU Jia-wei1,
CHEN Wen-xing1,2,
WANG Ai-yun1,2
,
ZHONG Jin-qiu1,
CAO Yu-zhu1,
WU Jia-wei1,
CHEN Wen-xing1,2,
WANG Ai-yun1,2
 ,
LU Yin1,2
,
LU Yin1,2
2. Jiangsu Collaborative Innovation Center of Traditional Chinese Medicine(TCM) Prevention and Treatment of Tumor, Nanjing University of Chinese Medicine, Nanjing 210023, China
肿瘤作为严重威胁人类生命及健康的最主要疾病之一,已成为全球研究的热点[1]。肿瘤具有高度复杂性、可变性和多样性的生物学特征,肿瘤发生发展的机制以及有效合理的治疗方案仍是目前科学研究的重心。传统的肿瘤治疗方式包括外科手术、放疗、化疗,显示出较好疗效但均存在诸多弊端。近年来兴起的肿瘤免疫疗法较传统肿瘤治疗手段明显提高患者的生存质量。干扰素(interferons, IFNs)疗法作为肿瘤免疫疗法中的重要一员,已有多年肿瘤治疗的临床经验。大量研究表明,干扰素对多种肿瘤的生长具有很好的抑制作用。例如,对于黑色素瘤[2]、恶性淋巴瘤[3]、肾癌[4]等临床治疗均表现出明显的抗肿瘤效应。最新研究显示,采用IFNs与其他新兴疗法联合治疗肿瘤能够明显提高抗肿瘤疗效,为肿瘤治疗提供了新的契机。本文结合最新研究对干扰素抗肿瘤机制及其与肿瘤治疗的关系加以综述,为后续的科学研究及临床指导提供参考。
1 干扰素的分类IFNs是一类高活性、多功能的分泌型糖蛋白,具有抗增殖、抗病毒、免疫调节和抗肿瘤等作用。根据其基因序列、染色体定位和受体特异性等特点可分为Ⅰ型、Ⅱ型和Ⅲ型IFNs。人类Ⅰ型干扰素基因位于第9号染色体短臂,编码17种不同的蛋白质,包括有13种亚型的IFNα及IFNβ、IFNε、IFNκ、IFNω。Ⅰ型IFNs具有一个共同的细胞表面受体IFNAR(interferon alpha receptor),由IFNAR1和IFNAR2两个亚基组成。Ⅱ型干扰素只有1种,即IFNγ。IFNγ的细胞表面受体为IFNGR(interferon gamma receptor),由IFNGR1和IFNGR2两个亚基组成。Ⅲ型IFNs包括IFNλ1、IFNλ2、IFNλ3和IFNλ4,前三者也分别被称为IL-29、IL-28A和IL-28B。IFNα主要来源于B淋巴细胞、巨噬细胞、NK细胞;IFNβ主要由成纤维细胞和上皮细胞产生,少部分来源于巨噬细胞;IFNγ主要由浆细胞样树突细胞(plasmacytoid dendritic cells, pDC)生成;而淋巴细胞、髓样或上皮细胞能够产生IFNλ。其中,主要在抗肿瘤方面发挥重要作用的为Ⅰ型和Ⅱ型IFNs,而Ⅱ型IFNs相比于Ⅰ型IFNs毒副作用较小,在抗病毒和抗肿瘤方面具有应用前景。Ⅲ型IFNs通过基础研究已被证明有一定的抗肿瘤作用[5],但目前仅用于病毒性肝炎的临床治疗。近年来,大量实验数据和临床报道证实IFNs具有明显的抗肿瘤作用,可以明显延长肿瘤患者的无进展生存期、提高肿瘤患者的生存质量。
2 干扰素发挥抗肿瘤效应的分子机制 2.1 干扰素调控肿瘤细胞增殖发挥抗肿瘤效应恶性肿瘤的形成是细胞生长失控,无限增殖所致。IFNs能够调节多种增殖相关基因的表达,阻滞肿瘤细胞周期、促进肿瘤细胞凋亡,从而抑制肿瘤细胞增殖。
2.1.1 干扰素对细胞周期的调控恶性肿瘤细胞分裂生长异常通常伴有细胞周期调节基因突变,导致生长启动蛋白过表达。研究显示,干扰素能够在一定程度上延长肿瘤细胞周期,抑制肿瘤细胞增殖发挥抗肿瘤作用。Maeda等[6]利用荧光泛素化细胞周期指示剂(FUCCI)对人肝癌细胞系Huh7检测,结果显示,IFNα能够诱导G0/G1期细胞周期阻滞,呈现直接的抗增殖效应。Xu等[7]研究发现,IFNs可以抑制膀胱癌细胞中的原癌基因c-myc、c-fos表达,上调抑癌基因p21的表达,有效抑制癌细胞从G0期进入G1期,进而延缓肿瘤细胞周期。此外,Liu等[8]利用携带人IFNγ的腺病毒感染鼻咽癌细胞后,发现IFNγ可上调p21受体的表达并促进Rb去磷酸化,诱导G1期阻滞抑制肿瘤细胞增殖。
2.1.2 干扰素诱导肿瘤细胞凋亡凋亡是由基因编码控制的细胞主动参与的自杀过程,能清除多余、衰老或损伤的细胞。IFNs能够通过死亡受体介导的外源性途径以及线粒体介导的内源性途径诱导肿瘤细胞凋亡。Yoon等[9]研究发现,人骨髓间充质干细胞(human mesenchymal stem/stromal cells, hMSCs)通过分泌IFNβ上调三阴性乳腺癌细胞MDA-MB-231内肿瘤坏死因子相关凋亡诱导配体(TNF related apoptosis inducing ligand, TRAIL)的表达引起肿瘤细胞凋亡。Song等[10]研究发现,IFNλ通过上调Bax和caspase-3的表达,引起口腔舌鳞状细胞癌细胞HSC-3和Tca8113凋亡。此外,Liu等[11]将携带有IFNγ基因的腺病毒载体感染人食管癌细胞,其胞质内细胞色素C、caspase-9及Bax蛋白表达增加,提示IFNγ能够通过线粒体介导的内源性凋亡通路促使肿瘤细胞凋亡。而将IFNγ基因转入到小鼠黑色素瘤细胞系B16后发现其能够通过外源性凋亡途径有效抑制小鼠黑色素瘤细胞的生长[12]。
2.2 干扰素调控肿瘤转移发挥抗肿瘤效应肿瘤转移是恶性肿瘤的主要特征,是癌症治疗失败和癌症患者死亡的首要原因。Rautela等[13]利用Ifnar1-/-小鼠证明破坏内源性Ⅰ型IFNs信号通路后,NK细胞抗肿瘤作用受到抑制,加速乳腺癌骨转移,说明Ⅰ型IFNs能通过激活肿瘤免疫,抑制肿瘤转移。另有研究表明[14],Ⅰ型IFNs还可通过激活CD8+T细胞,抑制乳腺癌细胞转移,明显延长荷瘤小鼠生存期。Yuan等[15]研究发现,IFNγ通过介导IRF1/miR-29b反馈环路抑制结肠癌细胞转移。此外,IFNγ还能够与钙调磷酸酶B亚基(calcineurin subunit B, CnB)发挥协同作用,促进肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)向M1表型转化,通过增强巨噬细胞抗肿瘤活性,从而改善肿瘤微环境,抑制结直肠癌细胞转移[16]。
2.3 干扰素调控肿瘤血管生成发挥抗肿瘤效应肿瘤血管新生与肿瘤的生长和转移密切相关,IFNs具有抑制肿瘤血管生成的作用。研究显示[17],IFNs能够抑制血管内皮生长因子(vascular endothelialgrowth factor, VEGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)及基质金属蛋白酶(matrix metalloproteinases, MMPs)等血管生成因子的表达,抑制血管内皮细胞的生长并促进其凋亡,从而抑制肿瘤血管新生和转移。
IFNα通过下调慢性粒细胞白血病(chronic myelocytic leukemia, CML)患者血清中PGE2、MMP2、bFGF等细胞因子水平,抑制肿瘤血管生成和转移[18]。内源性IFNβ通过下调趋化因子受体2(chemokine receptor 2, CXCR2),阻断CXCR2受体信号转导通路促进中性粒细胞迁移、抑制肿瘤血管生成,抑制肿瘤的发展[19]。Yildirim等[20]研究发现,IFNβ可通过激活蛋白酶calpain 1,减少循环血管生成细胞(circulating angiogenic cells, CACs)的数量及其分泌的血管生成因子,发挥抗肿瘤血管生成作用。韩健等[21]发现IFNγ可以抑制人黑色素瘤细胞MUM-2B迁移和侵袭,并通过抑制VEGF表达而抑制其血管生成拟态。
2.4 干扰素调控免疫系统发挥抗肿瘤作用激发肿瘤患者受到抑制的免疫功能是肿瘤治疗的理想策略,IFNs可以调动机体免疫系统杀伤肿瘤细胞。IFNs能够上调巨噬细胞、DC、B细胞、T细胞等多种免疫细胞活性发挥抗肿瘤作用。在肿瘤微环境中,pDCs在免疫应答与免疫耐受中发挥重要作用。在黑色素瘤小鼠模型中,活化的pDCs能够分泌大量Ⅰ型IFNs杀伤肿瘤细胞,抑制肿瘤生长[22]。此外,Ⅰ型IFNs可激活NK细胞和CD8+T细胞,同时直接上调肿瘤抗原的表达,激活DCs将肿瘤抗原呈递到T细胞,促进CD8+T细胞对肿瘤细胞杀伤作用[23]。调节性T细胞(regulatory cells, Tregs)可以通过多种机制抑制免疫效应细胞的功能,是肿瘤免疫逃逸的关键因素[24]。Ⅰ型IFNs能够抑制Tregs增殖[25],减少骨髓源性抑制细胞(myeloid-derived suppressor cell, MDSC)数目并抑制其功能[26]。Ⅱ型干扰素IFNγ能够活化T细胞、B细胞、NK细胞和巨噬细胞,并促进其分化[27],同时能诱导单核细胞向M1型巨噬细胞表型分化[28]。Ⅲ型干扰素IFNλ能够协助NK细胞发挥最佳活性,激活抗肿瘤免疫反应[29]。IFNs还可以通过刺激继发性炎症介质的释放发挥免疫调节作用[28]。例如,IFNs诱导IL-15表达促进淋巴细胞增殖,形成有效的抗肿瘤免疫微环境[30]。IFNγ能诱导产生趋化因子CXCL9和CXCL10,促进CXCR3+的淋巴细胞在肿瘤组织附近聚集发挥抗肿瘤免疫作用[31](Fig 1)。
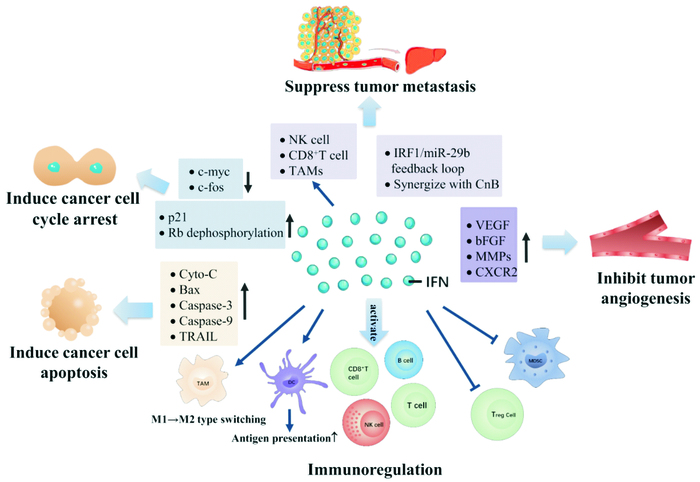
|
| Fig 1 The antitumor effects of IFNs and related mechanisms |
在肿瘤治疗领域,干扰素已被用于白血病、骨髓瘤、肾细胞癌、黑色素瘤等多种肿瘤的治疗,临床数据显示干扰素能够减少肿瘤患者的术后复发、控制肿瘤进展。
3.1 干扰素临床治疗的发展进程第一代IFNs疗法对于血液系统癌症有明显成效,包括毛细胞白血病(hairy cell leukemia,HCL)和其他淋巴组织增殖性和骨髓增殖性肿瘤,如CML[32-33]。相比于化疗,对HCL或CML病人给予IFNs治疗,能够明显改善生存率[32]。伊马替尼作为靶向BCR-ABL酪氨酸激酶抑制剂,已成功用于CML的一线治疗,但耐药现象极大地影响了伊马替尼的长期治疗效果。而将伊马替尼和Ⅰ型IFNs联合使用12个月后,其完全细胞遗传学缓解率(complete cytogenetic remission, CCgR)和主要分子遗传学缓解率(major molecular remission, MMR)均明显优于伊马替尼单药治疗组:CCgR(74% :68%)、MMR(66% :47%),提示IFNs能够通过靶向肿瘤干细胞发挥更加持久的治疗效果。
针对黑色素瘤、肾细胞癌、Kaposi肉瘤等实体瘤,IFNs也取得了不同程度的治疗效果。例如,利用高剂量IFNs对高危黑色素瘤(ⅡB期和Ⅲ期)患者辅助治疗,可延长患者无复发生存期和总生存期[35]。在肾细胞癌根治术后应用IFNγ有利于增强机体抗肿瘤能力及免疫功能的恢复,减少癌症的复发及转移[36]。
另外,将IFNs与细胞毒类药物、激素、放疗及免疫治疗等手段相结合对于肿瘤治疗具有潜在的协同和累加作用。IFNs与化疗药物联合给药能够通过刺激IFNs免疫反应来增强细胞毒性。例如,对72例晚期肾癌患者临床观察发现,与单用索拉非尼相比,干扰素联合索拉非尼组的患者疾病控制率由45.24%提高至100%,而并未增加毒副作用[37]。而将Ⅰ型IFNs联合化疗药治疗胆系肿瘤的有效性也已在临床得到初步验证[38]。另外,放疗可以改善肿瘤免疫抑制性微环境并且恢复肿瘤细胞的免疫原性。采用放疗与IFNs治疗相结合的治疗方式,能够发挥协同作用,减少免疫抑制作用,增强肿瘤治疗效果[39]。
3.2 干扰素临床不良反应及未来肿瘤治疗策略尽管IFNs能够通过其抗增殖、免疫调节、抑制肿瘤血管形成等方式发挥明显的抗肿瘤作用。但IFNs治疗所带来的一系列副作用仍不容忽视,包括流感样症状、抑郁症、白细胞减少症等。
Woo等[40]研究表明,STING是连接模式识别受体(pattern recognition receptor, PRR)到干扰素调节因子-3(interferon regulatory factor-3, IRF-3) 活化的一种配体蛋白,STING通路在识别肿瘤来源的DNA中起重要作用,可导致IFNβ产生。初步临床观察发现,相比于直接给药,使用PRR激动剂或TLR激动剂刺激患者体内产生Ⅰ型IFNs能够明显增效并减少毒副作用,这提示IFNs诱导剂相比于IFNs更适合用于肿瘤治疗。因此,采用PRR激动剂如卡介苗(BCG)、单磷酰脂质A和咪喹莫特等通过与PRR结合激活STING信号通路,刺激Ⅰ型IFNs产生,或许可以增加肿瘤治疗效果。另外,单独使用IFNs免疫激活疗法会导致PDL1和PD1的表达增加,激活PD-1/PD-L1信号通路,促进肿瘤免疫逃逸,从而缩短抗肿瘤免疫反应持续时间。因此,可以将IFNs与CAR-T疗法或免疫检查点阻滞剂抗PD-1或PD-L1抗体联合使用,克服免疫抑制反应并增加患者对药物的敏感性。例如,Sabatier等[41]研究发现,20%~30%的乳腺癌表达PD-L1,且多见于三阴性乳腺癌,将IFNs与PD-1/PD-L1抑制剂联合应用,对于治疗三阴性乳腺癌具有广阔前景。
4 小结综上所述,IFNs能够在肿瘤发生发展的多个环节发挥重要作用。长期的研究表明,IFNs主要通过激活机体免疫功能来发挥抗肿瘤作用,因此,对肿瘤细胞、IFNs和免疫细胞之间相互作用的理解是利用IFNs治疗肿瘤的关键。而IFNs很有可能由于巨大的肿瘤负荷和肿瘤免疫抑制微环境而无法治疗晚期癌症[42]。因此,在癌症早期使用干扰素治疗肿瘤可能更加有效。而对于由原发灶扩散的肿瘤或者非实体瘤,如血液系统恶性肿瘤,利用IFNs辅助治疗从而清除癌细胞的作用则更加显著。另外,目前的临床实践尚无法设计出有针对性且有效的临床试验和联合治疗方案。所以对特定肿瘤类型中IFNs的作用靶点和机制的进一步研究有助于设计合理的个性化治疗方案,完善临床治疗策略,促进肿瘤治疗向个体化、精准化方向发展。因此,探索以IFNs为基础的肿瘤治疗新途径,对于改善肿瘤治疗效果具有重要的指导意义。
| [1] | 沈培亮, 刘兆国, 孙丽华, 等. 肿瘤治疗新靶点TRAP1研究进展[J]. 中国药理学通报, 2016, 32(04): 459-63. Shen P L, Liu Z G, Sun L H, et al. Research progress of a new oncotherapy target TRPA1[J]. Chin Pharmacol Bull, 2016, 32(04): 459-63. doi:10.3969/j.issn.1001-1978.2016.04.004 |
| [2] | Hribernik A, Cemazar M, Sersa G, et al. Effectiveness of electrochemotherapy after IFN-α adjuvant therapy of melanoma patients[J]. Radiol Oncol, 2016, 50(1): 21-7. |
| [3] | Lapenta C, Donati S, Spadaro F, et al. NK cell activation in the antitumor response induced by IFN-α dendritic cells loaded with apoptotic cells from follicular lymphoma patients[J]. J Immunol, 2016, 197(3): 795-806. doi:10.4049/jimmunol.1600262 |
| [4] | Elkord E, Burt D J, Sundstedt A, et al. Immunological response and overall survival in a subset of advanced renal cell carcinoma patients from a randomized phase 2/3 study of naptumomab estafenatox plus IFN-α versus IFN-α[J]. Oncotarget, 2015, 6(6): 4428-39. doi:10.18632/oncotarget.v6i6 |
| [5] | Kroeker A L, Coombs K M. Systems biology unravels interferon responses to respiratory virus infections[J]. World J Biol Chem, 2014, 5(1): 12-25. doi:10.4331/wjbc.v5.i1.12 |
| [6] | Maeda S, Wada H, Naito Y, et al. Interferon-α acts on the S/G2/M phases to induce apoptosis in the G1 phase of an IFNAR2-expressing hepatocellular carcinoma cell line[J]. J Biol Chem, 2014, 289(34): 23786-95. doi:10.1074/jbc.M114.551879 |
| [7] | Xu B, He Y, Wu X, et al. Exploration of the correlations between interferon-γ in patient serum and HEPACAM in bladder transitional cell carcinoma, and the interferon-γ mechanism inhibiting BIU-87 proliferation[J]. J Urol, 2012, 188(4): 1346-53. doi:10.1016/j.juro.2012.06.005 |
| [8] | Liu R Y, Zhu Y H, Zhou L, et al. Adenovirus-mediated delivery of interferon-γ gene inhibits the growth of nasopharyngeal carcinoma[J]. J Transl Med, 2012, 10: 256. doi:10.1186/1479-5876-10-256 |
| [9] | Yoon N, Park M S, Shigemoto T, et al. Activated human mesenchymal stem/stromal cells suppress metastatic features of MDA-MB-231 cells by secreting IFN-β[J]. Cell Death Dis, 2016, 7(4): e2191. doi:10.1038/cddis.2016.90 |
| [10] | Song B, Yang Y, Wang Y L, et al. Adenovirus expressing IFN-λ(Ad/hIFN-λ) produced anti-tumor effects through inducing apoptosis in human tongue squamous cell carcinoma cell[J]. Int J Exp Med, 2015, 8(8): 12509-18. |
| [11] | Li Q, Kawamura K, Okamoto S, et al. Adenoviruses-mediated transduction of human oesophageal carcinoma cells with the interferon-λ genes produced anti-tumour effects[J]. Br J Cancer, 2011, 105(9): 1302-12. doi:10.1038/bjc.2011.379 |
| [12] | Bahrambeigi V, Ahmadi N, Moisyadi S, et al. PhiC31/PiggyBac modified stromal stem cells: effect of interferon γ and/or tumor necrosis factor(TNF)-related apoptosis-inducing ligand(TRAIL) on murine melanoma[J]. Mol Cancer, 2014, 13(1): 255. doi:10.1186/1476-4598-13-255 |
| [13] | Rautela J, Baschuk N, Slaney C Y, et al. Loss of host type-Ⅰ IFN signaling accelerates metastasis and impairs NK cell antitumor function in multiple models of breast cancer[J]. Cancer Immunol Res, 2015, 3(11): 1207-17. doi:10.1158/2326-6066.CIR-15-0065 |
| [14] | Bidwell B N, Slaney C Y, Withana N P, et al. Silencing of Irf7 pathways in breast cancer cells promotes bone metastasis through immune escape[J]. Nat Med, 2012, 18(8): 1224-31. doi:10.1038/nm.2830 |
| [15] | Yuan L, Zhou C, Lu Y, et al. IFN-γ-mediated IRF1/miR-29b feedback loop suppresses colorectal cancer cell growth and metastasis by repressing IGF1[J]. Cancer Lett, 2015, 359(1): 136-47. doi:10.1016/j.canlet.2015.01.003 |
| [16] | Su Z, Yang R, Zhang W, et al. The synergistic interaction between the calcineurin B subunit and IFN-γ enhances macrophage antitumor activity[J]. Cell Death Dis, 2015, 6: e1740. doi:10.1038/cddis.2015.92 |
| [17] | Yoshiji H, Noguchi R, Kuriyama S, et al. Combination of interferon and angiotensin-converting enzyme inhibitor, perindopril, suppresses liver carcinogenesis and angiogenesis in mice[J]. Oncol Rep, 2005, 13(3): 491-5. |
| [18] | 李静. 干扰素-α在治疗慢性粒细胞白血病患者中的综合应用价值[J]. 实用癌症杂志, 2015, 30(2): 171-3. Li J. Research about the integrated value of IFN-α for patients with chronic myelocytic leukemia[J]. Practical J Cancer, 2015, 30(2): 171-3. |
| [19] | Jablonska J, Wu C F, Andzinski L, et al. CXCR2-mediated tumor-associated neutrophil ecruitment is regulated by IFN-β[J]. Int J Cancer, 2014, 134(6): 1346-58. doi:10.1002/ijc.v134.6 |
| [20] | Yildirim C, Favre J, Weijers E M, et al. IFN-β affects the angiogenic potential of circulating angiogenic cells by activating calpain 1[J]. Am J Physiol Heart Circ Physiol, 2015, 309(10): H1667-78. |
| [21] | 韩健, 孙保存, 马跃美, 等. 干扰素-γ对黑色素瘤细胞血管生成拟态的影响及机制[J]. 天津医药, 2015, 43(5): 453-6. Han J, Sun B C, MA Y M, et al. Effects and mechanism of interferon-γ on vasculogenic mimicry of melanoma cells[J]. Tianjin Med J, 2015, 43(5): 453-6. doi:10.11958/j.issn.0253-9896.2015.05.002 |
| [22] | Dunn G P, Bruce A T, Sheehan K C, et al. A critical function for type I interferons in cancer immunoediting[J]. Nature Immunol, 2005, 6(7): 722-9. doi:10.1038/ni1213 |
| [23] | Joffre O P, Segura E, Savina A, et al. Cross-presentation by dendritic cells[J]. Nat Rev Immunol, 2012, 12(8): 557-69. doi:10.1038/nri3254 |
| [24] | Flemming A. Cancer: Tumour-specific ablation of Treg cells induces anticancer response[J]. Nat Rev Drug Discov, 2016, 15(10): 676-7. |
| [25] | Srivastava S, Koch M A, Pepper M, et al. Type I interferons directly inhibit regulatory T cells to allow optimal antiviral T cell responses during acute LCMV infection[J]. J Exp Med, 2014, 211(5): 961-74. doi:10.1084/jem.20131556 |
| [26] | Zoglmeier C, Bauer H, N renberg D, et al. CpG blocks immunosuppression by myeloid-derived suppressor cells in tumor-bearing mice[J]. Clin Cancer Res, 2011, 17(7): 1765-75. doi:10.1158/1078-0432.CCR-10-2672 |
| [27] | Mandai M, Hamanishi J, Abiko K, et al. Dual faces of IFNγ in cancer progression: a role of PD-L1 induction in the determination of pro-and anti-tumor immunity[J]. Clin Cancer Res, 2016, 22(10): 2329-34. doi:10.1158/1078-0432.CCR-16-0224 |
| [28] | Anthony S M, Howard M E, Hailemichael Y, et al. Soluble interleukin-15 complexes are generated in vivo by type Ⅰ interferon dependent and independent pathways[J]. PLoS One, 2015, 10(3): e0120274. doi:10.1371/journal.pone.0120274 |
| [29] | Souza-Fonseca-Guimaraes F, Young A, Mittal D, et al. NK cells require IL-28R for optimal in vivo activity[J]. Proc Natl Acad Sci USA, 2015, 112(18): E2376-84. doi:10.1073/pnas.1424241112 |
| [30] | Waldmann T A. The shared and contrasting roles of IL2 and IL15 in the life and death of normal and neoplastic lymphocytes: implications for cancer therapy[J]. Cancer Immunol Res, 2015, 3(3): 219-27. doi:10.1158/2326-6066.CIR-15-0009 |
| [31] | 李琳, 钱晓萍, 杜娟, 等. 趋化因子CXCL9和CXCL10介导的胃癌免疫细胞浸润的探讨[J]. 现代肿瘤医学, 2015, 23(20): 2899-904. Li L, Qian X P, Du J, et al. Chemokine-driven lymphocyte infiltration in human gastric cancer[J]. J Mod Oncol, 2015, 23(20): 2899-904. doi:10.3969/j.issn.1672-4992.2015.20.05 |
| [32] | Platanias L C. Interferons and their antitumor properties[J]. J Interferon Cytokine Res, 2013, 33(4): 143-4. doi:10.1089/jir.2013.0019 |
| [33] | Stein B L, Tiu R V. Biological rationale and clinical use of interferon in the classical BCR-ABL-negative myeloproliferative neoplasms[J]. J Interferon Cytokine Res, 2013, 33(4): 145-53. doi:10.1089/jir.2012.0120 |
| [34] | Talpaz M, Hehlmann R, Quintás-Cardama A, et al. Re-emergence of interferon-α in the treatment of chronic myeloid leukemia[J]. Leukemia, 2013, 27(4): 803-12. doi:10.1038/leu.2012.313 |
| [35] | Ascierto P A, Chiarion-Sileni V, Muggiano A, et al. Interferon alpha for the adjuvant treatment of melanoma: review of international literature and practical recommendations from an expert panel on the use of interferon[J]. J Chemother, 2014, 26(4): 193-201. doi:10.1179/1973947813Y.0000000154 |
| [36] | 郑殿宇, 王勤章. 干扰素-γ治疗肾细胞癌的生物学效应[J]. 中华实用诊断与治疗杂志, 2013, 27(3): 213-5. Zheng D Y, Wang Q Z. Biological effects of interferon-γ on renal cells[J]. J Chin Practical Diagn Ther, 2013, 27(3): 213-5. |
| [37] | 白蓉. 干扰素联合索拉非尼治疗晚期肾癌的临床效果及安全性评价[J]. 中国医药导报, 2016, 13(18): 161-4. Bai R. Clinical efficacy and safety evaluation of patients with advanced renal cell carcinoma by using interferon combined with sorafenib[J]. China Med Herald, 2016, 13(18): 161-4. |
| [38] | 方祯, 华海清. 干扰素在胆系肿瘤治疗中的作用及其研究进展[J]. 临床肿瘤学杂志, 2014, 19(2): 180-5. Fang Z, Hua H Q. Progression of interferon for biliary tract cancer[J]. Chin Clin Oncol, 2014, 19(2): 180-5. |
| [39] | Demaria S, Pilones K A, Vanpouille-Box C, et al. The optimal partnership of radiation and immunotherapy: from preclinical studies to clinical translation[J]. Radiat Res, 2014, 182(2): 170-81. doi:10.1667/RR13500.1 |
| [40] | Woo S R, Fuertes M B, Corrales L, et al. STING-dependent cytosolic DNA sensing mediates innate immune recognition of immunogenic tumors[J]. Immunity, 2014, 41(5): 830-42. doi:10.1016/j.immuni.2014.10.017 |
| [41] | Sabatier R, Finetti P, Mamessier E, et al. Prognostic and predictive value of PDL1 expression in breast cancer[J]. Oncotarget, 2015, 6(7): 5449-64. doi:10.18632/oncotarget.v6i7 |
| [42] | Lin C F, Lin C M, Lee K Y, et al. Escape from IFN-γ-dependent immunosurveillance in tumorigenesis[J]. J Biomed Sci, 2017, 24(1): 10. doi:10.1186/s12929-017-0317-0 |