


2. 暨南大学 中药及天然药物研究所,广东 广州 510632
2. Institute of Traditional Chinese Medicine & Natural Products, Jinan University, Guangzhou 510632, China
Ⅰ型单纯疱疹病毒(herpes simplex virus type 1, HSV-1) 是一种至少能够编码80种蛋白的双链DNA病毒。HSV-1在人群中普遍存在,并将人类作为其唯一的天然宿主。据流行病学统计,HSV-1的全球感染率接近90%[1],多发生在幼儿期。在感染初期,HSV-1在黏膜上皮细胞内复制,立即早期基因(immediate-early, IE)、早期基因(early, E)、晚期基因(late, L)级联线性表达。其中,IE基因编码ICP0(infected cell polypeptide 0, ICP0)、ICP4(infected cell polypeptide 4, ICP4) 等立即早期蛋白,这些蛋白主要参与E基因和L基因的激活和病毒的免疫逃逸。E基因主要编码参与病毒DNA合成的酶,L基因编码形成病毒颗粒的蛋白。随后,成熟的HSV-1颗粒大量复制,细胞裂解死亡。此时,机体产生的免疫力将大部分病毒清除,只有少部分的病毒进入神经末梢并沿轴突逆行至神经元胞体,建立长期的潜伏感染。当机体受到多种因素如紫外线、心理和生理应激等刺激后,HSV-1可重新激活复制,引起唇疱疹、单纯疱疹病毒性角膜炎及脑炎。此外,越来越多的研究表明,HSV-1的感染也与阿尔茨海默病密切相关,能够增加HSV-1携带者患老年痴呆的风险[2]。近年来,HSV-1的潜伏感染研究取得了一定的进展,本文综述了HSV-1潜伏感染的建立、维持、激活三步循环及其分子基础,阐明HSV-1潜伏感染与应激复发的相关机制,对寻找药物治疗靶点以及防治HSV-1感染有着重要意义。
1 HSV-1潜伏感染的建立HSV-1在宿主内的生存策略是建立潜伏感染。潜伏感染的建立是HSV-1基因不能成功线性表达的结果,由神经元独特的分化形态和精细结构所决定。体外研究发现,HSV-1感染发生在胞体和树突时,常形成增殖性裂解感染,而通过轴突末端感染则易建立潜伏感染。但经过IE基因的转录诱导剂六亚甲基二乙酰胺和HSV-1辅助病毒蛋白16(virus protein 16, VP16) 处理后,通过轴突末端感染的HSV-1增殖性复制能力明显提高,提示HSV-1沿轴突逆行并转运至细胞核时,因没有足够的VP16进入细胞核而无法与POU转录因子家族的Oct-1(octamer binding protein-1)、HCF-1(host cell factor-1) 结合形成三联体,启动IE基因的表达[3]。由于VP16/HCF1/Oct1三联体的缺乏,ICP0表达减少,神经元能通过HDAC/LSD1/REST/CoREST宿主沉默复合物阻断病毒E和L基因的表达,进一步促进潜伏的建立。与上皮细胞和黏膜细胞不同,神经元中的HCF-1均位于胞质,Oct-1的表达下调,还存在其它POU转录因子成员可以竞争性抑制Oct-1的作用[4]。这些研究也表明了为什么神经节是HSV-1建立潜伏感染的主要位点。
此外,HSV-1已进化出多种进行免疫逃逸策略,促进潜伏感染的形成。HSV-1感染宿主细胞后,宿主能通过一系列胚系基因编码的病原模式识别受体,如Toll样受体(Toll-like receptor, TLRs)、RIG-Ⅰ样受体(RIG-Ⅰ-like receptors, RLRs),以及DNA识别受体如DAI、cGAS、AIM等,识别HSV-1病原相关分子,感知其入侵(Fig 1),然后通过相关的细胞信号转导,激活下游的转录因子包括核因子κB(nuclear factor kappa B, NF-κB)及干扰素调控因子(interferon regulatory factor, IRF),诱导Ⅰ型干扰素(type Ⅰ interferon, IFN-Ⅰ)及炎症因子的表达,同时诱导适应性免疫反应,清除HSV-1感染。因此,拮抗宿主的干扰素诱导的免疫应答反应是HSV-1完成生命循环的关键策略。研究表明,HSV-1能够通过编码与宿主抗病毒反应相关的蛋白,干扰宿主体内各种病原模式受体的识别及下游蛋白,抑制其下游信号通路激活,阻断IFN-Ⅰ产生,从而有效抑制细胞抗病毒的免疫反应。HSV-1皮层蛋白激酶US1、皮层蛋白US11、ICP0分别拮抗TLR、RLR以及DNA识别受体介导的IFN-Ⅰ抗病毒作用[5]。ICP47,一种HSV-1编码的极早期蛋白,通过与宿主细胞的抗原加工相关转运体(transporter associated with antigen processing, TAP)结合,阻断MHC Ⅰ(major histocompatibility complex, MHC)介导的抗原多肽呈递,影响免疫系统的识别。研究表明,与人源细胞相比,啮齿类动物细胞中HSV-1的ICP47阻断抗原呈递的效率,至少降低了100倍,因而HSV-1更容易被免疫系统清除,自发性重激活事件不易在啮齿类动物中发生[6]。HSV-1还能编码一种神经毒性因子—ICP34.5,多途径抑制自噬诱导的免疫反应。研究表明,ICP34.5不仅能通过招募蛋白磷酸酶1α(protein phosphatase 1α, PP1α),使已被双链RNA依赖的蛋白质激酶(double-stranded RNA-dependent protein kinase, PKR)磷酸化的真核起始因子2A(eukaryotic translation initiation factor 2A, eIF2α)水解为去磷酸化状态,阻断PKR/eIF2α自噬信号通路,还与自噬相关蛋白Beclin1结合,逃逸宿主的清除[7]。
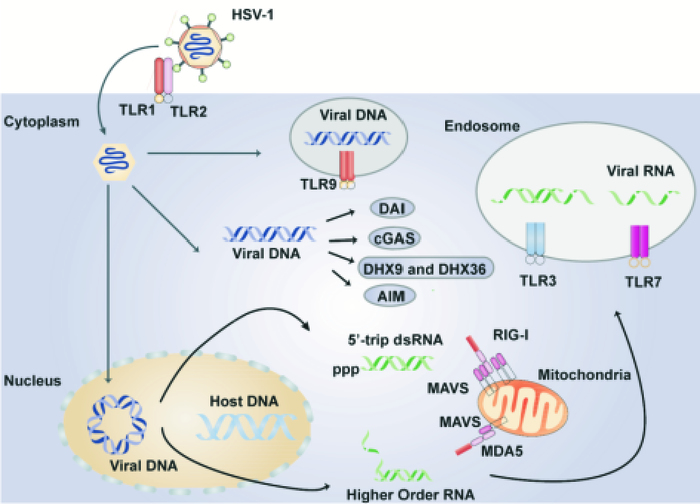
|
| Fig 1 Innate immune recognition and activation by HSV-1 |
HSV-1的潜伏感染需要一个精细的平衡来维持,在允许控制病毒复制的同时,保证宿主组织的生存能力。这一平衡受病毒、宿主神经元、周围免疫细胞调控[8],包括HSV-1编码的潜伏相关转录子(latency associated transcript, LAT)、microRNA、神经生长因子(nerve growth factor, NGF)、宿主细胞的表观遗传调控和T淋巴细胞。
2.1 HSV-1编码潜伏相关转录子和microRNA维持潜伏感染HSV-1建立了一系列病毒性调节机制以阻止宿主细胞凋亡,从而避免被宿主清除,发挥潜伏的功能。在小鼠的潜伏感染期,除了LAT和非编码RNA之外,其他大部分HSV-1抗凋亡的基因ICP27、Us3、Us5、gJ、gD都处于沉默状态[4],因此,LAT的抗凋亡作用对潜伏感染的维持有着重要的作用。研究发现,表达LAT质粒的小鼠成神经瘤细胞C1300,能够减少caspase-3的活化,抑制由冷应激和颗粒酶B(granzyme B, GrzB)诱导的凋亡。这种作用可能与LAT通过上调促存活蛋白—蛋白激酶B(protein kinase B, Akt)的表达,抑制p-Akt的去磷酸化有关[9]。此外,LAT还能抑制死亡受体介导的caspase-8依赖性途径,发挥抗凋亡作用[10]。宿主的激活转录因子3(activating transcription factor 3, ATF3) 是碱性亮氨酸拉链蛋白家族中ATF/CREB亚家族的成员之一。作为一个应激早期快速反应基因,ATF3在HSV-1潜伏感染的维持发挥着关键的作用。其作用机制与ATF3增加病毒LAT的表达,维持宿主细胞完整性有关[11]。
在抗凋亡的同时,HSV-1通过编码不同的非编码RNA在转录后调控病毒裂解基因的表达,进一步维持潜伏感染。HSV-1能够编码24种成熟的microRNA,这些microRNA通过碱基互补配对的方式识别靶mRNA,并根据互补程度的不同,指导沉默复合体降解靶mRNA或者阻遏靶mRNA的翻译。LAT是HSV-1潜伏期转录最活跃的位置,大部分HSV-1编码miRNA的基因都分布在其编码区及周围。在增殖性复制感染阶段,miR-H1、miR-H6表达最高,用人工合成的miR-H6转染到HSV-1感染的人角膜上皮细胞中发现,miR-H6抑制了早期和晚期基因转录所必需的ICP4的表达,降低IL-6的产生水平,从而抑制病毒的增殖性复制和角膜炎症。而潜伏感染阶段,病毒主要大量编码miR-H2、miR-H3、miR-H4,这3种miRNA能通过抑制HSV-1裂解性关键蛋白的表达,维持潜伏感染。ICP0在裂解感染和激活中发挥重要作用,可以激活立即早期、早期和晚期基因表达,促进HSV-1进入裂解周期。而miR-H2能够靶向阻遏ICP0的表达,抑制HSV-1进行增殖性复制。miR-H3、miR-H4能够抑制ICP34.5的表达,研究表明ICP34.5缺失的病毒突变株,不丧失其在宿主内复制能力,但却不能被激活复制[12]。HSV-1的LAT抗凋亡区域内还存在2个非编码的小RNA—sRNA1、sRNA2。这2个小RNA不仅能下调裂解性感染蛋白的表达,不同程度的抑制病毒增殖性感染,还能协同发挥抗凋亡作用,有利于潜伏感染状态的维持[13]。
2.2 神经元通过神经生长因子和表观遗传调控机制介导HSV-1潜伏感染的维持HSV-1潜伏在神经元后,就不可避免地受神经元特有的生理环境影响。神经生长因子是这种特有的生理环境中最重要的成员,使得感染的神经元自身就可作为HSV-1的潜伏控制器。NGF具有神经元营养和促突起生长双重生物学功能,作为神经细胞生长调节因子,在单纯疱疹病毒潜伏的维持中发挥至关重要的作用[14]。NGF能够激活酪氨酸激酶(tyrosine kinase, TrkA)—磷酸肌醇3-激酶(phosphatidylinositide 3-kinase, PI3K)途径的信号通路下游分子3-磷酸肌醇依赖性蛋白激酶1(3-phosphoinositide-dependent protein kinase-1, PDK1),持续磷酸化其下游Akt,维持HSV-1的潜伏感染。这种作用与哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin 1, mTOR1) 密切相关。mTOR1是PI3K-Akt信号通路的一个效应分子,活化的mTOR1主要通过磷酸化真核细胞翻译抑制因子4E-BP1,使其激活并与真核转录启动因子-4E分离,解除对帽依赖性翻译的抑制作用,有利于病毒潜伏感染蛋白的合成,使得神经元以一种自主性方式维持病毒的潜伏感染[15]。
染色质的表观遗传调控是宿主抵御大多数DNA病毒的自主反应,这种固有的防御机制动员细胞内组蛋白以及其相关复合物来沉默病毒基因的转录和复制[16]。HSV-1的DNA以游离的环状附加体,存在于潜伏感染的神经元中。病毒的DNA本身不存在广泛的甲基化修饰,而是像宿主染色质一样,与组蛋白结合形成核小体,发生组蛋白转录后修饰,并表现出常染色质状态与异染色质状态的形态和功能区别,表明潜伏期的病毒基因表达受到染色质水平上的调控。研究发现,常染色质上的组蛋白修饰,如组蛋白H3K9和H3K14的高乙酰化常见于潜伏基因LAT启动子及增强子区域,而异染色质上的抑制性组蛋白修饰如H3K9me3、H3K9me2以及H3K27me富集在裂解基因上,且裂解基因启动子区域组蛋白低乙酰化,这些研究结果与潜伏期病毒LAT基因高表达、裂解基因低表达现象一致。此外,潜伏感染的小鼠注射组蛋白酶去乙酰化酶抑制剂后,潜伏感染的病毒重激活,而使用组蛋白H3K27me3去甲基化的特异性抑制剂能减少潜伏感染神经元的激活[17]。这些研究表明,宿主细胞可以通过各种组蛋白修饰来综合调控潜伏感染的基因表达,沉默裂解基因的转录活性,从而维持HSV-1的潜伏感染
2.3 宿主免疫系统监控与HSV-1潜伏感染的维持在潜伏感染的神经元中,HSV-1裂解基因并不是完全沉默,而是以一种随机有限方式进行表达,其表达的抗原能够被神经元MHC Ⅰ类细胞或者卫星胶质细胞呈递,导致大量的特异性CD4+和CD8+ T淋巴细胞活化,并聚集在潜伏感染的神经节内。这些T细胞对潜伏感染状态的维持至关重要[18]。在潜伏感染的神经节中,存在gB-CD8+特异性和非gB-CD8+特异性两类T细胞,能够协同发挥免疫监视作用,其比例受病毒感染途径的影响[19]。当HSV-1裂解基因低水平表达时,非gB-CD8+特异性T细胞能够通过分泌IFN-γ,抑制ICP0的表达,阻止病毒的重激活,但并不针对所有潜伏感染的神经元。对于IFN-γ无法有效抑制的神经元,gB-CD8+特异性的T细胞直接与其形成免疫突触,通过颗粒酶B(granzyme B, GrzB)降解病毒基因表达所必须的立即早期蛋白ICP4,以一种非细胞毒性的方式抑制裂解基因表达。研究表明,三叉神经中HSV-1特异性的CD8+ T细胞属于组织常驻记忆T细胞,当受到破坏时,不能进行自身增殖或从外周血液招募特异性的CD8+ T细胞[20],这种特性使得研发特异性CD8+ T记忆细胞的疫苗变得复杂化。研究表明,特异性CD4+ T细胞在维持潜伏感染的中并没有发挥直接作用,但它能够防止部分特异性CD8+ T出现功能耗竭,维持其对病毒的免疫抑制能力[21]。这些研究表明机体的免疫系统发挥一种免疫监视的作用,当宿主固有的沉默防御机制失灵时,这作用可以使得机体的免疫系统能够迅速及时做出反应,抑制HSV-1基因的表达,阻断HSV-1的重激活,维持潜伏感染。
3 应激负荷与HSV-1的激活复发维持潜伏感染的平衡易受到应激负荷的影响,导致潜伏的HSV-1从感觉神经元内重激活而进入裂解周期,释放有感染活性的病毒,引起复发性疾病。
3.1 应激负荷增加HSV-1复发易感性在监视和抑制HSV-1的激活和复制过程中,IFN-Ⅰ发挥了重要的作用。细胞内有多个IFN-Ⅰ的产生途径,其中线粒体抗病毒信号蛋白(mitochondrial antiviral-signaling protein, MAVS)作为一种接头蛋白,在调节宿主IFN-Ⅰ信号通路过程中扮演重要角色。RLRs等细胞模式识别受体识别入侵的病原体,并将信号传递给MAVS,进而激活IFN-Ⅰ表达,诱发细胞内抗HSV-1感染天然免疫反应[22]。RIG-Ⅰ主要识别单链RNA病毒,只识别少数的DNA病毒,但是潜伏的HSV-1病毒基因激活转录成病毒RNA后,仍然是通过RIG-1识别[23]。潜伏感染期,HSV-1病毒基因随机表达,释放的单链病毒RNA被RIG-Ⅰ识别,RIG-Ⅰ的CARD结构域募集到线粒体外膜上,与MAVS的CARD结构域相互嵌合,激活MAVS发生自身聚合反应,形成一个更大的活性聚合体。该聚合体大量募集下游信号复合体TBK1/IKKε和IKK1/IKK,从而激活下游IRF3和NF-κB,诱导瀑布式的信号级联反应,产生IFN-Ⅰ来抑制病毒的复制,抵抗感染[24]。研究表明,拘束应激负荷能引起细胞的氧化应激,尤其是免疫细胞的氧化损伤,导致线粒体功能受损,进而导致MAVS蛋白表达下降[25],导致IFN-Ⅰ产生下降。因此,任何干预线粒体MAVS信号通路的因素都可能削弱宿主细胞内的天然免疫屏障作用,增加HSV-1激活再感染的易感性。
3.2 应激通过多种途径激活HSV-1应激反应有很多种激素参与, 这表明HSV-1的激活复发受到机体激素水平的调控,其中糖皮质激素在HSV-1的激活复发中发挥着关键的作用。在应激负荷后,机体大量分泌的糖皮质激素,通过激活糖皮质激素受体(glucocorticoid receptor, GR),从而促进细胞转录因子的表达,激活病毒裂解基因的ICP0的启动子。糖皮质激素水平的升高,还能促进宿主细胞内糖皮质激素调节蛋白激酶1的表达(serum and glucocorticoid-regulated protein kinases 1, SGK1),介导病毒的激活复制。研究表明,在应激刺激后,SGK1能促进HSV-1的增殖复制,而特异性抑制SGK1的活性,则下调病毒调节蛋白的表达水平,抑制HSV-1的复制[26]。此外,潜伏感染HSV-1的小鼠,在拘束应激负荷后,血浆中的皮质酮升高,三叉神经节特异性CD8+ T细胞的数量减少,分泌IFN-γ能力降低,从而引起HSV-1激活复发[8]。可见,在心理和生理应激负荷后,HSV-1重激活是由于机体的糖皮质激素水平的升高,病毒基因表达增加,机体免疫能力受到抑制所导致的结果。甲状腺激素也在调控HSV-1激活复发扮演着一个重要的角色。甲状腺激素能通过甲状腺激素受体激活LAT的转录,抑制ICP0表达,并募集抑制性组蛋白H3K9me3和H3K9me2至HSV-1胸苷激酶的启动子[27],阻断病毒基因的表达,抑制病毒的重激活。但在高热、手术创伤等刺激下,机体的甲状腺激素分泌大幅度的降低,无法有效对HSV-1的基因沉默,从而引起HSV-1激活复发[28]。
紫外线照射和物理创伤等应激诱导的重激活是通过介导凋亡信号途径来实现的。神经元中的线粒体均匀分布在整个神经元中,包括轴突。当皮肤表面受到紫外线照射时,诱导邻近的轴突末端中的线粒体产生ROS,抑制mTOR的活性,降低Bcl-2的表达水平,产生凋亡信号[29],诱导病毒IE、E、L基因同时表达,激活快速装配成成熟的病毒颗粒,逃离即将凋亡的宿主,感染新的细胞,从而延续其生存。综上所述,应激在HSV-1重激活的作用机制如Fig 2所示。
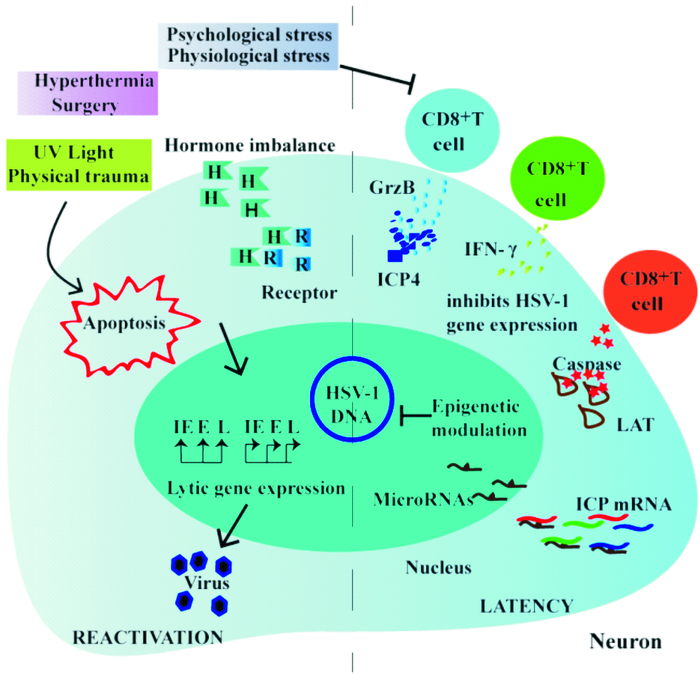
|
| Fig 2 Stress-induced HSV-1 reactivation |
目前,尽管并没有发现HSV-1的天然动物宿主,但小鼠和家兔仍是用于研究HSV-1潜伏转录、表观修饰以及潜伏再激活主要模型[30]。这些动物感染HSV-1后,病毒在其外周上皮细胞内复制,然后沿轴突逆行至感觉神经节的神经元细胞核中,建立潜伏感染,而不需要借助其它手段。潜伏的病毒DNA以环状的游离的染色质结构,沉默于宿主染色质上。通过高热、紫外照射等刺激,可诱导HSV-1的重激活。HSV-1潜伏位点根据感染途径的不同,也会随之改变。通常,经眼途径感染HSV-1,病毒潜伏在其三叉神经节中。而经足垫途径感染,背根神经节是其主要的潜伏位点。
HSV-1体外潜伏模型主要有PC12细胞潜伏模型、包皮成纤维细胞潜伏模型、颈上神经元潜伏模型。模型的建立是通过使用阿昔洛韦,一种病毒DNA多聚酶的抑制剂,抑制HSV-1的增殖性复制,使HSV-1能够这些细胞系如PC12细胞和原代神经元中建立并维持一种静息感染,然后用各种化学和物理刺激诱导HSV-1重激活,从而用于研究HSV-1和宿主潜伏激活之间的关键靶点。但这些体外建立的静息感染并不能完全的模拟其体内潜伏感染,一种真正意义上的潜伏还无法在体外建立[31]。
4.2 抗HSV-1复发药物目前,应对HSV-1感染临床治疗药物主要有阿昔洛韦、伐昔洛韦与泛昔洛韦,但这些标准的抗病毒药物却难以清除患者体内潜伏的病毒。因为,大多数的潜伏的宿主神经元既不复制DNA,也不分裂,所以一旦HSV-1基因组在核内建立潜伏感染,HSV-1的感染不再需要病毒的进一步复制,潜伏感染是绝对存在的。因此,研发抗HSV-1复发药物是目前治疗HSV-1感染及其复发性疾病的关键策略。
组蛋白修饰抑制剂能够通过特异性抑制HSV-1激活复发中某些关键的组蛋白修饰,从而阻断HSV-1的激活。研究表明,赖氨酸特异性组蛋白去甲基化酶(lysine-specific demethylase 1,LSD1)、十字形结构域蛋白2(jumonji C domain-containing protein 2,JMJD2) 的H3K27me3组蛋白去甲基化酶抑制剂能增加病毒基因组异染色质水平向常染色质水平转换的表观抑制,阻断HSV-1体外潜伏激活[19]。因此,基于HSV-1激活复发过程中关键的组蛋白修饰,调控HSV-1基因组染色质水平的活化是研发治疗HSV-1潜伏复发药物的新靶点。
miRNA作为一类新型的药物作用靶点逐渐受到各界关注[32-33],通过上调或者下调病毒和宿主特异性的miRNA,有针对性的阻止或抑制HSV-1复制。例如,上调神经元中特异性的miR-138,能够有效的抑制HSV-1的激活复发[34]。虽然这些研究都还停留在实验阶段,但有理由相信小分子miRNA药物有望成为一个治疗HSV-1潜伏感染的新方向。
研制高效、安全的疫苗是预防和治疗HSV-1感染的有效措施。HSV-1疫苗的研究已开展多年,并取得了一定进展,但目前针对HSV-1的疫苗研究大都仍停留在体外实验、动物实验和临床前实验阶段,少数几个处于临床试验阶段,全球范围内尚无HSV-1疫苗经批准上市[35]。根据成分及作用机制的不同,HSV-1疫苗大致可划分为灭活疫苗、复制缺陷性病毒疫苗、减毒活疫苗、亚单位疫苗、肽疫苗、活载体疫苗和DNA疫苗等。最新一项纳入8 323名女性的大型随机、双盲临床实验证实,gD2-铝剂-MPL亚单位病毒疫苗能够有效预防HSV-1感染。此外,近5年来,已有4种含有免疫佐剂,增强T细胞的免疫反应候选疫苗,GEN-003、HerpV、VCL-HB01/HM01、HSV529进入临床Ⅰ/Ⅱ期阶段。尽管初步的研究结果表明这些疫苗都对HSV-2的感染有疗效,但鉴于病毒之间的同源性,这些疫苗的研发也会有益于HSV-1的治疗。因此,随着对HSV-1的免疫学特点及感染机制更深入的研究,HSV-1疫苗的研制将会取得长足的进展。
5 展望近年来,随着社会生活节律的加快,生活环境的改变及社会竞争压力增大等影响,HSV-1激活引起复发性疾病已成为人们广泛关注且需待解决的问题。然而由于HSV-1潜伏感染的特性及其耐药株的出现,使得标准的抗病毒药物和疫苗并不能有效的治愈其感染和复发。而机体受到应激负荷是导致HSV-1复发的直接原因,所以通过提高机体应激负荷抵御能力或者降低应激负荷所引起的复发易感,将会是防治HSV-1复发性疾病的有效措施。此外,一些HSV-1的病毒蛋白需要人独有的细胞因子才能发挥最佳功能,这些在动物模型上已知的潜伏感染和复发的机理研究,是否适用于人这一天然宿主,仍需要进一步阐明。
总之,潜伏感染是HSV-1的生存策略,也是其复发的根本原因。潜伏与复发之间的转变是病毒与宿主相互作用的复杂过程,这一过程涉及到病毒基因的转录、神经细胞及其周围环境的调节和影响。但目前HSV-1潜伏和复发的确切分子机制尚不明确,还不足以解决HSV-1的复发性和终身性感染等问题。因此,只有深入研究单纯疱疹病毒的潜伏感染机制,明确应激复发这一过程中的决定因素,才能更有针对性地寻找治疗和预防HVS-1感染的有效方法及其策略。
| [1] | Bradley H, Markowitz L E, Gibson T, et al. Seroprevalence of herpes simplex virus types 1 and 2-United States, 1999-2010[J]. J Infect Dis, 2014, 209(3): 325-33. doi:10.1093/infdis/jit458 |
| [2] | Harris S A, Harris E A. Herpes simplex virus type 1 and other pathogens are key causative factors in sporadic Alzheimer's disease[J]. J Alzheimers Dis, 2015, 48(2): 319-53. doi:10.3233/JAD-142853 |
| [3] | Hafezi W, Lorentzen E U, Eing B R, et al. Entry of herpes simplex virus type 1(HSV-1) into the distal axons of trigeminal neurons favors the onset of nonproductive, silent infection[J]. PLoS Pathog, 2012, 8(5): e1002679. doi:10.1371/journal.ppat.1002679 |
| [4] | Nicoll M P, Proenca J T, Efstathiou S. The molecular basis of herpes simplex virus latency[J]. FEMS Microbiol Rev, 2012, 36(3): 684-705. doi:10.1111/j.1574-6976.2011.00320.x |
| [5] | Su C, Zhan G, Zheng C. Evasion of host antiviral innate immunity by HSV-1, an update[J]. Virol J, 2016, 13: 38. doi:10.1186/s12985-016-0495-5 |
| [6] | Verweij M C, Ressing M E, Knetsch W, et al. Inhibition of mouse TAP by immune evasion molecules encoded by non-murine herpesviruses[J]. Mol Immunol, 2011, 48(6-7): 835-45. doi:10.1016/j.molimm.2010.12.008 |
| [7] | O′Connell D, Liang C. Autophagy interaction with herpes simplex virus type-1 infection[J]. Autophagy, 2016, 12(3): 451-9. doi:10.1080/15548627.2016.1139262 |
| [8] | Egan K P, Wu S, Wigdahl B, et al. Immunological control of herpes simplex virus infections[J]. J Neurovirol, 2013, 19(4): 328-45. doi:10.1007/s13365-013-0189-3 |
| [9] | Carpenter D, Hsiang C, Jiang X, et al. The herpes simplex virus type 1(HSV-1) latency-associated transcript(LAT) protects cells against cold-shock-induced apoptosis by maintaining phosphorylation of protein kinase B(AKT)[J]. J Neurovirol, 2015, 21(5): 568-75. doi:10.1007/s13365-015-0361-z |
| [10] | Jin L, Carpenter D, Moerdyk-Schauwecker M, et al. Cellular FLIP can substitute for the herpes simplex virus type 1 latency-associated transcript gene to support a wild-type virus reactivation phenotype in mice[J]. J Neurovirol, 2008, 14(5): 389-400. doi:10.1080/13550280802216510 |
| [11] | Shu M, Du T, Zhou G, et al. Role of activating transcription factor 3 in the synthesis of latency-associated transcript and maintenance of herpes simplex virus 1 in latent state in ganglia[J]. Proc Natl Acad Sci USA, 2015, 112(39): E5420-6. doi:10.1073/pnas.1515369112 |
| [12] | Piedade D, Azevedo-Pereira J M. The role of microRNAs in the pathogenesis of herpesvirus infection[J]. Viruses, 2016, 8(6): 156. doi:10.3390/v8060156 |
| [13] | Shen W, Sa e Silva M, Jaber T, et al. Two small RNAs encoded within the first 1.5 kilobases of the herpes simplex virus type 1 latency-associated transcript can inhibit productive infection and cooperate to inhibit apoptosis[J]. J Virol, 2009, 83(18): 9131-9. doi:10.1128/JVI.00871-09 |
| [14] | Wilson A C, Mohr I. A cultured affair: HSV latency and reactivation in neurons[J]. Trends Microbiol, 2012, 20(12): 604-11. doi:10.1016/j.tim.2012.08.005 |
| [15] | Kobayashi M, Wilson A C, Chao M V, et al. Control of viral latency in neurons by axonal mTOR signaling and the 4E-BP translation repressor[J]. Genes Dev, 2012, 26(14): 1527-32. doi:10.1101/gad.190157.112 |
| [16] | Gu H, Zheng Y. Role of ND10 nuclear bodies in the chromatin repression of HSV-1[J]. Virol J, 2016, 13: 62. doi:10.1186/s12985-016-0516-4 |
| [17] | Messer H G, Jacobs D, Dhummakupt A, et al. Inhibition of H3K27me3-specific histone demethylases JMJD3 and UTX blocks reactivation of herpes simplex virus 1 in trigeminal ganglion neurons[J]. J Virol, 2015, 89(6): 3417-20. doi:10.1128/JVI.03052-14 |
| [18] | Russell T A, Tscharke D C. Lytic promoters express protein during herpes simplex virus latency[J]. PLoS Pathog, 2016, 12(6): e1005729. doi:10.1371/journal.ppat.1005729 |
| [19] | Sheridan B S, Cherpes T L, Urban J, et al. Reevaluating the CD8 T-cell response to herpes simplex virus type 1: involvement of CD8 T cells reactive to subdominant epitopes[J]. J Virol, 2009, 83(5): 2237-45. doi:10.1128/JVI.01699-08 |
| [20] | Himmelein S, St Leger A J, Knickelbein J E, et al. Circulating herpes simplex type 1(HSV-1)-specific CD8+ T cells do not access HSV-1 latently infected trigeminal ganglia[J]. Herpesviridae, 2011, 2(1): 1. doi:10.1186/2042-4280-2-1 |
| [21] | Frank G M, Lepisto A J, Freeman M L, et al. Early CD4(+) T cell help prevents partial CD8(+) T cell exhaustion and promotes maintenance of herpes simplex virus 1 latency[J]. J Immunol, 2010, 184(1): 277-86. doi:10.4049/jimmunol.0902373 |
| [22] | Seth R B, Sun L, Ea C K, et al. Identification and characterization of MAVS, a mitochondrial antiviral signaling protein that activates NF-kappaB and IRF 3[J]. Cell, 2005, 122(5): 669-82. doi:10.1016/j.cell.2005.08.012 |
| [23] | Paludan S R, Bowie A G, Horan K A, et al. Recognition of herpesviruses by the innate immune system[J]. Nat Rev Immunol, 2011, 11(2): 143-54. doi:10.1038/nri2937 |
| [24] | Wu B, Hur S. How RIG-Ⅰ like receptors activate MAVS[J]. Curr Opin Virol, 2015, 12: 91-8. doi:10.1016/j.coviro.2015.04.004 |
| [25] | Cai Y, Li Y F, Tang L P, et al. A new mechanism of vitamin C effects on A/FM/1/47(H1N1) virus-induced pneumonia in restraint-stressed mice[J]. Biomed Res Int, 2015, 2015: 675149. |
| [26] | Kook I, Jones C. The serum and glucocorticoid-regulated protein kinases(SGK) stimulate bovine herpesvirus 1 and herpes simplex virus 1 productive infection[J]. Virus Res, 2016, 222: 106-12. doi:10.1016/j.virusres.2016.06.007 |
| [27] | Chen F, Figliozzi R W, Bedadala G, et al. Overexpression of thyroid hormone receptor beta1 altered thyroid hormone-mediated regulation of herpes simplex virus-1 replication in differentiated cells[J]. J Neurovirol, 2016, 22(5): 555-63. doi:10.1007/s13365-016-0423-x |
| [28] | Hsia S C, Bedadala G R, Balish M D. Effects of thyroid hormone on HSV-1 gene regulation: implications in the control of viral latency and reactivation[J]. Cell & Biosci, 2011, 1(1): 24. |
| [29] | Alexander A, Cai S L, Kim J, et al. ATM signals to TSC2 in the cytoplasm to regulate mTORC1 in response to ROS[J]. Proc Natl Acad Sci USA, 2010, 107(9): 4153-8. doi:10.1073/pnas.0913860107 |
| [30] | Kollias C M, Huneke R B, Wigdahl B, et al. Animal models of herpes simplex virus immunity and pathogenesis[J]. J Neurovirol, 2015, 21(1): 8-23. doi:10.1007/s13365-014-0302-2 |
| [31] | Bloom D C, Giordani N V, Kwiatkowski D L. Epigenetic regulation of latent HSV-1 gene expression[J]. Biochim Biophys Acta, 2010, 1799(3-4): 246-56. doi:10.1016/j.bbagrm.2009.12.001 |
| [32] | 王沛, 李晓天, 张莉蓉. miRNA对药物代谢酶的转录后调控[J]. 中国药理学通报, 2015, 31(8): 1037-40. Wang P, Li X T, Zhang L R. Post-transcription regulation of drug metabolic enzymes by miRNAs[J]. Chin Pharmacol Bull, 2015, 31(8): 1037-40. |
| [33] | 刘晓丽, 王如峰, 胡秀华. MicroRNA在呼吸系统疾病预防和治疗中的研究进展[J]. 中国药理学通报, 2015, 31(7): 895-9. Liu X L, Wang R F, Hu X H. Advanced study on microRNAs involved in prevention and treatment of respiratory system diseases[J]. Chin Pharmacol Bull, 2015, 31(7): 895-9. |
| [34] | Frappier L. Regulation of herpes virus reactivation by host microRNAs[J]. J Virol, 2015, 89(5): 2456-8. doi:10.1128/JVI.03413-14 |
| [35] | Johnston C, Gottlieb S L, Wald A. Status of vaccine research and development of vaccines for herpes simplex virus[J]. Vaccine, 2016, 34(26): 2948-52. doi:10.1016/j.vaccine.2015.12.076 |

