


2. 漯河医学高等专科学校 药理学教研室,河南 漯河 462002
2. Dept of Pharmacology, Luohe Medical College, Luohe Henan 462002, China
研究显示,拓扑异构酶Ⅱ(topoisomerase Ⅱ, Top Ⅱ)涉及多种恶性肿瘤,与癌细胞中DNA复制、转录和染色质重塑相关,是一个重要的化疗靶点,而且Top Ⅱ抑制剂在化疗中非常有效,已作为多种恶性肿瘤的预后标记物[1]。因此,DNA Top Ⅱ是一个筛选抗癌剂重要靶点。目前,Top Ⅱ抑制剂已被用于人类恶性肿瘤临床治疗,但大多数Top Ⅱ抑制剂易产生心脏毒性、多药物抵抗等严重的副作用[2]。因此,寻求一种毒性和副作用较少的Top Ⅱ靶向药物迫在眉睫。本课题组前期研究表明,马鞭草总黄酮(total flavonoids of Verbena officinalis L, TFV)能抑制肝癌HepG-2细胞的增殖,诱导细胞凋亡[3-4],本研究重点考察不同剂量的TFV对肝癌HepG-2细胞凋亡、Top Ⅱ表达的影响。
1 材料与方法 1.1 细胞株人肝癌HepG-2细胞购自武汉博士德有限公司。
1.2 药物与试剂芦丁对照品(南京泽朗医药科技有限公司),纯度:>98%;TFV (漯河医专天然药物化学教研室),以芦丁为标准品,高效液相色谱法在检测波长510 nm测得总黄酮含量约为81%,溶于适量二甲基亚砜(dimethyl sulfoxide, DMSO)中,培养基稀释成不同浓度,过滤除菌4 ℃保存;DMEM高糖培养基(美国Hyclone公司);胎牛血清(杭州四季青生物技术公司);胰酶(美国Gibco公司);DNA TopoⅡ(美国USB公司);质粒pBR 322DNA(Fermentas公司);Dead end TM TUNEL荧光法检测系统(美国普洛麦格公司);TOPO Ⅱα、TOPO Ⅱβ兔抗人抗体(美国Abcam公司);caspase-3、Bcl-2、Bax兔抗人抗体、HRP标记的羊抗兔IgG二抗及β-actin抗体(美国Sigma公司)。
1.3 仪器ST-360酶联免疫检测仪(上海科华实验系统有限公司);Geldoc 2000凝胶成像分析系统(美国Bio-Rad公司);light cycleR 96实时荧光定量PCR仪(德国Roche Diagnostics公司)。
1.4 方法 1.4.1 细胞培养HepG-2细胞株由漯河市医学生物工程重点实验室传代保种,用含10%胎牛血清的DMEM培养基在37 ℃、5% CO2条件下培养,0.25%的胰蛋白酶消化。
1.4.2 TUNEL-DAPI双染色法检测细胞凋亡取对数期HepG-2细胞,以1×108·L-1的密度接种于6孔培养板内,各孔事先加入已清洗干净的盖玻片,细胞贴壁后,参照前期研究设置[3-4]质量浓度为50、100、200 mg·L-1的TFV组,对照组给予等量培养液,每组设置3个平行孔,培养48 h后,弃去上清,PBS漂洗2次。参照TUNEL试剂盒说明书,采用4%多聚甲醛固定、0.2% Triton X-100通透,加入TUNEL反应混合液(TdT和荧光素标记的dUTP),37 ℃孵育60 min,PBS漂洗2次,每次5 min,加DAPI 4 min,PBS漂洗2次,每次5 min,封片。荧光显微镜下观察,每个玻片随机选择10个视野,计数凋亡细胞,计算凋亡率。凋亡率/%=(阳性细胞数/细胞总数)×100%。
1.4.3 超螺旋pBR322 DNA松弛实验DNA拓扑异构酶Ⅱ活性采用超螺旋pBR322 DNA松弛实验测定,将0.2 μg pBR322 DNA与1U TopⅡ和不同浓度的TFV在20 μL反应缓冲液[10 mmol·L-1 Tris(pH 7.9)、50 mmol·L-1 KCl、50 mmol·L-1 NaCl、5 mmol·L-1 MgCl2、0.1 mmol·L-1 EDTA、15 mg·L-1 BSA、1 mmol·L-1 ATP]37℃反应30 min。然后,加入2 μL终止液(10% SDS和100 mmol·L-1 EDTA)终止反应。样品在0.8%琼脂糖凝胶1×TAE缓冲液120 V电泳60 min,0.5 mg·L-1溴化乙锭染色15 min,凝胶成像系统观察并拍照。
1.4.4 Real time PCR将药物处理48 h的细胞(TFV 50、100、200 mg·L-1组和对照组),TRIzol提取总RNA,测定纯度。按照逆转录试剂盒说明书逆转录生成cDNA。引物序列由上海英骏公司提供。TOP Ⅱα上游序列:5′-GCGGGCTAAAGGAAGGTTCA-3′,下游序列:5′-TGACACTTCCATGGTGACGG-3′,产物大小151 bp;TOP Ⅱβ上游序列:5′-CGTCCGCTCCGGATCTTCG-3′,下游序列:5′-CACCCACATGAACTGCGTCA-3′,产物大小408 bp;内参GAPDH上游引物:5′-CTCCTGTTCGACAGTCAGCC-3′,下游引物:5′-TTCCCGTTCTCAGCCTTGAC-3′,长度262 bp。PCR采用20 μL的反应体系,其中2×SYBRR Premix Ex-Taq Ⅱ 10 μL,上游(10 μmol)和下游(10 μmol)各0.5 μL,cDNA 1 μL,PCR级高纯水8 μL。采用light cycleR 96实时荧光定量PCR仪同时对目的基因和内参基因(GAPDH)进行基因扩增。采用Ct值计算基因的相对表达量,相对表达量=2-△△Ct×100%,△Ct=Ct(待测基因)-Ct(GAPDH)。
1.4.5 Western blot方法检测凋亡相关蛋白的表达收集TFV处理48 h后的细胞,常规提蛋白,考马斯亮蓝染色法测总蛋白的量,10% SDS-PAGE分离,PVDF膜转膜,5%山羊血清(PBS稀释)封闭;加入1 :3 000、1 :2 000、1 :2 000、1 :2 000、1 :2 000稀释(体积分数为1% BSA-PBS稀释)的Bcl-2、Bax、TOP Ⅱα、TOP Ⅱβ和caspase-3一抗,1 :1 000稀释的β-actin,4℃孵育过夜,加入辣根过氧化物酶标记的二抗(羊抗兔),室温孵育1 h。行ECL反应,显色。Bio-Rad凝胶成像系统拍照,GIS凝胶成像分析软件分析。
1.5 统计学处理统计学分析采用GraphPad Prism5软件,数据采用x±s表示,两组数据采用t检验,多组数据采用单因素方差分析。
2 结果 2.1 马鞭草总黄酮对肝癌HepG-2细胞凋亡的影响质量浓度分别为50、100、200 mg·L-1马鞭草总黄酮作用于肝癌HepG-2细胞48 h时,细胞凋亡率较对照组明显增加(Fig 1、2),差异均有统计学意义(P < 0.05)。
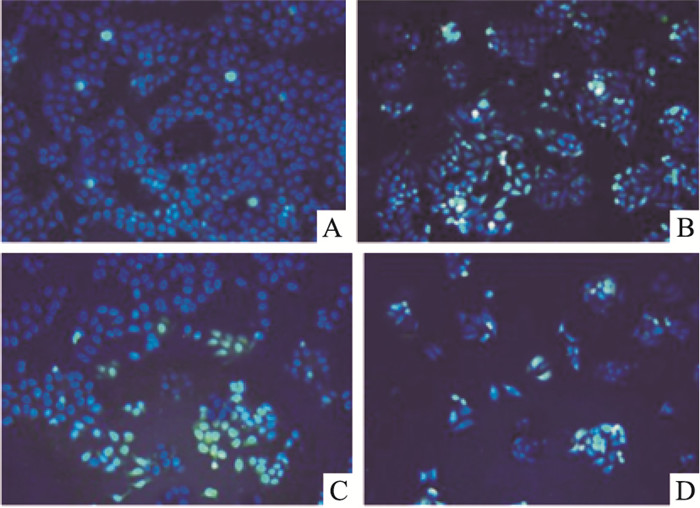
|
| Fig 1 TUNEL staining of HepG-2 cells following 48 h treatment with TFV(×200) A: 0 mg·L-1 TFV treated group; B: 50 mg·L-1 TFV treated group; C:100 mg·L-1 TFV treated group; D: 200 mg·L-1 TFV treated group |
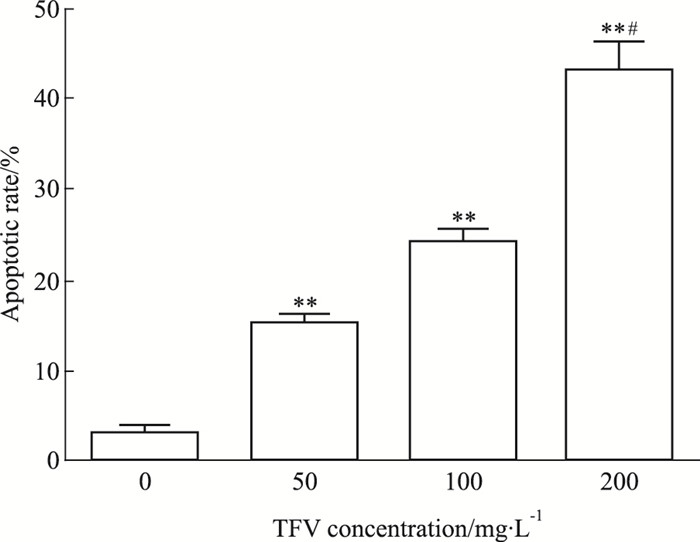
|
| Fig 2 Apoptotic rate of HepG-2 cells treated with TFV(x±s, n=3) **P < 0.01 vs control; #P < 0.05 vs 50 mg·L-1 TFV treated group |
Fig 3结果显示,泳道5为负超螺旋pBR322 DNA;泳道1为加TOP Ⅱ反应后,负超螺旋全部转化为松弛型DNA;加入50、100、200 mg·L-1的马鞭草总黄酮后,解旋的DNA明显减少,DNA保持超螺旋状态,并呈现剂量效应。
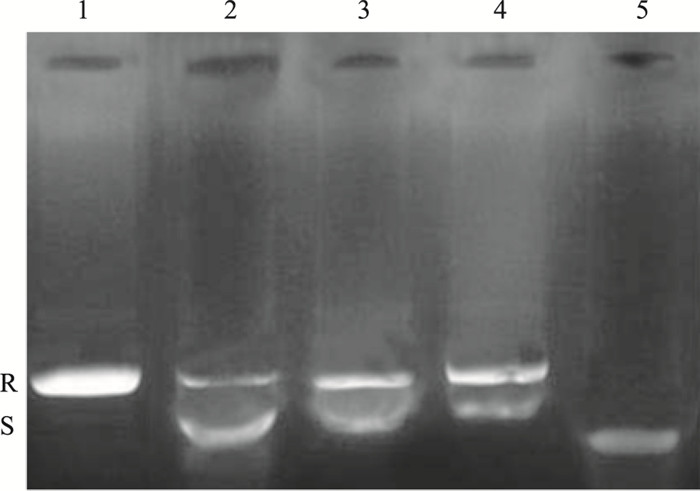
|
| Fig 3 Effect of TFV on DNA TOP Ⅱ activity in HepG-2 cells 1: 0.2 μg pBR322 DNA; 2~4:0.2 μg pBR322 DNA and TFV at 200, 100, 50 mg·L-1 +1 U TOP Ⅱ; 5: 0.2 μg pBR322 DNA+1 U TOP Ⅱ; R:Relaxed DNA; S: Supercolid DNA |
马鞭草总黄酮处理肝癌HepG-2细胞48 h后,TOP Ⅱα mRNA表达量较对照组明显下降,差异均有统计学意义(P < 0.05),同样TOP Ⅱβ mRNA表达量较对照组明显下降(Fig 4),差异均有统计学意义(P < 0.05)。
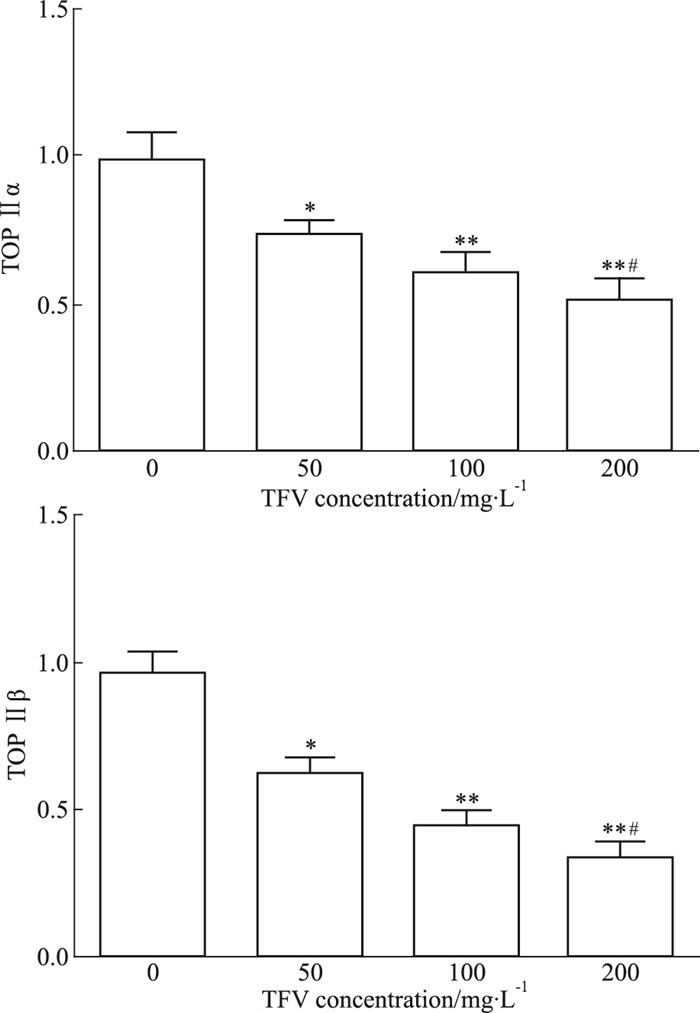
|
| Fig 4 Effect of TFV on expression of DNA TOP Ⅱ mRNA in HepG-2 cells(x±s, n=3) *P < 0.05, **P < 0.01 vs control; #P < 0.05 vs 50 mg·L-1 TFV treated group |
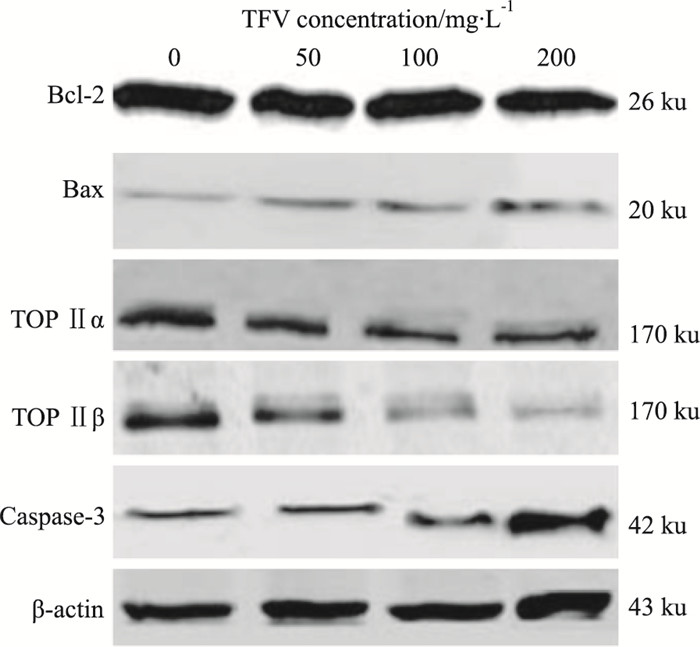
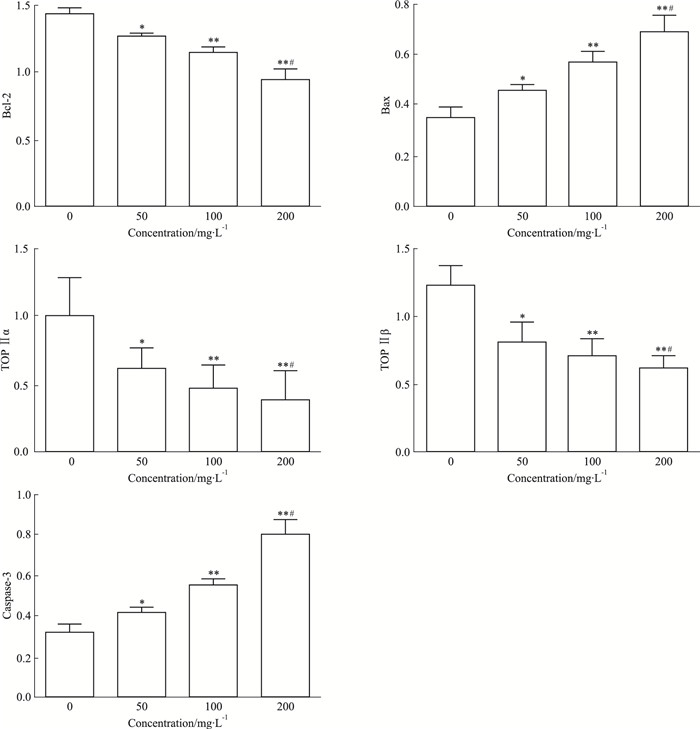
质量浓度分别为50、100、200 mg·L-1的马鞭草总黄酮处理HepG-2细胞48 h后, Bcl-2、TOP Ⅱα、TOP Ⅱβ蛋白表达量均较对照组明显下降,Bax、caspase-3蛋白水平明显升高,差异均有统计学意义(P < 0.05);质量浓度200 mg·L-1的马鞭草总黄酮作用于HepG-2细胞48 h后,Bcl-2、TOP Ⅱα、TOP Ⅱβ、Bax、caspase-3蛋白变化幅度较对照组更加明显(Fig 5、6),差异均有统计学意义(P < 0.05)。
|
| Fig 5 Expression of apoptotic protein detected by Western blot |
|
| Fig 6 Effect of TFV on expression of apoptotic protein in HepG-2 cells(x±s, n=3) *P < 0.05, **P < 0.01 vs control; #P < 0.05 vs 50 mg·L-1 TFV treated group |
TopⅡ为存在于细胞核中的一种重要的酶,由TOP Ⅱα、TOP Ⅱβ两种亚基组成,通过识别特殊的DNA序列选择性切断DNA双链,协调超螺旋和解螺旋相互转变,调节DNA拓扑异构化。研究显示,部分肿瘤细胞中TopoⅡ水平活性明显高于正常组织细胞,因此,通过干扰TopoⅡ调节DNA的断裂和连接,诱导肿瘤细胞凋亡是目前抗肿瘤重要机制,其中临床抗肿瘤药物依托泊苷和替尼泊苷就是以TopoⅡ作为作用靶点进行药物治疗[5]。Priyadarshani等[6]研究发现,黄酮和异黄酮能以拓扑异构酶Ⅱα为靶点,对各种癌细胞产生细胞毒性,对正常细胞低毒性、无凋亡作用。而Sudan等[7]发现,来源于苹果皮的黄酮能停滞HepG-2细胞细胞周期,并通过抑制DNA拓扑异构酶Ⅱ活性诱导凋亡。本研究结果表明,马鞭草总黄酮能抑制TOP Ⅱα和TOP Ⅱβ mRNA表达量,提示马鞭草总黄酮可能通过和TopⅡ直接结合,抑制TopⅡ的活性,并影响HepG-2细胞DNA复制转录过程,最终影响TOP Ⅱα、TOP Ⅱβ mRNA的转录水平,而且通过琼脂糖凝胶电泳也说明马鞭草总黄酮能抑制TopoⅡ的活性,并呈现明显的剂量效应。与此相对应的是,马鞭草总黄酮也能降低HepG-2细胞内TopoⅡα、TopoⅡβ蛋白表达水平,提示马鞭草总黄酮均可与RNA和DNA结合,并对TopoⅡα、TopoⅡβ蛋白表达水平产生影响,并进一步抑制HepG-2细胞内DNA的解旋,诱导细胞凋亡。
在细胞凋亡环节中,Bcl-2家族在caspase激活通路,尤其是线粒体途径中发挥了极为重要的调控作用。Bcl-2是一种存在于线粒体内膜蛋白,能通过增强线粒体膜电位,抑制钙离子释放,阻止核酸内切酶活化,并发挥抗凋亡作用[8]。此外,Bcl-2为活化的caspase-3作用底物之一,激活的caspase-3可以降解Bcl-2表达,因此,Bcl-2表达水平也能间接反映caspase-3活性。Bax属于Bcl-2家族成员,与Bcl-2作用相反,可直接激活死亡效应因子caspase-3或改变细胞膜通透性,引起细胞色素C释放,激活caspase-3活性,启动caspase级联反应[9]。Feng等[10]研究发现,狭基线纹香茶菜总黄酮能通过线粒体途径下调Bcl-2表达水平,启动细胞凋亡。Wang等[11]研究显示,来自金莲花总黄酮能下调Bcl-2水平,上调caspase-3表达水平,启动线粒体凋亡。本研究结果显示,马鞭草总黄酮能下调HepG-2细胞中Bcl-2蛋白水平,上调caspase-3以及Bax活性,并呈现明显的剂量效应,提示马鞭草总黄酮能通过调控Bcl-2家族蛋白,并对caspase-3产生激活作用,从而通过有效的调控酶联反应,启动线粒体凋亡,质量浓度越高,调节作用越明显。
总之,马鞭草总黄酮抑制TopoⅡ活性是诱导HepG-2细胞凋亡的直接因素,并通过Bcl-2/Bax/caspase-3信号通路启动级联反应,是其体外抗肿瘤作用的重要分子机制,而且马鞭草总黄酮主要来源于中成药马鞭草,为天然的抗炎、抗肿瘤药物,具有高效低毒的特点,且马鞭草资源丰富,临床应用无毒副作用[12],可以为马鞭草总黄酮的开发提供参考。
( 致谢: 本实验在河南省漯河市医学生物工程重点实验室完成,感谢实验室所有成员对本实验的支持和帮助!)
| [1] | Ma Y C, Wang Z X, Jin S J, et al. Dual inhibition of topoisomerase Ⅱ and tyrosine kinases by the novel bis-fluoroquinolone chalcone-like derivative HMNE3 in human pancreatic cancer cells[J]. PLoS One, 2016, 11(10): e0162821. doi:10.1371/journal.pone.0162821 |
| [2] | Turner J G, Dawson J L, Grant S, et al. Treatment of acquired drug resistance in multiple myeloma by combination therapy with XPO1 and topoisomerase Ⅱ inhibitors[J]. J Hematol Oncol, 2016, 9(1): 73. doi:10.1186/s13045-016-0304-z |
| [3] | 任丽平, 李先佳, 梁树才, 等. 马鞭草总黄酮对肝癌HepG-2细胞凋亡的影响[J]. 中国老年学杂志, 2016, 36(19): 4721-3. Ren L P, Li X J, Liang S C, et al. Effect of total flavonoids of Verbena officinalis L on apoptotic of human hepatocellular carcinoma HepG-2 cells[J]. Chin J Gerontol, 2016, 36(19): 4721-3. doi:10.3969/j.issn.1005-9202.2016.19.022 |
| [4] | 任丽平, 李先佳, 朱宝安, 等. 马鞭草总黄酮对HepG-2细胞增殖及侵袭力影响[J]. 中国公共卫生, 2016, 32(7): 935-7. Ren L P, Li X J, Zhu B A, et al. Impact of total flavonoids of Verbena officinalis L on proliferation and invasiveness of human hepatocellular carcinoma HepG-2 cells[J]. Chin J Public Health, 2016, 32(7): 935-7. doi:10.11847/zgggws2016-32-07-15 |
| [5] | Wu W, Ma B, Ye H, et al. Millepachine, a potential topoisomerase Ⅱ inhibitor induces apoptosis via activation of NF-κB pathway in ovarian cancer[J]. Oncotarget, 2016, 7(32): 52281-93. |
| [6] | Priyadarshani G, Amrutkar S, Nayak A, et al. Scaffold-hopping of bioactive flavonoids: discovery of aryl-pyridopyrimidinones as potent anticancer agents that inhibit catalytic role of topoisomerase Ⅱα[J]. Eur J Med Chem, 2016, 122(10): 43-54. |
| [7] | Sudan S, Rupasinghe H P. Flavonoid-enriched apple fraction AF4 induces cell cycle arrest, DNA topoisomerase Ⅱ inhibition, and apoptosis in human liver cancer HepG2 cells[J]. Nutr Cancer, 2014, 66(7): 1237-46. doi:10.1080/01635581.2014.951733 |
| [8] | 刘金娟, 曹成亮, 丁盼, 等. 野苋菜提取物抗肿瘤作用及诱导人肝癌HepG2细胞凋亡的分子机制[J]. 中国药理学通报, 2015, 31(11): 1558-62. Liu J J, Chao C L, Ding P, et al. Anticancer activity and mechanism of apoptosis induced by Amaranthus spinosus L.extract in Hep G2 cells[J]. Chin Pharmacol Bull, 2015, 31(11): 1558-62. doi:10.3969/j.issn.1001-1978.2015.11.016 |
| [9] | Zhou H, Ma Y, Zhou Y, et al. Effects of magnesium sulfate on neuron apoptosis and expression of caspase-3, Bax and Bcl-2 after cerebral ischemia-reperfusion injury[J]. Chin Med J(Engl), 2003, 116(10): 1532-4. |
| [10] | Feng C P, Tang H M, Huang S, et al. Evaluation of the effects of the water-soluble total flavonoids from Isodon lophanthoides var.gerardianus (Benth.) H. Hara on apoptosis in HepG2 cell: investigation of the most relevant mechanisms[J]. J Ethnopharmacol, 2016, 188(7): 70-9. |
| [11] | Wang S, Tian Q, An F. Growth inhibition and apoptotic effects of total flavonoids from Trollius chinensis on human breast cancer MCF-7 cells[J]. Oncol Lett, 2016, 12(3): 1705-10. |
| [12] | 杨海光, 方莲花, 杜冠华. 马鞭草药理作用及临床应用研究进展[J]. 中国中药杂志, 2013, 48(12): 948-52. Yang H G, Fang L H, Du G H. Advances in pharmacological effects and clinical application of verbena[J]. Chin Pharm J, 2013, 48(12): 948-52. |

