


2. 南方医科大学研究生院,广东 广州 510515
 ,
JIANG Zhi-hui2,
SUN Jing-wen1,
TAN Cui-wen1,
FAN Yu-lin1,
DING Xiao-yan1,
SHANGGUAN Xin-yi1,
WU Xin-rong1
,
JIANG Zhi-hui2,
SUN Jing-wen1,
TAN Cui-wen1,
FAN Yu-lin1,
DING Xiao-yan1,
SHANGGUAN Xin-yi1,
WU Xin-rong1
2. Graduate School of Southern Medical University, Guangzhou 510515, China
鱼藤素是一种具有强抗肿瘤活性的黄酮类天然化合物,多项体内外研究表明鱼藤素的抗瘤谱较广,可抑制口腔癌、肺癌、乳腺癌、结肠癌、头颈癌、食管癌等多种实体瘤增殖[1-8]。鱼藤素的抗肿瘤靶点极为广泛,作为一种极具潜力的抗肿瘤药物,有望提供新化疗方法,改善当前肿瘤化疗耐药的情况[9]。目前,鱼藤素的应用主要受限于其帕金森样神经毒性,研究发现,6 mg·kg-1的鱼藤素持续给药可引起小鼠脑部帕金森样综合征[10]。当前针对鱼藤素神经毒性的研究报道较少, 为进一步研究鱼藤素的神经毒性,本研究采用SH-SY5Y神经瘤细胞为模型,研究鱼藤素对神经细胞凋亡的诱导作用,进一步了解鱼藤素的神经毒性。
1 材料 1.1 细胞株人神经瘤细胞株SH-SY5Y(广州军区广州总医院医学实验科提供)。
1.2 药物鱼藤素(deguelin,批号:045M4736V)、二甲基亚砜(DMSO,批号:RNBD6895)、Accutase solution(批号:SLBN5790V), 均为Sigma公司;胎牛血清,杭州四季青生物工程材料有限公司,批号:20151225;RPMI 1640培养基,Gibco公司,批号:8116053;Cell Counting Kit-8(CCK-8) 试剂,日本同仁公司,批号:JU739;吖啶橙/溴化乙锭(AO/EB)双染试剂盒,索莱宝公司,批号:20160111;Annexin V-FITC细胞凋亡检测试剂盒,批号:C1065-2;活性氧(reactive oxygen species, ROS)检测试剂盒(批号:S0033-1)、Bradford蛋白浓度测定试剂盒(批号:P0006-1),均为碧云天公司;caspase-3分光光度法检测试剂盒,江苏凯基生物技术股份有限公司,批号:20160406。
1.3 仪器Multiscan-GO全波长酶标仪(美国Thermo公司);Ⅸ7型倒置荧光显微镜(日本Olympus公司);流式细胞仪(美国BD公司)。
2 方法 2.1 药物配制将鱼藤素溶于少量DMSO,配制成10 mmol·L-1母液,分装并于-20℃冰箱避光保存。使用时,用培养基将母液稀释至所需浓度,现配现用。
2.2 细胞培养SH-SY5Y细胞用含10%胎牛血清和100 kU·L-1青霉素、100 kU·L-1链霉素的RPMI 1640培养基培养于37 ℃、5% CO2恒温培养箱中,取对数生长期细胞进行实验。
2.3 CCK-8法检测细胞存活率取对数生长期细胞,调节细胞密度至5×107·L-1,将细胞接种于96孔板,每孔100 μL,24 h后加入100 μL不同浓度的鱼藤素(终浓度分别为0.625、1.25、2.5、5、10、20 μmol·L-1),以溶剂DMSO为对照组,另设空白组,每组3个复孔,分别作用24、48、72 h后,吸去旧培养基,将培养基与CCK-8试剂按10 :1比例混匀,每孔加入110 μL混合后试剂,将培养板置于37 ℃、5% CO2恒温培养箱中避光孵育2 h,用酶标仪于450 nm处测定吸光度。计算细胞存活率/%=[(A实验组-A空白组)/(A对照组-A空白组)]×100%。
2.4 光学显微镜观察细胞形态取对数生长期细胞,调节细胞密度至5×107·L-1,将细胞接种于6孔板,每孔2 mL,24 h后加入2 mL不同浓度的鱼藤素(终浓度分别为0、8、20、50 μmol·L-1),作用24 h后,于光学显微镜下观察细胞形态。
2.5 AO/EB双染观察细胞凋亡形态取对数生长期细胞,调节细胞密度至5×107·L-1,将细胞接种于6孔板,每孔2 mL,24 h后加入2 mL不同浓度的鱼藤素(终浓度分别为0、8、20、50 μmol·L-1),24 h后,吸去培养基,PBS洗2遍,加入1 mL新的PBS,将AO溶液和EB溶液按1 :1混合成工作液,每孔加入20 μL工作液,室温放置5 min后,于荧光显微镜下观察细胞凋亡形态。
2.6 Annexin V-FITC/PI双染流式细胞仪检测细胞凋亡率取对数生长期细胞,调节细胞密度至5×107·L-1,将细胞接种于6孔板,每孔2 mL,24 h后加入2 mL不同浓度的鱼藤素(终浓度分别为0、8、20、50 μmol·L-1)处理,24 h后收集细胞,PBS洗2次,将细胞重悬于195 μL结合液中,加入5 μL Annexin V-FITC,混匀后加入10 μL PI,上流式细胞仪检测细胞凋亡率。
2.7 流式细胞仪检测ROS取对数生长期细胞,调节细胞密度至5×107·L-1,将细胞接种于6孔板,每孔2 mL,24 h后加入2 mL不同浓度的鱼藤素(终浓度分别为0、8、20、50 μmol·L-1)处理,24 h后收集细胞,以终浓度为10 μmol·L-1的DCFH-DA重悬各组细胞,37℃避光孵育20 min,期间每隔5 min震荡1次。离心弃上清,PBS洗2次,上流式细胞仪检测荧光强度以反映细胞ROS水平。
2.8 分光光度法检测caspase-3活化程度取对数生长期细胞,分别加入不同浓度鱼藤素(终浓度分别为0、8、20、50 μmol·L-1)处理;24 h后收集细胞,加入50 μL冰冷Lysis Buffer(每50 μL Lysis Buffer加入0.5 μL DTT);冰上裂解30 min,每隔10 min涡旋振荡10 s;4 ℃,12 000 r·min-1离心10 min;将离心上清液移至新离心管,置冰上;测定蛋白浓度;吸取50 μL含100 μg蛋白的细胞裂解上清,如体积不足50 μL,加入Lysis Buffer补齐至50 μL;加入50 μL的2×Reaction Buffer(每50 μL 2×Reaction Buffer加入0.5 μL DTT);加入5 μL caspase-3底物;37 ℃避光孵育4 h;用酶标仪在λ=405 nm处测定其吸光值。通过计算OD诱导剂/OD阴性对照的倍数,确定凋亡诱导剂组caspase-3活化程度。
2.9 统计学分析实验结果数据以x±s表示。采用SPSS 20.0对实验数据进行统计学分析。组间比较采用单因素方差分析。
3 结果 3.1 CCK-8法检测细胞存活率如Fig 1所示,随着鱼藤素给药浓度升高,SH-SY5Y细胞存活率降低,呈剂量依赖性,各组与对照组相比,差异有显著性(P < 0.01),且同浓度的不同处理时间组间,细胞存活率差异也有显著性,表现为随着鱼藤素处理时间延长,SH-SY5Y细胞存活率降低,呈时间依赖性。采用Calcusyn软件计算鱼藤素处理SH-SY5Y细胞24、48、72 h的IC50值分别为(26.07±2.18)、(18.33±0.94)、(12.5±1.49) μmol·L-1。
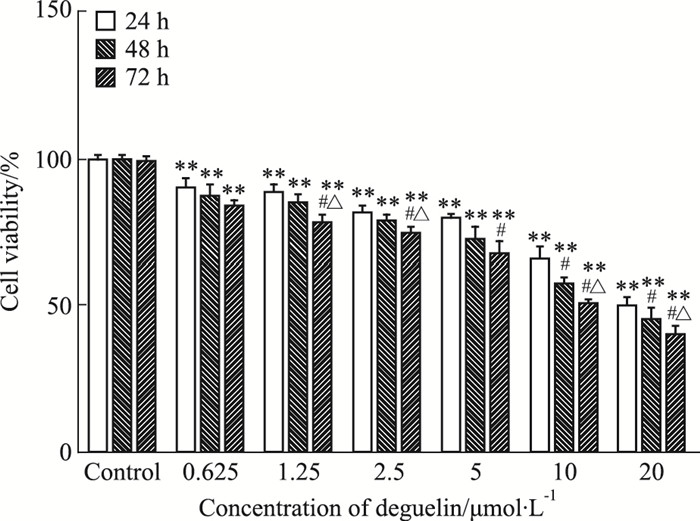
|
| Fig 1 Effect of different concentrations of deguelin on cell viability of SH-SY5Y cells with different incubation time **P < 0.01 vs control group; #P < 0.05 vs 24 h group treated with equal concentration of deguelin; △P < 0.05 vs 48 h group treated with equal concentration of deguelin |
光学显微镜下观察发现,对照组细胞贴壁能力强,细胞形态较好,不同浓度鱼藤素处理SH-SY5Y细胞24 h后,细胞数量较对照组明显减少,细胞形态发生明显变化,随着鱼藤素浓度升高,细胞皱缩变圆,贴壁能力减弱。50 μmol·L-1鱼藤素处理24 h后,部分细胞漂浮死亡(Fig 2)。
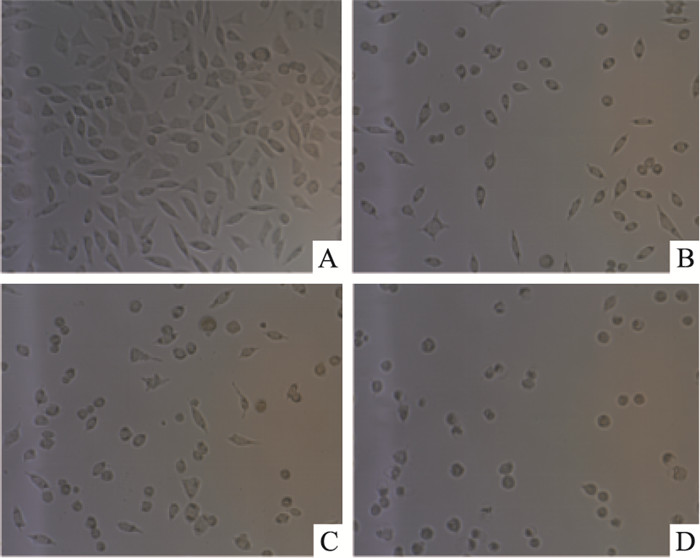
|
| Fig 2 Morphological changes of SH-SY5Y cells after deguelin treatment for 24 h observed under optical microscope(×200) A:Control; B, C and D: Deguelin 8, 20 and 50 μmol·L-1, respectively |
对照组SH-SY5Y细胞呈多边形,核内染色质均匀,少见凋亡细胞。不同浓度鱼藤素处理24 h后,早期凋亡细胞增多,细胞体积减小,细胞核固缩,致密浓染,部分细胞核染色呈新月状。50 μmol·L-1鱼藤素处理24 h后,晚期凋亡细胞增多,胞膜受损,细胞核被EB染成橘红色,呈固缩状致密浓染,且可见部分染橘红色的细胞碎片(Fig 3)。
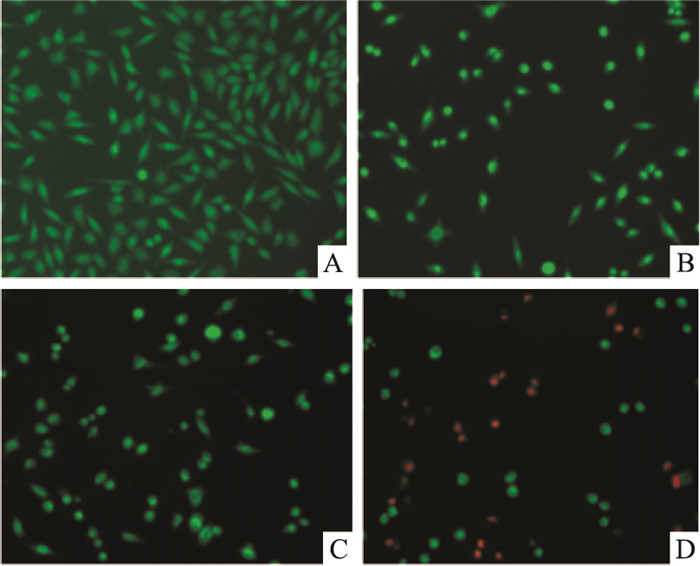
|
| Fig 3 Apoptotic morphology of SH-SY5Y cells after deguelin treatment for 24 h with AO/EB double staining(×200) A:Control; B, C and D: Deguelin 8, 20 and 50 μmol·L-1, respectively |
Tab 1和Fig 4结果显示,与对照组比较,经8、20、50 μmol·L-1鱼藤素处理24 h后,SH-SY5Y细胞总凋亡率明显升高(P < 0.05),呈浓度依赖性升高(r=0.993,P < 0.05)。其中,早期凋亡率也随鱼藤素的给药浓度升高明显升高(r=0.989,P < 0.05)。
| Deguelin/μmol·L-1 | Early apoptosisrate/% | Late apoptosisrate/% | Total apoptosisrate/% |
| Control | 0.40±0.16 | 4.03±0.68 | 4.43±0.52 |
| 8 | 2.45±0.59* | 7.93±0.91* | 10.33±1.46* |
| 20 | 6.41±0.90* | 16.13±1.64* | 22.53±2.54* |
| 50 | 11.73±0.93* | 54.80±1.40* | 66.67±1.42* |
| *P < 0.05 vs control group | |||
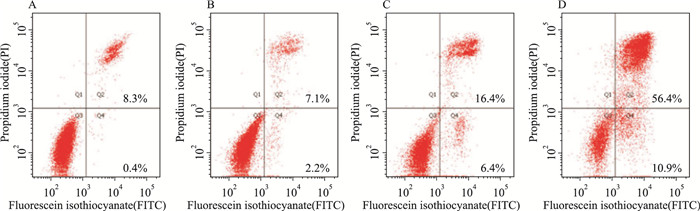
|
| Fig 4 Apoptosis inducing effect of deguelin treatment for 24 h on SH-SY5Y cells by flow cytometry A:Control; B, C and D: Deguelin 8, 20 and 50 μmol·L-1, respectively. The fourth quadrant: early stage apoptotic cells; the first quadrant: late stage apoptotic cells |
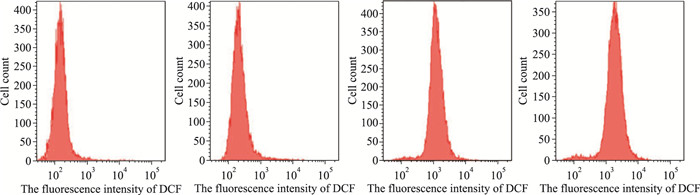
Tab 2和Fig 5的结果表明,经8、20、50 μmol·L-1鱼藤素处理24 h后,与对照组相比,SH-SY5Y细胞ROS水平明显升高(P < 0.05),且SH-SY5Y细胞ROS水平呈浓度依赖性升高(r=0.993,P < 0.05)。
| Deguelin/μmol·L-1 | ROS(reflected by thefluorescence intensity of DCF) |
| Control | 215.7±57.7 |
| 8 | 1 380.3±211.8* |
| 20 | 2 186.3±186.2* |
| 50 | 6 174.7±218.6* |
| *P < 0.05 vs control group | |
|
| Fig 5 Effect of deguelin treatment for 24 h on ROS of SH-SY5Y cells measured by flow cytometry A: Control; B, C and D: Deguelin 8, 20 and 50 μmol·L-1, respectively |
如Tab 3所示,8 μmol·L-1鱼藤素处理SH-SY5Y细胞24 h,caspase-3活性略有升高,但与对照组相比差异无显著性,鱼藤素浓度上升至20、50 μmol·L-1,caspase-3活性升高,且与对照组相比差异有显著性,结果表明caspase-3活性随鱼藤素给药浓度升高而升高。
| Deguelin/μmol·L-1 | Activation extent of caspase-3 (reflected by ODinducer/ODnegative control) |
| Control | 1.002±0.001 |
| 8 | 1.286±0.151 |
| 20 | 1.494±0.110* |
| 50 | 2.076±0.068* |
| *P < 0.05 vs control group | |
SH-SY5Y源自人成神经瘤细胞系SK-N-SH, 由于具有神经元生化功能特征且易于培养,被广泛应用于神经系统疾病发病机制和药物作用机制相关研究。本研究采用SH-SY5Y细胞为模型,使用CCK-8法检测不同浓度鱼藤素分别作用24、48、72 h,对SH-SY5Y细胞存活率的影响。结果显示,鱼藤素呈时间和浓度依赖性抑制SH-SY5Y细胞存活,随着作用时间的延长和给药浓度升高,细胞存活率降低。通过细胞形态观察和AO/EB双染观察发现,鱼藤素处理后,细胞皱缩变圆,呈现凋亡甚至坏死特征,说明鱼藤素具有神经毒性,与此前报道的鱼藤素体内帕金森样神经毒性相符合[10]。
为确定鱼藤素对SH-SY5Y细胞凋亡的影响,采用流式细胞仪检测鱼藤素处理后细胞凋亡率。发现鱼藤素处理后,SH-SY5Y细胞早期凋亡率和总凋亡率均明显升高,呈浓度-效应关系,表明鱼藤素可通过诱导细胞凋亡,抑制SH-SY5Y细胞增殖。
适当水平的ROS对机体是有益的,但过量的ROS会导致氧化应激,可能作为第二信使影响凋亡,从而诱导细胞凋亡或坏死[11]。氧化应激是帕金森病的主要病因之一[12],研究发现[13],鱼藤素的同类化合物鱼藤酮可通过抑制线粒体复合物Ⅰ诱导帕金森病,线粒体复合物Ⅰ受抑制后,增加ROS生成,ROS可导致氧化应激,从而形成恶性循环[14]。本研究发现鱼藤素作用下,细胞ROS水平明显提高,且与细胞存活率具有良好负相关线性关系(r=0.993)。以上结果表明鱼藤素可能通过提高ROS水平,诱导SH-SY5Y细胞凋亡。
Caspase是一类与细胞凋亡密切相关的蛋白水解酶家族,caspase级联反应是导致细胞凋亡的中心环节,其中caspase-3是caspase级联反应中下游的效应蛋白酶[15]。本研究结果显示,20 μmol·L-1鱼藤素可明显活化caspase-3,且活化程度随鱼藤素的给药浓度升高而升高。
本研究证实鱼藤素主要通过诱导细胞凋亡导致神经毒性,其诱导凋亡机制与氧化应激和活化caspase-3有关,进一步研究鱼藤素神经毒性及降低神经毒性的方法对于鱼藤素作为新型化疗药物的应用极为关键。
( 致谢: 本实验在广州军区广州总医院药剂科及实验科完成,感谢各位同学的帮助,使实验得以顺利完成。)
| [1] | Wang Y, Ma W, Zheng W. Deguelin, a novel anti-tumorigenic agent targeting apoptosis, cell cycle arrest and anti-angiogenesis for cancer chemoprevention[J]. Mol Clin Oncol, 2013, 1(2): 215-9. |
| [2] | Liu Y P, Lee J J, Lai T C, et al. Suppressive function of low-dose deguelin on the invasion of oral cancer cells by downregulating tumor necrosis factor alpha-induced nuclear factor-kappa B signaling[J]. Head Neck, 2016, 38(1): E524-34. |
| [3] | Zhao H, Jiao Y, Zhang Z. Deguelin inhibits the migration and invasion of lung cancer A549 and H460 cells via regulating actin cytoskeleton rearrangement[J]. Int J Clin Exp Pathol, 2015, 8(12): 15582-90. |
| [4] | Lee S C, Min H Y, Choi H, et al. Synthesis and evaluation of a novel deguelin derivative, L80, which disrupts ATP binding to the C-terminal domain of heat shock protein 90[J]. Mol Pharmacol, 2015, 88(2): 245-55. doi:10.1124/mol.114.096883 |
| [5] | Wu W, Hai Y, Chen L, et al. Deguelin-induced blockade of PI3K/protein kinase B/MAP kinase signaling in zebrafish and breast cancer cell lines is mediated by down-regulation of fibroblast growth factor receptor 4 activity[J]. Pharmacol Res Perspect, 2016, 4(2): e00212. doi:10.1002/prp2.212 |
| [6] | Kang H W, Kim J M, Cha M Y, et al. Deguelin, an Akt inhibitor, down-regulates NF-κB signaling and induces apoptosis in colon cancer cells and inhibits tumor growth in mice[J]. Dig Dis Sci, 2012, 57(11): 2873-82. doi:10.1007/s10620-012-2237-x |
| [7] | Baba Y, Fujii M, Maeda T, et al. Deguelin induces apoptosis by targeting both EGFR-Akt and IGF1R-Akt pathways in head and neck squamous cell cancer cell lines[J]. Biomed Res Int, 2015, 2015: 657179. |
| [8] | 白美玲, 刘星亮, 张林西, 等. 鱼藤素对食管癌EC-109细胞增殖的抑制作用及部分机制[J]. 中国药理学通报, 2016, 32(8): 1181-2. Bai M L, Liu X L, Zhang L X, et al. The inhibitive effect and molecular mechanism of deguelin against the proliferation of esophagus cancer EC-109 cells[J]. Chin Pharmacol Bull, 2016, 32(8): 1181-2. |
| [9] | Wen L, Chen Y. Molecular mechanism of deguelin in anti-tumor effect[J]. Curr Pharm Anal, 2012, 8(1): 14-9. doi:10.2174/157341212798995467 |
| [10] | Caboni P, Sherer T B, Zhang N, et al. Rotenone, deguelin, their metabolites, and the rat model of Parkinson′s disease[J]. Chem Res Toxicol, 2004, 17(11): 1540-8. doi:10.1021/tx049867r |
| [11] | Bhat A H, Dar K B, Anees S, et al. Oxidative stress, mitochondrial dysfunction and neurodegenerative diseases; a mechanistic insight[J]. Biomed Pharmacother, 2015, 74: 101-10. doi:10.1016/j.biopha.2015.07.025 |
| [12] | Dexter D T, Jenner P. Parkinson disease: from pathology to molecular disease mechanisms[J]. Free Radic Biol Med, 2013, 62: 132-44. doi:10.1016/j.freeradbiomed.2013.01.018 |
| [13] | Sherer T B, Betarbet R, Testa C M, et al. Mechanism of toxicity in rotenone models of Parkinson′s disease[J]. J Neurosci, 2003, 23(34): 10756-64. |
| [14] | 刘佳, 段春理, 杨慧. 帕金森病发病机制与治疗研究进展[J]. 生理科学进展, 2015, 46(3): 163-9. Liu J, Duan C L, Yang H. The pathogenesis and therapy research progress of Parkinson′s disease[J]. Prog Physiol Sci, 2015, 46(3): 163-9. |
| [15] | 刘金娟, 杨成流, 陈永强, 等. 鱼腥草地下茎提取物诱导胃癌细胞SGC-7901凋亡机制的研究[J]. 中国药理学通报, 2014, 30(2): 257-61. Liu J J, Yang C L, Chen Y Q, et al. Study on apoptosis of gastric cancer cell line SGC-7901 induced by stem extract of Houttuynia Cordata Thunb[J]. Chin Pharmacol Bull, 2014, 30(2): 257-61. |