


2. 山西医科大学第一医院 药学部,山西 太原 030001;
3. 山西医科大学第一医院 山西医科大学药理学教研室,山西 太原 030001
 ,
WANG Ke-ke1,
XU Hui-yu3,
HUANG Ting-juan1,
LYU Yi1,
WU Dong-mei3
,
WANG Ke-ke1,
XU Hui-yu3,
HUANG Ting-juan1,
LYU Yi1,
WU Dong-mei3
 ,
ZHANG Xuan-ping3,
ZHENG Xiao-jun2
,
ZHANG Xuan-ping3,
ZHENG Xiao-jun2

2. Dept of Pharmacy, the First Hospital of Shanxi Medical University, Taiyuan 030001, China;
3. Dept of Pharmacology, Shanxi Medical University, Taiyuan 030001, China
咪达唑仑(midazolam)作为一种新一代的水溶性和短效的苯二氮艹卓类药物,主要通过苯二氮艹卓受体作用于脑干网状结构和大脑边缘系统。临床中,咪达唑仑作为麻醉诱导药而广泛应用[1]。特别是一些心脏手术在局麻下进行,病患处于应激状态,同时需要克服紧张、焦虑及恐惧心理,会增加心肌的耗氧量,此时会出现不同程度的心肌缺血[2],运用咪达唑仑可增加患者对局麻的耐受性,减少应激反应,增加冠脉血流量,改善心脏供氧平衡,改善心肌缺血[3]。但是咪达唑仑引起心功能改变的原因、咪达唑仑对冠状动脉作用的确切机制还未完全阐明。本实验采用离体血管张力记录方法,进一步探究咪达唑仑对预收缩离体猪冠状动脉的作用及可能的机制,为保证咪达唑仑在临床中安全有效使用提供药理学实验依据。
1 材料 1.1 实验动物猪,♀♂不限,月龄3~4个月,体质量100~150 kg,取自山西省太原市小井峪屠宰场。
1.2 药品与试剂咪达唑仑:江苏恩华药业股份有限公司,批号20080828;缓激肽、左旋硝基精氨酸甲酯(L-NAME)、吲哚美辛(Indo)、四乙胺(TEA)、格列苯脲(Gli)、氯化钡(BaCl2)、4-氨基吡啶(4-AP)均购自美国Sigma公司;KB-R7943购自TOCRIS公司;其余均为国产分析纯。
1.3 仪器PowerLab生物信号采集分析系统(埃德仪器国际贸易上海有限公司);张力换能器(成都泰盟科技有限公司);精密天平(BS124S,赛多利斯科学仪器北京有限公司);pH计(PHS-3C,上海理达仪器厂)。
2 方法 2.1 离体猪冠状动脉环制备刺破猪的心脏并待血流结束后,迅速取出心脏,剪取猪冠状动脉左前降支及其周围心肌组织,立即置入4℃的PSS液(pH=7.38) 中,迅速返回实验室。本研究分离猪冠状动脉左前降支中下段,直径为1~2 mm,细心剔除冠脉周围的脂肪及结缔组织,将冠脉剪成5 mm左右的血管环。随后,用2个不锈钢微型三角挂钩贯穿冠脉管腔,水平悬挂在恒温的10 mL玻璃浴管内,浴管内提前加入37 ℃的PSS液10 mL,并通入100% O2,下方挂钩固定在浴管底部,上方挂钩以一不锈钢丝连接于张力环能器。每个冠脉环在浴管内的基础张力调整至3 g,平衡1.5~2 h,其间随时调整张力,使之恒定地维持在3 g,每20 min换1次PSS液。所有冠脉环用KCl(30 mmol·L-1)PSS液刺激3次并洗脱,收缩稳定后,记录在加入不同血管活性物质后,冠脉环的张力变化。
2.2 去内皮冠脉环制备取剔除周围脂肪及结蹄组织的猪冠状动脉5 mm,两端用针头固定,取缠少许棉花(与冠脉内径相适)的针头从管腔擦过,连续2次。冠脉环悬挂稳定2 h后,用KCl(30 mmol·L-1)PSS液刺激,收缩达坪值后,加入缓激肽(1×10-5 mol·L-1),以KCl预收缩幅度为1,舒张幅度0.05时,认为冠脉内皮完全去除,可进行后续实验。
2.3 咪达唑仑对KCl预收缩内皮完整和去内皮猪冠脉环的影响冠脉环稳定后,向KCl(30 mmol·L-1)预收缩内皮完整猪冠脉环、KCl(30 mmol·L-1)预收缩去内皮猪冠脉环,累积加入3×10-6、1×10-5、3×10-5、1×10-4 mol·L-1的咪达唑仑,对照组累积加入相应体积的溶剂。描记猪冠脉环张力的变化曲线。以KCl诱发的冠脉环的最大收缩幅度为1,计算给予不同浓度咪达唑仑后,冠脉舒张幅度占最大收缩幅度的百分比。建立浓度效应曲线,观察咪达唑仑对猪冠状动脉环的作用。
2.4 内皮在咪达唑仑舒张KCl预收缩猪冠状动脉中的作用机制冠脉环稳定后,给予30 mmol·L-1 KCl收缩达坪值后,加入非特异性一氧化氮合酶(NOS)抑制剂L-NAME(1×10-4 mol·L-1)、外源性的NO合成底物L-Arg(1×10-5 mol·L-1)、L-NAME+L-Arg、iNOS抑制剂1400W(1×10-5 mol·L-1)、环氧合酶抑制剂Indo(1×10-5 mol·L-1),对照组加入溶剂后,血管张力进一步发生改变,再次达到坪值后,累积加入3×10-6、1×10-5、3×10-5、1×10-4 mol·L-1的咪达唑仑,记录相应血管张力并计算变化值。
2.5 Na+/Ca2+交换体在咪达唑仑舒张KCl预收缩猪冠状动脉中的作用冠脉环稳定后,给予30 mmol·L-1 KCl收缩达坪值后,加入Na+/Ca2+交换体阻断剂KB-R7943(1×10-6 mol·L-1),对照组加入溶剂,血管张力进一步发生改变,再次达到坪值后,累积加入3×10-6、1×10-5、3×10-5、1×10-4 mol·L-1的咪达唑仑,记录相应血管张力并计算变化值。
2.6 K+通道在咪达唑仑舒张KCl预收缩猪冠状动脉中的作用冠脉环稳定后,给予30 mmol·L-1 KCl收缩达坪值后,加入延迟整流钾通道(KV)阻断剂4-AP(1×10-3 mol·L-1)、内向整流钾通道(Kir)阻断剂BaCl2(1×10-3 mol·L-1)、钙激活钾通道(BKCa)阻断剂TEA(1×10-2 mol·L-1)和ATP敏感钾通道(KATP)阻断剂Gli(1×10-5 mol·L-1),对照组加入溶剂,血管张力进一步发生改变,再次达到坪值后,累积加入3×10-6、1×10-5、3×10-5、1×10-4 mol·L-1的咪达唑仑,记录相应血管张力并计算变化值。
2.7 统计学方法数据以x±s表示,采用GraphPad Prism 6作浓度-舒张效应曲线,应用SPSS19.0,两样本比较采用t检验进行显著性差异检验;多组比较采用重复测量方差分析进行显著性检验。
3 结果 3.1 咪达唑仑对KCl预收缩内皮完整和去内皮猪冠脉环的影响在内皮完整的冠脉环中,用KCl(30 mmol·L-1)预收缩后,各浓度(3×10-6、1×10-5、3×10-5、1×10-4 mol·L-1)的咪达唑仑能产生明显的舒张作用,其Emax为(0.92±0.04),各浓度咪达唑仑的舒张作用与溶剂对照组比较,差异有统计学意义(P < 0.01)。在去内皮的冠脉环中,用KCl(30 mmol·L-1)预收缩后,3×10-6、1×10-5、3×10-5、1×10-4 mol·L-1的咪达唑仑能产生明显的浓度依赖性的舒张作用,其Emax为(0.74±0.04)。与内皮完整组比较,差异有统计学意义(P < 0.01),见Fig 1。
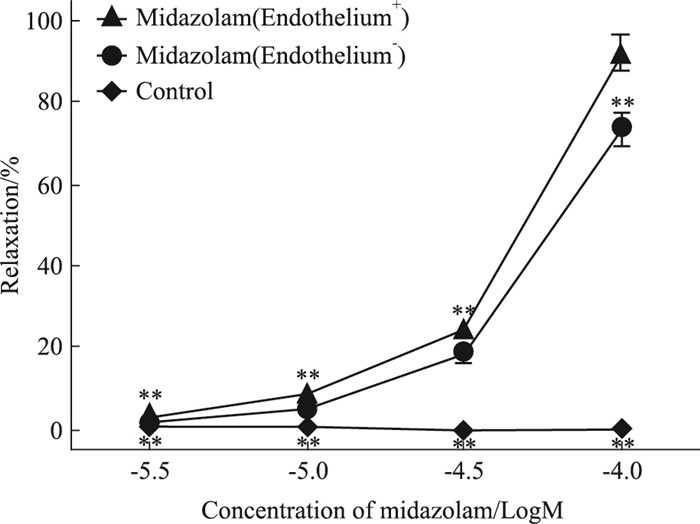
|
| Fig 1 Midazolam-induced relaxation in endothelium-intact (Endothelium+) or-denuded(Endothelium-) porcine isolated coronary artery rings with precontraction induced by KCl (30 mmol·L-1)(x±s, n=5) **P < 0.01 vs vehicle group or midazolam(Endothelium+) group |
在KCl(30 mmol·L-1)预收缩的猪冠脉环上,预孵L-NAME后,咪达唑仑舒血管作用明显减弱,其Emax为(0.78±0.03),差异有统计学意义(P < 0.01);预孵L-NAME+L-Arg后,咪达唑仑舒血管作用明显减弱,其Emax为(0.83±0.02),与无阻断药组比较, 差异有统计学意义(P < 0.05),与单加L-NAME组相比,差异无统计学意义(P>0.05);分别预孵L-Arg、1400W、Indo后,对咪达唑仑舒血管作用无明显影响,其Emax分别为(0.94±0.03)、(0.94±0.03)、(0.91±0.03),见Fig 2。
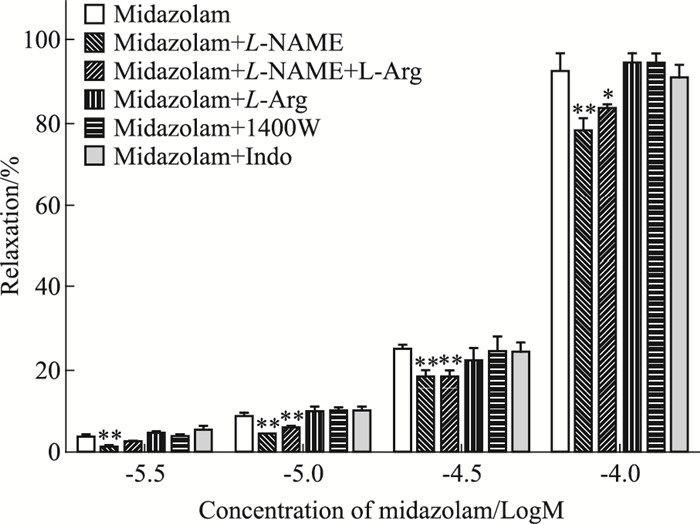
|
| Fig 2 Effects of L-NAME, L-Arg, 1400W, Indo on relaxation induced by midazolam in porcine isolated coronary artery rings with precontraction induced by KCl (30 mmol·L-1)(x±s, n=5) *P < 0.05, **P < 0.01 vs midazolam alone group |
在KCl(30 mmol·L-1)预收缩的猪冠脉环上,Na+/Ca2+交换体阻断剂KB-R7943预孵后,其Emax为(0.95±0.04),对咪达唑仑的舒血管作用无影响(P>0.05),见Fig 3。
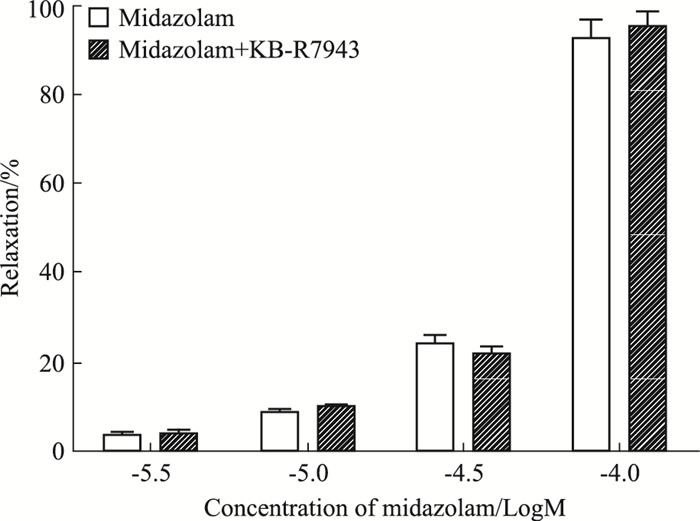
|
| Fig 3 Effects of KB-R7943 on relaxation induced by midazolam in porcine isolated coronary artery rings with precontraction induced by KCl(30 mmol·L-1)(x±s, n=5) |
在KCl(30 mmol·L-1)预收缩的猪冠脉环上,分别预孵K+通道阻断剂4-AP、BaCl2、TEA后,对咪达唑仑的舒血管作用无影响(P>0.05),其Emax分别为(1.02±0.06)、(1.05±0.03)、(1.10±0.06);预孵Gli后,咪达唑仑舒血管作用明显减弱,其Emax为(0.59±0.04),差异有统计学意义(P < 0.01),见Fig 4。
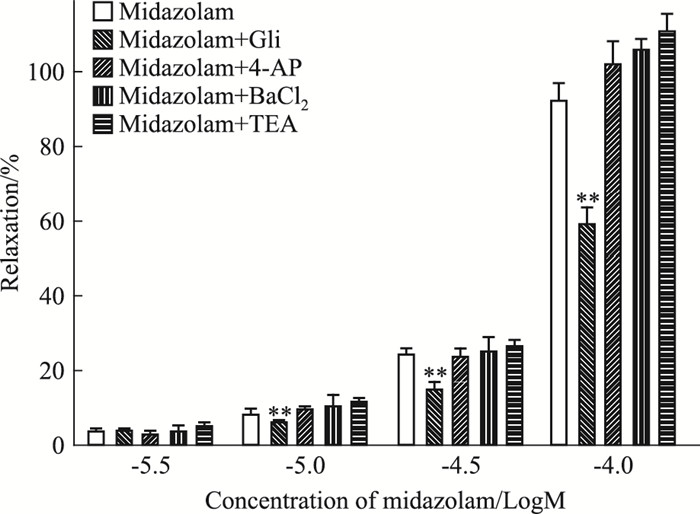
|
| Fig 4 Effects of 4-AP, BaCl2, TEA, Gli on relaxation induced by midazolam in porcine isolated coronary artery rings with precontraction induced by KCl(30 mmol·L-1)(x±s, n=5) **P < 0.01 vs midazolam alone group |
猪冠状动脉的口径、分布、走向、结构与人的冠状动脉有很大的相似性[4],因此,本实验研究了咪达唑仑对猪冠状动脉的舒张作用及其机制。实验结果表明,咪达唑仑对内皮完整的猪冠状动脉环有浓度依赖性的舒张作用,去除内皮后,其舒张作用明显减弱。由此可见,咪达唑仑对冠状动脉的舒张作用主要两方面的机制,部分依赖于血管内皮的舒张机制,部分作用于血管平滑肌的舒张机制。
依赖于内皮的舒血管机制主要源于内皮释放的一系列调节血管平滑肌张力的血管活性物质,主要有一氧化氮(NO)、前列腺环素(PGI2)等[5-6]。其中,NO是维持血管基础张力的最重要的舒血管因子,它的合成和释放受到抑制后,内皮相关的舒血管作用则会减弱[7]。文献表明[8],NO可通过NO-鸟苷酸环化酶(sGC)-环磷酸鸟苷(cGMP)途径、作用于K+通道等机制而舒张血管。我们用非特异性NOS抑制剂L-NAME预孵KCl预收缩的猪冠脉后,咪达唑仑的舒张血管作用部分被阻断,提示咪达唑仑的舒张血管作用可能与NO有关。L-Arg在NO的调节中发挥着关键的作用,它是体内NO合成的唯一底物。猪冠脉环预孵外源性NO合成底物L-Arg后,咪达唑仑舒血管作用并没有变化。同时应用L-NAME后,即使预孵L-Arg,咪达唑仑的舒血管作用仍然部分抑制,说明NO参与咪达唑仑舒张血管作用与外源性NO合成底物无关,L-NAME阻断咪达唑仑的舒血管作用也不受外源性NO合成底物的影响。
NOS是NO合成最关键的限速酶,目前常见的有3种同工酶,分别为神经元型(nNOS,Ⅰ型)、巨噬细胞诱导型(iNOS,Ⅱ型)和内皮细胞型(eNOS,Ⅲ型)[9],在一些病理状态下,iNOS大量持续表达,NO持续大量产生。同时,越来越多的研究发现,NO是一种复杂的生物活性介质,可以参与多种体内代谢的病理和生理过程,大量NO可能造成组织和细胞的损害,甚至死亡。所以,iNOS的诱导合成就成为众多疾病发病的关键。此外,在NO合成底物缺乏的情况下,iNOS可促使O2-大量形成,与NO形成氮氯化合物,通过细胞毒作用损伤机体[10]。1400W是迄今为止选择性最强的iNOS抑制剂,抑制iNOS的作用比抑制eNOS强200~5 000倍,是评价iNOS抑制剂必需的最新工具。实验中应用1400W后,发现对咪达唑仑的血管舒张作用无影响,说明咪达唑仑不是通过诱导合成iNOS来发挥舒血管作用。
与内皮相关的主要舒血管因子还有PGI2,由环氧合酶(COX)催化花生四烯酸生成,COX是其合成的主要限速酶,其抑制剂Indo对咪达唑仑的舒张冠脉作用无影响,提示PGI2途径没有参与咪达唑仑的舒血管作用。
Ca2+在血管平滑肌的收缩与舒张中起着关键作用,细胞外钙内流和细胞内钙释放促使血管平滑肌收缩。电压依赖钙通道(VDC)、受体操纵钙通道(ROC)、钙释放激活的钙通道(CRAC)以及其他离子载体(Na+/Ca2+交换体、漏通道等)的激活是钙内流的主要途径。高浓度KCl使冠脉血管平滑肌细胞膜去极化,VDC开放,从而促使细胞外的Ca2+内流,引起血管平滑肌收缩[11]。前期研究表明,咪达唑仑可以阻断VOC,其舒血管作用还涉及ROC和细胞内储存钙释放的抑制。在本实验中,咪达唑仑可浓度依赖性地抑制KCl预收缩的猪冠状动脉环,提示咪达唑仑引起的血管环舒张可能是通过抑制VDC介导的细胞外钙内流而舒张血管。本实验中,冠脉环预孵Na+/Ca2+交换体特异性阻断剂KB-R7943(1×10-6 mol·L-1)后,咪达唑仑的舒血管作用无变化,提示咪达唑仑不通过Na+/Ca2+交换体发挥舒血管作用。
K+通道在维持血管平滑肌张力中发挥着重要作用,激活血管平滑肌上的K+通道,K+外流,细胞膜超级化,从而抑制细胞外Ca2+内流,引起血管舒张。为了探讨咪达唑仑的舒张冠脉作用与K+通道之间的关系,我们分别观察了不同K+通道阻断剂对咪达唑仑舒张冠脉作用的影响。结果显示,KATP阻断剂Gli可以抑制咪达唑仑的舒张冠脉作用,BKCa阻断剂TEA、Kir阻断剂BaCl2、KV阻断剂4-AP对咪达唑仑的舒张冠脉作用无影响。结果表明,KATP通道在咪达唑仑的舒张冠脉中发挥了作用,BKCa、Kir和KV通道未参与其舒张冠脉作用。
综上所述,咪达唑仑可舒张KCl(30 mmol·L-1)预收缩的猪冠脉环,其舒血管作用具有浓度依赖性和内皮依赖性,内皮分泌的NO参与了其舒血管作用,外源性NO、iNOS以及PGI2的合成与其舒血管作用无关,咪达唑仑对猪冠脉的舒张可能与KATP通道有关,与KV通道、BKCa通道、Kir通道以及Na+/Ca2+交换体无关。本实验是咪达唑仑舒血管机制的初步研究,本课题组将在后续的研究中从分子生物学、NO浓度测定、离子通道电生理等方面深入探讨咪达唑仑舒血管机制。通过对咪达唑仑舒血管机制的研究,有助于阐明咪达唑仑在麻醉诱导或者镇静时,减少心肌氧耗、增加冠脉血流量、维持心血管系统的稳定的作用机制。
( 致谢: 本实验在山西医科大学基础医学院药理学教研室完成。感谢各老师和同学在实验过程中的帮助。)
| [1] | 王雷, 孙飞, 李艳, 等. 咪达唑仑对异氟烷小鼠的镇痛、催眠作用的影响[J]. 中国药理学通报, 2010, 26(11): 1528-9. Wang L, Sun F, Li Y, et al. Influences of midazolam on the analgesic and hypnotic effects of isoflurane treated mice[J]. Chin Pharmacol Bull, 2010, 26(11): 1528-9. |
| [2] | Palmer P P, Miller R D. Current and developing methods of patient-controlled analgesia[J]. Anesthesiol Clin, 2010, 28(4): 587-99. doi:10.1016/j.anclin.2010.08.010 |
| [3] | Chen C C, Shen T Y, Chang M C, et al. Stress-induced myocardial ischemia is associated with early post-stress left ventricular mechanical dyssynchrony as assessed by phase analysis of 201Tl gated SPECT myocardial perfusion imaging[J]. Eur J Nnucl Med Mol Imag, 2012, 39(12): 1904-9. doi:10.1007/s00259-012-2208-7 |
| [4] | Sahni D, Kaur G D, Jit H, et al. Anatomy & distribution of coronary arteries in pig in comparison with man[J]. Indian J Med Res, 2008, 127(6): 564-70. |
| [5] | Weksler B B. Prostanoids and NSAIDs in cardiovascular biology and disease[J]. Curr Atheroscler Rep, 2015, 17(7): 41. doi:10.1007/s11883-015-0514-9 |
| [6] | 阎雨, 王夙博, 袁天翊, 等. Rho激酶抑制剂DL0805-0对大鼠离体胸主动脉的舒张作用及机制研究[J]. 中国药理学通报, 2014, 30(4): 473-7. Yan Y, Wang S B, Yuan T Y, et al. Vasorelaxant effect of Rho kinase inhibitor DL0805-0 on isolated rat aortic rings and its underlying mechanisms[J]. Chin Pharmacol Bull, 2014, 30(4): 473-7. |
| [7] | 房龙梅, 侯晓敏, 杨蓉, 等. 阿魏酸对离体大鼠冠状动脉的舒张作用及机制探讨[J]. 中国药理学通报, 2016, 32(4): 554-8. Fang L M, Hou X M, Yang R, et al. Vasodilatory effect of ferulic acid on in vitro rat coronary artery[J]. Chin Pharmacol Bull, 2016, 32(4): 554-8. |
| [8] | Wang T T, Zhou G H, Kho J H, et al. Vasorelaxant action of an ethylacetate fraction of Euphorbia humifusa involves NO-cGMP pathway and potassium channels[J]. J Ethnopharmacol, 2013, 148(2): 655-63. doi:10.1016/j.jep.2013.05.025 |
| [9] | O′connor D M, O′brien T. Nitric oxide synthase gene therapy: progress and prospects[J]. Expert Opin Biol Ther, 2009, 9(7): 867-78. doi:10.1517/14712590903002047 |
| [10] | Qi W N, Chaiyakit P, Cai Y, et al. NF-kappaB p65 involves in reperfusion injury and iNOS gene regulation in skeletal muscle[J]. Microsurgery, 2004, 24(4): 316-23. doi:10.1002/(ISSN)1098-2752 |
| [11] | Dick G M, Tune J D. Role of potassium channels in coronary vasodilation[J]. Exp Biol Med (Maywood), 2010, 235(1): 10-22. doi:10.1258/ebm.2009.009201 |