


2. 河北医科大学第二医院免疫风湿科,河北 石家庄 050000;
3. 河北省人民医院医院感染管理科,河北 石家庄 050000
 ,
YANG Ran1
,
YANG Ran1 ,
GUO Hui-fang2,
FENG Xiao-juan1,
WEI Qun3,
ZHANG Yu2,
WANG Yi-zhuo1,
LI Jin-ze1,
LIU Shu-xia1
,
GUO Hui-fang2,
FENG Xiao-juan1,
WEI Qun3,
ZHANG Yu2,
WANG Yi-zhuo1,
LI Jin-ze1,
LIU Shu-xia1

2. Dept of Rheumatology, the Second Hospital of Hebei Medical University, Shijiazhuang 050000, China;
3. Dept of Nosocomial Infection Control, Hebei General Hospital, Shijiazhuang 050000, China
狼疮性肾炎(lupus nephritis,LN)是系统性红斑狼疮常见并发症之一,也是其主要的致死原因,其在国内的发病率逐年攀升,但因具体作用机制并不清楚,治愈率很低[1]。因此,对其作用机制的研究尤为重要。
高迁移率族蛋白1(high mobility group protein B1,HMGB1) 是一种非组蛋白染色质结合蛋白,参与DNA的转录及修饰等生物学功能。新近研究发现,HMGB1作为炎症因子参与了呼吸系统、肝脏、肿瘤及自身免疫性疾病如类风湿性关节炎、干燥综合征等多种疾病的发生[2-4],其在系统性红斑狼疮中的作用也得到越来越多的重视[5],但HMGB1在LN中发挥了何种作用尚不明确。
之前我们的研究发现在小鼠系膜细胞中,HMGB1能够活化NF-κB信号通路,从而促进系膜细胞的增殖[6],但在LN患者及人类系膜细胞中是否也存在相似作用仍是未知。此外,我们近来研究发现,在LN患者外周血中肿瘤坏死因子-α-诱导蛋白-3(tumor necrosis factor α-induced protein 3,TNFAIP3) mRNA表达水平明显升高。TNFAIP3作为炎症反应负向调节的关键分子,是一种表达于多个免疫器官的诱导性胞质蛋白,该基因既具有泛素化酶又具有去泛素化酶的功能[7],以往研究发现其表达水平异常可能与NF-κB的功能异常有关。然而,TNFAIP3是否与HMGB1共同参与调控NF-κB的活性,从而参与LN的发生发展目前仍不清楚。
因此,本实验拟以Ⅳ型LN患者及人肾小球系膜细胞(human mesangial cell, HMC)为研究对象,通过对HMGB1及TNFAIP3相关信号通路的研究,探讨HMGB1和TNFAIP3在LN肾小球系膜细胞过度增殖中的作用。
1 材料与方法 1.1 材料采用癌旁远端正常组织和LN患者肾组织各15例,实验已经过伦理委员会核准,由河北医科大学第二医院提供。人系膜细胞系购自中南大学高等研究中心。兔抗HMGB1单克隆抗体(Abcam公司,货号ab79823),兔抗TNFAIP3多克隆抗体(ABclonal公司,货号A2127),兔抗IkBα单克隆抗体(Abcam公司,货号ab32518),兔抗p65多克隆抗体(Abcam公司,货号ab90532),SP法免疫组化试剂盒(北京中杉金桥生物技术有限公司,货号SP9001),Dylight 649-山羊抗兔荧光二抗(KPL公司,货号072051806),BrdU参入试剂盒(Merck Millipore公司,货号2752)。
1.2 分组肾穿样本分为正常组织对照组和LN患者组。细胞分组:采用人重组HMGB1蛋白刺激HMC细胞,对细胞增殖水平影响的研究分为空白对照组和不同浓度刺激组,收集不同浓度刺激后各个时间点的细胞;对蛋白表达水平影响的研究分为空白对照组和不同时间点刺激组。
1.3 免疫组化肾组织脱蜡至水;3%过氧化氢避光孵育20 min,0.01 mmol·L-1枸橼酸修复液,高压修复5 min并自然晾凉;正常山羊血清37℃封闭60 min;滴加抗TNFAIP3或IκBα抗体(1 :200稀释)4℃过夜;二抗37℃孵育30 min;三抗37℃孵育30 min;DAB显色液显色5 min;苏木精染色2 min;氨水返蓝30 s,盐酸酒精分化30 s;脱水透明,中性树胶封片。
1.4 免疫荧光肾组织脱蜡至水;0.01 mmol·L-1枸橼酸修复液,高压修复5 min;正常山羊血清37℃封闭60 min;滴加抗HMGB1抗体(1 :200稀释),4℃过夜;0.01 mmol·L-1 PBS洗涤3次,每次5 min;TRITC-山羊抗兔IgG(1 :200稀释)37℃孵育60 min(避光);DAPI复染;荧光显微镜下观察结果。免疫荧光染色结果判定:HMGB1蛋白阳性信号均呈红色荧光。
1.5 BrdU参入法检测细胞增殖水平HMC细胞以1×105/孔接种于96孔板,用50、100、200μg·L-1的人重组HMGB1蛋白刺激细胞,每组设立3个复孔。37℃、5% CO2孵箱中培养2、4、8、12 h;收集细胞前1 h,每孔加入100 μL BrdU参入液;收集细胞,每孔加入固定液200 μL,室温孵育30 min;Washing Buffer冲洗3次;每孔滴加抗BrdU抗体100 μL,室温放置1 h,Washing Buffer冲洗3次;每孔滴加二抗100 μL,室温孵育30 min,Washing Buffer冲洗3次, 滴加过氧化物酶底物每孔100 μL,室温孵育30 min,此时增殖活跃的细胞孔呈蓝色。每孔加入终止液100 μL,细胞孔由蓝色变为亮黄,酶标仪于450 nm处检测其OD值。
1.6 Western blot采用100 μg·L-1人重组HMGB1蛋白刺激HMC,收集刺激后0、10、20、30、40、50、60 min各时间点的细胞,裂解后,采用BCA试剂盒进行蛋白定量,煮沸5 min变性。50 μg样品进行10% SDS聚丙烯酰胺凝胶电泳,蛋白分离后湿转至PVDF膜。5%脱脂奶粉37℃封闭1 h。加入TNFAIP3、IκBα或p65抗体(稀释浓度均为1 :1 000)4℃孵育过夜。辣根过氧化物酶标记的二抗(稀释浓度为1 :5 000)37℃孵育2 h。Odyssey FC成像系统显影,并对条带进行定量分析,以目的条带和β-actin条带积分光密度值(IOD值)的比值代表目的蛋白的相对表达量。
1.7 统计学分析计量资料用x±s表示,采用SPSS 18.0软件进行统计分析,多组间比较采用单因素方差分析,并进行两两比较。
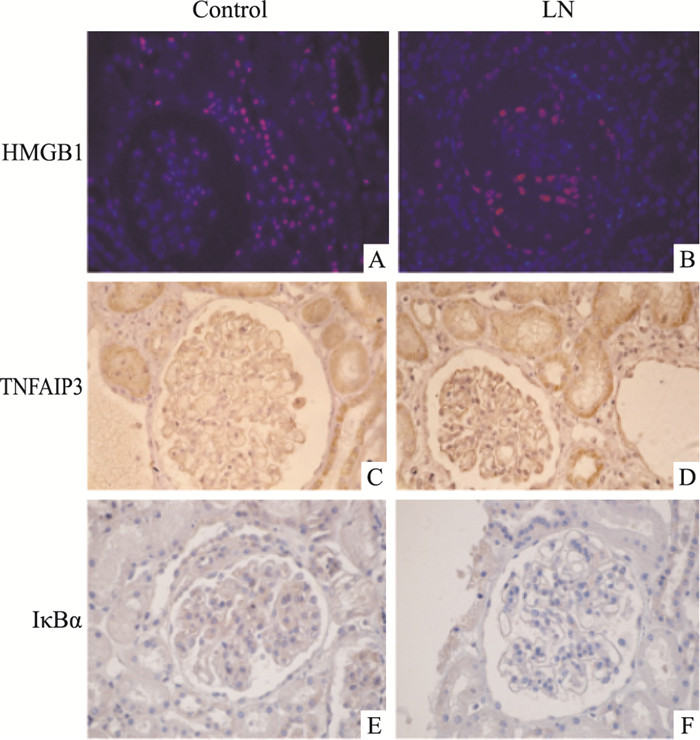
2 结果 2.1 肾组织中HMGB1、TNFAIP3和IκBα蛋白的表达水平免疫荧光结果提示,与对照组癌旁远端正常组织相比,LN患者肾小球HMGB1蛋白(红色)阳性细胞比例明显升高,且主要定位于细胞核(Fig 1A、1B)。免疫组化结果提示,与对照组相比,TNFAIP3蛋白表达水平升高(Fig 1C、1D),IκBα蛋白表达水平降低(Fig 1E、1F),二者均定位于细胞质。
|
| Fig 1 HMGB1, TNFAIP3 and IκBα expression levelsin glomerular cells of type Ⅳ LN patients and normal tissuesby immunofluorescence and immunohistochemistry technique A~B:Immunofluorescence of HMGB1 expression; C~D:Immunohistochemistry of TNFAIP3 expression; E~F:Immunohistochemistry of IκBα expression |
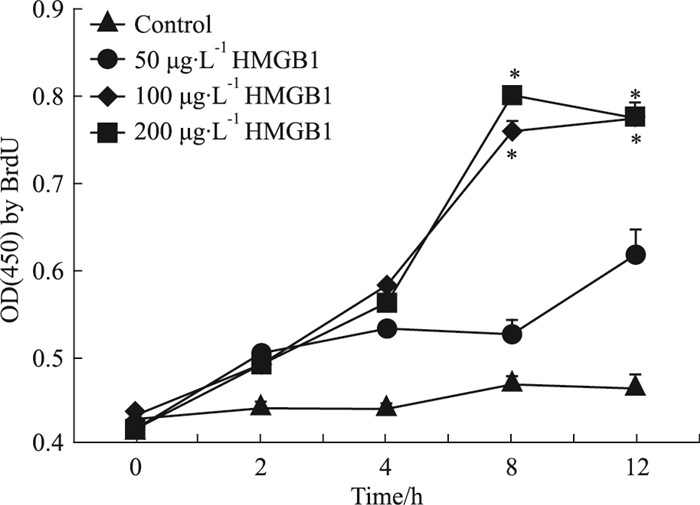
LN患者体内存在HMGB1的上调,该上调是否与细胞增殖有关呢?我们进一步采用HMGB1重组蛋白对人类的系膜细胞(HMC)进行刺激,BrdU参入结果提示,与对照组相比,100、200 μg·L-1 HMGB1刺激HMC 8、12 h后,HMC增殖水平均明显升高(P < 0.05),二者之间无明显差异(Fig 2)。
|
| Fig 2 HMC proliferation levels increased significantlyafter HMGB1 stimulation using BrdU incorporation technology *P < 0.05 vs control |
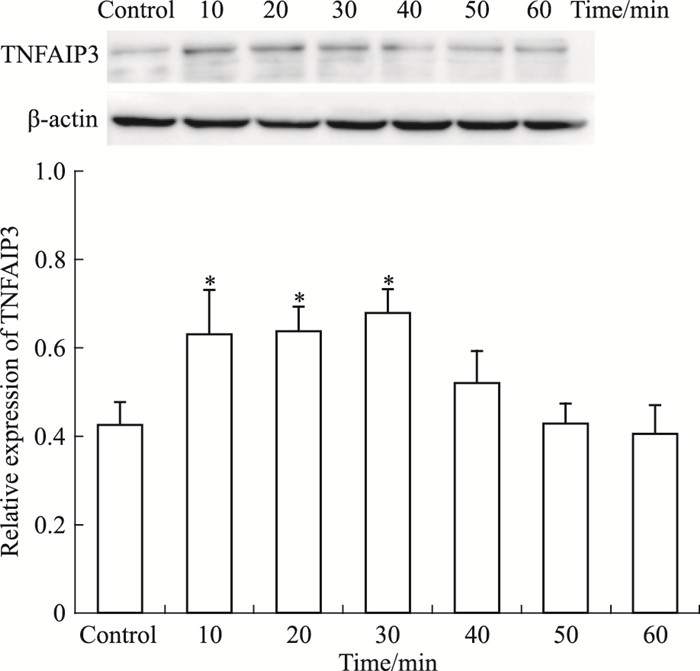
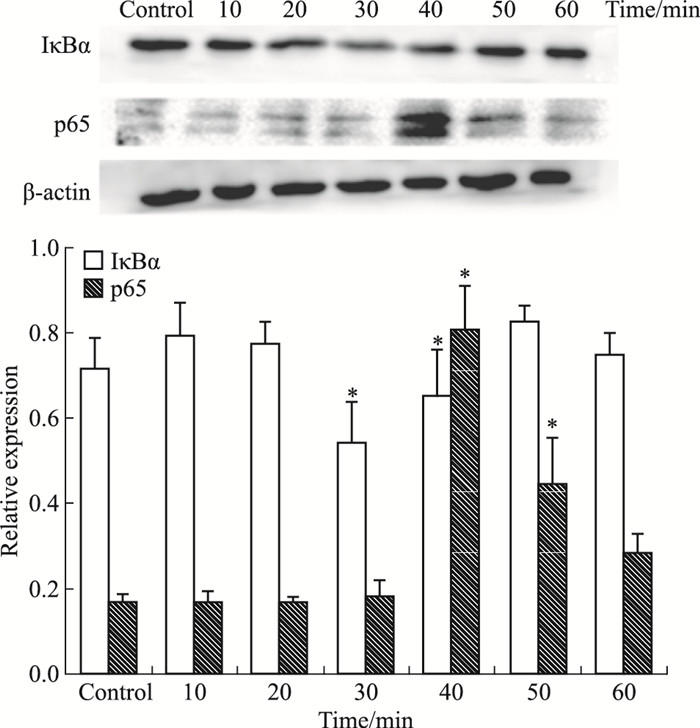
是否由于HMGB1的上调引起TNFAIP3表达量的变化,从而影响了NF-κB信号通路的活化水平呢?我们采用HMGB1重组蛋白对HMC在不同时间点进行刺激,研究TNFAIP3的表达情况。结果显示,与对照组相比,人重组HMGB1刺激10 min后,HMC中TNFAIP3蛋白表达水平明显增加(P < 0.05),见Fig 3。而IκBα蛋白表达水平与TNFAIP3正好相反,与对照组相比,人重组HMGB1刺激30 min后,HMC中IκBα蛋白表达明显降低(P < 0.05),见Fig 4。p65蛋白表达水平与IκBα相反,与对照组相比,刺激40 min后,明显升高(P < 0.05)。提示TNFAIP3可能参与HMGB1诱导的HMC中NF-κB信号通路的活化,从而促进细胞增殖。
|
| Fig 3 TNFAIP3 protein expression levelincreased 10, 20, 30 min after HMGB1 stimulation *P < 0.05 vs control |
|
| Fig 4 IκBα protein expressionlevel decreased, while p65 increased significantly30 min and 40 min after HMGB1 stimulation *P < 0.05 vs control |
LN是系统性红斑狼疮最常见、最严重的并发症,但其发病机制尚未清楚。细胞免疫及体液免疫功能紊乱导致多种细胞因子分泌失衡,并通过相互协同或拮抗作用参与多种组织和器官的损伤[8],其中HMGB1的作用得到越来越多的关注。HMGB1是一种非组蛋白染色质结合蛋白,我们的前期实验证实了HMGB1在小鼠狼疮性肾炎中异常表达[6, 9],提示HMGB1可能参与了LN的发病过程,但是具体机制如何仍不十分清楚。
肾小球细胞的增殖是LN的主要病理特征之一,也是其肾脏病理的活动性指标。我们以往研究发现,在小鼠系膜细胞中HMGB1可能促进肾小球细胞增殖,参与疾病发生[6, 10]。本研究也证实了HMGB1在LN患者肾小球细胞中,尤其是系膜区细胞中存在表达水平的上调;体外实验则证实了人重组HMGB1能够诱导HMC增殖水平的升高。这些结果提示HMGB1可能在LN的发病过程中发挥了重要作用,而这一作用是通过促增殖作用实现的。那么,HMGB1又是如何发挥作用的呢?
HMGB1可能是通过激活细胞内信号通路发挥其功能的。其中,NF-κB信号通路与免疫性疾病的关系最为密切[11-12]。正常情况下,NF-κB与IκB组成三聚体处于失活状态。IκB蛋白的降解使NF-κB从三聚体中得以释放,并被转移至细胞核中发挥其核转录因子作用。在这个过程中,IκBα的降解是整个信号通路的中心环节之一。在本研究中,我们证实了在LN患者肾小球细胞胞质内确实存在着IκBα蛋白表达水平的降低,提示IκBα有可能遭到降解,泛素化是常见的蛋白降解途径之一。我们对多种泛素连接酶进行了筛选,结果发现TNFAIP3在LN患者中表达水平明显升高。TNFAIP3是一种表达于多个免疫器官的诱导性胞质蛋白,该基因既具有泛素化酶又具有去泛素化酶的功能,因而在免疫调节、抑制肿瘤、TNF介导的细胞凋亡等方面均具有重要作用[7]。有研究证实其与NF-κB-IκB三聚体的关系密切[13],能够抑制NF-κB的活化,是重要的炎症抑制因子,而且TNFAIP3与风湿性关节炎等多种自身免疫性疾病的关系也十分密切[14]。但是TNFAIP3在LN进展中的作用仍不十分明了,我们在研究中发现,与对照组相比,TNFAIP3在LN患者肾小球中的表达出现上调,推测TNFAIP3表达水平的变化可能是由HMGB1所介导的。
因此,我们以人重组的HMGB1刺激HMC,结果发现TNFAIP3表达水平迅速升高,随后我们检测到了IκBα蛋白表达水平的下调,p65蛋白表达水平明显增加。以上实验结果均提示,HMGB1可能通过上调TNFAIP3蛋白表达水平,影响IκBα的表达水平,诱发NF-κB信号通路的活化,介导系膜细胞过度增殖,从而参与LN的发病。以往研究认为TNFAIP3为NF-κB的负调节因子[15],但是在LN中TNFAIP3的具体作用尚不明确,因此,是否有其他的因素影响其负调控作用仍是未知[16]。总之,TNFAIP3是如何影响IκBα表达水平,其具体作用机制有待进一步研究。
综上所述,本研究证实了HMGB1和TNFAIP3在LN肾小球系膜细胞过度增殖中的重要作用,为揭示LN的发病过程提供了新的依据,同时为其靶向治疗提供了新的思路。
( 致谢: 本实验在河北省肾脏病重点实验室、河北医科大学病理实验室完成,特此致谢! )
| [1] | Gatto M, Iaccarino L, Ghirardello A, et al. Clinical and pathologic considerations of the qualitative and quantitative aspects of lupus nephritogenic autoantibodies: a comprehensive review[J]. J Autoimmun, 2016, 69: 1-11. doi:10.1016/j.jaut.2016.02.003 |
| [2] | Pistoia V, Pezzolo A. Involvement of HMGB1 in resistance to tumor vessel-targeted, monoclonal antibody-based immunotherapy[J]. J Immunol Res, 2016, 2016: 3142365. |
| [3] | 莫思燕, 韦明中, 邱金慧, 等. 基于高迁移率族蛋白B1对老鼠生物碱A抗肝纤维化作用机制的研究[J]. 中国药理学通报, 2016, 32(11): 1553-8. Mo S Y, Wei M Z, Qiu J H, et al. Anti-hepatic fibrotic mechanism of Acanthus ilicifolius alkaloid A involved in high mobility group box 1[J]. Chin Pharmacol Bull, 2016, 32(11): 1553-8. doi:10.3969/j.issn.1001-1978.2016.11.015 |
| [4] | 李留成, 高建, 李俊. HMGB1在呼吸系统疾病中的作用及其机制[J]. 中国药理学通报, 2015, 31(1): 15-8. Li L C, Gao J, Li J. Role and mechanisms of HMGB1 in respiratory diseases[J]. Chin Pharmacol Bull, 2015, 31(1): 15-8. |
| [5] | Abdulahad D A, Westra J, Limburg P C, et al. HMGB1 in systemic lupus erythematosus: its role in cutaneous lesions development[J]. Autoimmun Rev, 2010, 9(10): 661-5. doi:10.1016/j.autrev.2010.05.015 |
| [6] | Feng X J, Liu S X, Wu C, et al. The PTEN/PI3K/Akt signaling pathway mediates HMGB1-induced cell proliferation by regulating the NF-kappaB/cyclin D1 pathway in mouse mesangial cells[J]. Am J Physiol Cell Physiol, 2014, 306(12): C1119-28. doi:10.1152/ajpcell.00385.2013 |
| [7] | Catrysse L, Vereecke L, Beyaert R, et al. A20 in inflammation and autoimmunity[J]. Trends Immunol, 2014, 35(1): 22-31. doi:10.1016/j.it.2013.10.005 |
| [8] | Rekvig O P, Thiyagarajan D, Pedersen H L, et al. Future perspectives on pathogenesis of lupus nephritis: facts, problems, and potential causal therapy modalities[J]. Am J Pathol, 2016, 186(11): 2772-82. doi:10.1016/j.ajpath.2016.06.026 |
| [9] | Feng X, Hao J, Liu Q, et al. HMGB1 mediates IFN-gamma-induced cell proliferation in MMC cells through regulation of cyclin D1/CDK4/p16 pathway[J]. J Cell Biochem, 2012, 113(6): 2009-19. doi:10.1002/jcb.v113.6 |
| [10] | Seret G, Le Meur Y, Renaudineau Y, et al. Mesangial cell-specific antibodies are central to the pathogenesis of lupus nephritis[J]. Clin Dev Immunol, 2012, 2012: 579670. |
| [11] | Karuppagounder V, Arumugam S, Thandavarayan R A, et al. Modulation of HMGB1 translocation and RAGE/NFkappaB cascade by quercetin treatment mitigates atopic dermatitis in NC/Nga transgenic mice[J]. Exp Dermatol, 2015, 24(6): 418-23. doi:10.1111/exd.2015.24.issue-6 |
| [12] | Sun J, Shi S, Wang Q, et al. Continuous hemodiafiltration therapy reduces damage of multi-organs by ameliorating of HMGB1/TLR4/NFkappaB in a dog sepsis model[J]. Int J Clin Exp Pathol, 2015, 8(2): 1555-64. |
| [13] | Kanayama M, Inoue M, Danzaki K, et al. Autophagy enhances NFkappaB activity in specific tissue macrophages by sequestering A20 to boost antifungal immunity[J]. Nat Commun, 2015, 6: 5779. doi:10.1038/ncomms6779 |
| [14] | Majumdar I, Paul J. The deubiquitinase A20 in immunopathology of autoimmune diseases[J]. Autoimmunity, 2014, 47(5): 307-19. doi:10.3109/08916934.2014.900756 |
| [15] | Shembade N, Harhaj E. A20 inhibition of NFkappaB and inflammation: targeting E2:E3 ubiquitin enzyme complexes[J]. Cell cycle, 2010, 9(13): 2481-2. doi:10.4161/cc.9.13.12269 |
| [16] | Verstrepen L, Verhelst K, van Loo G, et al. Expression, biological activities and mechanisms of action of A20(TNFAIP3)[J]. Biochem Pharmacol, 2010, 80(12): 2009-20. doi:10.1016/j.bcp.2010.06.044 |