


2. 贵阳中医学院第二临床医学院神经内科,贵州 贵阳 550025
2. Dept of Neurology, the Second Affiliated Hospital, Guiyang College of Traditional Chinese Medicine, Guiyang 550025, China
脑血管疾病是危害人类身体健康的一类常见病,而脑中风是世界死亡率排名第二的疾病,每年死于脑中风的人大约为600万,据估计,患脑中风的概率为8%~10%[1],其发病率、致残率、病死率高,病因病机复杂[2]。糖尿病(diabetes mellitus, DM)是以高血糖、高胰岛素血症为特征的代谢性疾病,长期高血糖可使脑内产生大量氧自由基,导致氧化应激的过度发生,从而加重脑缺血/再灌注损伤[3]。研究表明高血糖可增加急性心梗及中风的发病率和死亡率, 且糖尿病合并中风患者的神经功能预后不良及残疾程度都远高于非糖尿病中风患者,但糖尿病加重脑缺血损伤的病理机制还未明确,其临床治疗仍然是一大难题。西药治疗往往副作用大,且对大多数心脏病患者禁忌,近年来人们越来越多地把目光放到了中药上,对中药治疗糖尿病合并缺血性脑卒中进行了大量研究。我国多年以来也一直以丹参应用最为广泛,有研究证实丹参长期使用可造成低钾血症,副作用相对大且疗效不稳定。而注射用丹参多酚酸是由中药丹参的水溶性酚酸类化合物制成的粉针剂,临床上已广泛用于治疗轻、中度脑梗死及冠心病。已有研究表明,丹参多酚酸有抗凝、抗血小板聚集、增加氧自由基功能,可以改善脑部血液微循环,从而减轻脑神经细胞的再灌注损伤,恢复脑部功能[4-6],其主要成分丹酚酸B有明确的抗脑缺血损伤作用,其机制可能与神经保护、血脑屏障保护及抗氧化和清除自由基等有关[7-9]。然而,注射用丹参多酚酸对糖尿病脑血管疾病是否有治疗作用,其作用机制如何,尚未见报道。随着高通量筛选技术的快速发展,中药分子网络机制的研究相对容易,其中基因表达谱芯片是较成熟且常用的技术之一,从基因水平为中药治疗复杂疾病的研究提供大量数据来源。本研究基于基因芯片技术,从分子机制方面探索注射用丹参多酚酸对糖尿病局灶脑缺血/再灌注大鼠脑组织基因的表达的影响,以此阐明注射用丹参多酚酸治疗糖尿病脑中风的作用机制。
1 材料 1.1 动物健康Wistar大鼠,78只,♂,体质量(200±20) g,清洁级,购于北京维通利华实验动物技术有限公司,合格证号SCXK(京)2012-0001。实验动物所有操作均严格按照天津中医药大学动物伦理委员会标准执行(TCM-LAEC2015028)。
1.2 试剂与药品链脲佐菌素(STZ,批号101347685,Sigma,美国);总RNA提取试剂盒(AM1556,AMBION,美国);水合氯醛(批号Q/12HB 4218-2009,天津科密欧化学试剂有限公司);注射用丹参多酚酸(SLI,每支含丹参多酚酸100 mg、辅料甘露醇30 mg,批号20121101,天津天士力之骄药业有限公司);依达拉奉注射液(edaravone,ED,南京先声东元制药有限公司生产,批号:80-140403);红四氮唑(2, 3, 5-triphenyltetrazolium chloride,TTC,美国Sigma公司,批号101060273)。
1.3 仪器Agilent Rat lncRNA(8×60 K,设计标示号062716型芯片,上海欧易生物医学科技有限公司),Gene Genius型电泳凝胶成像系统(Gene Genius,美国),ND-2000型超微量分光光度计(Thermo Scientific,美国),2100型生物分析仪(Agilent Technologies,美国),G2505C Sure Scan基因芯片-微阵列扫描仪(Agilent Technologies,美国),Feature Extraction软件(version 10.7.1.1,Agilent Technologies),Gene spring软件(version12.5,Agilent Technologies)。
2 方法 2.1 Ⅰ型糖尿病大鼠模型的制备诱导前禁食6 h(上午7点到下午1点),然后经腹腔注射链脲佐菌素(streptozotocin,STZ)溶液60 mg·kg-1。14 d后断尾采血测定血糖,若空腹血糖≥16.7 mmol·L-1,且有多尿、多饮、多食现象的大鼠视为Ⅰ型糖尿病模型造模成功[5, 7]。所有动物正常饮食、自由饮水,饲养6周。
2.2 局灶性脑缺血/再灌注损伤(middle cerebral artery occlusion/reperfusion, MCAO/R)大鼠模型的制备将糖尿病大鼠建立脑缺血/再灌注损伤动物模型,具体操作参考Longa等[8]方法,缺血1.5 h后进行再灌注,实验中用激光多普勒监测缺血侧脑血流变化,以血流迅速下降至初始血流的30%以下,并在整个缺血过程中保持于此水平,直至线栓拔出之后迅速恢复至基础值,为脑缺血的标准。手术24 h后参考Longa等[8]方法进行神经功能评分:无神经功能缺损症状,0分;轻微神经功能缺损,不能完全伸展左侧前爪,1分;中度神经功能缺损,向左侧转圈,2分;重度神经功能缺损,向左侧倾倒,3分;不能自发行走,意识水平下降,4分。评分为1~4分为造模成功,用于实验。术后大鼠放在电热恒温板(37.0±0.5) ℃上保温,观察生命体征,等待动物清醒后放入饲养笼中,在20~25 ℃恒温条件下饲养,自由进食进水。假手术组分离血管不插线栓。
2.3 分组及给药将大鼠随机分为6组,假手术组(DM+Sham)、糖尿病脑缺血/再灌注损伤模型组(DM+MCAO/R)、依达拉奉组(6 mg·kg-1,ED)、丹参多酚酸治疗组(5.25、10.5、21 mg·kg-1,SLI),每组13只。缺血/再灌注3 h后尾静脉注射给药,每日1次,连续给药14 d,假手术组和模型组给予等体积的生理盐水。
2.4 大鼠血糖、脑梗死体积及行为学测定大鼠注射STZ 1周后测血糖,d 14给药30 min后,首先做3分行为学评分,然后随机选取10只,腹腔注射10%水合氯醛(10 mL·kg-1)麻醉大鼠,剪开胸腔,暴露心脏,经左心尖将灌注针头插入主动脉后,剪开右心耳,缓慢推注冰生理盐水200 mL灌流至大鼠眼睛、肝、肾泛白,立即断头并置于冰盒上开颅取脑,置于脑槽内,冠状切4刀,共切5个脑片,每片2 mm,迅速将脑片置于TTC染液中(每100 mL染液中含有5% TTC 30 mL),37 ℃避光孵育30 min。采用Leica照相机采集图像。梗死体积/%=[(缺血对侧面积之和-缺血侧未梗死面积)×2 mm÷缺血对侧面积×2 mm]×100 %。红色为非缺血区,白色为梗死区。
2.5 取材由梗死体积和行为学评价结果可得,SLI (21 mg·kg-1)组效果最佳,所以选取SLI组(21 mg·kg-1)3只大鼠心脏灌流后取脑,快速分离缺血半暗带区,用锡纸包裹,液氮速冻,然后置于-80 ℃超低温冰箱保存,做基因芯片检测。
2.6 总RNA提取及质量鉴定按总RNA提取试剂盒Animal Total RNA Isolation Kit(Applied Biosystem p/n AM1556) 的说明书进行操作。样品总RNA利用Nano Drop ND-2000(Thermo Scientific)定量,Agilent Bioanalyzer 2100(Agilent Technologies)检测RNA完整性,如RNA完整性计数(RNA integrity number,RIN)≥7,则用于后续mRNA表达谱分析。
2.7 探针标记与杂交RNA质检合格后,样本的标记、芯片的杂交以及洗脱参照Agilent表达谱基因芯片检测流程进行,总RNA的纯化,cDNA的合成,cRNA的合成、纯化及质控,芯片杂交。具体操作由上海欧易生物医学科技有限公司完成。
2.8 琼脂凝胶电泳检测取琼脂糖0.9 g,加100 mL 1×TAE电泳缓冲液于烧瓶中,加热溶解。平衡凝胶槽,放好挡板,在凝胶中加入溴化乙锭溶液铺板,冷却后上样品,进行电泳检测。
2.9 芯片数据分析芯片结果采用Agilent Scanner G2505C扫描得到原始图像,Feature Extraction软件进行数据的分析和处理,并利用Gene spring 12.5软件对数据进行定量标准化分析,Funrich-V3进行后续分析。利用t检验的P值和差异倍数变化(FC)进行差异基因筛选,筛选的标准为上调或者下调FC≥2.0且P≤0.05,并对差异基因进行聚类分析,以判定差异基因的主要生物学功能。
2.10 统计学分析实验数据采用x±s表示,运用SPSS 16.0统计软件进行统计分析。先将各组数据进行方差齐性检验,多组间比较采用单因素方差分析,方差齐者用LSD检验。方差不齐时先将数据转换后,使之方差齐,再同上进行分析。
3 结果 3.1 对糖尿病大鼠局灶性脑缺血后脑梗死体积及神经功能缺损评分的影响血糖值均≥16.7 mmol·L-1[5],梗死体积方面,除假手术组未见脑组织异常改变外,模型组和给药组大鼠均有不同程度梗死灶,与模型组相比,各治疗组(除丹参多酚酸5.25 mg·kg-1组)的梗死灶范围均明显减少,差异具有显著性。行为学方面,假手术组未见行为异常改变,造模后各组实验动物偏瘫症状明显,均有程度不同的神经功能缺失。14 d后与正常组相比,模型组的神经功能评分明显升高,治疗各组(除丹参多酚酸5.25、10.5 mg·kg-1组)的神经功能评分明显低于模型组,差异具有显著性。由此可见模型成功,且可以看出21 mg·kg-1是丹参多酚酸的有效剂量,见Fig 1。
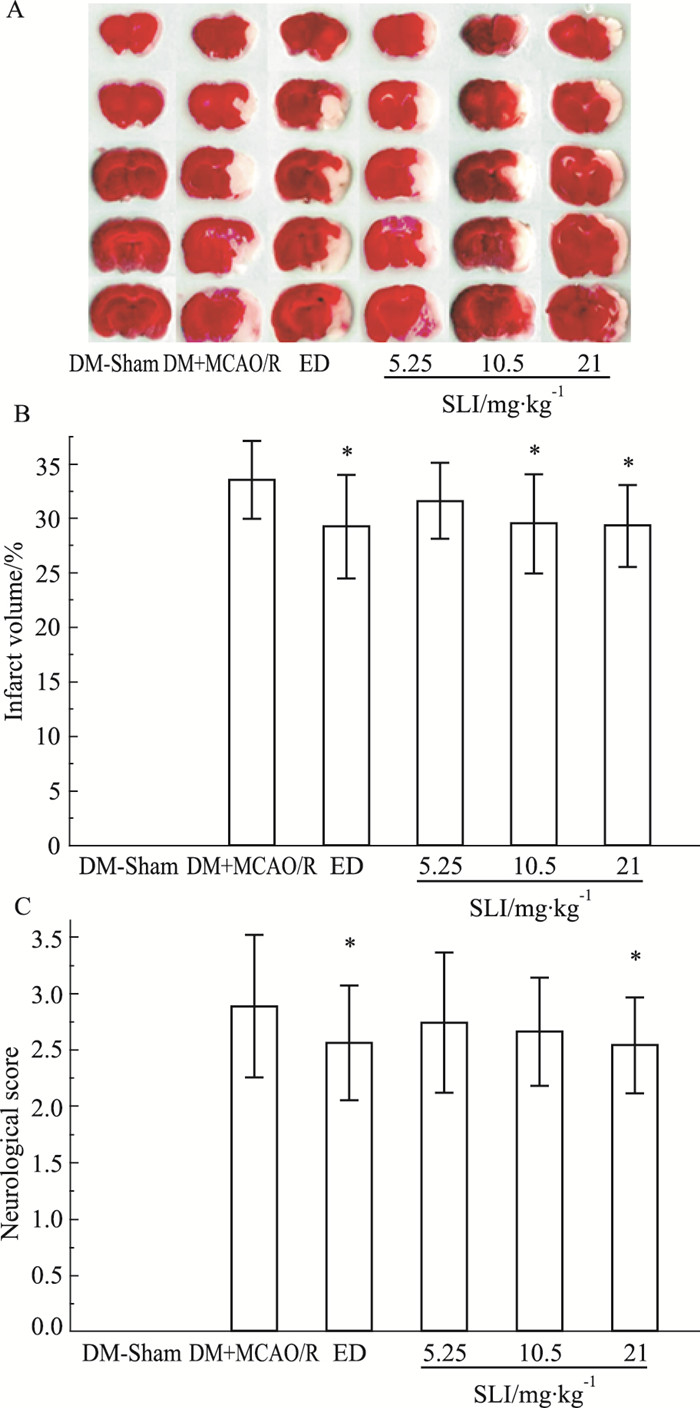
|
| Fig 1 Ischemic neuronal damage reduced 14 dafter MCAO in treatment groups(x±s, n=10) A: Representative TTC staining; B: Determination of tissue infarction; C: Neurological score of rats 14 d after surgery.*P < 0.05 vs DM+MCAO/R |
分别抽提假手术组、模型组和丹参多酚酸21 mg·kg-1组大鼠脑组织的总RNA。电泳结果显示,20 ℃和70 ℃各水浴1 h后,28 S RNA和18 S RNA条带清晰,5 S RNA条带不够清晰,28 S条带的亮度约为18 S条带亮度的2倍(RIN≥7,且28 S/18 S≥0.7),总RNA吸光度A260/A280>1.9,表明RNA受DNA污染不明显,其纯度及完整性均能满足后续芯片实验的要求。另外,利用Agilent软件对芯片扫描图进行质量分析,表明芯片样本背景信号值与噪点值都在适当范围内,芯片数据质量较高,见Fig 2。
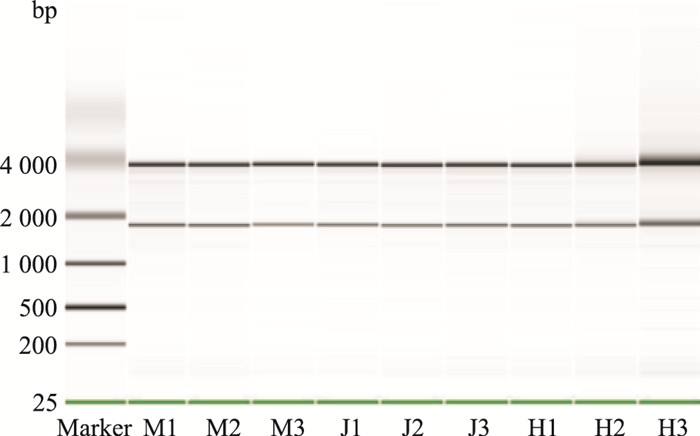
|
| Fig 2 Electrophoresis analysis ofmRNAs from brain tissues(n=3) M1~M3:DM+MCAO/R group 3 rats; J1~J3:DM+Sham group 3 rats; H1~H3:SLI(21mg·kg-1) group 3 rats |
基因表达谱芯片的原始数据经过均一化和对数转换后绘制箱线图,评估芯片杂交数据的分布和分散程度。研究显示,治疗前后样品基本对称,在生物学性质上具有可比性。将样品数据两两比较的散点图列阵绘制成散点图,图中每个点代表芯片上的探针点,表明样品间的数据总体分布呈集中趋势(Fig 3)。
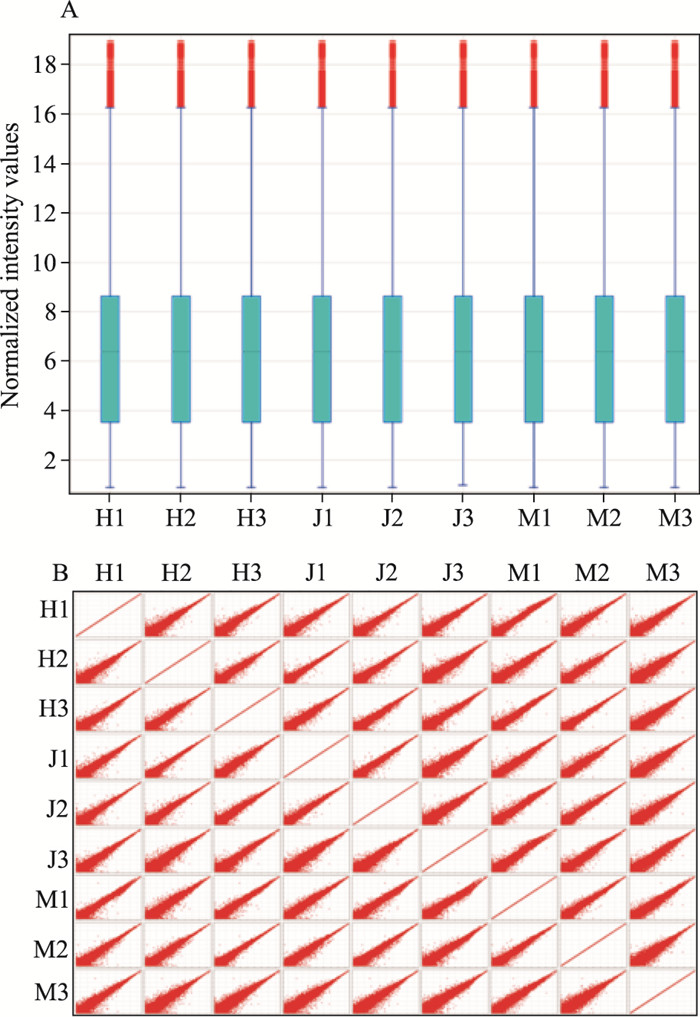
|
| Fig 3 Box-whisker plot and matrix plotof gene expression profiles(n=3) A:Box-whisker plot; B: Matrix plot. M1~M3:DM+MCAO/R group 3 rats; J1~J3:DM+Sham group 3 rats; H1~H3: SLI(21mg·kg-1) group 3 rats |
根据基因芯片上的序列信息,共获得差异基因23 322个,分析发现假手术组、模型组与丹参多酚酸治疗组共同表达基因有176个(Tab 1)。
| Group | Differential gene | Up | Down |
| SLI-DM+Sham | 31 | 10 | 21 |
| SLI-DM+MCAO/R | 59 | 45 | 14 |
| DM+MCAO/R-DM+Sham | 67 | 41 | 26 |
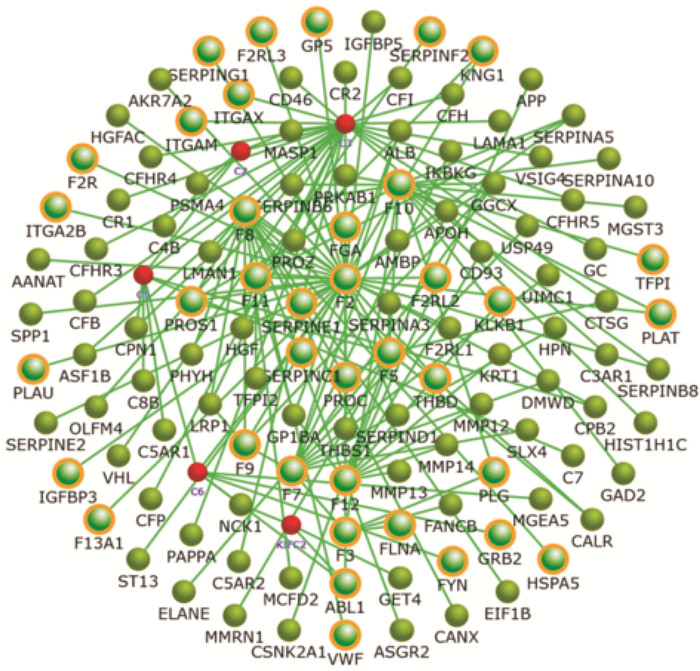
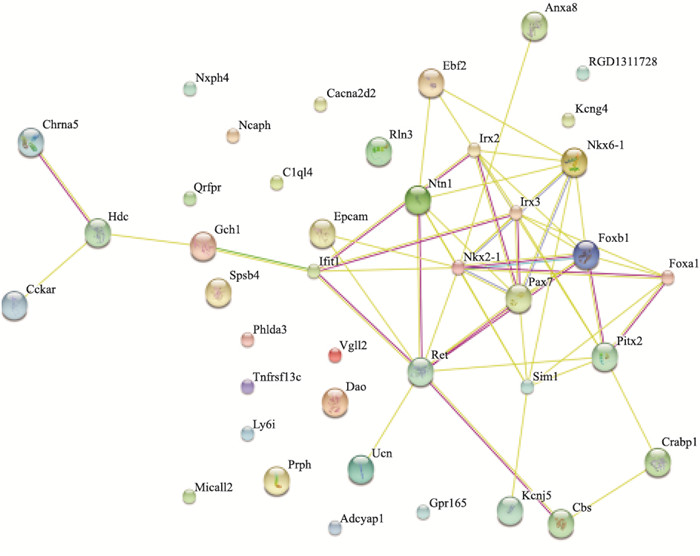
应用FunrichV3对模型组与丹参多酚酸组样品中59个差异基因进行分层聚类分析和基因间相互关系网络构建,结果发现有45个基因在丹参多酚酸组中高表达,14个低表达,其中红色区域表示上调基因,绿色区域表示下调基因,见Fig 4、5。结合KEGG和Gen Mapp等数据库对筛选出59个差异基因进行信号通路分析,结果发现P值前11条通路大部分与凝血止血、炎症、氧化应激有关(Tab 2)。进一步结合String软件分析45个基因所调控的蛋白相互作用关系,结果显示,主要以Irx2、Fox1、Pax7、Irx3、Hdc、Ret、Sim1等蛋白为主,而这些蛋白大多调控糖代谢、自身免疫、组织再生、炎症等,在脑部调控这些蛋白的表达,可以抑制脑部炎症、脑血管再生、促进损伤大脑的恢复,这些基因及蛋白可能是丹参多酚酸治疗糖尿病脑缺血/再灌注脑损伤的关键因子(Fig 6)。
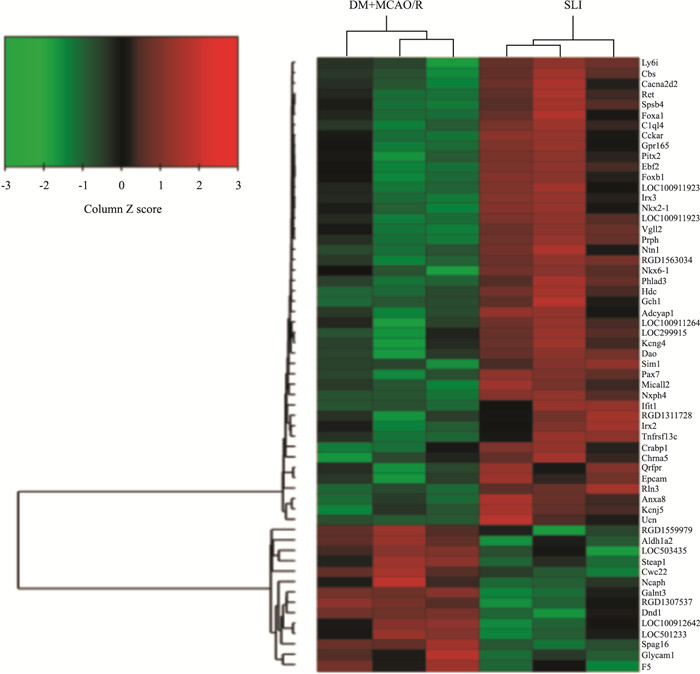
|
| Fig 4 Hierarchical cluster of genes differentially expressed between DM+MCAO/R and SLI samples(n=3) Red: high expression; Green: low expression |
|
| Fig 5 The differential gene interaction network |
| Biological pathway | Percentage | -log10(P-value) | Fold |
| Formation of fibrin clot(clotting cascade) | 39.10% | 19.503 535 45 | 228.1 |
| Intrinsic pathway | 26.10% | 13.577 391 82 | 278.9 |
| Extrinsic pathway | 17.40% | 11.109 755 3 | 668.9 |
| Complement cascade | 21.70% | 10.398 764 07 | 190.2 |
| Transport of gamma-carboxylated protein precursors from the endoplasmic reticulum to the Golgi apparatus | 17.40% | 9.964 657 747 | 418.4 |
| Gamma-carboxylation of protein precursors | 17.40% | 9.709 728 743 | 371.9 |
| Hemostasis | 39.10% | 9.623 417 946 | 20.1 |
| Removal of aminoterminal propeptides from gamma-carboxylated proteins | 17.40% | 9.488 223 499 | 334.8 |
| Gamma-carboxylation, transport, and amino-terminal cleavage of proteins | 17.40% | 9.116 524 615 | 279.0 |
| Activation of C3 and C5 | 13.00% | 8.825 500 286 | 835.7 |
| Post-translational modification: gamma carboxylation and hypusine formation | 17.40% | 8.811 382 772 | 239.2 |
|
| Fig 6 The protein-protein interaction network |
糖尿病是脑中风的独立危险因素,据统计,糖尿病人群脑血管病发病率为非糖尿病人群的4~5倍[9]。高血糖和糖尿病能够引起血管内皮细胞功能紊乱,增加血管通透性,加重脑缺血/再灌注损伤,预后较差[10]。糖尿病引起的脑部病变主要包括脑神经损伤及脑血管病变,研究表明,高血糖控制不良的患者在中风发生后神经功能损伤的程度加重,其机制可能与高血糖诱导的氧化应激及炎症反应有关。探讨糖尿病合并脑缺血发生的病理机制,研究药物对其治疗作用具有十分重要的价值。本研究探讨丹参多酚酸注射液对大鼠糖尿病局灶性脑缺血/再灌注损伤恢复期相关基因表达的影响,阐明其降低大脑梗死面积,改善神经功能,发挥脑保护的作用机制。
缺血性脑中风发病机制主要是各种原因造成的脑组织供血不足,从而导致局部脑组织缺血缺氧性坏死、软化,造成脑细胞损伤,严重者可致死,其病理机制大概有细胞内离子失衡、细胞酸性中毒、细胞内钙离子浓度增加、兴奋性神经递质毒性、花生四烯酸的产生、自由基和细胞因子分别介导的细胞毒性、血脑屏障的破坏、神经胶质细胞激活和炎症介质的释放等[11-14]。中医理论认为中风与风、痰、气、血的功能紊乱有关,血瘀贯穿于中风病发病的始终。利用现代血液流变学及影像学手段进行微观判断,更可证明血瘀证是造成中风的至关重要原因,而糖尿病合并脑中风发病初期以阴虚风动为主要症候,恢复期以气虚血瘀证为主,这与本研究所概述的丹参多酚酸治疗糖尿病中风恢复期与凝血止血机制相一致。
综上所述,注射用丹参多酚酸治疗糖尿病脑缺血/再灌注损伤是通过多种途径、作用于多个靶点而发挥药理作用,主要干预凝血止血、炎症、氧化应激、物质代谢、神经血管新生及信号传导等路径,达到治疗目的,这为后期研究注射用丹参多酚酸治疗糖尿病脑病的作用机制指明了方向。
( 致谢: 本实验分别在天津中医药大学天津市现代中药重点实验室和上海欧易生物医学科技有限公司完成,在此对各位老师的指导和帮助表示感谢。)
| [1] | Seshadri S A, Beiser M, Kelly-Hayes, et al. The lifetime risk of stroke: estimates from the Framingham Study[J]. Stroke, 2006, 37(2): 345-50. doi:10.1161/01.STR.0000199613.38911.b2 |
| [2] | Mazighi M, Amarenco P. Hyperglycemia: a predictor of poor prognosis in acute stroke[J]. Diabetes Metab, 2001, 27(6): 718-20. |
| [3] | Brownlee M. The pathobiology of diabetic complications: a unifying mechanism[J]. Diabetes, 2005, 54(6): 1615-25. doi:10.2337/diabetes.54.6.1615 |
| [4] | Zhuang P, Wan Y, Geng S, et al. Salvianolic acids for injection(SAFI) suppresses inflammatory responses in activated microglia to attenuate brain damage in focal cerebral ischemia[J]. J Ethnopharmacol, 2017, 198(2): 194-204. |
| [5] | He Q, Wang S, Liu X, et al. Salvianolate lyophilized injection promotes post-stroke functional recovery via the activation of VEGF and BDNF-TrkB-CREB signaling pathway[J]. Int J Clin Exp Med, 2015, 8(1): 108-22. |
| [6] | Chen X, Guo Y, Hu Y, et al. Quantitative analysis of highly similar salvianolic acids with 1H qNMR for quality control of traditional Chinese medicinal preparation Salvianolate Lyophilized Injection[J]. J Pharm Biomed Anal, 2016, 124(3): 281-7. |
| [7] | Fallahi F, Roghani M, Moghadami S. Citrus flavonoid naringenin improves aortic reactivity in streptozotocin-diabetic rats[J]. Indian J Pharmacol, 2012, 44(3): 382-6. doi:10.4103/0253-7613.96350 |
| [8] | Longa E Z, Weinstein P R, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. doi:10.1161/01.STR.20.1.84 |
| [9] | Bomont L, MacKenzie E T. Neuroprotection after focal cerebral ischaemia in hyperglycaemic and diabetic rats[J]. Neurosci Lett, 1995, 197(1): 53-6. doi:10.1016/0304-3940(95)11899-8 |
| [10] | Li W, Prakash R, Kelly-Cobbs A I, et al. Adaptive cerebral neovascularization in a model of type 2 diabetes: relevance to focal cerebral ischemia[J]. Diabetes, 2010, 59(1): 228-35. doi:10.2337/db09-0902 |
| [11] | 黄小平, 卢金冬, 丁煌, 等. 黄芪和三七的主要有效成分配伍对脑缺血/再灌注小鼠NF-κB信号通路及炎性因子表达的影响[J]. 中国药理学通报, 2015, 31(1): 141-6. Huang X P, Lu J D, Ding H, et al. Effects of main active component combinations between Astragalus and Panax notoginseng on NF-κB signaling pathway and expressions of inflammatory factors after cerebral ischemia-reperfusion in mice[J]. Chin Pharmacol Bull, 2015, 31(1): 141-6. |
| [12] | Halladin N L. Oxidative and inflammatory biomarkers of ischemia and reperfusion injuries[J]. Dan Med J, 2015, 62(4): B5054. |
| [13] | Yao Y, Chen L, Xiao J, et al. Chrysin protects against focal cerebral ischemia/reperfusion injury in mice through attenuation of oxidative stress and inflammation[J]. Int J Mol Sci, 2014, 15(11): 20913-26. doi:10.3390/ijms151120913 |
| [14] | Gouriou Y, Demaurex N, Bijlenga P, et al. Mitochondrial calcium handling during ischemia-induced cell death in neurons[J]. Biochimie, 2011, 93(12): 2060-7. doi:10.1016/j.biochi.2011.08.001 |

