


2. 雅安职业技术学院药学检验系,四川 雅安 625000;
3. 中药资源系统 研究与开发利用省部共建国家重点实验室培育基地,四川 成都 611137;
4. 成都第一制药有限公司,四川 成都 610031
2. Dept of Pharmacy and Examination, Ya'an Polytechnical Colledge, Ya'an Sichuan 625000, China;
3. State Key Lab Breeding Base of Systematic Research, Development and Utilization of Chinese Medicine Resources, Sichuan Province and Ministry of Science and Technology, Chengdu 611137, China;
4. Chengdu No.1 Pharmaceutical Co Ltd., Chengdu 610031, China
缺血性脑卒中是最常见的卒中类型,是由于脑部血液供应障碍,缺血、缺氧引起的局限性脑组织的缺血性坏死或脑软化。临床上该病具有发病率高、致残率高、死亡率高等特点。药物治疗是目前脑卒中的主要治疗方式之一,而其中溶栓治疗又是缺血性脑卒中急性期采取的最有效的措施之一。但是,由于溶栓治疗时间窗的限制(如病人就诊较晚、诊断延迟、或者医生未当机立断等)导致目前急性缺血性脑卒中作溶栓治疗的比例还很低。因此,需要积极探索更多行之有效的治疗脑卒中的药物。
近年来,莨菪烷类生物碱对抗脑缺血/再灌注的研究比较活跃[1-2],但是其抗缺血性脑卒中的分子机制尚未见报道。樟柳碱是从茄科植物唐古特山莨菪的根中所提取出的一种莨菪烷类生物碱,氢溴酸樟柳碱(anisodine hydrobromide,AH)为其氢溴酸盐。20世纪90年代,Xu等[3]就对其抗大鼠脑缺血/再灌注损伤进行了研究,结果显示,樟柳碱可使急性脑缺血/再灌注大鼠异常升高的前脑钙含量和伊文思蓝含量明显降低,减少脑组织水肿。基于目前的研究现状,本研究采用线栓法建立大鼠大脑中动脉阻塞(middle cerebral artery occlusion, MCAO)致脑缺血/再灌注损伤模型,拟从一般病理学形态、神经元存活情况、生化指标以及PI3K/Akt信号通路等方面来探索AH抗缺血性脑卒中的作用机制。
1 材料 1.1 实验动物与细胞SD大鼠,SPF级,♂,体质量(300±20) g,购自四川省中医药科学院实验动物中心,质量合格证号:SCXK(川)2013-19。大鼠肾上腺嗜铬细胞瘤细胞(pheochromocytoma cells,PC12 cells)购于江苏凯基生物技术股份有限公司。
1.2 药品与试剂原料药AH由成都第一药业有限公司提供,生产批号140903,使用时超纯水充分溶解并过0.22 μm微孔滤膜备用。尼莫地平(nimodipine,Nim)注射液,由拜耳医药保健有限公司广州分公司生产,批号BXGVZ71;丁苯酞(n-butylphthalide,NBP)氯化钠注射液,石药集团恩必普药业有限公司,批号:618160320;DMEM高糖培养基、DMEM无糖培养基(Gibco公司);小牛血清(浙江天杭生物科技有限公司);连二亚硫酸钠(分析纯,上海阿拉丁生化科技股份有限公司);水合氯醛(成都市科龙化工试剂厂,批号2015090602);脂质过氧化物(lipid peroxidation,LPO)测试盒(批号:20160413)、乳酸脱氢酶(lactate dehydrogenase, LDH)测定试剂盒(批号:20160413)、过氧化氢酶(catalase,CAT)测试盒(批号:20160414)、蛋白定量测试盒(批号:20160407),均购自南京建成生物工程研究所;兔抗Bcl-2抗体、Bax抗体、Akt抗体(Abcam公司);兔抗p-Akt抗体、caspase-3抗体(Cell Signaling公司);兔抗GAPDH抗体(博士德生物公司);鼠抗β-actin抗体、HRP标记山羊抗兔IgG、HRP标记山羊抗鼠IgG,均购自北京中杉金桥生物技术有限公司。
1.3 仪器Enspire多标记微孔板检测仪(珀金埃尔默新加坡有限公司);TDZ4A-WS台式低速离心机(湖南湘仪实验仪器开发有限公司);FA2004B型电子天平(上海越平科学仪器有限公司);EPED-E2-30TJ实验室级超纯水器(南京易普达科技发展有限公司);1384型超净工作台、3111型CO2培养箱(美国Thermo Fisher Scientific公司);BA400Digital数码三目摄像显微镜(麦克奥迪实业集团有限公司);GS-900校准型光密度计、电泳槽/电转移槽/电源(美国Bio-Rad公司)。
2 方法 2.1 大鼠MCAO模型的复制采用线栓法制备急性大鼠脑缺血/再灌注模型,具体方法在参考文献[4]方法的基础上加以改进:术前大鼠禁食12 h,自由饮水,手术过程中用10%水合氯醛0.3 g·kg-1腹腔注射麻醉。待大鼠翻正反射消失后,取仰卧位固定,剪去颈部被毛,消毒,正中切口。于气管左侧找到颈总动脉(common carotid artery,CCA),结扎CCA近心端、远心端被线,再分离颈外动脉(external carotid artery,ECA)和颈内动脉(internal carotid artery,ICA),结扎ECA,在ICA远端放置动脉夹,CCA切口,近心端距分叉处4 mm切口插入直径为0.285 mm、头端打磨光滑的鱼线,直视下进入颈内动脉,插入长度约为20 mm,完全阻断其对大脑中动脉的供血,固定栓线。缺血2 h后再灌注时,轻柔回抽鱼线约10 mm。术中和术后保持室温25℃左右,同时白炽灯照动物使其肛温维持在(37±1)℃,直到动物恢复活动。假手术组动物除不插入鱼线外,其余操作同模型动物。
2.2 动物分组与给药手术动物术后按照Longa等[4]的5分制评分标准进行分级评分:0分,无明显神经损伤症状;1分,不能完全伸展对侧前爪;2分,向对侧转圈;3分,向对侧倾倒;4分,不能自发行走,意识丧失。评分为1~3分者入选本次实验,其余评分动物剔除。本次实验造模成功率约50%,将复制成功的模型动物随机分为MCAO模型组,Nim组和AH 1.2、0.6、0.3、0.15 mg·kg-1 4个剂量组。再灌注时假手术组注射生理盐水,Nim组注射尼莫地平注射液1 mg·kg-1,AH各剂量组对应尾静脉注射AH 1.2、0.6、0.3、0.15 mg·kg-1,再灌注6 h同法进行第2次给药,共计给药2次。
2.3 PC12细胞的培养及氧糖剥夺再灌注(oxygen and glucose deprivation -reperfusion, OGD-R)模型的复制PC12细胞用含10%小牛血清的DMEM高糖培养基于37 ℃、5% CO2培养箱中进行培养。当显微镜下观察到细胞覆盖瓶底约达70%~80%时,用0.25%胰蛋白酶消化离心,完全培养基重悬,调节细胞浓度为2×108·L-1接种于60 cm培养皿中,设空白对照组(control group,control)、OGD-R组、NBP阳性对照组、AH 100、50、25 μmol·L-1组。于37 ℃、5% CO2培养箱中培养24 h,弃上清,用PBS清洗2次;除空白对照组加入无血清的高糖DMEM培养液2 mL外,其余各组加入含有8 mmol·L-1连二亚硫酸钠的无糖DMEM培养液2 mL,于37 ℃、5% CO2培养箱中孵育1 h,弃原液,用PBS清洗2次。空白对照组和模型组分别加入含10%小牛血清的高糖DMEM培养液2 mL,AH各组及阳性对照组分别加入培养基含终浓度分别为100、50、25 μmol·L-1 AH及130 μmol·L-1 NBP,复糖复氧2 h[5]。
2.4 大鼠脑组织苏木精伊红(HE)染色和尼氏染色实验结束后水合氯醛麻醉动物,断头处死,迅速选取缺血侧视交叉附近约1 mm厚度冠状切片脑组织,10%甲醛溶液固定,按照常规HE和尼氏染色实验步骤进行染色。HE染色脑组织病理评分按以下标准进行量化:光镜下未见病变评分为0分;光镜下若见小灶性灰、白质轻度水肿,细胞溶解,灶性少许细胞增生(增生细胞主要为胶质细胞),少许炎细胞浸润,轻度灰质萎缩等病理表现评分为1分;光镜下若见多灶性灰、白质水肿,细胞溶解、变性、坏死,灶性较多细胞增生(增生细胞主要为胶质细胞),较多炎细胞浸润等病理表现评分为2分;光镜下若见弥漫性灰、白质水肿,细胞溶解、变性、坏死,灶性大量细胞增生(增生细胞主要为胶质细胞),大量炎细胞浸润等病理表现评分为3分。尼氏染色每个脑组织均选取3个视野400倍镜下观察,计数神经元,每个视野计数后取均值作为该样本的细胞密度。
2.5 脑组织生化指标的测定实验结束后水合氯醛麻醉动物,断头处死,每只大鼠取缺血侧视交叉附近冠状切片脑组织约100 mg,按1 :9(W/V)加入冰冷生理盐水,制成10%的脑组织匀浆。将匀浆液3 000 r·min-1离心15 min,取上清液,-80℃超低温冰箱保存待测。按试剂盒说明书测定脑组织匀浆LDH、CAT活性以及LPO含量。
2.6 脑组织Bcl-2、Bax、caspase-3、p-Akt以及Akt蛋白表达的测定断头处死动物后,每组随机选取3只大鼠,取缺血侧半暗带附近固定解剖部位脑组织约50 mg,加入含蛋白酶抑制剂的蛋白裂解液(W :V=1 :10) 提取脑组织蛋白,用考马斯亮蓝法进行蛋白含量的测量。按10 μL蛋白样品/泳道上样,行SDS-PAGE电泳,然后电转至PVDF膜上,用脱脂奶粉封闭2 h,进行一抗孵育,用TBST洗膜,10 min × 3次,将PVDF膜放入稀释好的Bcl-2、Bax、caspase -3、p-Akt、Akt、β-actin及GAPDH (1:1 000稀释)一抗中,4 ℃封闭过夜;TBST洗膜3次后,将PVDF膜放入HRP标记的二抗中(1 :5 000),37℃孵育1 h;TBST洗膜后,暗室中加ECL发光液并进行曝光、显影、定影,利用BIO-RAD GS-900校准型光密度计扫描X线胶片,采用Image-lab图像处理软件分析实验结果。
2.7 PC12细胞Bcl-2、Bax、caspase-3、p-Akt以及Akt蛋白表达的测定药物作用结束后,收集细胞,蛋白裂解液裂解,测定蛋白含量,按20μL蛋白样品/泳道上样,其余操作同“2.6”。
2.8 统计学方法实验数据采用SPSS17.0统计软件包建立实验结果数据库并进行one-way ANOVA分析。以x±s表示各定量指标的平均值和分散程度。
3 结果 3.1 HE染色由Fig 1可见,假手术组动物脑皮层、白质区域层次清楚,细胞排列整齐有序,形态结构正常,染色清晰。与假手术组相比,模型组动物脑皮层白质区域细胞可见弥漫性不同程度的水肿,部分细胞变性、坏死,皮质颗粒层细胞排列紊乱,可见数量不等的胶质细胞增生,神经纤维排列紊乱,呈网状和条索状,病理评分明显增加(P < 0.01);与模型组相比,AH 0.15 mg·kg-1剂量组能明显减轻病理改变,评分明显降低(P < 0.01),AH其他剂量组与模型组比较也有降低病理评分的趋势(Tab 1)。
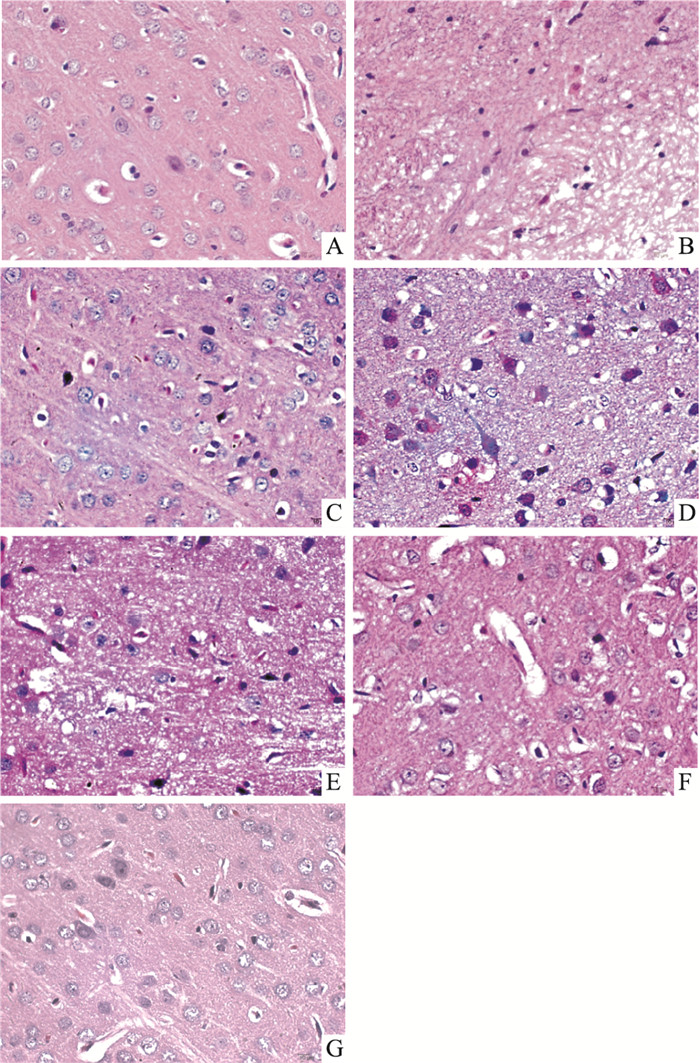
|
| Fig 1 HE staining of brain tissue in all groups (×400) A: Sham group; B: MCAO group; C: Nim group; D: AH 1.2 mg·kg-1 group; E: AH 0.6 mg·kg-1 group; F: AH 0.3 mg·kg-1 group; G: AH 0.15 mg·kg-1 group |
| Group | Dose/mg·kg-1 | Pathological score |
| Sham | - | 0.13±0.23 |
| MCAO | - | 2.50±0.53## |
| Nim | 1.0 | 1.56±1.27 |
| AH | 1.2 | 1.50±1.31 |
| 0.6 | 1.69±1.07 | |
| 0.3 | 1.94±1.05 | |
| 0.15 | 0.81±0.80** | |
| ##P < 0.01 vs sham; **P < 0.01 vs MCAO | ||
Fig 2结果显示,假手术组神经元细胞排列整齐致密,胞体较大,胞质蓝染,尼氏体丰富;模型组细胞排列疏松,核仁消失,出现空泡样变性,尼氏体明显减少,大量细胞脱失,存活细胞减少,与假手术组比较差异有显著性(P < 0.01);阳性药物Nim和AH 0.15 mg·kg-1可明显提高大鼠脑组织存活神经元数目(P < 0.05或P < 0.01);AH其他剂量组也表现出提高脑组织存活神经元数目的趋势(Tab 2)。
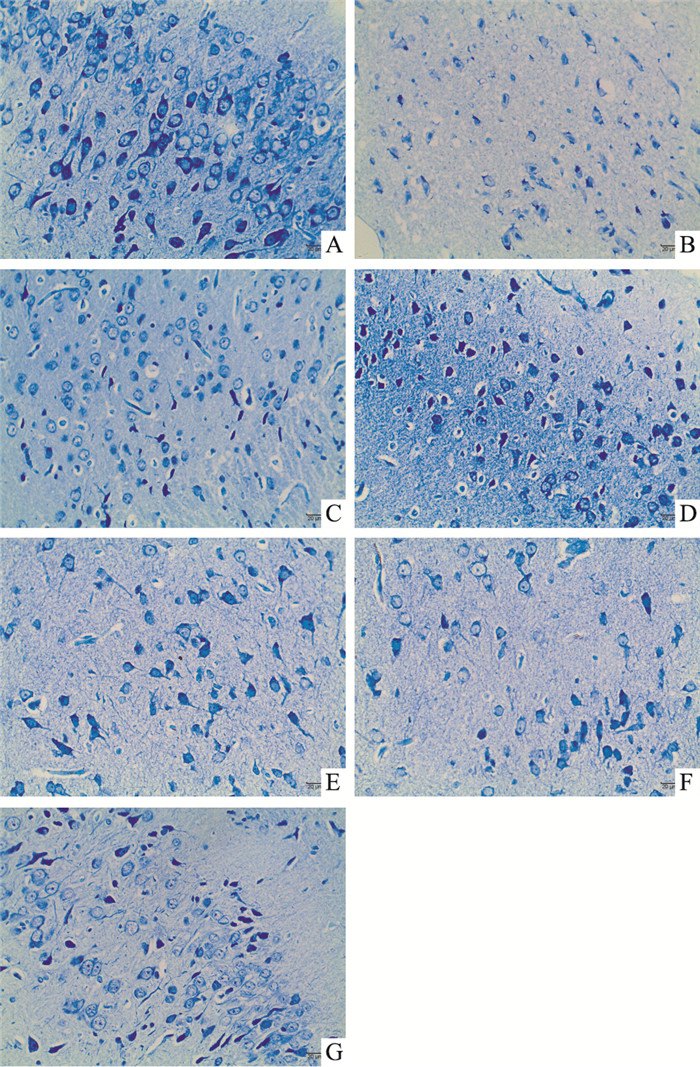
|
| Fig 2 Nissl staining of all groups(×400) A: Sham group; B: MCAO group; C: Nim group; D: AH 1.2 mg·kg-1 group; E: AH 0.6 mg·kg-1 group; F: AH 0.3 mg·kg-1 group; G: AH 0.15 mg·kg-1 group |
| Group | Dose/mg·kg-1 | Number of surviving neurons |
| Sham | - | 123.75±3.99 |
| MCAO | - | 60.63±1.69## |
| Nim | 1.0 | 66.63±6.76* |
| AH | 1.2 | 65.13±6.77 |
| 0.6 | 64.25±5.52 | |
| 0.3 | 64.63±3.74 | |
| 0.15 | 107.38±8.05** | |
| ##P < 0.01 vs sham;*P < 0.05,**P < 0.01 vs MCAO | ||
由Tab 3可知,与假手术组比较,模型组大鼠脑组织LPO含量明显增加(P < 0.05),CAT活性明显降低(P < 0.05),脑组织LDH活性明显增加(P < 0.05);AH 0.3 mg·kg-1剂量组能明显降低模型大鼠脑组织LPO含量和明显提升脑组织CAT含量,与模型组比较差异有显著性(P < 0.05或P < 0.01);AH 0.15 mg·kg-1剂量组能明显升高脑组织CAT含量,与模型组比较差异有显著性(P < 0.05)。AH 1.2 mg·kg-1剂量组能明显降低模型大鼠脑组织LDH含量,与模型组比较差异有显著性(P < 0.05)。
| Group | Dose/mg·kg-1 | LPO/μmol·g-1 Pro | CAT/kU·g-1 Pro | LDH/U·g-1 Pro |
| Sham | - | 0.8425±0.10762 | 130.06±23.09 | 10870.59±776.04 |
| MCAO | - | 1.0067±0.17978# | 94.71±8.25# | 12245.13±1418.95# |
| Nim | 1.0 | 0.8600±0.07290 | 95.95±32.34 | 10891.34±591.28* |
| AH | 1.2 | 0.9472±0.20415 | 100.29±55.91 | 11125.07±479.46* |
| 0.6 | 0.8895±0.12455 | 95.57±17.22 | 11903.82±1074.93 | |
| 0.3 | 0.8283±0.12178* | 138.42±19.94** | 11813.33±1108.90 | |
| 0.15 | 0.9743±0.17370 | 129.98±30.32* | 12078.62±1246.56 | |
| #P < 0.05 vs sham;*P < 0.05,**P < 0.01 vs MCAO | ||||
如Fig 3、Tab 4所示,模型动物脑组织Bax、Bcl-2、caspase-3及p-Akt的表达均明显升高,与假手术组比较差异有显著性(P < 0.01);与模型组相比,AH各剂量组均可明显降低Bax的表达(P < 0.01),与此同时AH各剂量组均可调高Bcl-2/Bax、p-Akt/Akt的比值(P < 0.05或P < 0.01);AH在0.3~1.2 mg·kg-1剂量下可明显提高Bcl-2的表达(P < 0.01),在0.3~0.6 mg·kg-1剂量下可明显降低caspase-3的表达(P < 0.05或P < 0.01)。
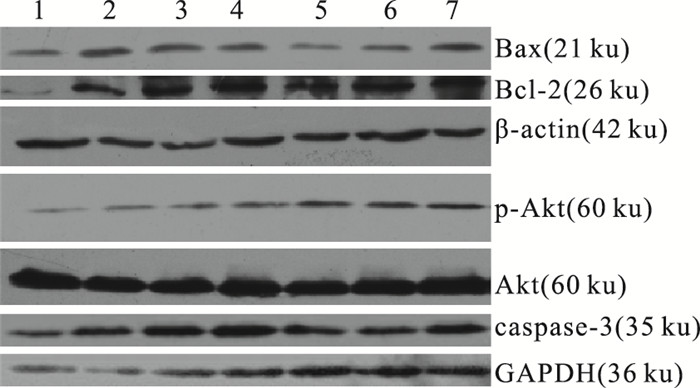
|
| Fig 3 Expression of Bax, Bcl-2, p-Akt, Akt and caspase-3 protein expression in all rats 1:Sham group; 2:MCAO group; 3:Nim group; 4:AH 1.2 mg·kg-1; 5: AH 0.6 mg·kg-1; 6:AH 0.3 mg·kg-1; 7:AH 0.15 mg·kg-1 |
| Group | Dose/mg·kg-1 | Bax/β-actin | Bcl-2/β-actin | Bcl-2/Bax | caspase-3/GAPDH | p-Akt/Akt |
| Sham | - | 0.2331±0.0191 | 0.0767±0.0051 | 0.3312±0.0465 | 0.2446±0.0078 | 0.0831±0.0053 |
| MCAO | - | 0.4518±0.0124## | 0.7383±0.0259## | 1.6353±0.0850## | 0.5948±0.0362## | 0.1060±0.0045## |
| Nim | 1.0 | 0.3350±0.0151** | 1.0927±0.0847** | 3.2720±0.3670 | 0.5869±0.0487 | 0.1271±0.0044** |
| AH | 1.2 | 0.2731±0.0115** | 1.7114±0.0855** | 6.2677±0.1288** | 0.6148±0.0885 | 0.1370±0.0010** |
| 0.6 | 0.1452±0.0114** | 0.9017±0.0931** | 6.2290±0.6796* | 0.4828±0.0175* | 0.1900±0.0057** | |
| 0.3 | 0.1613±0.0127** | 0.9676±0.0902** | 6.0089±0.5377* | 0.4241±0.0426** | 0.1647±0.0089** | |
| 0.15 | 0.2760±0.0082** | 0.7923±0.0559 | 2.8687±0.1172** | 0.6351±0.0316 | 0.1740±0.0069** | |
| ##P < 0.01 vs sham;*P < 0.05,**P < 0.01 vs MCAO | ||||||
如Fig 4、Tab 5所示,PC12细胞OGD-R后抗凋亡蛋白Bcl-2蛋白的表达有所提升,与空白对照组相比差异有显著性(P < 0.01),而促凋亡蛋白Bax及caspase-3的表达也有升高趋势;与模型组相比,AH各剂量组均可明显提高Bcl-2的表达(P < 0.01),也表现出降低Bax表达的趋势;AH在较低剂量25~50 μmol·L-1表现出降低caspase-3表达的趋势。同时,与空白对照组相比,模型组Bcl-2/Bax比值有明显提升(P < 0.05),而与模型组相比,AH各剂量组均可明显提高Bcl-2/Bax比值(P < 0.01);在PC12细胞OGD-R模型中,p-Akt表达水平明显降低(P < 0.01),与模型组相比,AH在50 μmol·L-1剂量下可明显提高p-Akt/Akt比值(P < 0.01)。
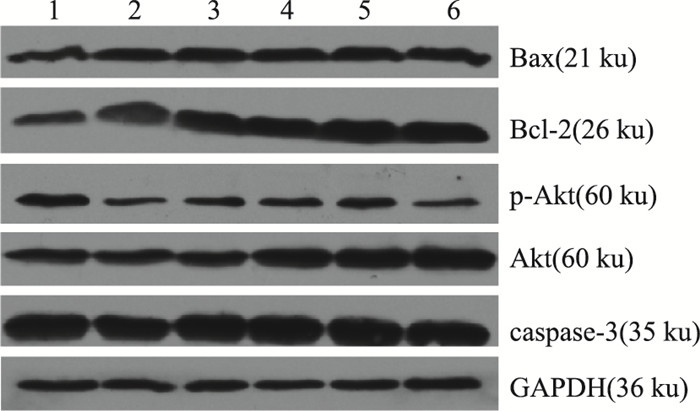
|
| Fig 4 Expression of Bax, Bcl-2, p-Akt, Akt and caspase-3 protein in PC12 cells 1:Contol group; 2: OGD-R group; 3: NBP group; 4: AH 100 μmol·L-1; 5: AH 50 μmol·L-1; 6: AH 25 μmol·L-1 |
| Group | Dose/μmol·L-1 | Bcl-2/ GAPDH | Bax/GAPDH | Bcl-2/Bax | caspase-3/GAPDH | p-Akt/Akt |
| Control | - | 0.3936±0.0173 | 1.3461±0.0303 | 0.7107±0.0472 | 4.2102±0.1272 | 0.7106±0.0704 |
| OGD-R | - | 0.7229±0.0223## | 2.5841±0.3714 | 0.8680±0.0546# | 4.8890±0.7458 | 0.1002±0.0394## |
| NBP | 130 | 1.3082±0.0159** | 2.4619±0.1417 | 1.2834±0.0852 | 5.0333±0.0845 | 0.2280±0.0624* |
| AH | 100 | 1.8691±0.0331** | 2.3704±0.4959 | 1.4508±0.0232** | 5.2882±1.1070 | 0.1156±0.0674 |
| 50 | 2.1073±0.0171** | 1.9521±0.6197 | 1.7679±0.0883** | 4.1430±1.2269 | 0.2801±0.0248** | |
| 25 | 1.6124±0.0420** | 1.4512±0.4739 | 1.7316±0.0806** | 2.8055±0.8352 | 0.1800±0.0770 | |
| #P < 0.05, ##P < 0.01 vs sham;*P < 0.05,**P < 0.01 vs MCAO | ||||||
缺血性脑卒中是脑卒中的主要类型,也是脑卒中死亡的首要原因,其高致残率为患者家庭和社会带来了沉重的负担。研究资料显示,缺血性脑卒中是由多因素、多环节损伤所致的动态复杂的疾病,其发病机制复杂,其公认的主要机制之一为氧化应激[6]。而报道显示,抗氧化损伤为莨菪烷类药物抗缺血/再灌注损伤的重要机制[7]。LPO在体内水平的高低反映了体内脂质过氧化反应的速率,CAT是机体内源性抗过氧化损伤的主要酶系[8]。本研究结果显示,模型动物脑组织CAT活性明显降低,LPO含量明显增加,而AH在较低剂量(0.3 mg·kg-1)以下,可明显提高MCAO大鼠脑组织CAT活性,减少LPO含量。LDH是脑血管疾病时脑组织损害最敏感的酶[9],本研究中模型动物LDH活性明显增加,AH在大剂量时(1.2 mg·kg-1)时能明显降低模型大鼠脑组织LDH活性,表明AH对抗缺血/再灌注损伤的作用机制与其抗自由基过氧化有关。
尼氏小体是神经元细胞质内的一种正常结构,它由大量平行排列的粗面内质网和夹杂其间的核糖核蛋白体组成,是细胞内的一种蛋白质合成装置,可作为观察神经元细胞功能状态的指标[10]。本研究中,模型动物大量神经元丢失,尼氏体明显减少, 氢溴酸各剂量组对神经元的存活情况都有一定程度的改善,尤以小剂量(0.15 mg·kg-1)效果明显。
Bcl-2、Bax基因是目前已知的在凋亡调控过程中功能相互对立的一对最重要的调控基因。研究资料显示,细胞内这两种对立蛋白的比率关系是决定细胞存亡的关键。当Bcl-2高表达时,对抗细胞凋亡,反之,细胞对死亡信号的反应性增强,启动凋亡。而caspase家族成员中的caspase-3在细胞凋亡过程中占据核心地位,被称为“死亡执行蛋白酶”[11]。本研究中,MCAO模型动物脑组织Bax、Bcl-2及caspase-3水平明显升高,AH各剂量组能明显降低促凋亡基因Bax及凋亡执行者caspase-3的表达,提升Bcl-2及Bcl-2/Bax水平,表明AH能对抗神经细胞凋亡。
PI3K/Akt信号转导通路是重要的细胞存活通路,其中发挥作用的是Akt。尽管目前的文献报道,动物脑缺血/再灌注模型和PC12细胞OGD-R模型中p-Akt的表达强弱较正常组尚存争议,但是p-Akt表达的增强可发挥抗凋亡作用是得到公认的[12-16]。激活的Akt可以通过磷酸化Bad、caspase-9、Forkhead、NF-κB、GSK-3β等抑制细胞凋亡[17-18]。本研究中,AH各剂量组均能明显提高MCAO大鼠p-Akt的表达,表明AH对抗细胞凋亡与激活Akt有关。
PC12细胞在神经细胞的保护及信号通路的研究中被广泛应用,而氧糖剥夺模型也是国际公认的研究脑缺血的经典模型[19]。本实验的体外研究中,AH能明显提高PC12细胞OGD-R模型Bcl-2及p-Akt的表达,同时能明显提高Bcl-2/Bax比率,在蛋白表达的调控上表现出了与动物实验相近的作用趋势。这也从另一个角度确证了提高p-Akt蛋白的表达是AH抗凋亡的作用机制之一。
综上所述,本研究结果显示,AH在不同剂量下均可对大脑缺血/再灌注损伤不同指标作出一定程度的改善。但是由于动物实验个体差异大,加之缺血性脑卒中发病机制复杂,在本研究所采取的各方面评价指标中,药物未显示出良好的量效关系,但是综合各方面指标分析,药物在较小剂量时疗效相对较好,这与早期Xu等[3]的报道基本吻合。本研究的不足之处为在PI3K/Akt信号通路中只研究了Akt的表达,缺乏对其下游或上游相关蛋白的进一步探讨,这些都是本课题下一步值得探讨的问题。
( 致谢: 本实验完成于成都中医药大学中药资源系统研究与开发利用省部共建国家重点实验室培育基地,实验过程中得到该实验室全体老师的指导及同学的协助,在此表示感谢。同时感谢成都第一制药有限公司给予本实验的大力支持。)
| [1] | 蒋崇慧, 杨光田, 汤彦. 山莨菪碱在大鼠脑缺血/再灌注时对神经元凋亡的影响[J]. 中国急救医学, 2001, 21(3): 131-3. Jiang C H, Yang G T, Tang Y. Influence of anisodamine on neuronal apoptosis after cerebral ischemia/reperfusion in the rats[J]. Chin J Crit Care Med, 2001, 21(3): 131-3. |
| [2] | 彭新琦, 可君. 三种莨菪类药物在大鼠急性前脑缺血及再灌注损伤中的作用[J]. 中国药理学报, 1992, 13(4): 357-8. Peng X Q, Ke J. Effect of 3 henbane drugs on acute forebrain ischemia and reperfusion injury in rats[J]. Acta Pharmacol Sin, 1992, 13(4): 357-8. |
| [3] | Xu W, Deng Y F. Effect of anisodine on acute forebrain ischemia-reperfusion damage in rats[J]. Acta Pharmacol Sin, 1996, 17(2): 161-3. |
| [4] | Longa E Z, Weinstein P R, Carlson S, et al. Reversible middle cerbral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. doi:10.1161/01.STR.20.1.84 |
| [5] | Zhang X Q, Eyzaguirre C. Effect of hypoxia induced by Na2S2O4 on intracellar calcium and resting potential of mouse glomus cell[J]. Brain Res, 1999, 818(1): 118-26. doi:10.1016/S0006-8993(98)01249-9 |
| [6] | 路畅, 杜肖, 贺晓丽, 等. 小续命汤有效成分组对局灶性脑缺血/再灌注大鼠恢复早期的神经保护作用研究[J]. 中国药理学通报, 2016, 32(7): 938-44. Lu C, Du X, He X L, et al. Neuroprotective effect of active components of Xiaoxuming decoction on focal cerebral ischemia /reperfusion injury in rats during early recovery period[J]. Chin Pharmacol Bull, 2016, 32(7): 938-44. |
| [7] | 陈群, 曾因明, 许鹏程, 等. 亚低温复合山莨菪碱对脑缺血/再灌注期间羟自由基产生的影响[J]. 中华麻醉学杂志, 1999, 19(8): 509. Chen Q, Zeng Y M, Xu P C, et al. The effects of hypothermia combined with anisodamine on the hydroxyl free radical during cerebral ischemia-reperfusion[J]. Chin J Anesthesiol, 1999, 19(8): 509. |
| [8] | Husain K, Whitworth C, Somani S M, et al. Carboplatin-induced oxidative stress in rat cochlea[J]. Hear Res, 2001, 159(1-2): 14. doi:10.1016/S0378-5955(01)00306-9 |
| [9] | 肖丽萍, 黄益兴. 急性脑梗死患者血清乳酸脱氢酶的测定及临床意义[J]. 脑与神经疾病杂志, 2000, 8(1): 54. Xiao L P, Huang Y X. The determination of serum lactate dehydrogenase and its clinical significance on patients with acute cerebral infarction[J]. J Brain Nerv Dis, 2000, 8(1): 54. |
| [10] | 季旭明, 车萍, 齐东梅, 等. 川芎嗪干预大鼠局灶性脑缺血模型神经元细胞凋亡的作用机制研究[J]. 中华中医药学刊, 2012, 30(11): 2461-3. Ji X M, Che P, Qi D M, et al. Study on the mechanisms of tetramethylpyrazine(TMP) resisting neural apoptosis in focal cerebral ischemia rats[J]. Chin Arch Tradit Chin Med, 2012, 30(11): 2461-3. |
| [11] | 董雅洁, 高维娟. Bcl-2、Bax、caspase-3在细胞凋亡中的作用及其关系[J]. 中国老年学杂志, 2012, 11(32): 4828-30. Dong Y J, Gao W J. The role and relationship of Bcl-2, Bax, caspase-3 in cell apoptosis[J]. Chin J Gerontol, 2012, 11(32): 4828-30. |
| [12] | Liang K, Ye Y, Wang Y, et al. Formononetin mediates neuroprotection against cerebral ischemia/reperfusion in rats via downregulation of the Bax/Bcl-2 ratio and upregulation PI3K/Akt signaling pathway[J]. J Neurol Sci, , 344(1-2): 100-4. doi:10.1016/j.jns.2014.06.033 |
| [13] | Xue X H, You Y M, Tao J, et al. Electro-acupuncture at points of Zusanli and Quchi exerts anti-apoptotic effect through the modulation of PI3K/Akt signaling pathway[J]. Neurosci Lett, 2014, 558: 14-9. doi:10.1016/j.neulet.2013.10.029 |
| [14] | Chen X H, Chen S Q, Jiang Y, et al. Minocycline reduces oxygen-glucose deprivation-induced PC12 cell cytotoxicity via matrix metalloproteinase-9, integrin β1 and phosphorylated Akt modulation[J]. Neurol Sci, 2013, 34(8): 1391-6. doi:10.1007/s10072-012-1246-z |
| [15] | Liu X M, Zhou X Y, Hou J C, et al. Ginsenoside Rd promotes neurogenesis in rat brain after transient focal cerebral ischemia via activation of PI3K/Akt pathway[J]. Acta Pharmacol Sin, 2015, 36(4): 421-8. doi:10.1038/aps.2014.156 |
| [16] | 王春燕, 黄萍, 张朕华. 3β-双水杨酰薯蓣皂苷元对脑缺血/再灌注损伤大鼠的梗死体积及PI3K/Akt信号通路的影响[J]. 中国药理学通报, 2013, 29(12): 1672-5. Wang C Y, Huang P, Zhang Z H. Effects of 3β-double salicyloyl diosgenin on infarct volume and PI3K/Akt signal path in rats with focal cerebral ischemia /reperfusion injury[J]. Chin Pharmacol Bull, 2013, 29(12): 1672-5. doi:10.3969/j.issn.1001-1978.2013.12.011 |
| [17] | 许艺超, 石松生. PI3K/Akt信号通路在脑缺血神经元凋亡中作用的研究进展[J]. 国际神经病学神经外科学杂志, 2012, 39(6): 530-3. Xu Y C, Shi S S. The research progress of PI3K/Akt signaling pathway in the neuron apoptosis of cerebral ischemia[J]. J Int Neurol Neurosurg, 2012, 39(6): 530-3. |
| [18] | Guo C, Yin Y, Duan J L, et al. Neuroprotective effect and underlying mechanism of sodium danshensu [3-(3, 4-dihydroxyphenyl) lactic acid from Radix and Rhizoma Salviae miltiorrhizae =Danshen] against cerebral ischemia and reperfusion injury in rats[J]. Phytomedicine, 2015, 22(2): 283-9. doi:10.1016/j.phymed.2014.12.001 |
| [19] | Vaudry D, Stork P J, Lazarovici P, et al. Signaling pathways for PC12 cell differentiation: makingthe right connections[J]. Science, 2002, 296(5573): 1648-9. doi:10.1126/science.1071552 |

