


2. 中山大学肿瘤防治中心药学部,广东 广州 510060;
3. 中山大学药学院,广东 广州 510006
2. Dept of Pharmacy, Cancer Center of Sun Yat-sen University, Guangzhou 510060, China;
3. School of Pharmaceutical Sciences, Sun Yat-sen University, Guangzhou 510006, China
受体相互作用蛋白140(receptor interacting protein 140,RIP140) 与过氧化物酶体增殖物受体γ共激活因子1α(PPARγ coactivator-1α,PGC-1α)为转录调控辅助因子,在能量代谢旺盛的心脏中,通过调控线粒体能量代谢途径的关键酶及基因的表达,调节心肌能量代谢平衡,维持心脏的正常形态及功能。代谢紊乱与炎症反应是心肌肥大、心力衰竭等心血管疾病发生发展的重要机制。越来越多的研究表明[1],心脏能量代谢紊乱与炎症反应密切相关,高脂饮食喂养的肥胖小鼠心脏表现糖代谢减少、炎症因子水平升高。心肌细胞中,激活核受体NF-κB可增加p65与PGC-1α的直接相互作用,抑制PDK4的表达,导致葡萄糖代谢的增加[2-3]。RIP140与PGC-1α共定位于细胞核中,在调控心肌能量代谢中有共同的下游靶基因,RIP140是否也与心肌NF-κB炎症通路密切相关,有待进一步证明。本研究通过心肌多点注射携带RIP140基因的腺病毒载体,诱导RIP140在心肌组织中的特异性过表达,探讨其对心脏功能及炎症通路的影响。
1 材料与方法 1.1 材料健康♂ SD大鼠,体质量220~250 g,购自中山大学药学院实验动物中心。腺病毒纯化试剂盒(美国,Clontech);发光液、核蛋白提取试剂盒、蛋白定量试剂盒(美国,Pierce);RIP140、p65、IκB-α抗体(英国,Abcam);α-tubulin、Histone H3(美国,Sigma);RIPA蛋白裂解液(南京碧云天生物技术有限公司);ELISA试剂盒(南京建成生物有限公司)。小动物呼吸机HX-300、BL-420S生物信号采集与分析软件(成都泰盟科技有限公司);MPX DU8超声心动图分析仪(意大利,Technos);蛋白电泳仪、电转仪、GEL DOC 2000成像系统、蛋白定量酶标仪(美国,BioRad);透射电镜(日本,JEM1400)。
1.2 腺病毒纯化携带RIP140基因的腺病毒(Ad-RIP140) 包装与出毒方法参照前期研究[4],收集裂解的细胞上清液对腺病毒进行纯化,严格按照Clontech腺病毒纯化试剂盒(Adeno-XTM Maxi purification kit)操作规程,收集感染Ad-RIP140和Ad-Null的细胞沉淀,用富含5%的FBS的DMEM培养基重悬,-80℃/37℃反复冻融3次,使细胞内的病毒颗粒完全释放,3 000 r·min-1离心5 min,将上清转移至一新的离心管中。加入5 μL Nuclease于37℃放置30 min,去除核酸,加入等体积1×Dilution buffer混匀后,用带0.45 μm滤膜的针头滤器过滤上述待纯化液体。用30 mL 1×Wash buffer清洗滤膜,卸下滤器,将其安装到一新的装有3 mL 1×Elution buffer的注射器管中,以3 mL·min-1的速率缓缓推出1 mL的1×Elution buffer,洗脱滤膜上的病毒颗粒,静置5 min后,再将余下的洗脱液缓慢推出。取洗脱稀释液,紫外分光光度法检测病毒DNA在260 nm处的吸光度,测定线粒体的病毒滴度。病毒滴度(VP/mL)=OD260×稀释度×1.1×1012。
1.3 心肌多点注射腺病毒载体220~250 g SPF级SD大鼠20只,用水合氯醛(320 mg·kg-1)麻醉后,固定在手术台上,经口腔直接行气管插管。剪除胸廓部位皮毛,碘伏消毒,斜向开口切开胸腔处皮肤,钝性分离胸大肌和前锯肌。将气管套管连接呼吸机(呼吸参数:潮气量,2.5 mL/100 kg;呼吸比,1 :1;呼吸频率,79次/min)以及标准Ⅱ导程导联。右手持弯镊于呼气时在3、4肋间撑开胸膜,挑破心包膜,用左手挤出心脏。准备好带1-gauge针头的注射器,吸取纯化好的腺病毒颗粒,参考并改良已发表的实验方法[9],向心室室壁多点注射100 μL腺病毒(Ad-RIP140:5×109 viral particles,Ad-Null:5×109 viral particles, 3-5 regions)。
1.4 超声心动图与血流动力学分析动物造模4周后乙醚麻醉,胸廓剃毛后,在心脏乳突肌水平进行2维短轴和M-型超声心动图成像检测,检测左室收缩末期内径(left ventricular end-systolic dimension, LVDs)、左室收缩末期室后壁厚度(left ventricular posterior wall end-systolic thickness, PWs)、左室射血分数(left ventricular ejection fraction, LVEF)以及左室缩短分数(left ventricular fraction shortening, LVFS)等心功能指标。实验后d 2,行血流动力学指标检测,操作如下:动物腹腔注射戊巴比妥钠(30 mg·kg-1)麻醉,颈正中切口分离出右颈动脉,连通压力传感器的聚乙烯导管插入该血管,并继续推进入升主动脉,连接生理记录仪连续记录血压5 min。导管继续推进感觉有突破感,此时进入左心室,通过生理分析软件分析计算左室收缩末期压(left ventricular systolic pressure,LVSP)、左室舒张末期压(left ventricular end-diastolic pressure,LVEDP)、左室内压最大上升和下降速率(maximum ascending and declining rate of left ventricular pressure,±dp/dtmax)等心功能参数。
1.5 免疫荧光法观察心脏组织RIP140过表达情况取造模7 d后的心脏组织冰冻切片,室温复温2 h。PBS清洗5 min×3次。1%的TritonX-100透膜10 min后,再用PBS清洗5 min×3次。山羊血清封闭1 h后,37℃下于湿盒内孵育RIP140一抗(稀释度1 :100)1 h。PBS清洗5 min×3次后,孵育相应的荧光二抗(1 :100)1 h。PBS清洗5 min×3次,DAPI复染细胞核10 min。再次清洗后甘油封片,激光共聚焦显微镜拍照。
1.6 ELISA与Western blot分析从-80℃取出保存的心肌组织,立刻置冰上,匀浆后分为两部分。一部分按照ELISA试剂盒测定心肌组织释放的炎症因子,另一部分用核蛋白试剂盒提取心肌细胞核蛋白,考马斯亮蓝定量后,分装50 μg蛋白留作上样。配置8%的分离胶和5%的浓缩胶,70 V分离30 min,于120 V电压继续电泳至溴酚蓝到达分离胶底部。220 mA恒流电转90 min,5%牛奶室温封闭1 h,然后加入GFP(1 :1 000稀释)、p65(1 :800稀释)、IκB-α(1 :1 000) 等抗体,4℃孵育过夜。二抗(1 :1 000) 室温孵育1 h,洗膜后于暗室下加入生物发光液显影、定影。采用GEL DOC 2000成像系统、Quantity one软件对条带进行灰度分析,以组蛋白Histone H3、tubulin分别作为核蛋白与胞质蛋白的内参对照。
1.7 统计学分析采用SPSS13.0统计软件对数据进行统计分析,结果用x±s表示。两均数比较用t检验。
2 结果 2.1 腺病毒介导RIP140基因在心肌组织中过表达验证由于包装的RIP140腺病毒自身携带GFP标签,借助免疫荧光技术验证外源基因是否导向心脏组织。如Fig 1所示,大鼠心室室壁多点注射携带RIP140的腺病毒载体7 d后,心脏组织冰冻切片后免疫荧光分析显示,大量散在绿色荧光分布在细胞内,说明腺病毒介导的RIP140基因可成功并特异性过表达于心脏。
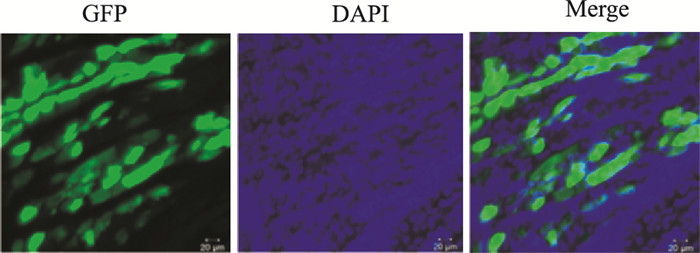
|
| Fig 1 Immunofluorescence detection for GFP tagged to Ad-RIP140 vector, confirming successful cardiac-specific overexpression of RIP140 7 days after injection(scale bar=20 μm) |
腺病毒载体介导RIP140在心肌组织中过表达4周后,借助超声心动图及血流动力学参数评估心脏功能。与对照组相比,过表达RIP140组大鼠心脏从外观上即可见明显心室扩张;HE染色结果表明心肌细胞肿胀、纤维化更为明显,并伴有炎症细胞浸润;超声心动图成像也提示心室内径扩大,收缩期室内径扩大更为明显(Fig 2)。Tab 1结果显示,尽管心脏舒张期内径(LVDd)、室壁厚度(PWs)、左室心室压上升速率(-dp/dtmax)较对照组有轻微改变,但差异无显著性(P>0.05)。心脏收缩期内径增大约25%(P<0.05),血流动力学参数也提示心室舒张压(LVEDP)明显增高、左室心室压上升速率明显下降(+dp/dtmax)(P<0.05)。此外,心脏射血分数值(EF%)与缩短分数(FS%)均明显下降(P<0.05),提示大鼠心脏过表达RIP140使得心输出量下降、心脏功能受损。
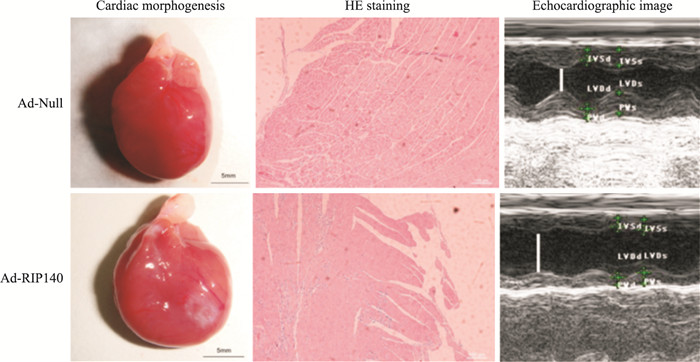
|
| Fig 2 Cardiac wall morphogenesis(scale bar=5 mm), HE staining(scale bar=100 μm) and echocardiographic image of heart injected with Ad-Null or Ad-RIP140 |
| Echocardiographic data | LVDd/mm | LVDs/mm | PWs/mm | EF/% | LVFS/% |
| Ad-Null | 6.36±0.40 | 4.05±0.63 | 2.09±0.12 | 80.88±6.31 | 42.31±6.12 |
| Ad-RIP140 | 6.73±0.31 | 5.01±0.45* | 1.99±0.12 | 68.19±9.44* | 35.39±4.37* |
| Hemodynamic data | LVEDP/mmHg | +dp/dtmax(mmHg/ms) | -dp/dtmax(mmHg/ms) | ||
| Ad-Null | 9.50±1.36 | 5.41±0.25 | 4.22±0.44 | ||
| Ad-RIP140 | 13.00±1.92* | 4.81±0.47* | 4.02±0.25 | ||
| LVDd:left ventricular end-diastolic dimension; LVDs: left ventricular end-systolic dimension; PWs: left ventricular posterior wall end-systolic thickness; EF: ejection fraction; FS: fraction shortening; LVEDP: left ventricle end-diastolic pressure; +dp/dtmax: maximum ascending rate of left ventricular pressure; -dp/dtmax: maximum declining rate of left ventricular pressure.*P < 0.05 vs Ad-Null group | |||||
炎症反应中,NF-κB是相当保守的蛋白,它调控着多个病理反应网络中的多个诱导因子和效应因子的表达。TNF-α、IL-1β等促炎症因子都是NF-κB的靶基因。心脏组织中过表达RIP140促进炎症因子的释放,与对照组相比,TNF-α、IL-2、IL-1β分别升高3.96、4.04、3.41倍(Tab 2,P<0.05)。与腺病毒空载Ad-Null注射组比较,过表达RIP140组心脏组织核蛋白p65含量明显增加(Fig 3A,P<0.01),IκB-α的含量下降(Fig 3B,P<0.05),提示心脏组织中过表达RIP140促发的炎症反应与NF-κB/p65通路激活相关。
| Group | TNF-α/ng·L-1 | IL-2/ng·L-1 | IL-1β/ng·L-1 |
| Ad-Null | 88.72±14.30 | 25.57±4.0 | 198.11±20.41 |
| Ad-RIP140 | 351.76±60.29* | 103.40±19.66* | 675.33±54.28* |
| *P < 0.05 vs Ad-Null group | |||
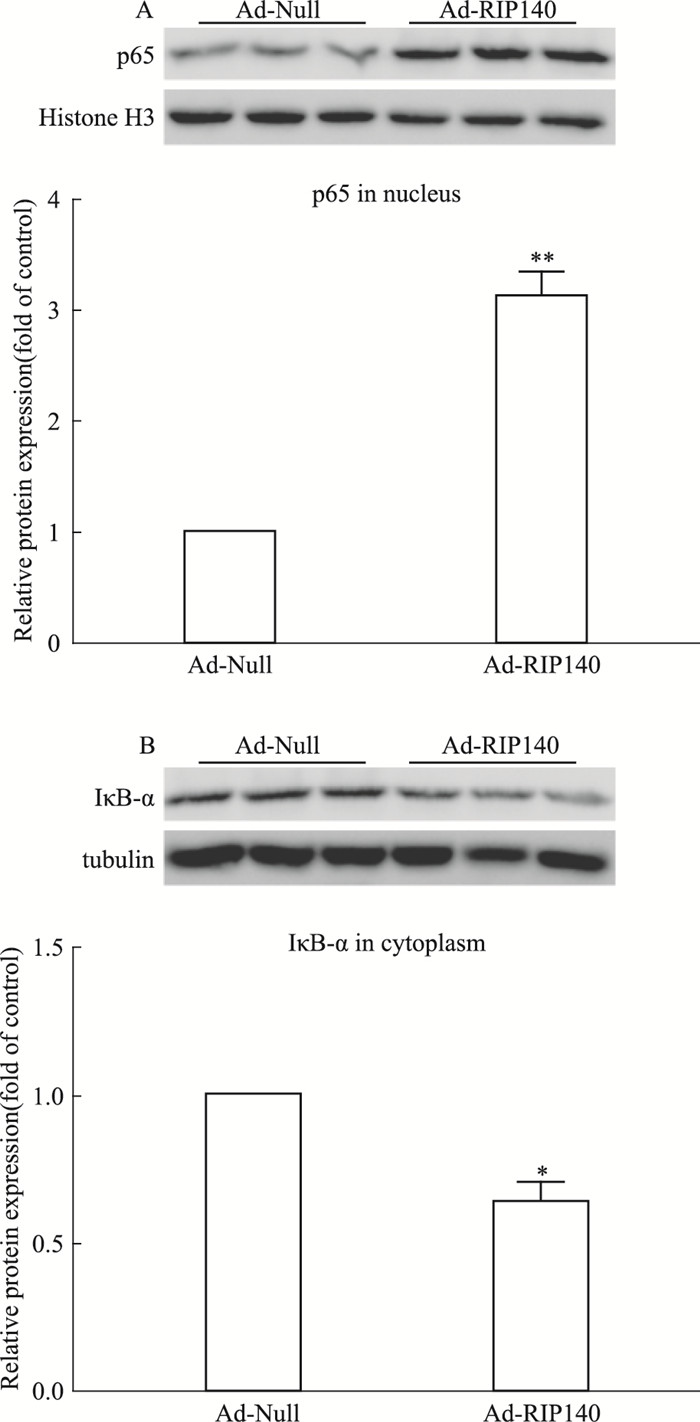
|
| Fig 3 Activated NF-κB/p65 signalingin rats with intro-myocardial RIP140 overexpression RIP140 induced p65 protein translocation into the nucleus(A) and IκB-α protein degradation in cytoplasm(B). *P < 0.05, **P < 0.01 vs Ad-Null group |
RIP140为转录辅抑制因子,在能量代谢旺盛的细胞和组织中通过抑制线粒体能量代谢相关基因、酶的表达,从而抑制葡萄糖和脂肪酸的摄入、氧化以及能量ATP的合成。巨噬细胞中RIP140促进NF-κB的转录活性,诱导促炎症细胞因子的表达与分泌[5-6],说明RIP140在转录调控方面具有双重作用,是调控能量代谢及炎症的双重开关。我们前期的研究也表明,乳鼠心肌细胞过表达RIP140可通过激活NF-κB通路,下调PPARs的表达,从而抑制CPT-1β、CPT-2、PDK4等代谢基因的表达、损伤线粒体结构,最终使得ATP生物合成减少[7]。本研究在前期心肌细胞水平的基础上,进一步借助腺病毒过表达载体,探讨心肌组织中特异性过表达RIP140对大鼠心脏炎症通路及心功能的影响。
转录因子NF-κB调控多种基因的表达,这些基因参与了炎症反应、免疫反应、细胞存活与凋亡等多种病理生理学效应。哺乳动物的NF-κB家族包括5个成员,分别是p65 (RelA)、RelB、c-Rel、p50/p105 (NF-κB1) 和p52/p100(NF-κB2)。NF-κB是由以上亚基组成的同源或异源二聚体,p65/p50是最常见的活性二聚体。静息情况下,抑制蛋白IκB(α、β、ε)与NF-κB相互结合,封锁后者的核定位序列,存在于胞质中。当细胞遇到外源性刺激时,通过IκB激酶使NF-κB抑制蛋白IκB-α发生磷酸化,进而由泛素化途径降解,NF-κB的核定位序列得以释放,进入细胞核内后与靶基因的κB位点结合,促进炎症因子的转录,诱发炎症和免疫反应[8]。本研究发现心脏组织过表达RIP140,促进炎症因子TNF-α、IL-2、IL-1β释放、诱导胞质组织IκB-α蛋白的降解及核蛋白p65的核转位、损伤心脏结构与功能。本研究在前期细胞水平上,进一步从动物整体水平上验证了RIP140与炎症反应之间的关系。腺病毒介导RIP140基因在心脏组织中的特异性过表达损伤心脏功能,激活NF-κB/p65炎症通路,促进炎症因子释放。
腺病毒介导外源基因RIP140在心肌组织中的特异性表达是本研究的特色与创新之处,虽然国外目前已有RIP140的转基因小鼠,但并非心脏特异性过表达RIP140的转基因小鼠。然而,转基因小鼠RIP140过表达往往早于所研究的疾病发生前,不利于观察在缺血、缺氧等疾病应激下,RIP140对疾病发展进程的动态影响。转基因小鼠中RIP140对其他代谢旺盛组织(如肌肉、脑、肝脏等组织)的作用势必会间接影响心脏。最后,转基因技术所需要的动物成本非常高。本研究我们成功借助前期收获的Ad-RIP140腺病毒,通过纯化将其多点注射在大鼠心脏室壁周围,7 d后取心脏组织切片免疫荧光验证了RIP140成功表达于心肌中。国外文献以及我们前期研究证实,腺病毒介导的外源基因可在心肌组织中持续高表达1月余[9-11]。尽管腺病毒载体只是瞬时表达的工具,本研究发现心肌多点注射Ad-RIP140载体4周后,大鼠心室扩张明显、射血分数值下降明显,充分说明腺病毒介导RIP140基因在心肌组织中的过表达足以损伤心脏功能。此外,通过控制注射的Ad-RIP140滴度,开展量效关系研究,为后续的分子机制研究奠定了可靠的基础。总之,已有的文献和我们前期的研究基础均验证了这种通过腺病毒携带蛋白过表达心脏组织中的特异性、安全性及可靠性,该项技术的创新为后续分子机制研究提供了更为经济、便利、可靠的途径。
( 致谢: 本研究的实验动物由中山大学动物中心提供,在中山大学药学院药理毒理实验室完成。)
| [1] | Ko H J, Zhang Z, Jung D Y, et al. Nutrient stress activates inflammation and reduces glucose metabolism by suppressing AMP-activated protein kinase in the heart[J]. Diabetes, 2009, 58(11): 2536-46. doi:10.2337/db08-1361 |
| [2] | Palomer X, Alvarez-Guardia D, Rodríguez-Calvo R, et al. TNF-alpha reduces PGC-1alpha expression through NF-kappaB and p38 MAPK leading to increased glucose oxidation in a human cardiac cell model[J]. Cardiovasc Res, 2009, 81(4): 703-12. doi:10.1093/cvr/cvn327 |
| [3] | Alvarez-Guardia D, Palomer X, Coll T, et al. The p65 subunit of NF-kappaB binds to PGC-1alpha, linking inflammation and metabolic disturbances in cardiac cells[J]. Cardiovasc Res, 2010, 87(3): 449-58. doi:10.1093/cvr/cvq080 |
| [4] | 陈艳芳, 王若伦, 刘培庆. RIP140重组腺病毒的构建及在乳鼠心肌细胞中的表达[J]. 中国药理学通报, 2016, 32(12): 1735-40. Chen Y F, Wang R L, Liu P Q. Construction of RIP140 recombinant adenovirus and its expression in nenonatal rat cardiaomyocytes[J]. Chin Pharmacol Bull, 2016, 32(12): 1735-40. doi:10.3969/j.issn.1001-1978.2016.12.019 |
| [5] | Ho P C, Tsui Y C, Feng X, et al. NF-κB-mediated degradation of the coactivator RIP140 regulates inflammatory responses and contributes to endotoxin tolerance[J]. Nat Immunol, 2012, 13(4): 379-86. doi:10.1038/ni.2238 |
| [6] | Zschiedrich I, Hardeland U, Krones-Herzig A, et al. Coactivator function of RIP140 for NF-kappaB/RelA-dependent cytokine gene expression[J]. Blood, 2008, 112(2): 264-76. doi:10.1182/blood-2007-11-121699 |
| [7] | Zhang L, Chen Y, Yue Z, et al. The p65 subunit of NF-κB involves in RIP140-mediated inflammatory and metabolic dysregulation in cardiomyocytes[J]. Arch Biochem Biophys, 2014, 554: 22-7. doi:10.1016/j.abb.2014.05.005 |
| [8] | Sun S C, Ley S C. New insights into NF-kappaB regulation and function[J]. Trends Immuno, 2008, 29(10): 469-78. doi:10.1016/j.it.2008.07.003 |
| [9] | Ding L, Dong L, Chen X, et al. Increased expression of integrin-linked kinase attenuates left ventricular remodeling and improves cardiac function after myocardial infarction[J]. Circulation, 2009, 120(9): 764-73. doi:10.1161/CIRCULATIONAHA.109.870725 |
| [10] | Guzman R J, Lemarchand P, Crystal R G, et al. Efficient gene transfer into myocardium by direct injection of adenovirus vectors[J]. Circ Res, 1993, 73(6): 1202-7. doi:10.1161/01.RES.73.6.1202 |
| [11] | Chen Y, Chen S, Yue Z, et al. Receptor-interacting protein 140 overexpression impairs cardiac mitochondrial function and accelerates the transition to heart failure in chronically infarcted rats[J]. Transl Res, 2017, 180: 91-102. doi:10.1016/j.trsl.2016.08.005 |

