


2. 江苏吴中苏药医药开发有限责任公司,江苏 南京 210009;
3. 广州品竞生物医药技术有限公司,广东 广州 510000
 ,
ZHU Jing-jing2,
XU Deng-qiu1,
XIE Yang-hui1,
WANG Chang-ling1,
WANG Hua3,
JIANG Zhen-zhou1,
LOU Feng-chang2,
WANG Tao1
,
ZHU Jing-jing2,
XU Deng-qiu1,
XIE Yang-hui1,
WANG Chang-ling1,
WANG Hua3,
JIANG Zhen-zhou1,
LOU Feng-chang2,
WANG Tao1

2. Jiangsu Wuzhong Su Medicine Development Co Ltd, Nanjing 210009, China;
3. Guangzhou Precision Biomedical Technology Co Ltd, Guangzhou 510000, China
中药山茱萸为山茱萸科植物山茱萸Cornus officinalis Sieb.et Zucc.的干燥成熟果实,其具有多种生物活性,如免疫调节[1]、降血糖[2]、抗心律失常[3]。本实验中所用的山茱萸总萜(terpenes from Cornus officinalis,TCF)由中药山茱萸经乙醇提取、大孔树脂纯化所得。本课题组在前期研究中,证明TCF对KKay小鼠、db/db小鼠均具有明显的降糖作用[4-5],尤其在中度2型糖尿病中降血糖程度更好,但其降糖途径尚不清楚。本实验通过建立STZ诱导SD大鼠胰岛素缺乏糖尿病模型,选用正常ICR小鼠和SD大鼠,考察TCF对葡萄糖体内吸收、利用的影响,以及降糖作用的可能途径,为临床使用TCF治疗糖尿病提供实验依据。
1 材料 1.1 药品与试剂山茱萸总萜(每克相当于43.5 g原药材),批号:110309,由江苏吴中苏药医药开发有限公司提供;盐酸二甲双胍片,批号:20101212,由北京中惠药业有限公司生产;参芪降糖颗粒,批号:1011712,由鲁南厚普制药有限公司生产;阿卡波糖片(拜糖苹),批号:124357,由拜耳医药保健有限公司(中国北京)生产;罗格列酮片(爱能),批号:100506,由成都恒瑞制药有限公司生产;格列吡嗪片,批号:A2110F03,由购于海南赞邦制药有限公司生产;葡萄糖,批号:080708,由广西梧州制药(集团)股份有限公司生产;链脲佐菌素(STZ,SB0130),批号:MC0304B0511M,由生工生物(上海)有限公司生产;葡萄糖、糖化血清蛋白、糖化血红蛋白检测试剂盒,均由威特曼生物科技(南京)有限公司生产;小鼠胰岛素(Ins)检测试剂盒(ELISA法),由上海依科赛生物制品有限公司生产。
1.2 动物SPF级SD大鼠,体质量(165±15) g;SPF级ICR小鼠,体质量(20±2) g,均160只,♀♂各半,均由上海西普尔-必凯实验动物有限公司提供,生产许可证号为SYXK(沪)2013-0016。动物均饲养于使用型屏障系统内[动物设施使用许可证号:SYXK(苏)2010-0004],空气洁净度10 000级,气流速度0.1~0.2 m·s-1,环境压差20~50 Pa,温度(20~25) ℃,湿度40%~70%,氨浓度≤14 mg·m-3,换气10~20次/h,动物照度15~20 lux,工作照度150~300 lux,噪音≤60 dB,昼夜明暗交替时间12 h/12 h,♀♂分开饲养,大鼠、小鼠每笼均5只。
1.3 仪器FEJ-200电子天平(0.1~200 g),福州富日衡之宝电子有限公司;BS210S精密电子天平(0.1 mg~10 g),德国赛多利斯(Sartorius);TDL80-2B台式离心机,上海安亭科学仪器厂;强生稳豪ONE TOUCH Ultra血糖仪及血糖试纸、Safire2多功能酶标仪,瑞士TECAN公司。
2 方法 2.1 剂量设置二甲双胍(Met):给予SD大鼠0.1 g·kg-1,给予ICR小鼠0.2g·kg-1;拜糖苹(Acar)0.10 g·kg-1;格列吡嗪(Glipizide)0.02 g·kg-1;罗格列酮(Rosiglitazone)0.02 g·kg-1;参芪降糖颗粒(根据体表面积换算人的最大使用量):给予SD大鼠1.0g·kg-1,ICR小鼠1.5 g·kg-1;TCF:给予SD大鼠高、中、低剂量0.10、0.05、0.025 g·kg-1;给予ICR小鼠高、中、低剂量0.20、0.10、0.05 g·kg-1。
2.2 分组SD大鼠适应饲养1周后,禁食16 h(过夜禁食,不禁水)后,尾静脉注射STZ 50 mg·kg-1,72 h后剪尾采血,采用血糖试纸测定血糖值,以血糖>12.0 mmol·L-1者为糖尿病模型大鼠。血糖值低于12.0 mmol·L-1者同法追加注射STZ 35 mg·kg-1。随机选10只健康SD大鼠为正常对照组(control,CON)。选取60只糖尿病造模成功的大鼠,分成6组,每组10只,一组设为模型组(Model),其余5组分别给予二甲双胍(Met)、参芪降糖颗粒(Shenqi)、TCF高、中、低剂量。
另选60只健康SD大鼠,分成6组,每组10只,一组设为正常对照组(control, CON),其余5组分别给予格列吡嗪、罗格列酮、TCF高、中、低剂量。
选择120只正常ICR小鼠,分成7组,一组设为正常对照组(control, CON),其余6组给予二甲双胍、拜糖苹、参芪降糖颗粒,TCF高、中、低剂量。除二甲双胍组和拜糖苹组每组10只外,其余各组均20只。
所有组别均♀♂各半,正常对照组和模型组以0.5%CMC-Na灌胃,受试药物组按上述剂量设置,采用0.5%CMC-Na研磨配制所需浓度药液,均按10 mL·kg-1等体积灌胃给药。将STZ诱导的SD大鼠糖尿病模型组别每天上午、下午各灌胃给药1次,连续给药4周;正常ICR小鼠及正常SD大鼠组每天灌胃给药1次,连续给药7 d。
2.3 检测指标 2.3.1 STZ诱导SD大鼠糖尿病模型指标测定每次给药前观察动物毛色、排便、排尿、自发活动等一般状况;给药前及给药期间每周各测定1次体重和空腹血糖,上午禁食2 h后,剪尾采血,用血糖试纸测定血糖;4周给药试验完毕,大鼠眼眶采血,肝素抗凝,取全血检测HbA1c,其余血液3500 r·min-1离心15 min,分离血清,测定GSP。
2.3.2 正常ICR小鼠的血糖和糖耐量测定血糖:各组小鼠按上述方案连续给药7 d,除拜糖苹组外,其余组末次给药后0.5、1、2、4 h后,每组10只小鼠(♀♂各半)剪尾采血,血糖试纸测定血糖值;糖耐量:各组小鼠按上述方案连续给药10 d(血糖测定实验后继续给药3 d),末次给药前禁食5 h,进行ip葡萄糖(2.5 g·kg-1)或ig淀粉(3.0 g·kg-1)小鼠糖耐量实验。其中葡萄糖耐量测定选取二甲双胍组,除拜糖苹组外的其他组各1/2动物;余下的动物用于进行淀粉糖耐量测定。测定给药后0、0.5、1、2 h时的血糖,根据血糖值绘制血糖-时间曲线,参考文献方法[6],按以下公式求算各组血糖-时间曲线下面积:AUC/mmol·h·L-1=0.25×BG0 h+0.5×BG0.5 h+0.75×BG1.0 h+0.5×BG2.0 h。
2.3.3 正常SD大鼠的糖耐量及胰岛素测定连续给药7 d后,末次给药前禁食5 h,各组大鼠ig给药后分别ip葡萄糖2.5 g·kg-1,给药后于0、0.5、1、2 h,剪尾采血,采用血糖试纸测定血糖含量,绘制糖耐量曲线;此外各时间点分别留取部分血样,离心分离血清,采用ELISA试剂盒测定各时间点胰岛素水平。
2.4 统计学方法采用Graphpad Prism6.0统计软件对数据进行处理。各组计量数据均以x±s表示,组间比较采用student-t检验考察显著性。
3 结果 3.1 对STZ诱导SD大鼠糖尿病模型的影响 3.1.1 一般状况观察结果与正常对照动物相比,STZ造模大鼠表现为明显的多饮、多尿,体重明显下降,大都出现精神萎靡,活动减少症状。
3.1.2 体重与正常对照动物相比,STZ模型大鼠自造模第2周起直至4周给药完毕,大鼠体重明显下降(P<0.01),各受试药物组对STZ模型大鼠体重下降趋势减缓,但均未见明显影响,见Tab 1。
| Group | Start value | 1 wk | 2 wks | 3 wks | 4 wks |
| Control | 204.8±25.5 | 210.7±21.0 | 238.8±29.2 | 258.8±32.3 | 283.3±34.1 |
| Model | 202.4±19.1 | 205.6±21.2 | 182.7±20.6** | 170.9±21.2** | 140.4±29.4** |
| Met | 205.1±18.2 | 206.7±22.4 | 184.9±30.3 | 176.4±33.1 | 167.1±26.1 |
| Shenqi | 204.8±20.6 | 204.8±21.0 | 199.6±33.5 | 190.8±36.1 | 168.0±27.8 |
| TCF-H | 206.6±14.3 | 210.6±22.9 | 197.0±34.0 | 197.2±47.3 | 180.2±45.8 |
| TCF-M | 209.2±16.6 | 208.5±25.9 | 196.1±32.0 | 196.0±45.3 | 167.2±39.7 |
| TCF-L | 208.6±20.5 | 197.2±29.7 | 189.1±30.5 | 183.1±40.8 | 166.4±37.8 |
| Control:SD rats; Model: STZ-induced diabetic rats; Met: STZ-induced diabetic rats treated with metformin 0.1 g·kg-1; Shenqi : STZ-induced diabetic rats treated with Shenqi 1.0 g·kg-1; TCF -H: STZ-induced diabetic rats treated with TCF 0.10 g·kg-1; TCF-M: STZ-induced diabetic rats treated with TCF 0.05 g·kg-1; TCF-L: STZ-induced diabetic rats treated with TCF 0.025 g·kg-1. **P<0.01 vs control | |||||
与正常对照动物相比,STZ模型大鼠自造模1周起,血糖水平即明显升高(P<0.01),二甲双胍0.10 g·kg-1可明显降低STZ模型大鼠血糖水平(P<0.01,P<0.05),TCF高剂量组对STZ模型大鼠高血糖水平也有部分改善作用,其中给药2~3周较为明显(P<0.05)。参芪降糖颗粒1.0 g·kg-1对STZ模型大鼠高血糖水平仅有部分改善作用,未达统计学明显差异,见Tab 2。
| Group | Start value | 1 wk | 2 wks | 3 wks | 4 wks |
| Control | 5.8±0.5 | 6.3±0.5 | 7.6±0.6 | 6.5±1.0 | 5.8±0.6 |
| Model | 17.1±2.5** | 18.3±3.2** | 26.9±3.3** | 20.1±7.9** | 25.3±4.4** |
| Met | 17.4±3.6 | 13.9±5.5# | 20.4±5.0## | 13.9±4.5# | 20.9±5.0# |
| Shenqi | 17.1±3.6 | 14.7±5.9 | 21.8±9.1 | 16.1±5.3 | 22.4±7.1 |
| TCF-H | 16.7±3.1 | 14.9±4.6 | 21.2±4.2## | 13.9±3.7# | 22.5±4.0 |
| TCF-M | 17.3±2.8 | 19.3±2.8 | 24.0±3.8 | 16.5±6.1 | 24.2±5.1 |
| TCF-L | 17.5±2.7 | 22.3±4.1 | 21.8±3.5## | 16.9±4.2 | 25.9±4.0 |
| **P<0.01 vs control;#P<0.05,##P<0.01 vs model | |||||
与正常对照动物相比,STZ模型大鼠HbA1c、GSP明显升高(P<0.01),二甲双胍0.1 g·kg-1可明显降低STZ模型大鼠HbA1c(P<0.05)、GSP(P<0.05) 水平,TCF 0.10 g·kg-1可明显降低STZ模型大鼠HbA1c(P<0.05)、GSP(P<0.05) 水平,其余各治疗组对HbA1c、GSP未见明显影响,见Fig 1。
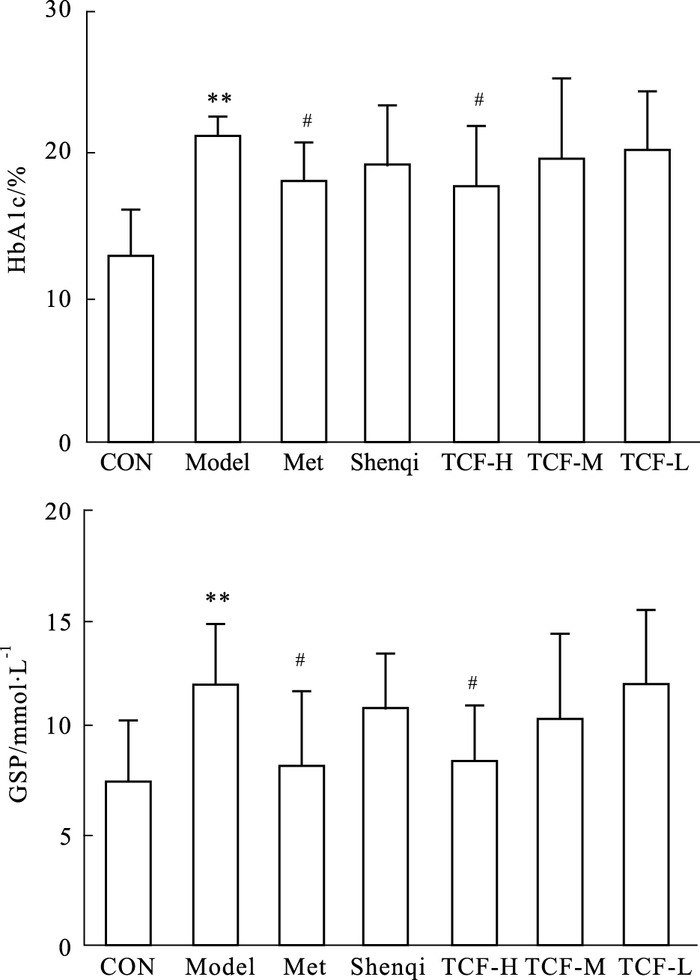
|
| Fig 1 Effects of TCF on HbA1c, GSP of STZ -induced diabetic rats (x±s, n=10) **P < 0.01 vs control; #P < 0.05 vs model |
各组连续给药7 d,末次给药后,二甲双胍0.2g·kg-1可明显降低2 h内的血糖水平(P<0.01),参芪降糖颗粒1.5g·kg-1和TCF高剂量组0.5、1 h血糖水平也有明显降低(P<0.05),但2 h和4 h无明显影响。TCF中、低剂量组给药4 h内对正常小鼠血糖影响较小,见Tab 3。
| Group | 0.5 h | 1 h | 2 h | 4 h |
| CON | 5.2±0.4 | 5.9±0.6 | 5.8±0.6 | 5.6±0.5 |
| Met | 3.6±0.7** | 4.5±0.6** | 5.0±0.3** | 5.2±0.7 |
| Shenqi | 4.5±0.7* | 5.1±0.9* | 5.2±0.7 | 5.3±0.7 |
| TCF-H | 4.4±0.8* | 5.1±0.7* | 5.0±1.0 | 5.4±0.4 |
| TCF-M | 4.8±0.5 | 5.4±0.7 | 5.3±0.7 | 5.1±0.6 |
| TCF-L | 4.9±0.5 | 5.4±0.6 | 5.5±0.7 | 5.4±0.7 |
| CON: ICR mice; Met: ICR mice treated with metformin 0.2 g·kg-1; Shenqi: ICR mice treated with Shenqi 1.5 g·kg-1; TCF-H: ICR mice treated with TCF 0.20 g·kg-1; TCF-M: ICR mice treated with TCF 0.10 g·kg-1; TCF-L: ICR mice treated with TCF 0.05 g·kg-1. *P<0.05, **P<0.01 vs control | ||||
与对照组相比,二甲双胍组和参芪降糖颗粒组明显降低ICR小鼠注射葡萄糖2 h内的血糖水平(P<0.01),其中二甲双胍降糖作用更明显。TCF高、低剂量组注射葡萄糖2 h内的血糖水平均明显降低(P<0.01),见Fig 2A。
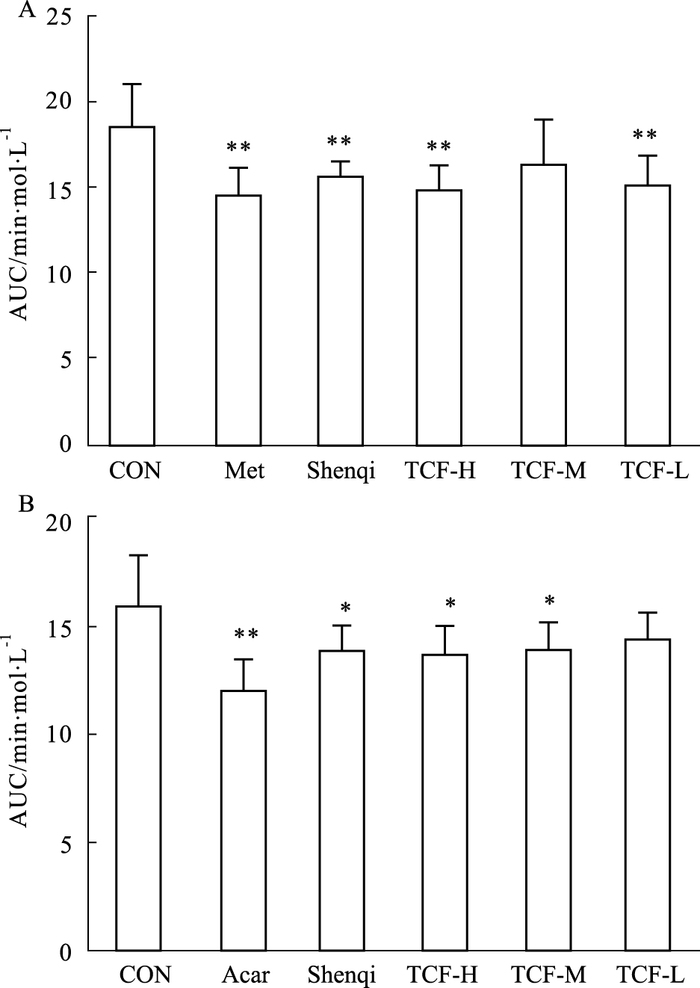
|
| Fig 2 Effects of TCF on area under curve (AUC) of blood glucose-time curve of ICR mice(x±s, n=10) A: Glucose tolerance test; B: Gavage starch tolerance. Acar:ICR mice treated with acarbose at 0.10 g·kg-1. *P < 0.05, **P < 0.01 vs control |
与对照组相比,拜糖苹组明显降低ICR小鼠灌胃淀粉2 h内的血糖水平(P<0.01),参芪降糖颗粒组与TCF高、中剂量组灌胃淀粉2 h内的血糖水平均明显低于对照组(P<0.05),见Fig 2B。
3.3 对SD大鼠糖耐量及胰岛素释放的影响 3.3.1 对腹腔注射葡萄糖后血糖水平的影响与对照组相比,格列吡嗪组可降低SD大鼠腹腔注射葡萄糖后2 h内的血糖水平, 但未达统计学明显差异。罗格列酮组与TCF高、中剂量组注射葡萄糖2 h内的血糖水平均明显降低(P<0.01),见Fig 3。
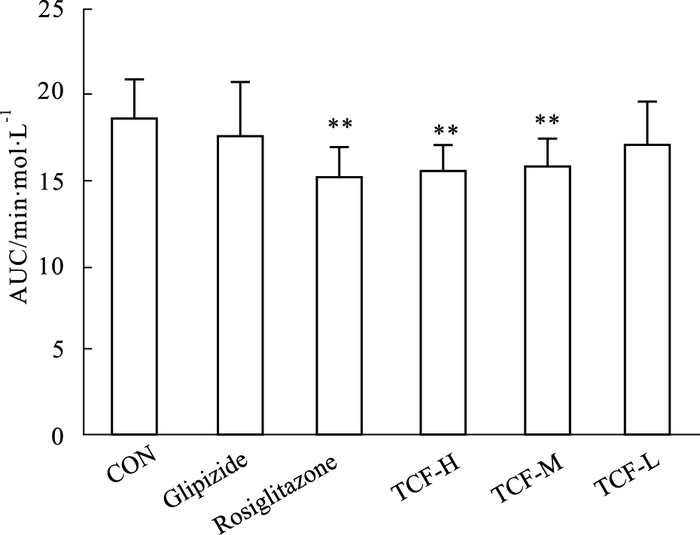
|
| Fig 3 Effects of TCF on AUC of blood glucose-time curve of SD rats(x±s, n=10) **P < 0.01 vs control |
与对照组相比,罗格列酮0.02 g·kg-1可明显降低大鼠腹腔注射葡萄糖后0.5、1 h的血清胰岛素水平(P<0.05),格列吡嗪0.02 g·kg-1可明显升高0.5 h血清胰岛素水平(P<0.05),1、2 h无明显影响。TCF高剂量组可明显降低0.5、1 h时间点血清胰岛素水平(P<0.05),2 h未见明显影响,TCF中、低剂量组对2 h内各时间点血清胰岛素水平均未见明显影响,见Tab 4。
| Group | 0 h | 0.5 h | 1 h | 2 h |
| CON | 1.6±0.2 | 6.3±1.4 | 8.2±0.8 | 6.4±0.9 |
| Glipizide | 1.7±0.3 | 7.6±1.3* | 8.1±1.0 | 6.9±0.7 |
| Rosiglitazone | 1.5±0.3 | 5.2±0.7* | 7.0±1.1* | 6.4±1.3 |
| TCF-H | 1.5±0.2 | 5.2±0.8* | 7.2±1.1* | 6.2±1.1 |
| TCF-M | 1.6±0.3 | 5.3±0.9 | 7.7±1.0 | 6.3±1.0 |
| TCF-L | 1.6±0.3 | 5.4±0.9 | 7.8±1.3 | 6.1±1.1 |
| CON: SD rats; Glipizide: SD rats treated with glipizide 0.02g·kg-1; Rosiglitazone: SD rats treated with rosiglitazone 0.02g·kg-1; TCF-H: SD rats treated with TCF 0.10 g·kg-1; TCF-M: SD rats treated with TCF 0.05 g·kg-1; TCF-L: SD rats treated with TCF 0.025 g·kg-1. *P<0.05 vs control | ||||
有研究表明山茱萸提取物能够降低STZ诱导的糖尿病大鼠血糖、血脂,预防糖尿病性肾病,是糖尿病及其并发症的潜在治疗剂[7]。根据文献报道,TCF主要单体成分降血糖相关作用的分子机制可能涉及以下几部分:(1) 抑制α-葡萄糖苷酶[8],减少糖类吸收,抑制餐后高血糖;(2) 抑制糖原磷酸化酶[9],减少葡萄糖动员;(3) 通过抑制蛋白酪氨酸磷酸酶1B(PTP1B),刺激葡萄糖的吸收,增强胰岛素受体磷酸化[10]。
考虑到TCF由多种天然成分组成,且中药成分大都具有多靶点的作用特点,因此,阐明其复杂的分子机制具有一定的难度和局限性。为此,在文献报道和已有作用机制研究基础上,本实验在研究方案设计时拟通过结合不同动物模型和阳性参比药物的药效作用综合分析,试图从以下几个方面进一步明确本品抗糖尿病作用途径和特点:(1) 不依赖于胰岛素的直接降糖作用;(2) 胰岛素增敏作用;(3) 抑制α-葡萄糖苷酶作用。
与正常对照动物相比,STZ造模大鼠表现为明显的多饮、多尿、体重明显下降,大都出现精神萎靡,活动减少症状。TCF高剂量组对STZ模型大鼠高血糖水平也有改善作用,其中给药2~3周较为明显。与正常对照动物相比,STZ模型大鼠HbA1c、GSP明显升高,二甲双胍0.1g·kg-1和TCF 0.10 g·kg-1可明显降低STZ模型大鼠HbA1c、GSP水平,其余各治疗组对HbA1c、GSP未见明显影响,提示TCF高剂量下对STZ诱导SD大鼠糖尿病模型高血糖和高血清HbA1c、GSP水平具有较明显的改善作用。此模型的原理是由于STZ破坏胰腺组织,造成体内胰岛素分泌量绝对不足,进而引起高血糖,而TCF高剂量下对此模型具有一定的降糖作用,提示本品可能具有部分不依赖于胰岛素的直接降糖作用。
α-葡萄糖苷酶抑制剂可减缓肠道内葡萄糖的吸收,降低餐后高血糖[11],有潜在预防糖尿病并发症的作用。有文献表明,山茱萸各萃取物均具有很好的α-葡萄糖苷酶抑制活性[8]。为了考察TCF对糖代谢的影响以及可能的作用途径,本试验分别测定了正常ICR小鼠腹腔注射葡萄糖耐量和灌胃淀粉糖耐量。TCF对ICR小鼠的糖耐量有明显的改善作用,可能与TCF具有一定的α-葡萄糖苷酶抑制作用相关。
格列酮类是一类新型口服抗糖尿病药物, 其抗糖尿病效应主要表现为增加靶组织对胰岛素的敏感性, 改善胰岛素抵抗[12]。张杰等[13]研究发现山茱萸提取物之一熊果酸能明显改善糖尿病大鼠的胰岛素敏感性。为了进一步考察TCF对葡萄糖体内吸收、利用的影响,本实验对正常SD大鼠进行了葡萄糖耐量和胰岛素水平的测定。实验结果显示,TCF降低正常动物糖耐量血糖和胰岛素释放作用的时效特征与罗格列酮较一致,而不同于格列吡嗪。但尚不能证明TCF具有胰岛素增敏作用。
综上,TCF在抑制葡萄糖体内吸收、促进葡萄糖利用等方面具有较明显的作用,可通过非胰岛素依赖途径发挥降糖作用,是否具有α-葡萄糖苷酶抑制、胰岛素增敏作用有待进一步验证。
(致谢: 本实验在中国药科大学新药筛选中心实验室、动物实验中心完成,在此对在实验过程中给予指导和帮助的老师及同学表示真挚的感谢! )
| [1] | Kim S H, Kim B K, Lee Y C. Effects of Corni fructus on ovalbumin-induced airway inflammation and airway hyper-responsiveness in a mouse model of allergic asthma[J]. J Inflamm (Lond), 2012, 9(1): 9. doi:10.1186/1476-9255-9-9 |
| [2] | Han Y, Jung H W, Park Y K. Selective therapeutic effect of Cornus officinalis fruits on the damage of different organs in STZ-induced diabetic rats[J]. Am J Chin Med, 2014, 42(5): 1169-82. doi:10.1142/S0192415X14500736 |
| [3] | Qi M Y, Liu H R, Dai D Z, et.al. Total triterpene acids, active ingredients from Fructus Corni, attenuate diabetic cardiomyopathy by normalizing ET pathway and expression of FKBP12.6 and SERCA2a in streptozotocin-rat[J]. J Pharm Pharmacol, 2008, 60(12): 1687-94. doi:10.1211/jpp.60.12.0016 |
| [4] | 刘薇, 朱晶晶, 徐志猛, 等. 山茱萸总萜对KKay糖尿病小鼠的治疗作用研究[J]. 药物评价研究, 2016, 39(6): 947-52. Liu W, Zhu J J, Xu Z M, et al. Effects of terpenes from Cornus Fructus on KKay diabetic mice[J]. Drug Eval Res, 2016, 39(6): 947-52. |
| [5] | 徐志猛, 朱晶晶, 江振洲, 等. 山茱萸总萜对db/db糖尿病小鼠的降血糖作用[J]. 中国药科大学学报, 2016, 47(3): 337-41. Xu Z M, Zhu J J, Jiang Z Z, et al. Hypoglycemic effects of terpenes from Fructus Corni on db/db diabetic mice[J]. J China Pharm Univ, 2016, 47(3): 337-41. doi:10.11665/j.issn.1000-5048.20160315 |
| [6] | Yang Z, Wang L, Zhang F, et al. Evaluating the antidiabetic effects of Chinese herbal medicine: Xiao-Ke-An in 3T3-L1 cells and KKAy mice using both conventional and holistic omics approaches[J]. BMC Complement Altern Med, 2015, 15: 272. doi:10.1186/s12906-015-0785-2 |
| [7] | Gao D, Li Q, Gao Z, et al. Antidiabetic effects of Corni Fructus extract in streptozotocin-induced diabetic rats[J]. Yonsei Med J, 2012, 53(4): 691-700. doi:10.3349/ymj.2012.53.4.691 |
| [8] | Park C H, Noh J S, Tanaka T. The effects of Corni Fructus extract and its fractions against α-glucosidase inhibitory activities in vitro and sucrose tolerance in normal rats[J]. Am J Chin Med, 2011, 39(2): 367-80. doi:10.1142/S0192415X11008889 |
| [9] | Chen J, Liu J, Zhang L, et al. Pentacyclic triterpenes. Part 3: Synthesis and biological evaluation of oleanolic acid derivatives as novel inhibitors of glycogen phosphorylase[J]. Bioorg Med Chem Lett, 2006, 16(11): 2915-9. doi:10.1016/j.bmcl.2006.03.009 |
| [10] | Zhang W, Hong D, Zhou Y, et al. Ursolic acid and its derivative inhibit protein tyrosine phosphatase 1B, enhancing insulin receptor phosphorylation and stimulating glucose uptake[J]. Biochim Biophys Acta, 2006, 1760(10): 1505-12. doi:10.1016/j.bbagen.2006.05.009 |
| [11] | 顾觉奋, 陈紫娟. α-葡萄糖苷酶抑制剂的研究及应用[J]. 药学进展, 2009, 33(2): 62-7. Gu J F, Chen Z J. The studies and applications of α-glucosidase inhibitors[J]. Prog Pharm Sci, 2009, 33(2): 62-7. |
| [12] | 罗谋伦, 郭欲晓, 胡映辉, 等. 罗格列酮的胰岛素增敏作用和胰岛素抵抗改善作用[J]. 中国药理学通报, 2000, 16(4): 425-8. Luo M L, Guo Y X, Hu Y H, et al. Insulin sensitizing effect and insulin resistance ameliorating effect of rosiglitazone[J]. Chin Pharmacol Bul, 2000, 16(4): 425-8. |
| [13] | 张杰, 吴淑艳, 王琳, 等. 熊果酸对高脂饮食诱导胰岛素抵抗大鼠脂质代谢的影响[J]. 中华中医药学刊, 2010, 28(5): 975-8. Zhang J, Wu S Y, Wang L, et al. Effects of ursolic acid on fat metabolism in high-fat-fed induced insulin resistance rats[J]. Chin Arch Tradit Chin Med, 2010, 28(5): 975-8. |