


脑胶质瘤是中枢神经系统最常见的原发肿瘤,约占颅内各类型肿瘤发生率的0.4~0.6。目前,治疗脑胶质瘤的主要手段是行肿瘤切除术,其次是放疗和化疗。由于肿块的不均一性、肿块与正常组织结合在一起无界限及胶质瘤细胞的高侵袭性,使得预后不良,术后易复发。因此,迫切需要探索新的观念和方法、新的分子靶点来治疗脑胶质瘤。
缝隙连接(gap junction, GJ)通道是相邻两细胞通过连接子两两对接而成,生理条件下,允许细胞间电流、离子、分子质量小于1.2 ku、直径小于10 nm的分子及第二信使物质通过[1]。Cx43是中枢神经系统表达最丰富的缝隙连接通道蛋白(connexins, Cxs),且主要分布在星型胶质细胞中。已有研究表明,Cx43是一种肿瘤抑制基因,可以扭转乳腺癌、神经胶质瘤细胞等癌细胞的表型转化。尽管Cx43表达水平的变化不是脑胶质瘤的始动因素,但Cx43表达水平与神经胶质瘤病理类型及恶性程度有关。Herrero-Gonzaález等[2]研究表明,Cx43能够抑制脑胶质瘤C6细胞中c-Src致癌活性,从而进一步降低C6细胞增殖率。此外,洪涛等[3]发现,转染Cx43 cDNA可明显抑制C6细胞增殖,且导致缝隙连接通讯功能(gap junctional intercellular communication, GJIC)增强。上述研究均证明Cx43参与肿瘤细胞增殖、迁移和黏附,所以Cx43成为治疗脑胶质瘤的一个潜在重要靶点。细胞因子能维持肿瘤细胞的快速生长,促进其播散转移,从而使肿瘤细胞不断增殖、转移侵袭入体正常组织。由于基因的突变,大部分肿瘤细胞都过表达EGF、IGF、PDGF等生长因子和其受体,这些因子的信号主要通过丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路传导到细胞核引起细胞过增殖反应。MAPK是一类重要的细胞内信息传递物质,参与细胞的增殖、分化和凋亡等生理、病理过程。大量的研究表明MAPK可将膜受体刺激信号传递入细胞核内靶部位,调节细胞基因转录和蛋白合成,它是许多胞外促细胞增殖信号传导通路的核心环节[4]。其中ERK1/2通路在生长因子相关的刺激引起的细胞增殖反应中起着重要的作用,而p38MAPK通路主要受紫外线、过氧化氢和促炎细胞因子等损伤性因素的激活和调节,参与应激反应[5]。Cx43对肿瘤细胞快速增殖的影响与MAPK信号通路是否密切相关尚不清楚,因此在前人研究的基础上,本实验通过转染Cx43cDNA介导C6细胞过表达Cx43,探讨C6细胞过表达Cx43与其增殖关系及可能的机制,为临床防治脑胶质瘤提供新的思路和策略。
1 材料与方法 1.1 材料大鼠C6细胞(中山大学生物实验中心卢慧敏博士后惠赠),pcDNA3.1质粒(南昌大学分子生物中心惠赠),pCMV-cx43cDNA重组质粒(本实验构建)。胎牛血清、DMEM、Lipofectamine 2000、G418(美国Gibco公司),MTT(北京天根公司),兔抗Cx43、p-Cx43、ERK1/2、p-ERK1/2、p38MAPK、p-p38MAPK、β-actin抗体(美国Santa Cruz公司),山羊抗兔IgG(北京康为世纪生物科技有限公司)、明胶(西安国安生物科技有限公司),其他试剂均为进口或国产分析纯。
1.2 方法 1.2.1 重组质粒及空载质粒转染C6细胞并筛选稳定细胞株 1.2.1.1 G418药物最优浓度筛选将细胞以1×106·L-1,接种到24孔板。接种后d 2按G418(0、50、100、200、400、800、1 000 mg·L-1)进行筛选。每3 d更换1次含相同浓度G418的新鲜培养基,观察细胞生长及死亡情况,以孔中细胞全部死亡的最低G418浓度为筛选剂量。本实验筛选出G418最优浓度为800 mg·L-1。
1.2.1.2 筛选稳转细胞株将细胞以5×107个·L-1接种到6孔板,培养24 h进行转染。配制溶液a:240 μL无血清培养基+10 μL Lipofectamine 2000,总体积250 μL,室温孵育5 min。溶液b:每孔加220 μL无血清培养基+30 μL质粒(130 mg·L-1),总体积250 μL。将溶液a与b充分混合,室温孵育20 min。将6孔板中的细胞用PBS冲洗2遍,加入2 mL无血清培养基,再加入溶液a与b的混合液500 μL,边加边摇动培养板混匀。6 h后,更换含体积分数为0.1 FBS的DMEM培养基培养48 h,更换含G418(800 mg·L-1)的DMEM培养液进行筛选。每隔3 d换用新鲜的含G418培养基,以替换含大量死细胞的培养基。待抗性细胞长满后,传代培养并冻存保种。
1.2.2 Western blot检测细胞内蛋白表达用BCA法进行总蛋白定量,在保证蛋白上样量一致的情况下,进行SDS-PAGE后,转移到PVDF膜上,用体积分数为0.05的脱脂牛奶室温封闭1 h,4℃孵育一抗过夜,以及室温孵育二抗1 h,使用ECL发光液在凝胶成像系统照相并记录,Image J软件分析条带灰度值。
1.2.3 细胞倍增时间测定收集各组细胞,经胰酶消化离心后,用含体积分数0.001的BSA DMEM培养液重悬细胞,以5×107个·L-1接种到6孔板,每组设5个复孔,放在体积分数0.05的CO2,37℃培养箱中培养。分别于培养24、48、72 h后胰酶消化离心,用体积分数0.001的BSA DMEM培养基重悬各组细胞,从每组细胞悬液中吸取20 μL滴入细胞计数板进行计数,并计算各组细胞倍增时间。细胞倍增时间计算公式为:Td=T×lg2/lg(N/N0)。Td:倍增时间、T:间隔时间、N:终点细胞数量、N0:初始细胞数量。
1.2.4 细胞的软琼脂集落培养实验收集各组细胞,胰酶消化后吹散成单细胞悬液,计数并调节细胞浓度为5×107·L-1。取6孔板,将体积分数0.012的琼脂糖(在65℃水浴中放置保持融化状态)与2×细胞培养基以1 :1的体积比混合制备成体积分数0.006的底层琼脂,每孔迅速加入1.4 mL,室温凝固。将体积分数0.006的琼脂糖与2×细胞培养基以1 :1的体积比混合,制备体积分数为0.003的上层琼脂,每孔加1 mL上层琼脂和100 μL单细胞悬液(约1 000个/孔),混匀,室温凝固。置于体积分数为0.05的CO2,37℃培养箱中培养2周。
1.2.5 MTT比色法测定细胞活性收集各组细胞,消化离心重悬,以3×106·L-1接种到96孔板,每组设5个复孔,放在体积分数为0.05的CO2,37℃培养箱中培养。分别于培养24、48、72 h后每孔分别加入20 μL MTT溶液(5 g·L-1,0.005 MTT),并继续培养4 h。取出96孔板,每孔加100 μL DMSO,轻轻震荡混匀,用全自动酶标仪在570 nm波长下测量光吸度值。
1.2.6 统计学处理采用SPSS17.0软件进行统计学处理,统计数据用x±s表示;方差齐时,计量资料采用单因素方差分析,多个样本均数两两比较采用SNK-q检验;方差不齐时采用秩和分析统计。
2 结果 2.1 Western blot检测重组质粒稳定转染C6细胞后Cx43蛋白表达水平采用Lipofectamine 2000将重组质粒稳定转染至C6细胞,Western blot检测Cx43表达水平。如Fig 1所示:C6-Cx43组与C6组相比,Cx43表达明显升高(P<0.01),C6-pCMV组与C6相比,差异无统计学意义(P>0.05),表明成功将重组质粒转入C6细胞并稳定表达Cx43。
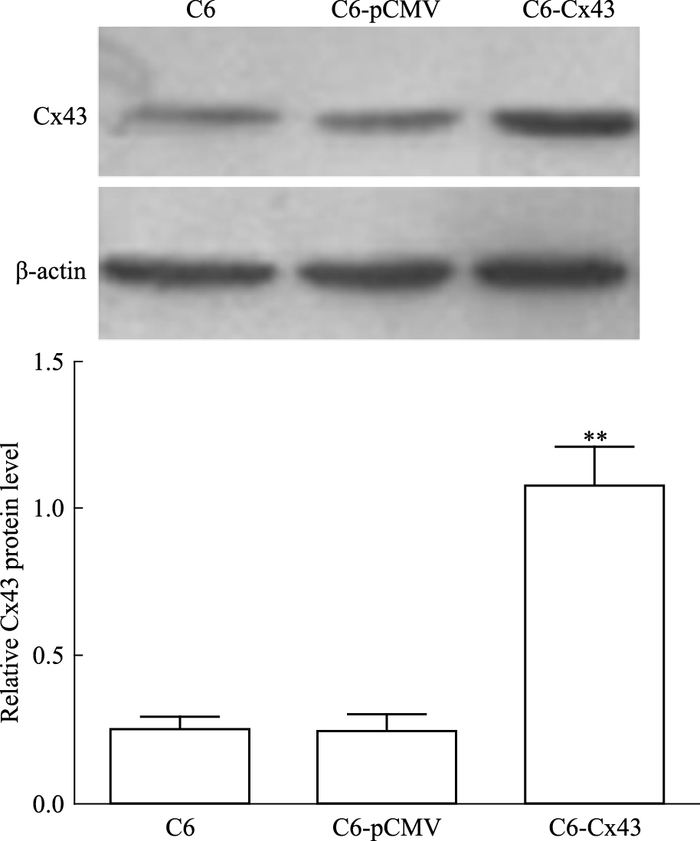
|
| Fig 1 Relative Cx43 protein level of each group **P < 0.01 vs C6 |
通过绘制细胞生长曲线,反映各组细胞增殖速度。经计算,3组细胞的倍增时间分别为28.5、29.4、70.3 h。如Fig 2所示,C6-Cx43组细胞倍增时间较C6组明显延长(P<0.01),而C6-pCMV与C6组细胞倍增时间差别不大,差异无统计学意义(P>0.05),提示Cx43蛋白过表达后C6细胞增殖速度明显减弱。
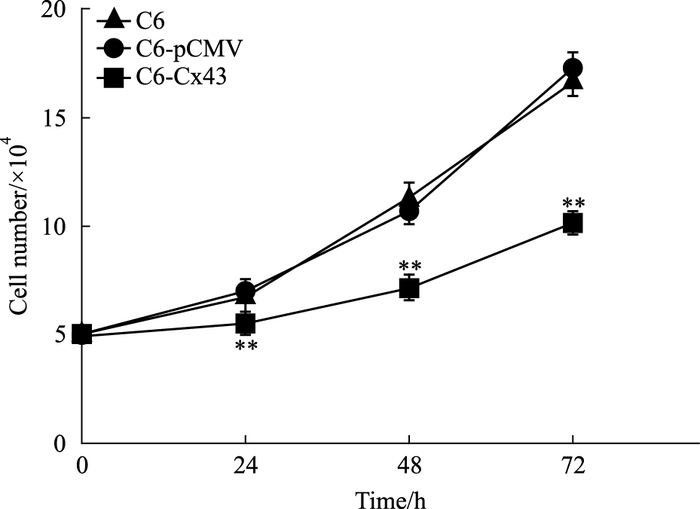
|
| Fig 2 The cell growth curve of each group **P < 0.01 vs C6 |
实验以肉眼可见的细胞团(含500个以上细胞)作为计数集落的标准。C6组、C6-pCMV组在含0.003的软琼脂培养基中生长良好,每个孔中可见有多个集落形成,集落数分别为(33±4)、(36±4),而C6-Cx43组集落数为(7±2)。如Fig 3所示,C6-Cx43组与C6组相比,软琼脂中的集落数明显减少(P<0.01);而C6-pCMV组与C6组相比集落数相当,差异无统计学意义(P>0.05)。提示过表达Cx43后C6细胞的恶性增殖程度降低。
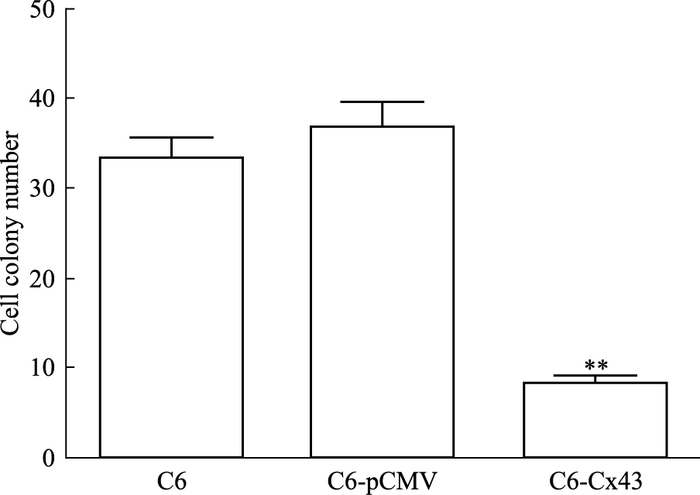
|
| Fig 3 The cell colony number of each group **P < 0.01 vs C6 |
各组细胞用ERK1/2阻断剂PD98059(30 μmol·L-1)处理2 h后收集细胞,提取总蛋白,检测各组细胞Cx43、p-Cx43、p-ERK1/2的表达情况。如Fig 4A所示,C6-Cx43 +PD98059组较C6-Cx43组Cx43蛋白表达增多(P<0.05),提示ERK1/2途径被阻断后,Cx43蛋白表达明显上调;C6-Cx43+PD98059组较C6-Cx43组p-Cx43蛋白表达减少(P<0.05),提示ERK1/2途径受阻断后,p-Cx43蛋白表达明显下调。如Fig 4B所示,C6-Cx43 +PD98059组较C6+PD98059组p-ERK1/2蛋白表达量明显下调(P<0.05),提示Cx43蛋白高表达降低了p-ERK1/2蛋白表达水平。
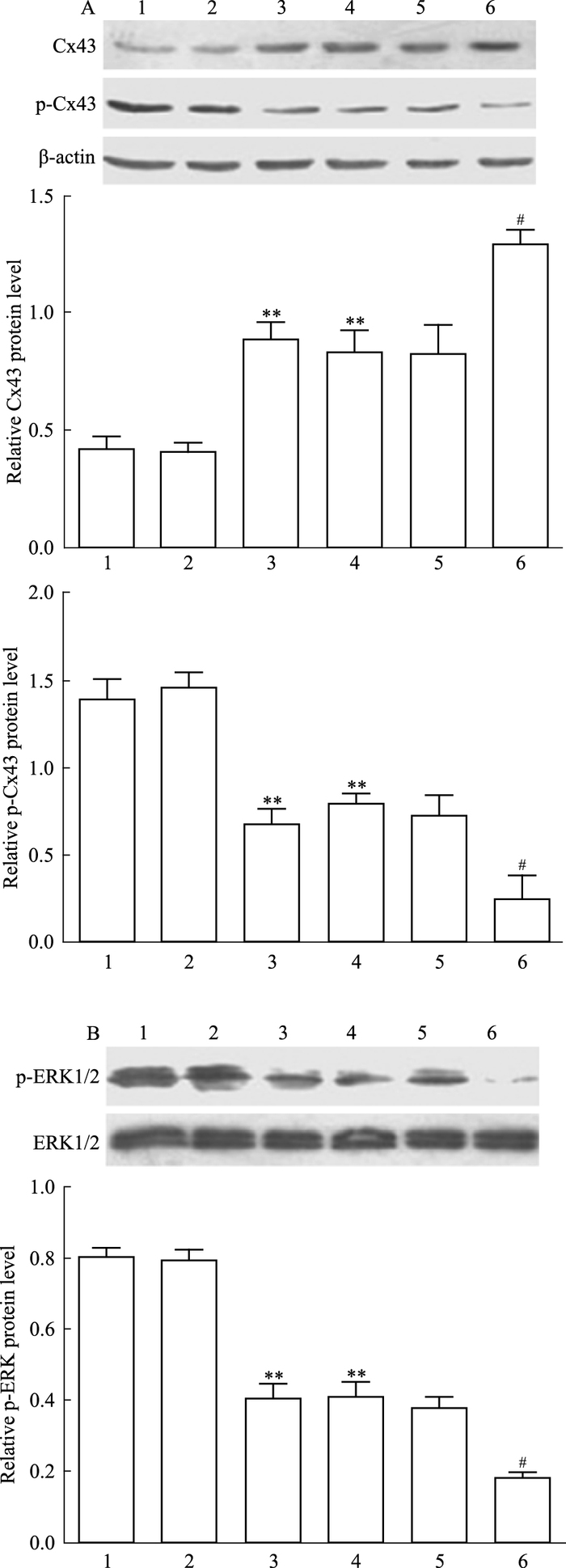
|
| Fig 4 Relative Cx43, p-Cx43(A) and p-ERK1/2(B) protein levels of each group 1:C6;2:C6-pCMV; 3:C6-Cx43;4:C6+PD98059;5:C6-pCMV+PD98059;6:C6-Cx43+PD98059.**P < 0.01 vs C6;#P < 0.05 vs C6-Cx43 |
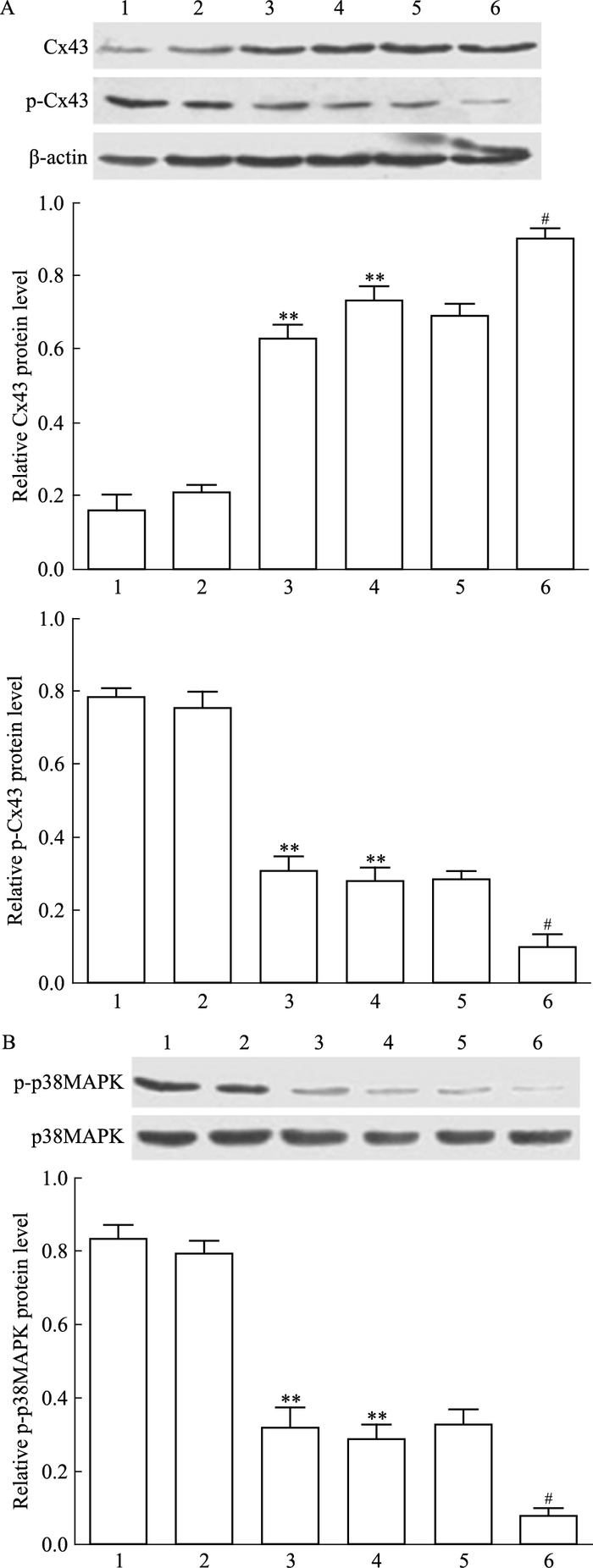
各组细胞用p38MAPK阻断剂SB202190(30 μmol·L-1)处理2 h后收集细胞,提取总蛋白,检测各组细胞Cx43、p-Cx43、p-p38MAPK的表达情况。如Fig 5A所示,C6-Cx43 +SB202190组较C6-Cx43组Cx43蛋白表达增多(P<0.05),提示p38MAPK途径被阻断后,Cx43蛋白表达明显上调;C6-Cx43 +SB202190组较C6-Cx43组p-Cx43蛋白表达减少(P<0.05),提示p38MAPK途径受阻断后,p-Cx43蛋白表达明显下调。如Fig 5B所示,C6-Cx43 +SB202190组比C6+SB202190组p-p38MAPK蛋白表达量明显下调(P<0.05),提示Cx43蛋白高表达明显降低了p-p38MAPK蛋白表达水平。
|
| Fig 5 Relative Cx43, p-Cx43(A) and p-p38MAPK(B) protein level of each group 1:C6;2:C6-pCMV; 3:C6-Cx43;4:C6+SB202190;5:C6-pCMV+SB202190;6:C6-Cx43+SB202190.**P < 0.01 vs C6;#P < 0.05 vs C6-Cx43 |
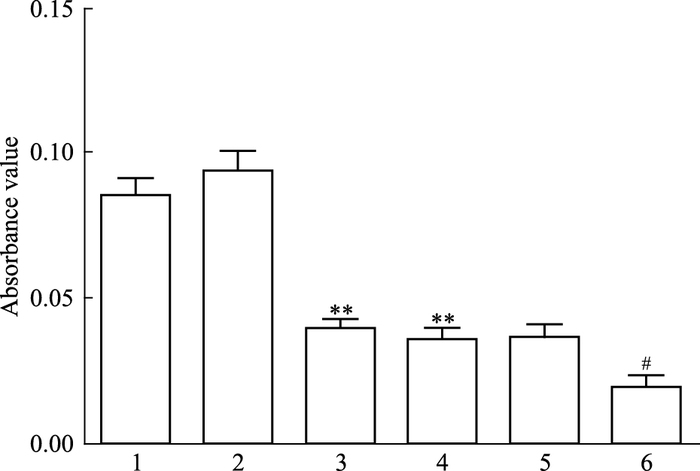
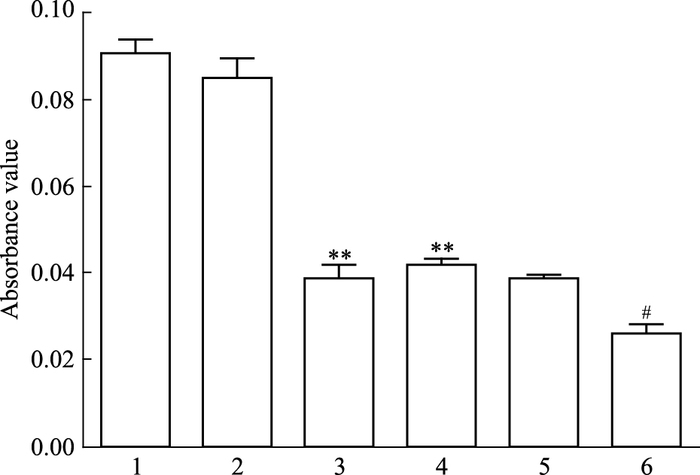
如Fig 6、7所示,C6-Cx43组较C6组吸光度值明显减少(P<0.01),提示Cx43蛋白过表达后C6细胞增殖能力明显下降;C6+PD98059组、C6+SB202190组较C6组吸光度值均明显减小(P<0.01),C6-Cx43+PD98059组、C6-Cx43+SB202190组较C6-Cx43组吸光度值均明显减小(P<0.05),提示经ERK1/2、p38MAPK阻断剂处理后C6细胞增殖能力明显下降。
|
| Fig 6 The absorbance values of each group 1:C6;2:C6-pCMV; 3:C6-Cx43;4:C6+PD98059;5:C6-pCMV+PD98059;6:C6-Cx43+PD98059.**P < 0.01 vs C6;#P < 0.05 vs C6-Cx43 |
|
| Fig 7 The absorbance values of each group 1:C6;2:C6-pCMV; 3:C6-Cx43;4:C6+SB202190;5:C6-pCMV+SB202190;6:C6-Cx43+SB202190.**P < 0.01 vs C6;#P < 0.05 vs C6-Cx43 |
GJIC与肿瘤密切相关,多数肿瘤细胞中发现Cxs突变、表达或胞内定位改变,GJIC能力降低或丧失[6]。Cx43作为构成GJIC的重要组成部分,在很大程度上调控着GJIC的功能。有研究者指出,脑胶质瘤恶性程度越高,GJIC功能越弱,Cx43表达越少[7]。将Cx43转染于人脑胶质瘤细胞U251和T98G,细胞增殖明显受到抑制,由此推测,Cx43可能是一种抑癌基因[8]。之后有许多研究都表明,Cxs能够抑制肿瘤细胞增殖,并把它视为一个抑癌基因家族,且Cxs可通过多种途径抑制肿瘤的增殖。MAPK信号通路对Cx43的调节近年来已成为一研究热点,其中ERK1/2、p38MAPK这两条通路已被证实可以调节Cx43的表达。ERK1/2和其他的一些激酶能促使缝隙连接蛋白Cxs磷酸化,从而调控缝隙连接通道的开合,同时它还能诱导Cx43的内吞作用。致癌物质通过激活细胞中ERK1/2通道,使细胞在早期核小体中滞留Cx43使得肿瘤细胞中Cx43蛋白的表达量减少,进而导致GJIC功能下降[9],该研究结果提示,化学物质激活MAPK信号转导通路并使得抑癌基因Cx43的功能受到抑制,导致细胞生长失控,肿瘤细胞增殖[10]。p38MAPK同样为MAPK家族中的重要成员,是调节细胞内生理和病理功能的主要信号通道,通过由Cx43蛋白组成的GJ,与胞内其他信号物质协同调节ATP的释放[11]。肿瘤细胞间缝隙连接通讯的减少和细胞膜通透性的增加也受到p38MAPK活性的调节[12]。有实验证明,Cx43的磷酸化导致GJIC功能减弱,p38MAPK的激活也会导致GJIC的减少。Cx43的磷酸化激活可能导致Cx43蛋白的损耗,而这些损失可能就是细胞间缝隙连接减少和GJIC减少的原因[13]。Cx43的高度磷酸化和Cx43表达的减少导致细胞间通讯的减少,Cx43的高度磷酸化部分原因是受到p38MAPK下游的两个直接靶点Ser279和Ser282位点的调节,相反,p38MAPK活性的抑制使Cx43的磷酸化减少[14]。同时p38MAPK的活性的抑制也能导致缝隙连接蛋白ATP释放通道的开放和诱导巨噬细胞死亡。在肿瘤细胞中p38MAPK介导肿瘤细胞有选择性的迁移,而这种效应是通过Cx43来调节的[15]。
本实验从基因水平上调Cx43表达,观察大鼠脑胶质瘤细胞C6增殖能力的变化。应用脂质体将Cx43重组质粒转染于C6细胞并用G418筛选,得到C6-Cx43稳定转染细胞株,同时以转染空质粒组为阴性对照组。通过体外培养测定细胞倍增时间发现C6-Cx43组细胞增殖速度明显降低,软琼脂集落培养实验发现C6-Cx43组细胞恶性增殖程度减弱;ERK1/2、p38MAPK阻断剂处理后Western blot检测发现C6细胞Cx43表达升高,p-Cx43表达降低;MTT法检测细胞活性发现,ERK1/2、p38MAPK阻断剂处理后C6细胞增殖能力减弱。综上所述,本实验提示Cx43蛋白可能通过ERK1/2、p38MAPK通路抑制脑胶质瘤C6细胞的增殖。
Cx43抑制肿瘤细胞增殖,可能存在多种机制相互作用。我们研究的MAPK信号通路,从信号转导的角度证明了Cx43可以对细胞的增殖产生影响,是Cx43作为抑癌因子抑制肿瘤细胞增殖的机制之一,为临床研究抗肿瘤药物提供新的途径和靶点,为Cx43的临床应用奠定坚实的理论基础。
| [1] | 彭力超, 梁尚栋. 缝隙连接与神经病理性痛的研究进展[J]. 中国药理学通报, 2015, 31(2): 157-62. Peng L C, Liang S D. Recent research progress on the role of gap junction in neuropathic pain[J]. Chin Pharmacol Bull, 2015, 31(2): 157-62. |
| [2] | Herrero-gonzález S, Gangoso E, Giaume C, et al. Connexin43 inhibits the oncogenic activity of c-Src in C6 glioma cells[J]. Oncogene, 2010, 29(42): 5712-23. doi:10.1038/onc.2010.299 |
| [3] | 洪涛, 何安慰, 卢明巍, 等. 转染Cx43cDNA对胶质瘤细胞生长影响的观察[J]. 中国神经肿瘤杂志, 2006, 4(2): 134-8. Hong T, He A W, Lu M W, et al. Effect of Cx43 cDNA transfection on the growth of glioma cells[J]. Chin J Neur Oncol, 2006, 4(2): 134-8. |
| [4] | McLachlan E, Plante I, Shao Q, et al. ODDD-linked Cx43 mutants reduce endogenous Cx43 expression and function in osteoblasts and inhibit late stage differentiation[J]. J Bone Miner Res, 2008, 23(6): 928-38. doi:10.1359/jbmr.080217 |
| [5] | Son Y, Cheong Y K. Mitogen-activated protein kinases and reactive oxygen species: how can ROS activate MAPK pathways?[J]. J Signal Transduct, 2011, 2011: 792639. |
| [6] | Liu L, Gao Z, Zhang L, et al. Temporal dynamic changes of connexin 43 expression in C6 cells following lipopolysaccharide stimulation[J]. Neural Regen Res, 2012, 7(25): 1947-53. |
| [7] | Moinfar Z, Dambach H, Schoenebeck B, et al. Estradiol receptors regulate differential connexin 43 expression in F98 and C6 glioma cell lines[J]. PLoS One, 2016, 11(2): e0150007. doi:10.1371/journal.pone.0150007 |
| [8] | Huang R P, Fan Y, Hossain M Z, et al. Reversion of the neoplastic phenotype of human glioblastoma cells by connexin 43(cx43)[J]. Cancer Res, 1998, 58(22): 5089-96. |
| [9] | Hernandez M, Shao Q, Yang X J, et al. A histone deacetylation-dependent mechanism for transcriptional repression of the gap junction gene cx43 in prostate cancer cells[J]. Prostate, 2006, 66(11): 1151-61. doi:10.1002/(ISSN)1097-0045 |
| [10] | Park J H, Lee M Y, Heo J S, et al. A potential role of connexin 43 in epidermal growth factor-induced proliferation of mouse embryonic stem cells: Involvement of Ca2+/PKC, p44/42 and p38 MAPKs pathways[J]. Cell Prolif, 2008, 41(5): 786-802. doi:10.1111/cpr.2008.41.issue-5 |
| [11] | Tacheau C, Fontaine J, Loy J, et al. TGF-beta induces connexin43 gene expression in normal murine mammary gland epithelial cells via activation of p38 and PI3K/AKT signaling pathways[J]. J Cell Physiol, 2008, 217(3): 759-68. doi:10.1002/jcp.v217:3 |
| [12] | Yang S R, Cho S D, Ahn N S, et al. Role of gap junctional intercellular communication(GJIC) through p38 and ERK1/2 pathway in the differentiation of rat neuronal stem cells[J]. J Vet Med Sci, 2005, 67(3): 291-4. doi:10.1292/jvms.67.291 |
| [13] | Behrens J, Kameritsch P, Wallner S, et al. The carboxyl tail of Cx43 augments p38 mediated cell migration in a gap junction-independent manner[J]. Eur J Cell Biol, 2010, 89(11): 828-38. doi:10.1016/j.ejcb.2010.06.003 |
| [14] | Aravindakshan J, Cyr D G. Nonylphenol alters connexin 43 levels and connexin 43 phosphorylation via an inhibition of the p38-mitogen-activated protein kinase pathway[J]. Biol Reprod, 2005, 72(5): 1232-40. doi:10.1095/biolreprod.104.038596 |
| [15] | Zvalova D, Cordier J, Mesnil M, et al. p38/SAPK2 controls gap junction closure in astrocytes[J]. Glia, 2004, 46(3): 323-33. doi:10.1002/(ISSN)1098-1136 |

