


2. 河南大学 淮河临床学院, 河南 开封 475004;
3. 河南大学 药学院,河南 开封 475004;
4. 安阳市人民医院内镜中心,河南 安阳 455000
2. Huaihe Clinical College, Henan University, Kaifeng Henan 475004, China;
3. College of Pharmacy, Henan University, Kaifeng Henan 475004, China;
4. Endoscopy Center, Anyang People's Hospital, Anyang Henan 455000, China
喹诺酮类药物作为抗感染药物广泛应用于临床[1],这类药物是细菌DNA回旋酶(DNA gyrase)的抑制剂。DNA回旋酶属Ⅱ型DNA拓扑异构酶[2],作用机制是通过切断DNA双链,改变DNA拓扑结构后再将其连接,在细胞DNA复制、转录和修复中发挥重要作用[3]。真核细胞的拓扑异构酶Ⅱ(topoisomerase Ⅱ)的某些序列片段与DNA回旋酶存在较高程度的同源性[4],临床常用的某些氟喹诺酮羧酸如环丙沙星、诺氟沙星、氧氟沙星等对真核生物的拓扑异构酶Ⅱ的活性具有轻微的抑制作用[5]。因此,对喹诺酮类抗菌药进行有效的结构改造后有望成为新一类抗肿瘤候选化合物。资料显示,经结构改造合成的氟喹诺酮抗肿瘤化合物多是拓扑异构酶Ⅱ毒剂,通过稳定拓扑异构酶Ⅱ介导的可裂解复合物阻断DNA双链的连接,达到杀灭肿瘤细胞的目的,类似于临床应用的阿霉素的作用[6],其作用机制主要与抑制细胞DNA拓扑异构酶Ⅱ的活性和诱导细胞凋亡有关[7-8]。最初对抗菌氟喹诺酮的改造主要集中于对喹啉环的N-1位和C-7位的结构修饰,合成了含多元环的抗肿瘤喹诺酮类衍生物,但由于生物利用度低、易被代谢失活以及体内毒性等原因未进入临床评价[9]。研究表明[10],氟喹诺酮羧酸碳-3位羧基是抗菌活性所必需的,但对抗肿瘤活性没有影响。绕丹宁-3-乙酸(rhodanine-N-acetic acid)作为某些药物的中间体具有多种生物活性的基团,常用于新药的合成[11]。本研究运用电子等排体和拼接原理,用绕丹宁不饱和酮修饰氟喹诺酮碳-3位羧基,设计合成了一系列溶解性好,分子质量较小的具查耳酮及舒尼替尼类似结构的氟喹诺酮类衍生物,并针对该类化合物的抗肿瘤活性进行筛选。结果显示该类衍生物均具有较好的抗肿瘤活性,其中6-(3-苄基-4-氧代-2-硫代-噻唑烷-5-叉甲基)-9-氟-3-甲基-10-(4-甲基哌嗪-1-基)-2, 3-二氢-7-氧代-7-氢-吡啶并[1, 2, 3-de][1, 4]苯并噁嗪(R3,Fig 1)活性最强,IC50值达3.893 μmol·L-1,具有进一步研究和开发的价值。
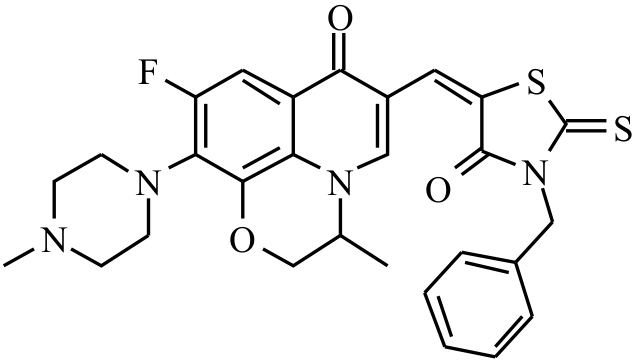
|
| Fig 1 Structure of 6-(3-benzyl-4-oxo-2-thioxo-thiazolidin-5-ylidenemethyl) -9-fluoro-3 -methyl-10-(4-methyl-piperazin-1-yl)-2, 3-dihydro-7-oxo-7-hydro-pyrido[1, 2, 3-de][1, 4] benzoxazine |
氧氟沙星-饶丹宁衍生物由河南大学化学生物学研究所设计合成,溶解在二甲基亚砜(DMSO,Solarbio公司)中,起始浓度为0.1 mol·L-1。
1.1.2 细胞株与试剂人肝癌细胞系SMMC-7721和人食管鳞癌细胞EC-9706生长在含体积分数为0.1的胎牛血清(杭州四季青生物工程材料有限公司)的DMEM培养基(Gibco公司)中;结肠癌细胞CaCO-2和肝细胞L-02生长在含体积分数为0.1的胎牛血清的RPMI 1640培养液(Gibco公司)中,置体积分数为0.05的CO2、37℃恒温培养。
四甲基偶氮唑盐(MTT)(Solarbio公司);DAPI(Sigma公司);DeadEndTM Flurometric TUNEL System (Promega公司);鼠抗caspase-3单克隆抗体(Novus公司);兔抗p53多克隆抗体(百奇公司);鼠抗β-actin多克隆抗体(中杉金桥公司);HRP标记的羊抗兔抗体和羊抗鼠抗体(Santa Cruz公司);其余试剂为国产分析纯产品。
1.1.3 主要仪器二氧化碳培养箱(Thermo Forma,3121);酶标仪(Thermo Multiskan Ascent);倒置显微镜(莱卡显微系统公司);BX51荧光显微镜(Olympus公司);高速离心机(艾本德公司);凝胶成像系统(UVP公司);流式细胞仪(艾森生物公司);电泳仪、半干式印迹膜转印仪(六一电子仪器设备厂)。
1.2 方法 1.2.1 MTT法测定药物对细胞增殖的影响细胞以1.6×108·L-1浓度接种于96孔细胞培养板,加入不同浓度的R3分别培养24、48、72 h后,每孔加入MTT 20 μL,置于37℃温箱避光孵育4 h,吸出微孔中液体,每孔加入DMSO 0.15 mL振荡8 min,酶标仪测570 nm吸收度(A)值并计算抑制率。以含等体积的培养液和DMSO的无细胞孔测的吸光度值为空白对照。
细胞生长抑制率/%=[1-(处理组OD值-空白参照组OD值)/(未处理组OD值-空白参照组OD值)]×100%
1.2.2 DAPI染色法观察细胞凋亡形态变化细胞以4×107·L-1浓度接种于放置盖玻片的6孔板,待细胞贴壁后,加入不同浓度的R3培养24 h,PBS洗2次,多聚甲醛固定20 min,20 μL DAPI工作液加于盖玻片上,室温染色10 min。PBS漂洗3次,78%的中性甘油封片,荧光显微镜下观察并记录。
1.2.3 TUNEL法测定细胞凋亡率取4×107·L-1细胞数接种细胞于放置盖玻片的6孔板,用不同浓度的R3作用24 h,按Promega公司的试剂盒说明书操作,统计细胞凋亡率。
1.2.4 PI染色流式细胞仪检测细胞周期变化将细胞以1×109·L-1接种于培养瓶,培养12 h,加入不同浓度R3作用24 h,收集细胞于EP管中,PBS洗涤1次,70%的乙醇固定,PBS洗涤1次,PI染液室温避光染色30 min, 流式细胞仪检测。
1.2.5 Western blot检测蛋白表达不同浓度R3作用细胞24 h,RIPA裂解液200 μL充分裂解细胞,4℃离心(12 000 r·min-1) 5 min提取蛋白,考马斯亮蓝G250法分光光度计测样品蛋白浓度,12% SDS-PAGE电泳分离。电转移蛋白至PVDF膜,5%脱脂奶粉封闭1 h,一抗(1 :2 000)4℃封闭过夜,二抗(1 :4 000) 孵育1 h,化学发光法显示结果,凝胶图像分析系统拍照。
1.2.6 统计学分析资料采用Excel和SPSS 17.0软件处理数据。计量资料用x±s表示,组间比较采用t检验分析。
2 结果 2.1 R3对各种肿瘤细胞的增殖抑制作用不同浓度的R3分别作用于SMMC-7721、EC-9706和CaCO-2细胞24、48和72 h,R3对肿瘤细胞有较强增殖抑制作用,并呈时间与浓度依赖关系,24 h的IC50值分别是3.893 μmol·L-1(r2=0.830 4)、4.181 μmol·L-1(r2=0.883 3) 和3.408 μmol·L-1(r2=0.960 1);R3分别作用于L-02肝细胞24、48和72 h,对细胞的增殖抑制作用不明显,24 h的IC50值为33.959 μmol·L-11(r2=0.930 9);R3合成原料氧氟沙星对SMMC-7721细胞增殖的影响不明显,24 h的IC50值为240.137 μmol·L-1(r2=0.800 5);舒尼替尼对SMMC-7721细胞增殖具有较强的抑制作用,但24 h的IC50值为8.075 μmol·L-1(r2=0.984 5),明显低于R3对SMMC-7721细胞24 h的IC50值(Fig 2)。
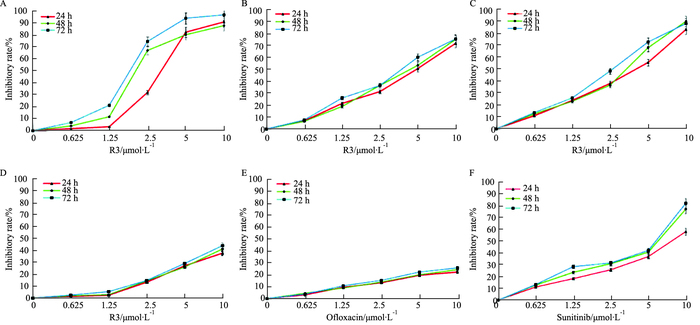
|
| Fig 2 Proliferation inhibition effect of R3, Ofloxacin and Sunitinib on human cancer cells and L-02 cells SMMC-7721 cells (A), EC-9706 cells (B), CaCO-2 cells (C) and L-02 (D) cells were treated with various concentrations of R3 for 24~72 h. SMMC-7721 cells were treated with various concentrations of Ofloxacin (E) and Sunitinib (F) for 24~72 h. |
DAPI染色结果显示,R3作用于SMMC-7721细胞24 h,出现细胞核碎裂、溶解,染色质凝集、浓缩、边缘化等凋亡形态学变化(Fig 3)。TUNEL结果显示,随着R3浓度增加,凋亡细胞明显增多,呈浓度依赖性(Fig 4,Tab 1)。
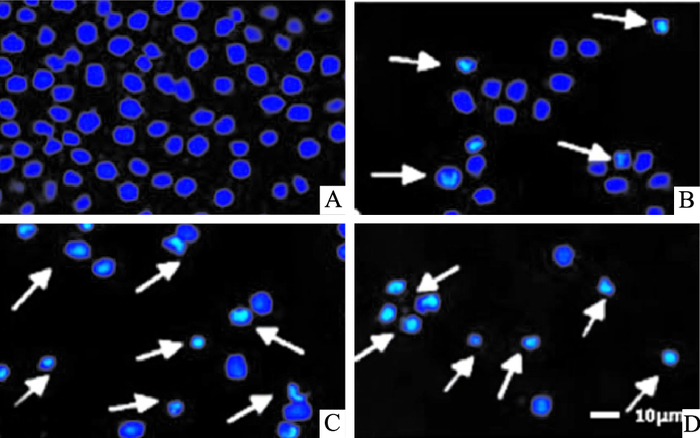
|
| Fig 3 SMMC-7721 cell apoptosis under fluorescent microscope stained by DAPI(×200) A: Control; B: R3 (2.688 μmol·L-1); C: R3 (3.893 μmol·L-1); D: R3 (5.639μmol·L-1) |
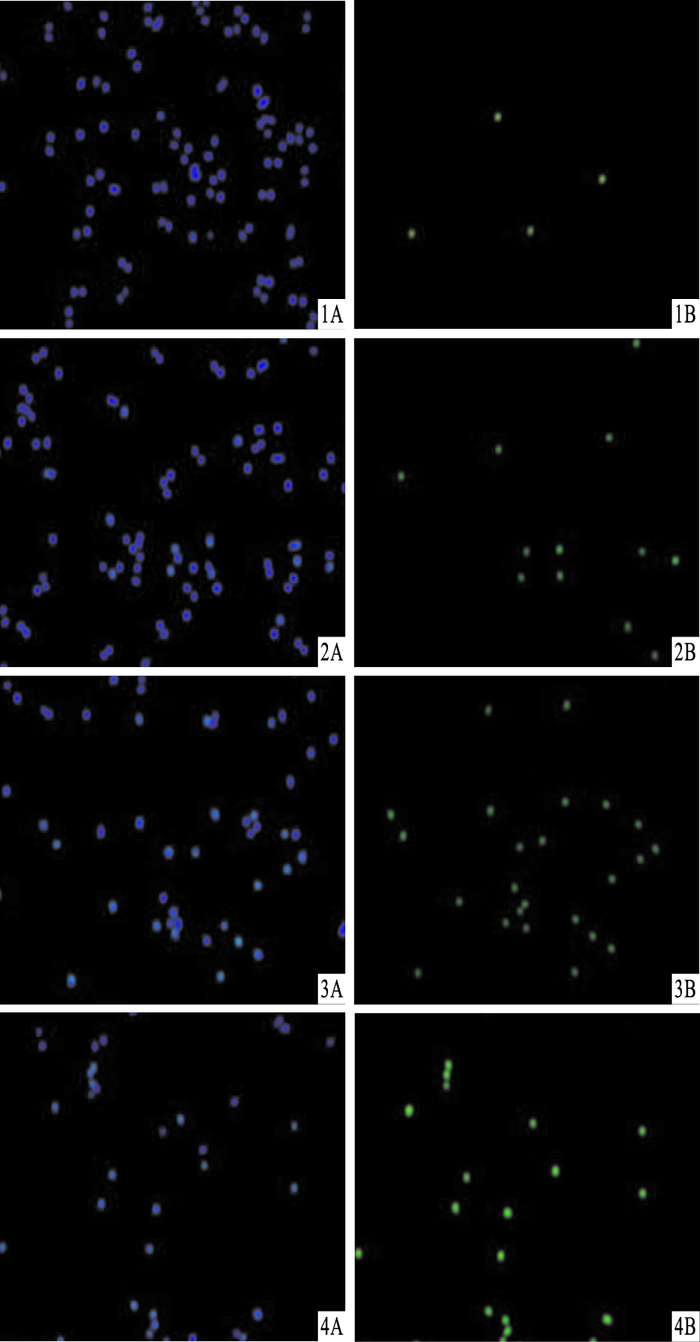
|
| Fig 4 Induction of apoptosis of SMMC-7721 cells treated with R3 for 24 h evaluated by TUNEL assay Representative images were taken, nuclear stain(DAPI, A) and apoptotic stain (TUNEL, B) overlaid.1: Control; 2: R3 (2.688 μmol·L-1); 3: R3 (3.893 μmol·L-1); 4: R3 (5.639 μmol·L-1).Magnification, 100× |
| Group | Dose/μmol·L-1 | Apoptotic ratio/% |
| Control | 4.04±4.88 | |
| R3 | 2.688 | 34.44±4.53** |
| 3.893 | 48.40±7.52** | |
| 5.639 | 67.27±6.86** | |
| **P<0.01 vs control | ||
分别用2.688、3.893和5.639 μmol·L-1的R3作用于SMMC-7721细胞24 h,与对照组相比,R3处理组的G0/G1期细胞数量明显增多(P=0.011,0.001,0.000),S期细胞数量无特异性改变(P=0.054,0.906,0.683),G2/M期细胞数量明显减少(P=0.024,0.000,0.000),Sub-G1期细胞数量明显增加(P=0.031,0.001,0.000);说明R3将SMMC-7721的细胞周期阻断于G1-S期,抑制了SMMC-7721细胞的分裂和增殖,见Fig 5。
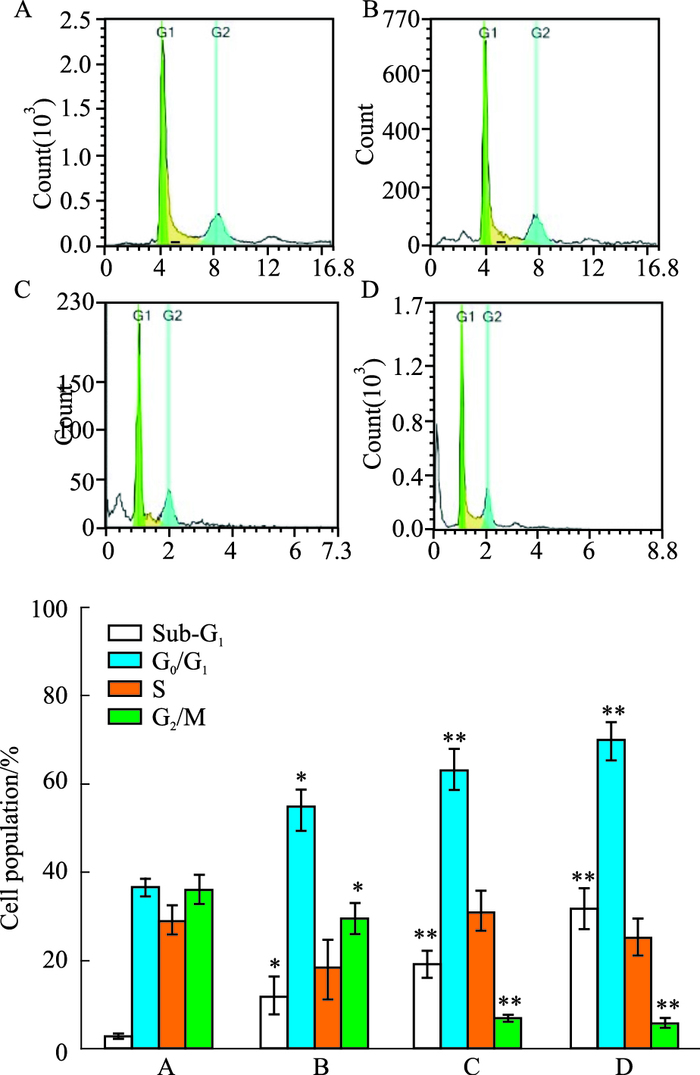
|
| Fig 5 Effect of R3 on cell cycle distribution in SMMC-7721 cells Cell cycle distribution was demonstrated by Flow cytometry analysis in SMMC-7721 cells after treatment with 0 (A), 2.688 (B), 3.893 (C) and 5.639 μmol·L-1 (D) R3 respectively for 24 h. *P < 0.05, **P < 0.01 vs control. |
以2.688、3.893和5.639 μmol·L-1的R3作用于SMMC-7721细胞24 h。Western blot法检测p53和caspase-3蛋白的表达。与对照组相比,R3作用后细胞p53蛋白表达明显增加,呈明显的浓度依赖关系,caspase-3蛋白表达量增多,活性片段增多,见Fig 6。

|
| Fig 6 Effects of R3 on p53 and caspase-3 protein expressions in SMMC-7721 cells Expression of p53(53 ku) and caspase-3(32 ku、19 ku) in SMMC-7721 cells were detected after treatment with 0 μmol·L-1(1):2.688 μmol·L-1(2):3.893 μmol·L-1(3):5.639 μmol·L-1(4) :R3 respectively for 24 h. **P < 0.01 vs control |
本研究把具有抗肿瘤活性的绕丹宁不饱和酮骨架与氟喹诺酮骨架在碳-3位置进行拼合, 构建了系列氟喹诺酮(绕丹宁不饱和酮)酰胺类目标化合物。应用MTT法对目标化合物进行筛选,12种氟喹诺酮-绕丹宁类衍生物对人肝癌SMMC-7721细胞的24 h的IC50值均在50 μmol·L-1以下,其中R3 IC50值达到3.893 μmol·L-1,明显低于母体氧氟沙星的IC50(240.137 μmol·L-1)值,也低于临床应用的抗癌药物舒尼替尼的IC50 (8.075 μmol·L-1)值,说明氧氟沙星与饶丹宁不饱和酮骨架相拼接构建的氧氟沙星-绕丹宁类衍生物作为抗肿瘤先导物,值得进一步的深入研究和开发。
为了解R3对不同肿瘤细胞的作用的差异,本研究选用3种不同类型的肿瘤细胞株(人肝癌SMMC-7721细胞、食管鳞癌EC-9706细胞、结肠癌CaCO-2细胞),检测R3对细胞的生长抑制作用。结果证明,R3对多种肿瘤细胞均有明显增殖抑制作用,并呈时间与浓度依赖性。本研究同时应用L-02肝转化细胞体外培养,检测R3的细胞生长抑制作用,IC50值为33.959 μmol·L-1,明显高于R3对SMMC-7721细胞作用的IC50值。说明R3对肿瘤细胞具有较好的选择性,在未来临床应用中可能具有较小的毒副作用。
本课题组前期实验已经证明,经碳-3羧基改造的氟喹诺酮衍生物具有明显抗肿瘤活性,主要是作用于DNA拓扑异构酶Ⅱ,作为DNA拓扑异构酶Ⅱ毒剂抑制DNA拓扑异构酶Ⅱ的活性,影响到DNA的复制[12-13]。本实验采用PI染色法流式细胞术对R3作用下SMMC-7721细胞的周期改变进行检测,结果显示,与对照组相比,经R3处理后,G0/G1的细胞数量明显增多,伴随G2/M期细胞的明显减少,S期细胞无明显变化,证明细胞周期被阻滞在G1-S期,与DNA复制受阻有关。DNA拓扑异构酶Ⅱ能够催化DNA拓扑学异构体相互转变,催化DNA双链的断开和结合,促进DNA解螺旋以完成复制过程[14]。DNA拓扑异构酶Ⅱ毒剂的作用是导致DNA不可逆性断裂、受损,这种作用可能激活p53蛋白,诱导细胞凋亡[15-16]。本实验应用Western blot法检测p53表达量的改变,提示R3杀伤SMMC-7721细胞的作用可能通过DNA损伤,p53增加,进而诱导细胞进入凋亡途径。应用DAPI荧光染色法观察SMMC-7721细胞核形态变化,观察到R3作用24h凋亡SMMC-7721细胞增加,表现为细胞核皱缩、碎裂,染色质凝集、边缘化,出现凋亡小体等凋亡细胞核形态学改变[17]。TUNEL法显示,随着R3浓度增加,细胞凋亡率明显升高。Western blot结果也证明,随着R3浓度的增加,caspase-3表达量增多,裂解片段增加。说明通过激活caspase-3途径诱导细胞凋亡[18]。
综上所述,经改造后的氧氟沙星-绕丹宁类衍生物R3能够将细胞周期阻滞于G1-S期,明显抑制肝癌等肿瘤细胞的分裂和增殖,并对肿瘤细胞具有选择性。R3的抗癌作用主要通过诱导细胞凋亡完成。
| [1] | Singh S, Kaur G, Mangla V, et al. Quinoline and quinolones: promising scaffolds for future antimycobacterial agents[J]. J Enzyme Inhib Med Chem, 2015, 30(3): 492-504. doi:10.3109/14756366.2014.930454 |
| [2] | Patel M N, Bhatt B S, Dosi P A. Topoisomerase inhibition, nucleolytic and electrolytic contribution on DNA binding activity exerted by biological active analogue of coordination compounds[J]. Appl Biochem Biotechnol, 2012, 166(8): 1949-68. doi:10.1007/s12010-012-9623-x |
| [3] | Schmidt B H, Osheroff N, Berger J M. Structure of a topoisomerase Ⅱ-DNA-nucleotide complex reveals a new control mechanism for ATPase activity[J]. Nat Struct Mol Biol, 2012, 19(11): 1147-54. doi:10.1038/nsmb.2388 |
| [4] | Berger J M, Oamblin S J, Harrison S C, et al. Structure and mechanism of DNA topoisomerase II[J]. Nature, 1996, 379(6562): 225-32. doi:10.1038/379225a0 |
| [5] | Williams G M, Brunnemann K D, Smart D J, et al. Relationship of cellular topoisomerase IIα inhibition to cytotoxicity and published genotoxicity of fluoroquinolone antibiotics in V79 cells[J]. Chem Biol Interact, 2013, 203(2): 386-90. doi:10.1016/j.cbi.2013.01.003 |
| [6] | Jiang M, Huang O, Xie Z, et al. A novel long non-coding RNA-ARA: adriamycin resistance-associated[J]. Biochem Pharmacol, 2014, 87(2): 254-83. doi:10.1016/j.bcp.2013.10.020 |
| [7] | Wang Z, Liang S, Lian X, et al. Identification of proteins responsible for adriamycin resistance in breast cancer cells using proteomics analysis[J]. Sci Rep, 2015, 5: 9301. doi:10.1038/srep09301 |
| [8] | Ahmed A, Daneshtalab M. Nonclassical biological activities of quinolone derivatives[J]. J Pharm Pharm Sci, 2012, 15(1): 52-72. |
| [9] | Liang J H, Han X. Structure-activity relationships and mechanism of action of macrolides derived from erythromycin as antibacterial agents[J]. Curr Top Med Chem, 2013, 13(24): 3131-64. doi:10.2174/15680266113136660223 |
| [10] | Bringmann G, Dreyer M, Faber J H, et al. Ancistrotanzanine C and related 5, 1′-and 7, 3′-coupled naphthylisoquinoline alkaloids from Ancistrocladus tanzaniensis[J]. J Nat Prod, 2004, 67(5): 743-8. doi:10.1021/np0340549 |
| [11] | Meyer T, Ogermann D, Pankrath A, et al. Phenothiazinyl rhodanylidene merocyanines for dye-sensitized solar cells[J]. J Org Chem, 2012, 77(8): 3704-15. doi:10.1021/jo202608w |
| [12] | Sun J P, Shi Z Y, Liu S M, et al. Trimethoxy-benzaldehyde levofloxacin hydrazone inducing the growth arrest and apoptosis of human hepatocarcinoma cells[J]. Cancer Cell Int, 2013, 13(1): 67. doi:10.1186/1475-2867-13-67 |
| [13] | 霍菲, 唐乃夫, 范媛媛, 等. 苯甲醛左氧氟沙星席夫碱诱导人肝癌细胞凋亡作用[J]. 中国药理学通报, 2015, 31(6): 821-6. Hou F, Tang N F, Fan Y Y, et al. Benzaldehyde levofloxacin schiff base induces apoptosis of human hepatocarcinoma cells[J]. Chin Pharmacol Bull, 2015, 31(6): 821-6. |
| [14] | Orlowski C, Mah L J, Vasireddy R S, et al. Double-strand breaks and the concept of short-and long-term epigenetic memory[J]. Chromosoma, 2011, 120(2): 129-49. doi:10.1007/s00412-010-0305-6 |
| [15] | Wanitchakool P, Jariyawat S, Suksen K, et al. Cleistanthoside A tetraacetate-induced DNA damage leading to cell cycle arrest and apoptosis with the involvement of p53 in lung cancer cells[J]. Eur J Pharmacol, 2012, 696(1-3): 35-42. doi:10.1016/j.ejphar.2012.09.029 |
| [16] | Calvino E, Estan M C, Simon G P, et al. Increased apoptotic efficacy of lonidamine plus arsenic trioxide combination in human leukemia cells. Reactive oxygen species generation and defensive protein kinase (MEK/ERK, Akt/mTOR) modulation[J]. Biochem Pharmacol, 2011, 82(11): 1619-29. doi:10.1016/j.bcp.2011.08.017 |
| [17] | Omlor G W, Nerlich A G, Tirlapur U K, et al. Loss of notochordal cell phenotype in 3D-cell cultures: implications for disc physiology and discrepair[J]. Arch Orthop Trauma Surg, 2014, 134(12): 1673-81. doi:10.1007/s00402-014-2097-2 |
| [18] | Liese J B, Abhari A, Fulda S. Smac mimetic and oleanolic acid synergize to induce cell death in human hepatocellular carcinoma cells[J]. Cancer Lett, 2015, 365(1): 47-56. doi:10.1016/j.canlet.2015.04.018 |

