


2. 广州领晟医疗科技有限公司,广东 广州 510663
2. Guangzhou Link Health Biotechnology co.Ltd, Guangzhou 510663, China
恶性肿瘤是威胁人类健康和生命的主要疾病之一,传统的癌症治疗手段如手术治疗、放射治疗、药物治疗均具有一定局限性[1]。由于靶向性较差,放射治疗和药物治疗易损伤正常人体细胞,产生不良反应。随着对肿瘤发生、发展的分子机制深入研究和生物技术的快速发展,生物治疗已经成为肿瘤综合治疗的第4种模式[2]。肿瘤多肽疫苗是由来自肿瘤细胞特异性抗原、病毒相关抗原、癌基因或者抑癌基因突变蛋白的多肽组成的疫苗,在细胞因子、趋化因子等佐剂的辅助下,能激活或者加强机体自身抗肿瘤免疫,进而杀伤和清除肿瘤细胞[3, 5]。与传统疫苗相比,肿瘤多肽疫苗具有易于合成纯化、安全性高、特异性强等优点[4],因此肿瘤多肽疫苗是肿瘤疫苗研究方向的热点。目前国外已有数个多肽疫苗进入或完成Ⅱ期临床试验阶段,一个进入Ⅲ期临床试验阶段[6](Tab 1),相关临床试验表明,多肽疫苗能够刺激诱导人体CD4-T和CD8-T淋巴细胞,明显增加两者在体内的含量水平[7]。
| Peptide name | Peptide sequence | Study phase |
| E75 HER-2/neu(369-377) | KIFGSLAFL | Ⅲ |
| GP2 HER-2/neu(654-662) | ⅡSAVVGIL | Ⅱ |
| AE37 HER-2/neu(776-790) | GVGSPYVSRLLGILL | Ⅱ |
CKL9与YL20是由我们筛选改造而来的多肽分子,分别含有11、20个氨基酸,用于HER-2阳性的实体瘤的预防和治疗,具有开发为一类抗肿瘤新药的前景。HER-2为原癌基因,在多种肿瘤(如乳腺癌、胃癌)中过度表达,并与肿瘤患者的恶性程度和预后密切相关,是肿瘤治疗的理想靶标[8]。CKL9与YL20来源于HER-2的表位肽,可以激活针对HER-2的特异性CTL,在GM-CSF免疫佐剂辅助下,攻击和溶解表达HER-2阳性的肿瘤细胞[9]。本研究通过体外细胞实验和体内动物实验探究CKL9与YL20的抗肿瘤活性,为开发为肿瘤新药提供依据。
1 材料与仪器 1.1 实验动物和细胞株BALC/c ♀小鼠,SPF级,6~8周龄,购于广东省医学实验动物中心,动物许可证号:SQHD203364,本动物实验经动物伦理委员会批准,批准号为:20160704153544;NCI-N87人胃癌细胞、SKOV-3人卵巢癌细胞、MCF-7人乳腺癌细胞皆由购自上海中科院细胞库。
1.2 主要药物与试剂多肽CKL9、YL20(上海强耀科技有限公司合成,纯度高于95%,批号SQH22350) RPMI 1640、DMEN培养基(Gibco,批号5114418);胎牛血清FBS(NQBB,批号7907843);青霉素、链霉素(Gibco,批号1665604);胰酶(Gibco,批号1676922);hGM-CSF人集落刺激因子(Pepro Tech,批号011330);鼠淋巴细胞分离液(达科为生物技术有限公司,批号33RO21502);Cyto Tox96®非放射性细胞毒性检测试剂盒(Promega,批号0000136684);CCK-8检测试剂(联科生物);PHA植物血凝素阳性对照(Sigma);PBS磷酸盐缓冲液(达科为,批号1437226)。
1.3 仪器低速台式离心机(上海安亭科学仪器,型号TDL-60B);显微镜(OLYMPUS,型号CKX41);酶标仪(Thermo,型号Multiskan Fc);细胞培养箱(Thermo,型号371);全自动细胞计数仪(Nexcelom,型号AUTO 1000);超净工作台(Thermo,型号1300)。
2 方法 2.1 测定肿瘤细胞HER-2蛋白表达选用抗HER-2荧光标记抗体与肿瘤细胞表面的HER-2结合后,利用流式细胞仪检测细胞表面荧光强度。培养肿瘤细胞至生长对数期,胰酶消化后用PBS洗涤离心,加入20μL荧光标记流式抗体到106个肿瘤细胞(0.5mL)中混合,(20~25) ℃避光孵育20 min,选用不与HER-2结合的抗体作为阴性对照,孵育后加入含1%多聚甲醛的PBS充分混匀,流式细胞仪进行上样分析细胞HER-2表达情况。
2.2 CCK-8法检测CKL9、YL20对小鼠淋巴细胞的增殖作用小鼠脱颈处死,75%乙醇浸泡消毒,转移至超净台中,无菌去除小鼠脾脏,剪刀除去附着的脂肪组织,置于固定在培养皿的尼龙膜上,往无菌培养皿中加入5 mL淋巴细胞分离液,用注射器柱芯研磨脾脏,将分离液转入15 mL离心管中,沿管壁小心加入约200 μL RPMI 1640培养基, 室温离心后用玻璃吸管将第二层淋巴细胞层吸出,加入10倍体积RPMI 1640培养基,混匀后250×g室温离心10 min,制成细胞悬液,加台盼蓝混匀后,细胞计数仪计数活细胞数。96孔细胞培养板中接种鼠淋巴细胞悬液每孔100 μL(105个细胞),共接种3块培养板,以备不同时间CCK-8检测(24、48、72h);每孔加入相应抗原刺激物PBS、CKL9、YL20、PHA各100 μL,其中PBS为阴性对照,PHA(植物血凝素)为阳性对照(10 mg·L-1),CKL9、YL20各设置2种浓度(20、50 mg·L-1),每受试物每浓度设6个复孔,37℃、5%CO2条件下孵育24、48、72 h,在指定时间点各取出1块培养板,加CCK-8检测试剂每孔10 μL,放入培养箱继续孵育1~4 h,酶标仪读OD450数值。
2.3 LDH法检测CKL9、YL20诱导小鼠细胞毒性T淋巴细胞(CTL)活性活细胞的胞质内含有乳酸脱氢酶(LDH)。正常情况下,LDH不能透过细胞膜,当细胞受到效应细胞的杀伤后,LDH释放到细胞外。经还原后能在酶标仪上用490nm比色测定LDH含量。
靶细胞的制备:复苏N87、SKOV-3用RPMI 1640培养基(含FBS、双抗),MCF-7用DMEN培养基,置于37℃、5% CO2培养箱中常规培养,收集靶细胞,加入96孔培养板,每孔100 μL,104/孔;效应细胞制备:健康巴比斯小鼠分2组,右侧腋下分别免疫多肽药物CKL9、YL20(30 μg/只+0.2 μg/只hGM-CSF)2周1次,免疫2次后,取脾脏研磨,分离出的淋巴细胞即作为效应细胞。
取靶细胞和效应细胞各100 μL(效靶比分别为80 :1、40 :1),加入U型96孔培养板中;靶细胞自然释放孔加靶细胞和培养液各100 μL,效应细胞自然释放孔加效应细胞和培养液各100 μL,靶细胞最大释放孔加靶细胞和1%Triton各100 μL;上述各项均设3个复孔,于37℃、5%CO2培养箱中培养4 h,然后将96孔培养板250×g离心5 min,每孔吸取上清100 μL置平底96孔培养板中加入相应的孔中,按照Cyto Tox96®非放射性细胞毒性检测试剂盒说明书,测量每种效靶比的OD490,按下列公式计算细胞毒性:
特异杀伤率/%= (实验孔OD-效应细胞自发释放孔OD-靶细胞自发释放孔OD)/(靶细胞最大释放孔-靶细胞自发释放孔)×100%
2.4 CKL9、YL20对巴比斯小鼠N87肿瘤抑制作用♀巴比斯小鼠随机分3组,每组6只,采用胸皮下注射给药免疫,给药方案见Tab 2。免疫2次后,取对数生长期的N87细胞收集,制备成5×109·L-1细胞悬液,以0.1 mL种于小鼠右侧腋下,待接种后7 d肿瘤体积达200 mm3后用游标卡尺测量肿瘤直径,动态观察受试动物抗肿瘤的效应,肿瘤直径测量次数为每隔1天测1次,肿瘤体积(tumor volume, TV)的计算公式为:TV=1/2×a×b2,其中a、b分别表示长宽,并记录体质量。接种肿瘤4周后,处死所有小鼠,终止实验并进行评价。
| Group | Drugs and dose | Days and ways |
| G1 | PBS+0.2 μg hGM-CSF | d1, 14 two days of drugs, subcutaneous injection |
| G2 | 30μg YL20+0.2 μg hGM-CSF | |
| G3 | 30μg CKL9+0.2 μg hGM-CSF |
抑瘤率/%=(对照组瘤体积-实验组瘤体积)/对照组×100%。
2.5 数据处理采用SPSS12.0软件进行统计学分析,采用单因素方差分析进行比较。
3 结果 3.1 肿瘤细胞表面HER-2表达荧光检测带有荧光标记的抗HER-2抗体能与细胞表面的HER-2受体特异性结合。细胞表面表达HER-2越多,所结合的抗体就越多,红色荧光强度也就越强,因此荧光强度与HER-2表达量成正比。如Fig 1所示,胃癌细胞N87、卵巢癌细胞SKOV-3,均有一定量的HER-2阳性表达,但表达量有差异,其中N87为高表达细胞株,SKOV-3为中表达细胞株,乳腺癌细胞MCF-7为HER-2阴性表达。
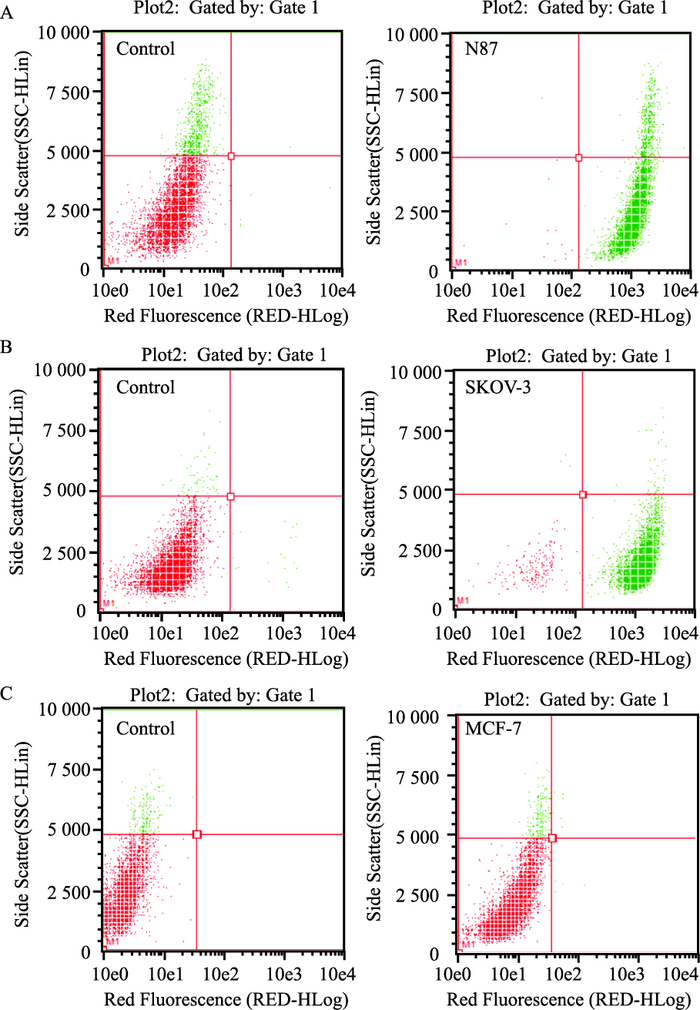
|
| Fig 1 Expression level of HER-2 on different tumor cell lines A: NCI-N87(gastric cancer); B: SKOV-3(ovarian cancer); C: MCF-7(breast cancer) |
采用CCK-8法体外测量CKL9与YL20对淋巴细胞增殖作用,测量时间点分别为24、48、72h,并计算相对增值率。如Fig 2所示,孵育时间从0至72 h,孵育PHA的阳性对照组对小鼠淋巴细胞诱导增殖效果最明显。此外,相比空白对照组,多肽CKL9与YL20在两种浓度下(20、50 mg·L-1)均能对小鼠淋巴细胞产生增殖作用,证明淋巴细胞诱导增殖成功。由Fig 2可见,孵育多肽YL20对淋巴细胞的增殖具有量效关系,但孵育多肽CKL9并没有表现出明显的剂量效应,孵育低浓度的CKL9相比高浓度更能促进淋巴细胞的增殖。
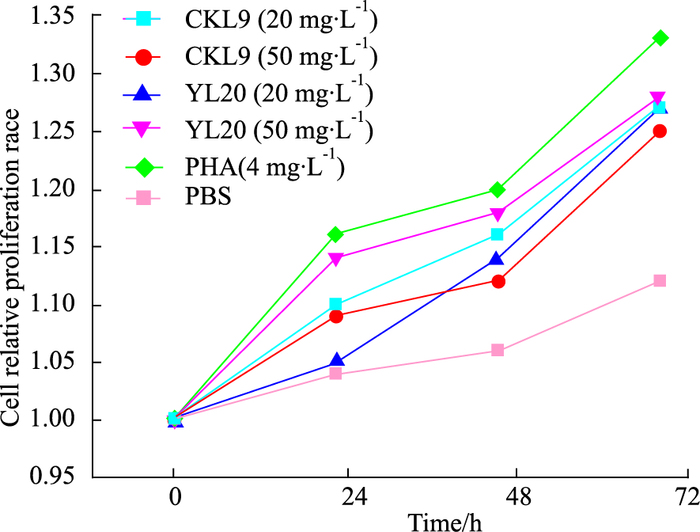
|
| Fig 2 The proliferation specific lymphocyte cells by incubation with CKL9 and YL20 |
CKL9和YL20为HER-2的表位肽,小鼠体内免疫后可以激活针对HER-2的T淋巴细胞,本研究目的是采用LDH法测试小鼠淋巴细胞被2种多肽诱导分化成CTL,对HER-2不同程度表达的肿瘤细胞的杀伤作用。结果显示,相比经PBS体内免疫的空白对照组(Fig 3C),由CKL9、YL20体内诱导产生的CTL在80 :1效靶比情况下均能对HER-2高表达的N87肿瘤细胞产生生长抑制作用,抑制率达84.3%、89.8%(Fig 3A、Fig 3B),而针对HER-2中表达的SKOV-3细胞,CTL效果则有一定程度的下降。同时,对于HER-2阴性表达的MCF-7细胞,2种多肽分子均无法产生有效的细胞毒性作用,说明多肽CKL9和YL20只能刺激诱导针对HER-2的特异性细胞毒性T淋巴细胞。
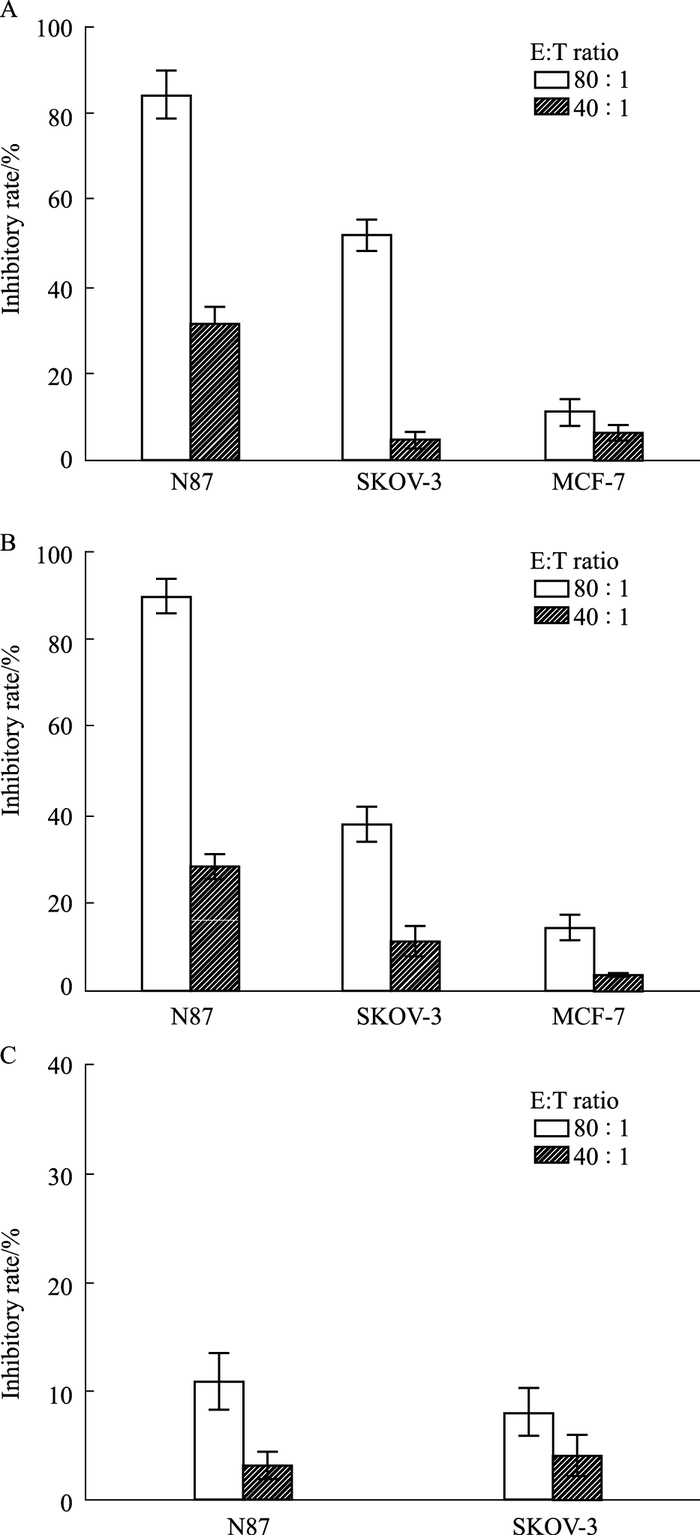
|
| Fig 3 Lymphocytes from HER-2/neu peptide-vaccinated mice efficiently recognize and lyse HER2-positive tumor cells A: Peptide CKL9; B: Peptide YL20; C: PBS |
小鼠免疫给药4周后,接种NCI-N87肿瘤细胞,观察其肿瘤生长情况(Tab 3、Fig 4)。接种细胞后,PBS免疫组、CKL9免疫组、YL20免疫组肿瘤体积生长前期差异不明显,而接种细胞后26 d的肿瘤测量体积中,PBS免疫组肿瘤体积达1300 mm3,YL20免疫组达1140 mm3,CKL9免疫组达880 mm3。CKL9组与PBS组体积相比,肿瘤体积明显变小,差异具有显著性(P=0.027)。
| Group and dose | d12 | d14 | d16 | d19 | d21 | d23 | d26 |
| G1:PBS+0.2 μg hGM-CSF | 300.2 | 366.2 | 439.3 | 613.7 | 745.0 | 840.7 | 1288.0 |
| G2:30 μg YL20+0.2 μg hGM-CSF | 235.2 | 267.6 | 421.1 | 538.9 | 765.5 | 834.3 | 1143.8 |
| G3:30 μg CKL9+0.2 μg hGM-CSF | 151.5 | 239.6 | 303.7 | 474.2 | 534.9 | 671.8 | 875.8 |
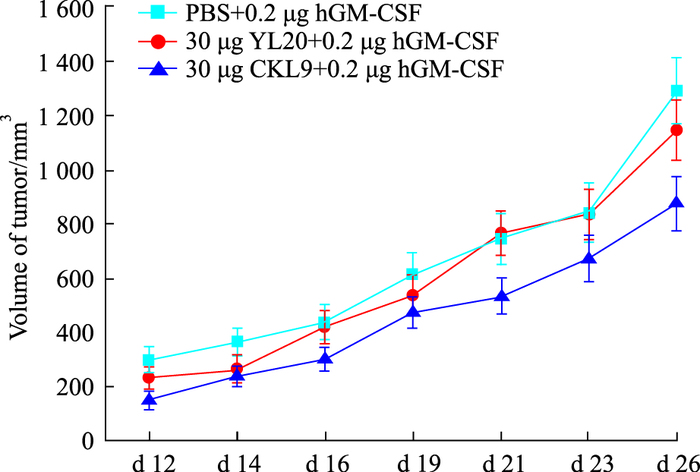
|
| Fig 4 Peptide CKL9 and YL20 inhibited tumor growth in vivo |
根据BALC/C小鼠体质量生长趋势(Fig 5)可以看出,多肽CKL9、YL20对小鼠体质量几乎没有影响,各组在实验周期内均没有出现非正常死亡事件,同时在实验周期内各组小鼠存活率均为100%,说明CKL9、YL20安全性高,没有明显不良反应产生。
|
| Fig 5 Average body weight of mice |
人类表皮生长因子受体2(HER-2) 在部分乳腺癌、胃癌、卵巢癌患者中均存在过度表达现象。1998年重组人源化单克隆抗体曲妥珠单抗获美国FDA批准用于转移性乳腺癌的治疗,是全球首个以HER-2为靶点的生物靶向治疗药物[10]。继曲妥珠单抗问世后,一系列针对HER-2的肿瘤治疗策略相继被建立,其中包括被动免疫治疗(如抗HER-2抗体)和主动免疫治疗(如靶向HER-2的肽疫苗)[11],目前国外已有多个基于HER-2的肿瘤多肽疫苗陆续展开相关临床试验[6]。
该类多肽疫苗来源于HER-2的表位肽片段,具有特异性强、安全性高的优点[12]。理论上可诱导持久的特异性细胞和体液免疫应答,在动物模型中,预免疫的多肽疫苗具有免疫原性,可诱导CD4和CD8阳性的T淋巴细胞免疫,以抑制HER-2阳性肿瘤细胞生长[13]。我们所合成的两种多肽分子CKL9、YL20,都来源于HER-2的表位肽,其中CKL9在原有序列基础上加入半胱氨酸环化,YL20为原有序列连接穿膜肽改造而成,能够提高多肽的稳定性,增加表位肽进入细胞的能力[14-15]。为了验证CKL9、YL20能够具有抗HER-2阳性肿瘤的活性,我们开展了细胞水平、整体动物水平相关的实验。
综合分析试验结果,多肽分子CKL9、YL20在体外孵育小鼠淋巴细胞情况下能刺激诱导淋巴细胞的增殖,增殖效果随孵育时间而明显提高,相对增殖率最高可达16.7%和17.1%,但增殖效果与孵育多肽疫苗的浓度并无明显线性关系,对表达不同程度HER-2的肿瘤细胞的体外抑制实验发现,被CKL9、YL20诱导的淋巴细胞在高效靶比时均能对HER-2阳性肿瘤细胞产生高特异性杀伤,却对HER-2阴性表达的细胞几乎无毒性作用。其中,两种多肽疫苗所诱导激活的细胞毒性T淋巴细胞均能对N87肿瘤细胞产生80%以上的杀伤,对SKOV-3产生30%~50%的杀伤,说明具有特异性。小鼠体内实验中,我们发现相比阴性对照组,预免疫多肽疫苗的实验组小鼠肿瘤增长速度缓慢,说明预免疫CKL9、YL20能诱导小鼠产生特异性细胞免疫,通过记忆T细胞产生较持久的免疫反应,进而能有效地抑制HER-2阳性肿瘤生长。目前国外已进入临床的同类HER2肿瘤疫苗E75疫苗对SKOV-3的杀伤可达72%[16-17]。这显示不同的基因序列的多肽所诱导的CTL反应会有所不同,我们将来会对多肽将进行进一步优化的工作。
(致谢: 本实验在暨南大学广东省生物工程药物重点实验室完成,感谢各位老师和同学的尽心协助。 )
| [1] | 张晓娟, 王文静, 王晶晶, 等. 多肽AP25抗肿瘤活性研究[J]. 中国药理学通报, 2013, 29(9): 1225-9. Zhang X J, Wang W J, Wang J J, et al. Study on anti-tumor effects of polypeptide AP25[J]. Chin Pharmacol Bull, 2013, 29(9): 1225-9. |
| [2] | 张天娇, 田浤, 高向东. 基于HER2的多肽疫苗抗肿瘤作用研究进展[J]. 药学进展, 2013, 37(10): 516-21. Zhang T J, Tian H, Gao X D. Advances in research on antitumor activities of HER2-based peptide vaccines[J]. Prog Pharm Sci, 2013, 37(10): 516-21. |
| [3] | Amin A, Benavides L C, Holmes J P, et al. Assessment of immunologic response and recurrence patterns among patients with clinical recurrence after vaccination with a preventive HER2/neu peptide vaccine: from US Military Cancer Institute Clinical Trials Group Study Ⅰ-01 and Ⅰ-02[J]. Cancer Immunol Immunother, 2008, 57(12): 1817-25. doi:10.1007/s00262-008-0509-2 |
| [4] | 赵莲君, 李琳, 邹征云. 恶性肿瘤个体化多肽疫苗的原理与临床研究[J]. 现代肿瘤医学, 2014, 22(3): 676-9. Zhao L J, Li L, Zhou Z Y, et al. A review of the rationale and clinical trials of personalized peptide vaccination[J]. J Mod Oncol, 2014, 22(3): 676-9. |
| [5] | Foy K C, Miller M J, Moldovan N, et al. Combined vaccination with HER-2 peptide followed by therapy with VEGF peptide mimics exerts effective anti-tumor and anti-angiogenic effects in vitro and in vivo[J]. Oncoimmunology, 2012, 1(7): 1048-60. doi:10.4161/onci.20708 |
| [6] | Mohit E, Hashemi A, Allahyari M. Breast cancer immunotherapy: monoclonal antibodies and peptide-based vaccines[J]. Expert Rev Clin Immunol, 2014, 10(7): 1-35. |
| [7] | Hueman M T, Stojadinovic A, Storrer C E, et al. Analysis of naive and memory CD4 and CD8 T cell populations in breast cancer patients receiving a HER2/neu peptide (E75) and GM-CSF vaccine[J]. Cancer Immunol Immunother, 2007, 56(2): 135-46. |
| [8] | Scott A M, Wolchok J D, Old L J. Antibody therapy of cancer[J]. Nat Rev Cancer, 2012, 12(4): 278-87. doi:10.1038/nrc3236 |
| [9] | Parmiani G, Castelli C, Pilla L, et al. Opposite immune functions of GM-CSF administered as vaccine adjuvant in cancer patients[J]. Ann Oncol, 2007, 18(2): 226-32. |
| [10] | Mittendorf E A, Storrer C E, Shriver C D, et al. Investigating the combination of trastuzumab and HER2/neu peptide vaccines for the treatment of breast cancer[J]. Ann Surg Oncol, 2006, 13(8): 1085-98. doi:10.1245/ASO.2006.03.069 |
| [11] | Hueman M T, Stojadinovic A, Storrer C E, et al. Levels of circulating regulatory CD4+CD25+ T cells are decreased in breast cancer patients after vaccination with a HER2/neu peptide (E75) and GM-CSF vaccine[J]. Breast Cancer Res Treat, 2006, 98(1): 17-29. doi:10.1007/s10549-005-9108-5 |
| [12] | Peoples G E, Gurney J M, Hueman M T, et al. Clinical trial results of a HER2/neu (E75) vaccine to prevent recurrence in high-risk breast cancer patients[J]. J Clin Oncol, 2005, 23(30): 7536-45. doi:10.1200/JCO.2005.03.047 |
| [13] | Mittendorf E A, Gurney J M, Storrer C E, et al. Vaccination with a HER2/neu peptide induces intra-and inter-antigenic epitope spreading in patients with early stage breast cancer[J]. Surgery, 2006, 139(3): 407-18. doi:10.1016/j.surg.2005.06.059 |
| [14] | Beignon A S, Brown F, Eftekhari P, et al. A peptide vaccine administered transcutaneously together with cholera toxin elicits potent neutralising anti-FMDV antibody responses[J]. Vet Immunol Immunopathol, 2005, 104(3-4): 273-80. doi:10.1016/j.vetimm.2004.12.008 |
| [15] | Knutson K L, Schiffman K, Disis M L. Immunization with a HER-2/neu helper peptide vaccine generates HER-2/neu CD8 T-cell immunity in cancer patients[J]. J Clin Invest, 2001, 107(4): 477-84. doi:10.1172/JCI11752 |
| [16] | Patil R, Clifton G T, Holmes J P, et al. Clinical and immunologic responses of HLA-A3+, breast cancer patients vaccinated with the HER2/ neu-derived peptide vaccine, E75, in a phase Ⅰ/Ⅱ clinical trial[J]. J Am Coll Surg, 2010, 210(2): 140-7. doi:10.1016/j.jamcollsurg.2009.10.022 |
| [17] | Efferson C L, Schickli J, Ko B K, et al. Activation of tumor antigen-specific cytotoxic T lymphocytes (CTLs) by human dendritic cells infected with an attenuated influenza A virus expressing a CTL epitope derived from the HER-2/neu proto-oncogene[J]. J Virol, 2003, 77(13): 7411-24. doi:10.1128/JVI.77.13.7411-7424.2003 |

