


2. 白求恩医务士官学校,河北 石家庄 050081;
3. 河北中医学院,科研中心,河北 石家庄 050200
2. Bethune Medical NCO School, Shijiazhuang 050081, China;
3. Hebei University of Chinese Medicine, Research Center, Shijiazhuang 050200, China
血管成纤维细胞结构和功能的改变是血管重构等引起的一系列疾病发病的主要机制之一。抑制血管成纤维细胞增殖是治疗血管性疾病的主要途径之一。丹参(Salvia miltiorrhiza Bunge)是一种草本植物,被广泛应用于医学和保健领域[1-2]。从丹参中分离并鉴定出的化学成分主要分为两类,一类是水溶性成分,如丹参素、丹酚酸A、丹酚酸B(salvianolic acid B,SAB)、丹酚酸C等,其中丹酚酸B含量可达2%~8%,是丹参水溶性成分中最主要的活性成分[3]。以丹酚酸B为例,能对抗氧自由基对心肌细胞的毒害作用,对心肌细胞的保护作用,抗氧化作用等[4];另一类是脂溶性成分,如丹参酮ⅡA(tanshinone ⅡA,TA)、丹参酮I等,其中TA含量相对较高。以TA为例,对动脉粥样硬化具有很好的治疗作用,能够抑制平滑肌细胞中氧自由基的生成,对心血管系统具有保护作用。有研究报道,丹参的活血化瘀功效与成纤维细胞增殖抑制关系密切[5-6],但是有关丹参中SAB和TA对血管外膜成纤维细胞增殖能力的影响,以及对Ang Ⅱ诱导的细胞增殖的影响,国内外鲜有报道。
1 材料与方法 1.1 药品和试剂SAB,CAS#115939-25-8,上海源叶生物科技有限公司,HPLC≥98%,20 mg,Lot:Y16M7H11316;TA 568-72-9,上海抚生实业有限公司,HPLC≥98%,20 mg,Lot:150106;丹参冻干粉(主要成分为salvia miltiorrhiza,SM),批准文号:国药准字Z10970093,400 mg,哈药集团中药二厂;DMEM/F-12 basic(1×),500 mL,北京,Gibco公司,Lot:8116066;0.25% Trypsin-EDTA(1×) 25200-056,100 mL,Grand Island NY 14072,USA,Gibco公司;胎牛血清(fetal bovine serum,FBS),500 mL,澳洲,Clark公司,Lot:JC30131;四甲基偶氮唑盐(methyl thiazolyl tetrazolium, MTT),CAS#298-93-1,Solarbio公司,400 mg;青链霉素混合液(100×),100 mL,Solarbio公司,货号:P1400。
1.2 仪器HERAcell-150 CO2培养箱(美国Thermo Fisher Scientific公司);CKS41倒置相差显微镜(日本Olympus公司);BioBASE生物安全柜(山东济南鑫贝西生物技术有限公司);Varioskan Flah型多功能检测仪(美国Thermo Fisher Scientific公司);Beckman coulter Allegra X-22R超速离心机(美国Beckman coulter公司);流式细胞仪FC500(美国Beckman coulter公司)。
1.3 实验动物SPF级,♂,Sprague-Dawley (SD)大鼠,(6~8) 周龄,购自河北医科大学实验动物中心,许可证号:SCXK(冀) 2013-1-003。
1.4 细胞培养将SD大鼠颈椎脱臼,取出胸主动脉,于解剖显微镜下去除结缔组织,并将血管内膜和中膜刮去,最后将外膜剪成小块,贴壁于培养皿中,加入适量含10% FBS的DMEM/F12培养基,待组织块周围爬出的细胞生长融合时,去除组织块,用0.25% Trypsin-EDTA消化,离心后传代培养,实验用细胞为第(3~5) 代成纤维细胞。
1.5 实验分组实验分3部分进行。首先检测SAB单独用药情况,分组如下:对照组(非药物处理组,Con);实验组,SAB浓度范围为10-3~10-8 mol·L-1、SM组(1 g·L-1,阳性对照组);第2部分检测TA单独用药情况,分组如下:对照组(同上);实验组,TA浓度依此为10-4~10-9 mol·L-1、SM组(同上)。
根据前两部分实验结果分别选择3个浓度进行组合,继续MTT实验,得出两个有效成分用药的最佳浓度配伍组合。进一步再用Ang Ⅱ诱导细胞,观察细胞生长的情况。
1.6 MTT检测细胞增殖情况将成纤维细胞制成悬液,于倒置相差显微镜下计数,以1.0×107 cells·L-1的浓度接种于96孔板中,每孔200 μL,培养过夜后饥饿处理,之后加药刺激,每组6孔,分别培养24、48和72 h后,MTT染色,酶联免疫检测仪测定各孔吸光度值(A值)。比较不同时间和不同浓度SAB和TA单独用药对成纤维细胞的抑制作用强度,分别选出3个抑制浓度后,继续MTT实验,最终筛选出最佳配伍组合的浓度。
1.7 流式细胞术(flow cytometry method,FCM)检测细胞周期取对数生长期的细胞,胰蛋白酶消化,计数后传至平皿中,饥饿处理后加入药物,培养48 h后,收集细胞,70%乙醇固定,4℃放置。流式检测前去除乙醇,PI染色,室温避光孵育30 min,最后FCM检测。
1.8 统计学处理数据均用x±s表示,采用Graphpad Prism 5软件分析数据,组内均数采用Two-way Anova进行组间比较。
2 结果 2.1 SAB对细胞增殖的影响单独应用SAB时,随时间延长,与自身对照相比,SAB对成纤维细胞的生长抑制作用有降低趋势,T=24 h时,SAB(10-3、10-5、10-6、10-7、10-8 mol·L-1)对成纤维细胞均具有明显抑制作用(P<0.01),而阳性对照SM明显促进了细胞的生长;T=48 h时,SAB(10-3、10-5、10-6、10-7、10-4、10-8 mol·L-1)对细胞有明显抑制作用(P<0.01,P<0.05),SM对细胞的生长也有明显抑制作用(P<0.01),与SM相比,SAB(10-3、10-6、10-7 mol·L-1)对细胞的增殖抑制差异具有显著性(P<0.01);T=72 h时,除SAB(10-3 mol·L-1)外(P<0.05),其他浓度对细胞的增殖抑制与SM相比,差异无显著性。综合考虑各个时间点,T=24 h,时间略短,部分浓度药物的作用不能充分体现,而72 h与48 h差别不明显,时间过长有营养成分不足的影响,因此选择作用时间为48 h较为合适。由于10-3 mol·L-1浓度偏高,舍去不用,以排除因其细胞毒性引起的影响。因此,选择抑制作用较明显的3个SAB浓度为10-5、10-6、10-7 mol·L-1。见Fig 1。
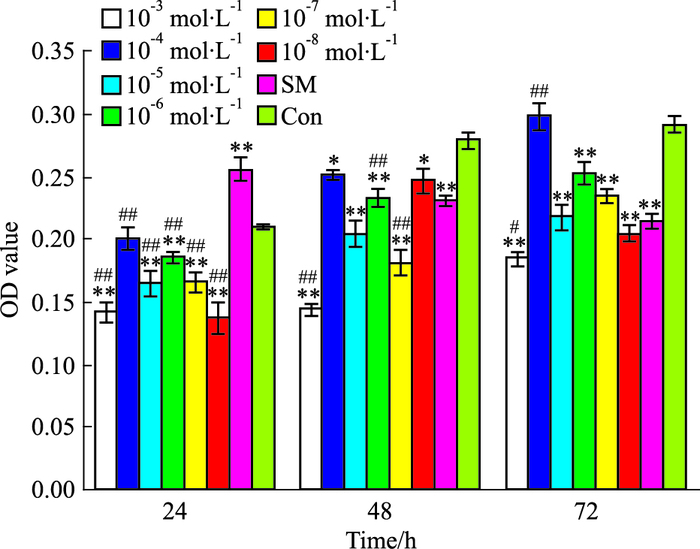
|
| Fig 1 Effects of SAB on cell proliferation(x±s, n=6) *P < 0.05, **P < 0.01 vs respective control group; #P < 0.05, ##P < 0.01 vs respective SM group |
单独应用TA,T=24 h时,TA(10-4 ~10-9 mol·L-1)对成纤维细胞的生长具有明显抑制作用(P<0.01,P<0.05);T=48 h时,TA(10-4~10-8 mol·L-1)对细胞的增殖有明显抑制作用(P<0.01)。与SM相比,不同浓度TA(10-4、10-5、10-7、10-8 mol·L-1)对细胞的增殖抑制差异具有显著性(P<0.01,P<0.05);T=72 h时,TA(10-4~10-9 mol·L-1)与对照组比,差异均具有显著性(P<0.01)。综合考虑,鉴于SAB作用时间选为48 h,TA亦定为T=48 h,作用浓度选为10-5、10-6、10-8 mol·L-1。见Fig 2。
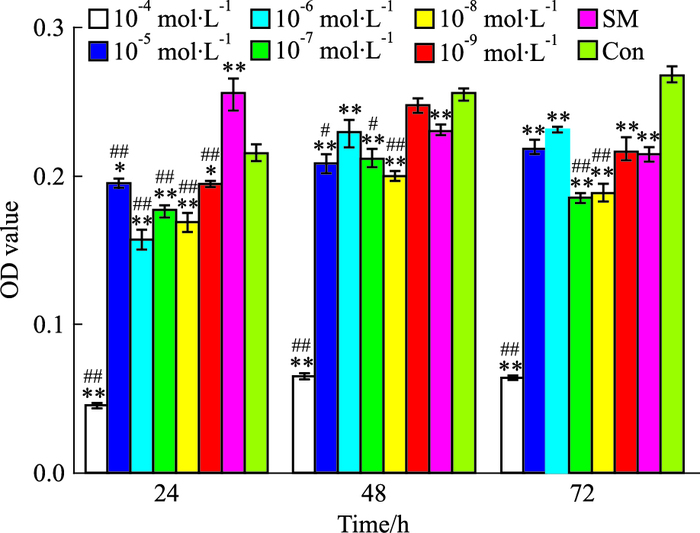
|
| Fig 2 Effects of TA on cell proliferation(x±s, n=6) *P < 0.05, **P < 0.01 vs respective Con group; #P < 0.05, ##P < 0.01 vs respective SM group |
根据上述实验结果对SAB和TA的3个浓度进行配伍组合,得出9个实验组,分别是T5S5组(TA 10-5 mol·L-1+SAB 10-5 mol·L-1)、T5S6组(TA 10-5 mol·L-1+SAB 10-6 mol·L-1)、T5S7组(TA 10-5mol·L-1+SAB 10-7 mol·L-1)、T6S5组(TA 10-6 mol·L-1+SAB 10-5 mol·L-1)、T6S6组(TA10-6 mol·L-1+SAB10-6 mol·L-1)、T6S7组(TA 10-6 mol·L-1+SAB 10-7 mol·L-1)、T8S5组(TA 10-8 mol·L-1+SAB 10-5 mol·L-1)、T8S6组(TA 10-8 mol·L-1+SAB 10-6 mol·L-1)和T8S7组(TA 10-8 mol·L-1+SAB 10-7 mol·L-1)。除以上9组外,还有对照组和SM组,继续进行增殖实验检测。见Fig 3。
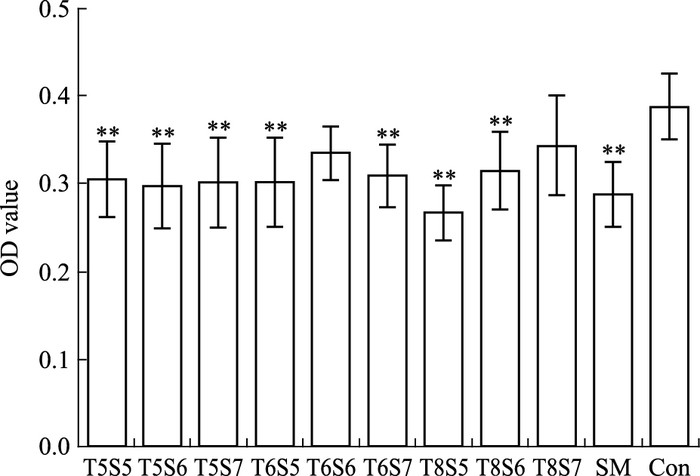
|
| Fig 3 Effects of TA on cell proliferation(x±s, n=6) **P < 0.01 vs Con group |
可看出,不同浓度两种药物的配伍组合均对成纤维细胞的生长具有抑制作用,除T6S6、T8S7外,与对照组相比,其余组的抑制作用差异均具有显著性(P<0.01),其中T8S5对细胞的增殖抑制作用最强。
2.4 Ang Ⅱ诱导后药物对细胞增殖的影响将实验分为12组,分别是对照组、Ang Ⅱ组(10-7 mol·L-1)、Ang Ⅱ+T5S5组、Ang Ⅱ+T5S6组、Ang Ⅱ+T5S7组、Ang Ⅱ+T6S5组、Ang Ⅱ+T6S6组、Ang Ⅱ+T6S7组、Ang Ⅱ+T8S5组、Ang Ⅱ+T8S6组、Ang Ⅱ+T8S7组和Ang Ⅱ+SM组,MTT实验结果如Fig 4所示。
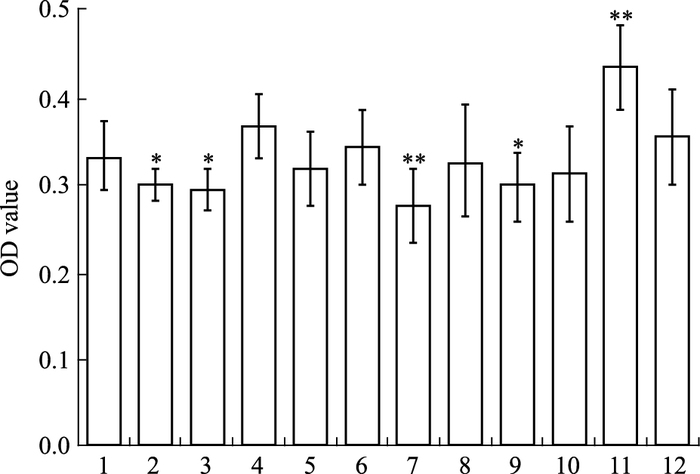
|
| Fig 4 Effects of SAB and TA after the induction of Ang Ⅱ on cell proliferation(x±s, n=6) 1:Ang Ⅱ+T5S5;2:Ang Ⅱ+T5S6;3:Ang Ⅱ+T5S7;4:Ang Ⅱ+T6S5;5:Ang Ⅱ+T6S6;6:Ang Ⅱ+T6S7;7:Ang Ⅱ+T8S5;8:Ang Ⅱ+T8S6;9:Ang Ⅱ+T8S7;10:Ang Ⅱ+SM; 11:Ang Ⅱ; 12:Con.*P < 0.05, **P < 0.01 vs Con group |
Ang Ⅱ对成纤维细胞的生长具有明显的促增殖作用(P<0.01),而加入SAB和TSⅡA配伍组合后,细胞的增殖情况均受到不同程度的抑制,其中T8S5组抑制作用最明显(P<0.01)。
2.5 细胞周期分析应用SAB和TA配伍组合(T8S5) 处理细胞时,G0/G1期细胞比例,较对照组明显增加(P<0.01),较SM组差异无显著性;S期细胞比例较对照组略有降低,较SM组明显减少(P<0.01);G2/M期细胞比例较对照组明显减少(P<0.01),与SM组差异无显著性;表明T8S5配伍抑制了G0/G1期向S期的转化,也抑制了S期向G2/M期的转化,主要将细胞阻滞在G0/G1期。经Ang Ⅱ诱导的T8S5配伍组,G0/G1期细胞比例较对照组明显增加(P<0.01),较Ang Ⅱ组亦明显增加(P<0.01),较T8S5组明显减少(P<0.01);S期细胞较对照组比例增加,较Ang Ⅱ组减少(P<0.01),较T8S5组增加(P<0.01);G2/M期细胞比例较对照组明显减少(P<0.01),较Ang Ⅱ组无明显差异,较T8S5组差异亦无显著性,表明经Ang Ⅱ诱导后,T8S5配伍抑制了G0/G1期向S期的转化,使细胞主要被阻滞在G0/G1期。见Fig 5和Tab 1。
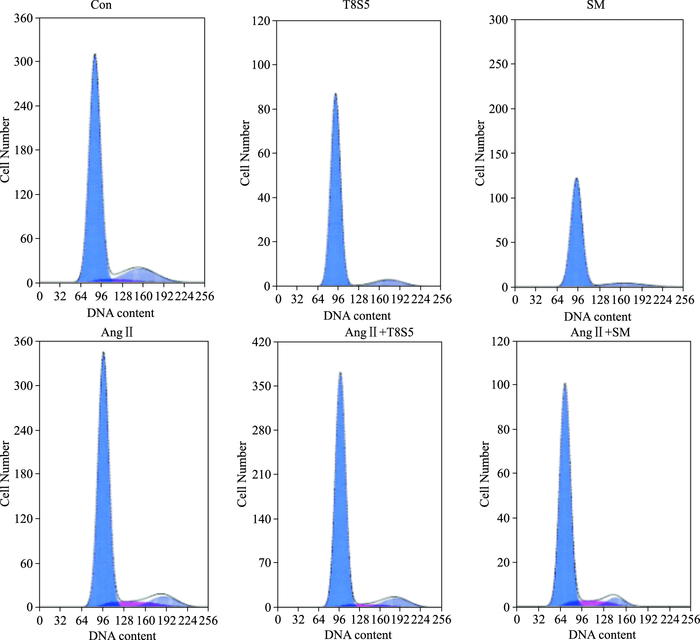
|
| Fig 5 Effects of drugs on cell cycle |
| Group phase | G0/G1 | S | G2/M |
| Con | 81.761±1.13 | 3.779±0.34 | 14.460±0.83 |
| T8S5 | 88.622±1.32** | 2.012±0.38 | 9.365±0.92** |
| SM | 88.258±0.98**△△ | 0.767±0.151**△△ | 10.975±0.691**△△ |
| Ang Ⅱ | 83.318±1.19## | 8.095±0.58**## | 8.587±0.74** |
| Ang Ⅱ+T8S5 | 85.705±1.25**##△△ | 5.304±0.47##△△** | 8.991±0.63** |
| Ang Ⅱ+SM | 85.631±1.06**##△△ | 8.495±0.72**## | 5.874±0.49**##△△ |
| **P<0.01 vs respective con group; ##P<0.01 vs respective T8S5 group; △△P<0.01 vs respective Ang Ⅱ group | |||
近年随着对成纤维细胞的深入研究,我们发现成纤维细胞在血管性疾病中发挥着不可替代的作用,当血管受损时,外膜成纤维细胞首先被快速激活,包括增殖、分化、迁移以及细胞外基质蛋白的上调,细胞因子的释放等等,这些改变尤其是细胞的增殖直接影响中层平滑肌细胞的协调和生长以及内膜的改变,是血管重构的第一个应答子和始动因素[7-8]。SAB和TA是丹参的主要有效成分,研究发现,两者均具有抗心肌缺血、抗氧化、保护心脑血管等作用,但是各有侧重。SAB的抗氧化作用更加突出;而TA以抗炎、抗动脉粥样硬化作用更明显。
本研究首先比较了SAB和TA单独用药对成纤维细胞增殖的影响,结果显示两种成分对细胞的生长均具有不同程度的抑制作用:随作用时间延长(24~72 h),抑制作用有不同程度的增加,但是随药物浓度增加(10-9 mol·L-1~10-4 mol·L-1)对细胞的抑制程度不呈现规律性的增加;SM是丹参多种成分的混合物,作为阳性对照(1 g·L-1)在短时间内(24 h)药效不明显,但48 h后,其能明显抑制成纤维细胞的生长(P<0.01)。因此,综合考虑,最终选择3个SAB浓度(10-5、10-6、10-7 mol·L-1)、3个TA浓度(10-5、10-6、10-8 mol·L-1),并将其进行两两组合,继续分析对细胞增殖的抑制情况,结果显示多个药物组合均能明显抑制细胞生长(P<0.01),其中T8S5抑制作用最强,但是与单独用药相比,这个程度的抑制作用与预期结果有差异,没有出现更加明显的抑制效果。
Ang Ⅱ是血管紧张素的重要组成成分,早期研究我们证实Ang Ⅱ能促进成纤维细胞的增殖、迁移等[9-12],在心脑血管性疾病中扮演重要角色。本研究以Ang Ⅱ诱导的成纤维细胞增殖为模型,采用已筛选出的SAB和TA的最佳配伍组合,检测该配伍组合是否能抑制细胞增殖,从而起到抑制血管增生、血管重塑的作用。结果显示SAB和TA的最佳配伍(T8S5) 明显抑制成纤维细胞增殖(P<0.01),在此基础上又观察了SAB和TA的最佳配伍对细胞周期的影响,表明经Ang Ⅱ诱导前后T8S5配伍组合均是将细胞阻滞在G0/G1期。本研究初步从细胞增殖角度说明了丹参单一有效成分和二者的最佳配伍组合对大鼠胸主动脉成纤维细胞的影响,后续将继续对细胞的迁移、分化以及作用机制进行深入研究。
(致谢: 在此感谢实验室为我提供优越的实验条件和平台,感谢领导和同事对我的指导和帮助以及中国药理学通报编辑老师对本文提出的宝贵意见和建议。 )
| [1] | 李时珍(明)著. 本草纲目[M]. 中医古籍出版社, ISBN: 7800135594, 2011: 7-15. Li S Z.Compendium of Materia Medica[M].Ancient books of tcm press, ISBN: 7800135594, 2011:7-15. |
| [2] | 冯玲玲, 周吉源. 丹参的研究现状与应用前景[J]. 中国野生植物资源, 2004, 23(2): 4-7. Feng L L, Zhou J Y. The research status and application prospection of salvia miltiorrhiza Bunge[J]. Chin Wild Plant Res, 2004, 23(2): 4-7. |
| [3] | 王新宇, 王曼, 孙帅军, 等. 丹酚酸B保护大鼠缺血心肌与炎症小体NLRP3表达的相关性研究[J]. 中国药理学通报, 2016, 32(10): 1383-8. Wang X Y, Wang M, Sun S J, et al. Protective effects of salvianolic acid B on isoproterenol induced myocardial ischemic rats and its relation with NLRP3 expression[J]. Chin Pharmacol Bull, 2016, 32(10): 1383-8. doi:10.3969/j.issn.1001-1978.2016.10.011 |
| [4] | 林超, 刘兆国, 钱星, 等. 丹酚酸B在心血管疾病中药理作用研究进展[J]. 中国药理学通报, 2015, 31(4): 449-52. Lin C, Liu Z G, Qian X, et al. Research progress of salvianolic acid B in cardiovascular disease[J]. Chin Pharmacol Bull, 2015, 31(4): 449-52. |
| [5] | 沈玲红, 王彬尧, 王长谦, 等. 丹参注射液及其活性成分丹参素、原儿茶醛对人红细胞胞浆Ca2+浓度影响的实验研究[J]. 中国中药杂志, 2004, 29(10): 984-8. Shen L H, Wang B Y, Wang C Q, et al. Effect of Danshensu, protocatechualdehyde and Danshen injection on calciumion concentration in cytoplasm of human erythrocytes[J]. China J Chin Mat Med, 2004, 29(10): 984-8. doi:10.3321/j.issn:1001-5302.2004.10.018 |
| [6] | 申绯翡. 丹参注射液对体外培养成纤维细胞的增殖和形态的影响[J]. 中国当代医药, 2012, 19(11): 24-5. Shen F F. Effects of Danshen injection on fibroblast proliferation and morphology[J]. China Mod Med, 2012, 19(11): 24-5. doi:10.3969/j.issn.1674-4721.2012.11.011 |
| [7] | An S J, Boyd R, Wang Y, et al. Endothelin-1 expression in vascular adventitial fibroblasts[J]. Am J Physiol Heart Circ Physiol, 2006, 290(2): H700-8. |
| [8] | Hu Y H, Xu Q B. Adventitial biology: differentiation and function[J]. Arterioscler Thromb Vasc Biol, 2011, 31(7): 1523-29. doi:10.1161/ATVBAHA.110.221176 |
| [9] | 刘培, 邵铁梅, 李雪, 等. 血管紧张素Ⅱ对血管外膜成纤维细胞亚群增殖的影响[J]. 中国药理学通报, 2013, 29(2): 292-3. Liu P, Shao T M, Li X, et al. Effects of angiotensin Ⅱ on vascular adventitial fibroblast subpopulations proliferation[J]. Chin Pharmacol Bull, 2013, 29(2): 292-3. |
| [10] | 刘培, 邵铁梅, 卢海刚, 等. 大鼠血管外膜成纤维细胞亚群生长特性及功能研究[J]. 中国病理生理杂志, 2012, 28(1): 47-52. Liu P, Shao T M, Lu H G, et al. Growth characteristics and function of rat vascular adventitia fibroblast subpopulations[J]. Chin J Pathophysiol, 2012, 28(1): 47-52. |
| [11] | 卢海刚, 刘培, 邵铁梅, 等. 血管紧张素Ⅱ及其受体阻断剂对大鼠血管外膜成纤维细胞亚群迁移和ET-1表达的影响[J]. 药学学报, 2012, 47(11): 1428-33. Lu H G, Liu P, Shao T M, et al. Effects of angiotensin Ⅱ And its receptor blockers on migration and endothelin-1 expression of rat vascular adventitial fibroblast subpopulations[J]. Acta Pharmaceut Sin, 2012, 47(11): 1428-33. |
| [12] | 刘培, 李雪, 焦展, 等. 血管紧张素Ⅱ及其受体拮抗剂对血管外膜成纤维细胞亚群增殖和胶原合成的影响[J]. 中国老年学杂志, 2014, 34(19): 5488-91. Liu P, Li X, Jiao Z, et al. Effects of angiotensin ⅡAnd its receptor antagonist Losartan on proliferation and collagen synthesis in rat vascular adventitial fibroblast subpopulations[J]. Chin J Gerontol, 2014, 34(19): 5488-91. doi:10.3969/j.issn.1005-9202.2014.19.076 |

