


甲基苯丙胺,俗称“冰毒”,是当前最为流行的一种新型合成毒品,其精神依赖性强、复吸率高、神经毒性大,不仅给成瘾者自身造成严重损害,而且引起严重社会、经济和公共卫生问题。大鼠肾上腺嗜铬细胞瘤细胞(rat pheochromocytoma cells,PC12) 起源于神经嵴,因其在神经生长因子(nerve growth factor,NGF)诱导下,形态、结构和功能都类似于交感神经细胞,已成为一个广泛使用的神经元体外细胞模型[1]。微小核糖核酸(microRNAs,MiRNAs)是一类长度约18~25个核苷酸的内源非编码小分子RNAs,通过与靶基因mRNA的互补配对,在转录后水平上对基因的表达进行负调控,从而导致靶基因mRNA的降解或翻译抑制。miRNA agomir是经过特殊化学修饰的miRNA激动剂,通过模拟内源性miRNA进入miRNA诱导的沉默复合体来调节靶基因mRNA的表达而发挥作用,适合进行长期的miRNA过表达功能研究。miRNAs已被发现存在于哺乳动物神经系统中并且部分在脑部富集,对中枢神经系统发育、神经元分化和突触可塑性发挥重要的调控作用[2]。关于miRNAs参与药物成瘾调控的研究自2008年Pietrzykowski等[3]首次报道后迅速增多。越来越多的证据显示,成瘾性物质能诱导miRNAs表达水平的变化,而成瘾相关脑区miRNAs表达的改变直接参与了对成瘾行为的调节。目前,对于miRNAs与可卡因、酒精、尼古丁及阿片类成瘾性药物的研究报道较多,而对miRNAs在甲基苯丙胺成瘾中的调控作用所知甚少,处于起步阶段。因此,研究miRNAs在甲基苯丙胺成瘾中的调控作用,对进一步揭示新型毒品的成瘾机制及发现新的药物作用靶点具有重要意义。
miR-124是一个高度保守、大脑中特定表达的miRNA,占整个大脑中miRNAs的25%~48%[4]。作为中枢神经系统表达最丰富的miRNA,miR-124与药物成瘾密切有关。Chandrasekar等[5]报道显示,慢性可卡因处理可导致中脑腹侧被盖区和海马区miR-124表达明显下调,过表达miR-124可抑制可卡因诱导的条件性位置偏爱效应的形成[6]。Qiu等[7]发现吗啡处理能明显上调小胶质细胞中miR-124表达,Xu等[8]报道氯胺酮给药可导致海马miR-124表达明显升高。与成熟的神经细胞中表达类似,miR-124在PC12细胞表达丰富。先前有研究显示,神经元中谷氨酸受体2亚单位(ionotropic glutamate receptor AMPA alpha 2,GluR2) 是miR-124的一个转录后调控靶基因[9]。GluR2是α-氨基羟甲基异恶唑丙酸型谷氨酸受体(alpha-amino-3-hydroxy-5-methyl-4-isoxazole propionate,AMPA)的一个重要亚型,AMPA受体作为脑内的一种兴奋性神经递质受体,在药物依赖形成过程中起着十分重要的作用。本研究通过观察甲基苯丙胺处理PC12细胞后miR-124和GluR2的表达情况,探讨miR-124参与甲基苯丙胺诱导PC12细胞成瘾的可能的调控机制。
1 材料与方法 1.1 材料 1.1.1 细胞NGF诱导分化的PC12细胞,由中国科学院上海细胞库提供。
1.1.2 药品与试剂盐酸甲基苯丙胺,国家麻醉品实验室,批号1212-9802。RPMI medium 1640 basic(1×)、FBS(fetal bovine serum,Qualified)、HS(horse serum,Qualified)、胰酶及Penicillin-streptomycin(pen strep),美国Gibco(life technologies)公司;二甲基亚砜(DMSO),天津市大茂化学试剂厂;噻唑蓝(MTT),Sigma公司;micrONTM rno-miR-124 agomir、micrONTM agomir Negative Control #22,广州市锐博生物科技有限公司;miRNeasy Mini Kit,QIAGEN公司;SYBR® PrimeScriptTM miRNA RT-PCR Kit,TaKaRa公司;兔抗GluR2多克隆抗体,Millipore公司;兔抗β-actin单克隆抗体、辣根过氧化物酶标记山羊抗兔二抗,博士德公司;SDS-PAGE凝胶配制试剂盒,碧云天生物技术研究所。
1.1.3 实验仪器BCM-1000A超净台,苏净集团苏州安泰空气技术有限公司;HERAcell 240i二氧化碳培养箱,美国Thermo Scientific公司;IX53荧光倒置显微镜,日本OLYMPUS公司;HC-3018R高速冷冻离心机,安徽中科中佳科学仪器有限公司;HVE-50高压灭菌锅,HIRAYAMA MANUFACTURING公司;Stratagene Mx3005P型Real-time PCR仪,美国安捷伦公司;Bio-Rad梯度PCR仪、Mini-PROTEAN 3垂直电泳及转移槽,美国Bio-Rad公司;ChemiImager 5500凝胶成像仪,美国Alpha Innotech公司。
1.2 方法 1.2.1 PC12细胞培养将PC12细胞置于预先配制好的完全培养基(RPMI 1640+10%灭活马血清+5%胎牛血清+0.5%双抗),在饱和湿度,37℃恒温的5% CO2浓度的细胞培养箱中培养,隔天换液,待细胞汇合至70%后传代培养。
1.2.2 MTT检测甲基苯丙胺处理的PC12细胞活力将PC12细胞接种于96孔板中,培养48 h后,吸净培养基,加入梯度稀释好的甲基苯丙胺(10、50、100、200 μmol·L-1)各100 μL,每个药均设置空白对照,每个浓度6个复孔。96孔板于培养箱中孵育48 h,每孔加入20 μL 0.5% MTT,培养箱孵育4 h,显微镜下观察,水不溶性的蓝紫色结晶甲臢沉积在细胞中,停止孵育,尽量弃去板内液体,各组每孔加入100 μL DMSO,水平摇床摇几分钟,使结晶充分溶解,酶标仪490 nm波长测OD值。
1.2.3 甲基苯丙胺处理PC12细胞将PC12细胞接种于96孔板中,接种1×105个细胞至含有1 mL完全培养基的12孔板中,当细胞汇合度大于50%(使给药时的细胞密度在50%~80%)时,弃去孔中的培养基,加入含甲基苯丙胺的培养基,加药后将12孔板继续放入培养箱中培养48 h,提取细胞的总RNA和蛋白。
1.2.4 PC12细胞转染miR-124 agomir接种1×105个细胞至含有1 mL完全培养基的12孔板培养皿孔中,当细胞生长密度大于50%时,弃去孔中的培养基,加入含miR-124 agomir或agomir Negative Control的培养基,轻轻吹打、混匀后,将12孔板继续放入培养箱中培养24 h进行转染。转染成功后,放入培养箱中培养24 h后,弃去12孔板中的培养基,加入含甲基苯丙胺的培养基,继续放入培养箱中培养48 h,提取细胞的总RNA和蛋白。
1.2.5 Real-time PCR检测PC12细胞中miR-124表达按照QIAGEN公司的RNA提取试剂盒miRNeasy Mini Kit说明书进行PC12细胞总RNA提取。RNA浓度、纯度和完整性检测合格后,参照试剂盒说明书进行Poly(A)加尾和反转录反应。Poly(A)加尾和反转录反应条件为:50℃ 60 min,85℃ 5 s。按照Real-time PCR引物设计原则设计引物,以U6作为内参对照,引物的序列见Tab 1,所设计的引物用于大鼠来源的基因。所有PCR引物均由宝生物工程(大连)有限公司合成。按照SYBR® PrimeScriptTM miRNA RT-PCR试剂盒的操作说明书配制Real-time PCR反应体系。Real-time PCR反应条件为:95℃预变性10 s;95℃ 5 s,60℃ 30 s,40个循环。分别扩增miR-124和U6的DNA片段。采用2-ΔΔCT法对Real-time PCR结果进行数据分析,计算ΔCT(域循环数)=CT(目的基因)-CT(内参基因),ΔΔCT=ΔCT(甲基苯丙胺或过表达处理组)-ΔCT(正常对照组),差别倍数=2-ΔΔCT,其中正常对照组的数值均为1。
| MiRNA | Primer sequence |
| miR-124 | 5′-GGCATTCACCGCGTGCCTTA-3′ |
| U6 | 5′-GCTTCGGCAGCACATATACTAAAAT-3′ |
按照每孔PC12细胞加相应比例的RIPA裂解液进行裂解,4℃,14 000×g离心后取上清(蛋白)分装于0.5 mL离心管中,BCA法检测蛋白浓度,其余-80℃保存。取总蛋白30 μg进行8%聚丙烯酰胺凝胶电泳;湿转100 V,90 min将蛋白转移至PVDF膜;5%脱脂奶粉封闭2 h,一抗4℃孵育过夜,洗膜后二抗室温孵育2 h。用Image-Pro Plus 6.0图象处理软件分析目的条带的积分光密度(IOD),与相应加样孔内参β-actin IOD的比值表示目的蛋白的表达强度。以对照组灰度值设为1。
1.2.7 统计学处理采用SPSS 13.0统计软件,数据以x±s表示,组间比较采用单因素方差分析,先进行方差齐性检验,方差齐选用LSD法;方差不齐采用校正的F检验(Welch法),并选用Dunnett′s T3做多重比较。
2 结果 2.1 甲基苯丙胺对PC12细胞活力的影响观察了PC12细胞施加不同浓度甲基苯丙胺48 h后细胞的活力,发现当甲基苯丙胺浓度超过50 μmol·L-1以后,细胞活力开始下降,当浓度达到100 μmol·L-1后,细胞活力明显降低(Fig 1)。因此,接下来实验中,我们以50 μmol·L-1的终浓度作为甲基苯丙胺的最大安全剂量。
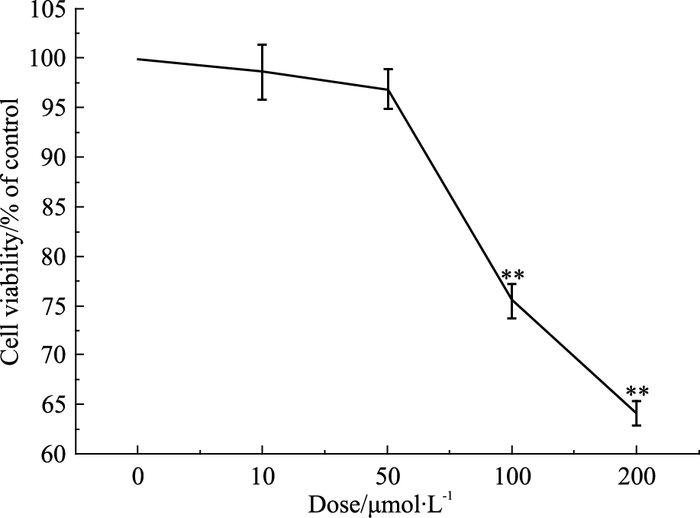
|
| Fig 1 Effect of methamphetamine on PC12 cell viability(x±s, μmol·L-1) **P < 0.01 vs 0 μmol·L-1 |
与正常对照组比较,甲基苯丙胺处理组PC12细胞中miR-124表达明显降低(P<0.01)。与agomir Negative Control组比较,miR-124 agomir组PC12细胞中miR-124表达明显升高(P<0.01),表明PC12细胞转染miR-124 agomir后,成功使miR-124过表达。与agomir Negative Control组比较,agomir Negative Control+甲基苯丙胺组PC12细胞中miR-124的表达明显降低(P<0.01);与agomir Negative Control+甲基苯丙胺组比较,miR-124 agomir+甲基苯丙胺组PC12细胞miR-124表达明显升高(P<0.01)(Fig 2)。
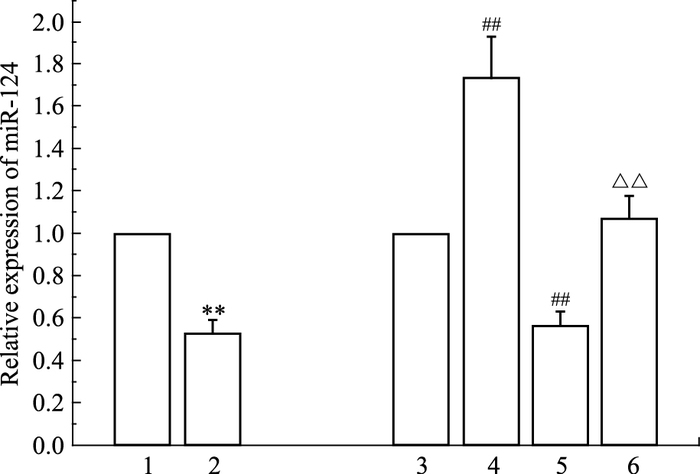
|
| Fig 2 Measurement of miR-124 expression in PC12 cells by Real-time PCR(x±s) 1:control group; 2:methamphetamine group; 3:agomir Negative Control group; 4:miR-124 agomir group; 5:agomir Negative Control+methamphetamine group; 6:miR-124 agomir+methamphetamine group.**P < 0.01 vs control group; ##P < 0.01 vs agomir negative control group; △△P < 0.01 vs agomir negative control+methamphetamine group |
与正常对照组比较,甲基苯丙胺处理组PC12细胞中GluR2蛋白表达明显升高(P<0.01)。与agomir Negative Control组比较,agomir Negative Control+甲基苯丙胺组PC12细胞中GluR2蛋白表达明显升高(P<0.01);与agomir Negative Control+甲基苯丙胺组比较,miR-124 agomir+甲基苯丙胺组PC12细胞GluR2蛋白表达明显降低(P<0.01)(Fig 3)。
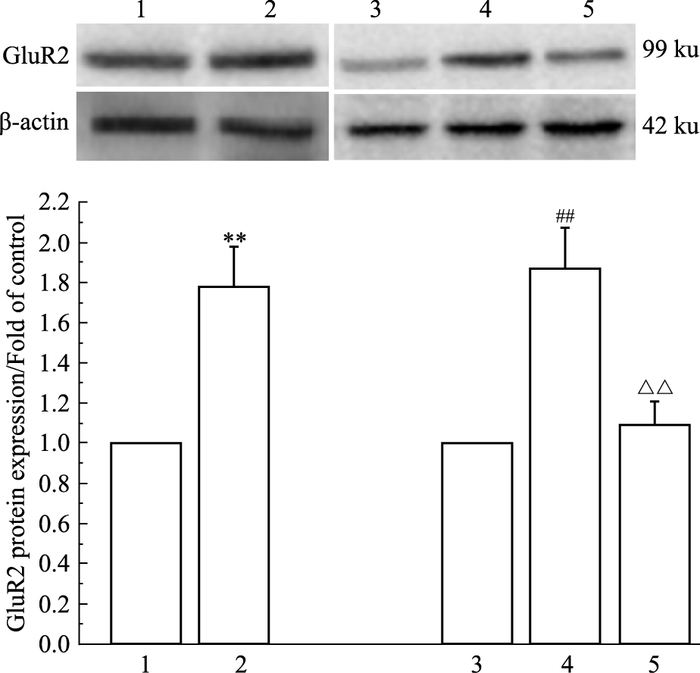
|
| Fig 3 Detection of expression of GluR2 protein in PC12 cells by Western blot(x±s) 1:control group; 2:methamphetamine group; 3:agomir negative control group; 4:agomir negative control+methamphetamine group; 5:miR-124 agomir+methamphetamine group.**P < 0.01 vs control group; ##P < 0.01 vs agomir negative control group; △△P < 0.01 vs agomir Negative control+methamphetamine group |
大量的研究表明,苯丙胺类导致PC12细胞兴奋成瘾的作用时间约在48 h左右[10-11]。时间太短无法建立起成瘾模型,太长又因本身的细胞毒作用易导致神经细胞的衰亡,因此本实验中我们设计甲基苯丙胺作用细胞的时间为48 h,以模拟细胞成瘾的时间。首先我们考察了不同浓度甲基苯丙胺处理48 h对细胞活力的影响,发现当甲基苯丙胺浓度超过50 μmol·L-1后,细胞活力开始下降,当浓度达到200 μmol·L-1后,细胞活力明显降低,因此接下来实验中,我们以50 μmol·L-1的终浓度作为甲基苯丙胺的最大安全剂量,排除由于甲基苯丙胺本身的兴奋性毒性使细胞死亡而对实验结果造成影响。
miRNAs在甲基苯丙胺成瘾中的作用日益受到关注[12]。miR-124作为中枢神经系统中含量最丰富的miRNA,在甲基苯丙胺成瘾形成过程中可能发挥着重要的调控作用。本实验结果显示,甲基苯丙胺处理48 h能使PC12细胞中miR-124表达明显降低。实验中,我们观察发现,甲基苯丙胺处理PC12细胞后,细胞突起变短,有聚集成团现象。先前有研究显示,miR-124能促进神经细胞突起生长[13],因此我们推测甲基苯丙胺使PC12细胞突起变短是由于其下调miR-124表达所致。对miR-124靶基因进行预测,发现miR-124与GluR2的3′UTR保守区域存在多个结合位点。先前有研究报道,额颞痴呆关联的社会行为学损伤小鼠皮层miR-124表达明显降低,进一步实验发现miR-124通过调控Gria2(即GluR2) 参与了其损伤机制[9]。GluR2是AMPA受体的一个重要亚型,其在AMPA受体中的相对含量决定了AMPA受体的功能特性。在成瘾性药物作用下,中脑边缘多巴胺系统及相关脑区神经元AMPA受体功能或数量早期即发生了一系列的变化,从而进一步介导了许多后续效应的发生与维持,AMPA受体的改变可能是触发药物成瘾的“扳机”。因此,我们利用Western blot检测GluR2蛋白表达,与miR-124表达结果刚好相反,甲基苯丙胺处理使PC12细胞中GluR2蛋白表达明显升高,这与先前研究[14]报道甲基苯丙胺可诱导大鼠纹状体和前额叶皮层GluR2表达明显升高相一致。
为了进一步验证miR-124是否通过抑制GluR2参与了甲基苯丙胺诱导的PC12细胞成瘾,我们通过转染miR-124 agomir使PC12细胞中miR-124过表达。结果显示:转染miR-124 agomir 24 h后,观察到PC12细胞中miR-124表达明显升高,表明PC12细胞转染miR-124 agomir后,成功使miR-124过表达。并且我们观察发现,转染agomir对PC12细胞的生长状态没有明显影响。因此,转染成功后,我们进一步给予甲基苯丙胺处理,结果发现:与甲基苯丙胺处理的PC12细胞相比较,过表达miR-124能使PC12细胞中GluR2蛋白表达明显降低。因此,本研究结果表明,miR-124可能通过抑制GluR2参与了甲基苯丙胺诱导的PC12细胞成瘾。
综上所述,我们利用50 μmol·L-1甲基苯丙胺处理PC12细胞48 h,模拟甲基苯丙胺成瘾细胞模型,发现甲基苯丙胺处理可使PC12细胞中miR-124表达明显降低,并且其作用可能与其抑制GluR2表达相关。但miR-124参与甲基苯丙胺成瘾的具体分子机制仍待体内实验的进一步研究阐明。
(致谢: 本实验在南昌大学第一附属医院临床药理研究室实验室完成,感谢全体实验室人员在实验中给予的帮助和支持! )
| [1] | Wang W L, Dai R, Yan H W, et al. Current situation of PC12 cell use in neuronal injury study[J]. Int J Biotechnol Wellness Ind, 2015, 4(2): 61-6. doi:10.6000/1927-3037.2015.04.02.3 |
| [2] | Im H I, Kenny P J. MicroRNAs in neuronal function and dysfunction[J]. Trends Neurosci, 2012, 35(5): 325-34. doi:10.1016/j.tins.2012.01.004 |
| [3] | Pietrzykowski A Z, Friesen R M, Martin G E, et al. Posttranscriptional regulation of BK channel splice variant stability by miR-9 underlies neuroadaptation to alcohol[J]. Neuron, 2008, 59(2): 274-87. doi:10.1016/j.neuron.2008.05.032 |
| [4] | Lagos-Quintana M, Rauhut R, Yalcin A, et al. Identification of tissue-specific microRNAs from mouse[J]. Curr Biol, 2002, 12(9): 735-9. doi:10.1016/S0960-9822(02)00809-6 |
| [5] | Chandrasekar V, Dreyer J L. microRNAs miR-124, let-7d and miR-181a regulate cocaine-induced plasticity[J]. Mol Cell Neurosci, 2009, 42(4): 350-62. doi:10.1016/j.mcn.2009.08.009 |
| [6] | Chandrasekar V, Dreyer J L. Regulation of miR-124, Let-7d, and miR-181a in the accumbens affects the expression, extinction and reinstatement of cocaine-induced conditioned place preference[J]. Neuropsychopharmacology, 2011, 36(6): 1149-64. doi:10.1038/npp.2010.250 |
| [7] | Qiu S, Feng Y, LeSage G, et al. Chronic morphine-induced microRNA-124 promotes microglial immunosuppression by modulating P65 and TRAF6[J]. J Immunol, 2015, 194(3): 1021-30. doi:10.4049/jimmunol.1400106 |
| [8] | Xu H, Zhang J, Zhou W, et al. The role of miR-124 in modulating hippocampal neurotoxicity induced by ketamine anesthesia[J]. Inter J Neurosci, 2015, 125(3): 213-20. doi:10.3109/00207454.2014.919915 |
| [9] | Gascon E, Lynch K, Ruan H, et al. Alterations in microRNA-124 and AMPA receptors contribute to social behavioral deficits in frontotemporal dementia[J]. Nat Med, 2014, 20(12): 1444-51. doi:10.1038/nm.3717 |
| [10] | Kantor L, Park Y H, Wang K K, et al. Enhanced amphetamine-mediated dopamine release develops in PC12 cells after repeated amphetamine treatment[J]. Eur J Pharmacol, 2002, 451(1): 27-35. doi:10.1016/S0014-2999(02)02190-8 |
| [11] | Kantor L, Zhang M, Guptaroy B, et al. Repeated amphetamine couples norepinephrine transporter and calcium channel activities in PC12 cells[J]. J Pharmacol Exp Ther, 2004, 311(3): 1044-51. doi:10.1124/jpet.104.071068 |
| [12] | 江明金, 李婵, 林莹波, 等. MiRNAs在苯丙胺类兴奋剂成瘾中作用的研究进展[J]. 中国药理学通报, 2015, 31(10): 1352-5. Jiang M J, Li C, Lin Y B, et al. Research progress on the role of miRNAs in amphetamine-type stimulants addiction[J]. Chin Pharmacol Bull, 2015, 31(10): 1352-5. doi:10.3969/j.issn.1001-1978.2015.10.006 |
| [13] | Yu J Y, Chung K H, Deo M, et al. MicroRNA miR-124 regulates neurite outgrowth during neuronal differentiation[J]. Exp Cell Res, 2008, 314(14): 2618-33. doi:10.1016/j.yexcr.2008.06.002 |
| [14] | Simões P F, Silva A P, Pereira F C, et al. Methamphetamine changes NMDA and AMPA glutamate receptor subunit levels in the rat striatum and frontal cortex[J]. Ann N Y Acad Sci, 2008, 1139(1): 232-41. doi:10.1196/nyas.2008.1139.issue-1 |

