


2. 南京医科大学第二附属医院疼痛科,江苏 南京 210011
2. Dept of Pain in the Second Affiliated Hospital of Nanjing Medical University, Nanjing 210011, China
骨质疏松是一种严重威胁中老年人健康的常见病和多发病,已成为一个增加医疗开支和经济负担的世界性问题。成骨细胞被认为是骨发生和骨形成最重要的物质基础,其增殖、分化缺陷是骨质疏松发生的根本原因之一[1]。葛根素(puerain)是从中药葛根中提取的单体成分,化学名为8-β-D-葡萄吡喃糖-4′, 7-二羟基异黄酮,具有与雌激素相类似的化学结构[2]。自上世纪50年代被分离鉴定以来,葛根素作为一种异黄酮类植物提取物被广泛用于临床和动物实验研究,其抗骨质疏松作用使其近年来受到了国内外学者的广泛关注[3-4],但其在体外对小鼠前成骨细胞MC3T3-E1的影响研究的相对较少。此外,本课题组前期研究发现葛根素能下调MC3T3-E1细胞中miRNA-204的表达[5],文献报道miR-204的宿主基因TRPM3(transient receptor potential melastatin 3) 可在人成骨细胞中表达[6-7],在小鼠成骨细胞中是否表达缺乏进一步研究证实,葛根素在体外对TRPM3的影响也有待研究。本实验旨在观察葛根素对小鼠成骨细胞MC3T3-E1的增殖、分化和矿化的影响,并进一步探讨葛根素对TRPM3基因表达及对细胞内钙离子浓度的影响,为临床应用葛根素治疗骨质疏松以及全面研究葛根素的药理作用提供实验依据。
1 材料与方法 1.1 试剂与仪器超净工作台(苏州佳宝净化工程设备有限公司);二氧化碳细胞培养箱(Sanyo公司);倒置相差显微镜(Olympus公司);多功能酶标仪(BioTek公司);流式细胞仪(Beckman Coulter公司);荧光实时定量PCR仪(Agilent Technologies Mx 3000P);葛根素标准品(中国药品生物制品检定所):白色粉末状,20 mg/支;β-雌二醇(E2)(国药集团化学试剂有限公司);胎牛血清(Sciencell公司);α-MEM培养基(维森特公司);CCK-8试剂(日本同仁化学研究所);碱性磷酸酶(ALP)检测试剂盒、周期检测试剂盒、BCA蛋白浓度测定试剂盒及钙离子荧光探针Fluo-3AM(均购于碧云天公司);茜素红S染色液(索莱宝公司);mRNA逆转录试剂盒及Realtime PCR SYBR premix 2×(TaKaRa公司);TRIzol、Triton X-100(Invitrogen公司);mRNA引物由上海生物工程有限公司合成。
1.2 细胞培养MC3T3-E1细胞购于中国科学研究院上海细胞库,在含有10%胎牛血清的α-MEM培养基中将细胞置于37 ℃、5% CO2培养箱中培养,待细胞融合度达80%~90%时,用0.25%胰酶消化传代培养。
1.3 细胞增殖检测MC3T3-E1细胞以每孔5×103个的密度接种于96孔板中。24 h后,按实验分组(空白对照组、0.1、1、10 μmol·L-1葛根素组和0.01 μmol·L-1雌激素阳性对照组)更换新鲜培养液,各为6复孔,每孔200 μL。分别干预24、48、72 h后,各孔加入10 μL的CCK-8溶液,继续37℃温育1 h,采用多功能酶标仪在450 nm波长处测定各孔吸光度值测。
1.4 细胞周期检测按照“1.3”所述的实验步骤进行细胞种板和分组。48 h后收集细胞,用1 mL冰浴预冷的PBS洗涤细胞,再用预冷的体积分数为0.70的乙醇固定细胞过夜,预冷的PBS洗涤细胞,每管细胞样品加入0.5 mL配制好的PI染色液,PI染色液的配制参照试剂盒说明书,37℃避光孵育30 min后行流式细胞仪检测,每管细胞样品计数1×104个细胞,通过Modfit LT软件记录分析细胞周期结果。
1.5 碱性磷酸酶活性测定6孔板中每孔接种5×105个MC3T3-E1细胞,实验分组为空白对照组、0.1 μmol·L-1葛根素处理组和0.01 μmol·L-1雌激素组,每组3个复孔。48 h后,吸去上清培养液,PBS洗涤2次,每孔加入200 μL体积分数为0.1的Triton X-100以裂解细胞,冰浴10 min。取上清液用BCA试剂盒测定裂解液中的蛋白质浓度,按照ALP试剂盒操作方法测定ALP活性。
1.6 成骨细胞钙化结节染色MC3T3-E1细胞以每孔5×104个的密度接种于24孔板中,每孔800 μL, 每组重复4个复孔。24 h后,更换为各组含药培养基,每隔3 d换液1次。分别干预14、21、28 d后吸去培养液,PBS洗涤2次,体积分数为0.95的乙醇固定30 min,蒸馏水洗涤3次,每孔加入400 μL 0.2%茜素红S染色液于37℃孵育30 min,再用蒸馏水洗涤2次,最后于显微镜下观察,低倍镜下每孔随机选择5个视野,采用Image J软件分析各组相对矿化结节面积。
1.7 TRPM3 mRNA表达水平检测将MC3T3-E1细胞以5×105个/孔接种于6孔板中,设置空白对照组、0.1 μmol·L-1葛根素组和0.01 μmol·L-1雌激素组,每组3个复孔。48 h后,TRIzol法提取各组细胞的总RNA,使用逆转录试剂盒得到cDNA。实时荧光定量聚合酶链反应(RT-PCR)检测TRPM3 mRNA的相对表达量。TRPM3的引物序列:Forward:5′-CTTTCGGACCCTCTACCACA-3′,Reverse:5′-CACCTCTTCCTCACGCTTCT-3′,扩增片段长度为127 bp;内参基因β-actin Forward: 5′-GTGCTATGTTGCTCTAGACT-3′,Reverse:5′-ATGCCACAGGATTCCATACC-3′,扩增片段长度为174 bp。PCR反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火34 s,共40循环;溶解曲线分析:94℃ 60 s,55 ℃ 30 s,94 ℃ 30 s,1个循环。
1.8 细胞内钙离子(Ca2+)浓度测定按照“1.5”所述的实验步骤进行细胞种板和分组。干预48 h后,收集细胞并用1 mL PBS悬浮细胞,加入终浓度为2.5 μmol·L-1的Flou-3/AM,在37 ℃二氧化碳培养箱中避光孵育45 min,用PBS漂洗2遍后,再次用1 mL PBS悬浮细胞,再次孵育30 min后,用流式细胞仪检测各组细胞荧光阳性率和平均荧光强度,以反映细胞内游离钙离子的浓度,每管细胞样品计数1×104个细胞,激发波长为488 nm,发射波长为530 nm。
1.9 统计学方法数据用x±s表示,利用SPSS 16.0软件进行分析,两组之间采用t检验,多组之间采用单因素方差分析及SNK检验。
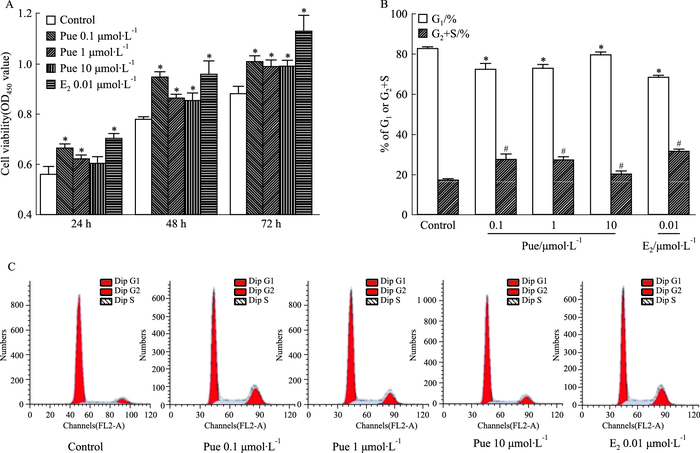
2 结果 2.1 葛根素对MC3T3-E1细胞增殖及周期的影响实验结果显示,与对照组相比,不同浓度葛根素(0.1、1、10 μmol·L-1)均能明显促进MC3T3-E1细胞的增殖,其中0.1 μmol·L-1效果最明显,而阳性对照0.01 μmol·L-1 E2的促进作用最强(Fig 1A)。作用48 h后,观察葛根素对细胞周期的影响。如Fig 1(B、C)所示,与对照组相比,不同浓度的葛根素组和0.01 μmol·L-1 E2组细胞处于G1期比例减少,处于S+G2期比例增加,差异具有统计学意义(P<0.05)。上述结果表明,葛根素可能通过调控细胞周期而促进MC3T3-E1细胞的增殖。
|
| Fig 1 Effect of puerarin on proliferation and cell cycle of MC3T3-E1 cells A:Effect of puerarin on MC3T3-E1 cell proliferation by CCK-8 assay.*P < 0.05 vs control; B~C:Effect of puerarin on MC3T3-E1 cell cycle for 48 h by Flow cytometry assay.*P < 0.05 vs control of G1; #P < 0.05 vs control of G2+S |
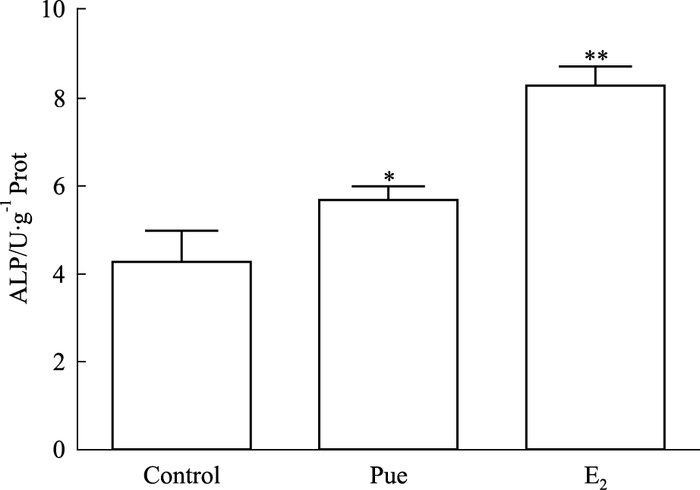
0.1 μmol·L-1葛根素作用MC3T3-E1细胞48 h后,细胞ALP活性的检测结果如Fig 2所示:与空白对照组比较,葛根素组细胞ALP活性明显提高,差异具有统计学意义(P<0.05)。E2组细胞ALP活性与空白组比较也明显提高,差异具有统计学意义(P<0.01)。
|
| Fig 2 Effect of puerarin on ALP activity of MC3T3-E1 cells ALP activity of MC3T3-E1 cells were tested after treatment with puerarin for 48 h.*P < 0.05, **P < 0.01 vs control |
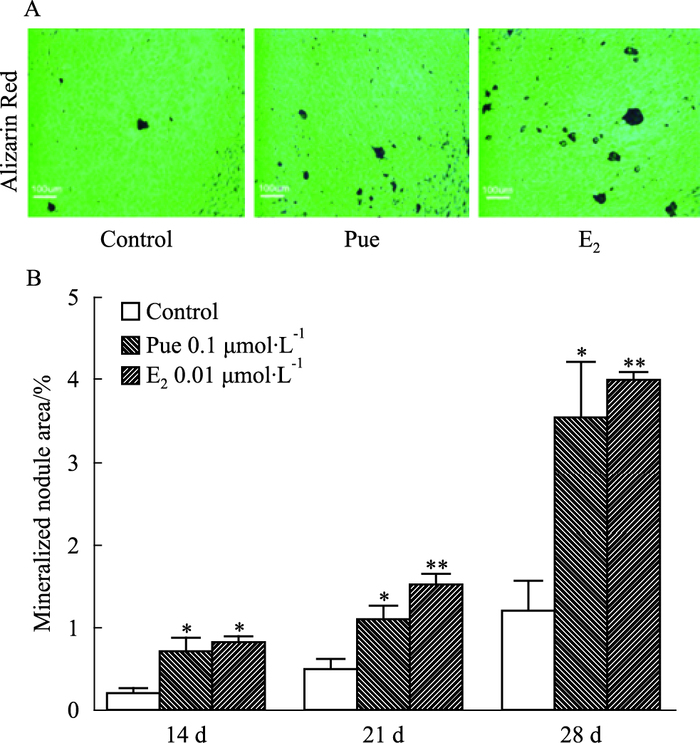
各组细胞培养14、21、28 d后行茜素红染色,显微镜下观察,0.1 μmol·L-1葛根素组和0.01 μmol·L-1 E2组细胞中间可见到大量的钙化结节,形状多为圆形和椭圆形,少数为不规则形,对照组较少(Fig 3A)。每孔随机选择5个视野,分析各组矿化结节面积发现,与对照组相比,葛根素组和E2组钙化结节面积明显增大(P<0.05或0.01)(Fig 3B)。
|
| Fig 3 Effect of puerarin on mineralized nodules of MC3T3-E1 cells A:Mineralized nodules under optical microscope(×100);B:Relative mineralized nodule area after treatment with puerarin for 14, 21 and 28 day respectively.*P < 0.05, **P < 0.01 vs control |
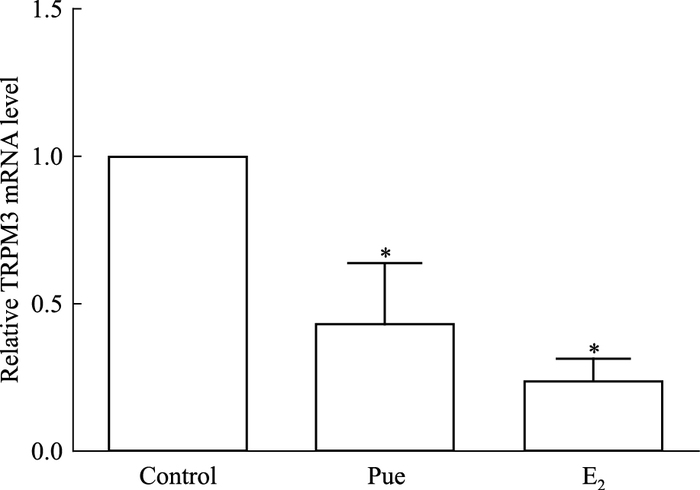
实验结果显示,作用48 h后,与空白组相比较,0.1 μmol·L-1葛根素组和0.01 μmol·L-1 E2组细胞TRPM3 mRNA的表达水平都明显降低,提示葛根素能明显抑制MC3T3-E1细胞TRPM3的转录(P<0.05)。
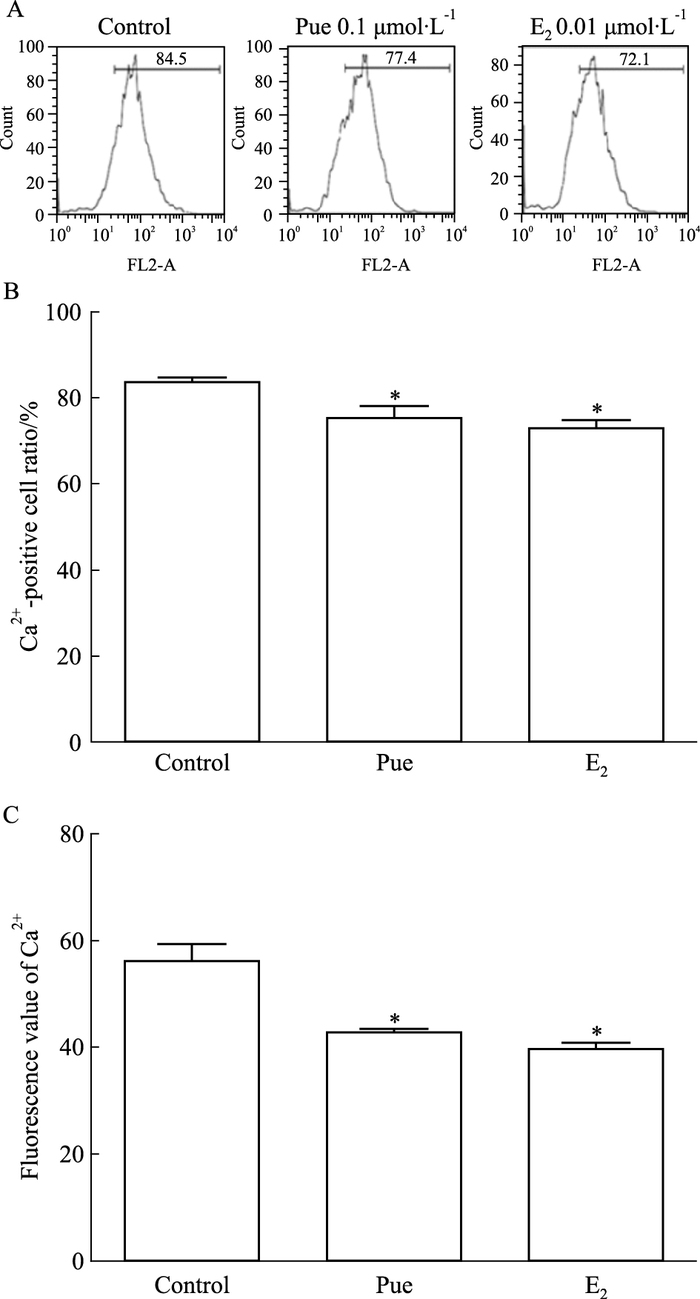
2.5 葛根素对MC3T3-E1细胞内钙离子浓度的影响0.1 μmol·L-1葛根素和0.01 μmol·L-1 E2分别作用于MC3T3-E1细胞48 h后,流式细胞术检测细胞内钙离子浓度结果见Fig 5A。与空白对照组比较,葛根素组和雌激素组细胞钙离子荧光阳性率(Fig 5B)和平均荧光强度(Fig 5C)均下降,差异具有统计学意义(P<0.05)。
|
| Fig 4 Effect of puerarin on TRPM3 mRNA expression of MC3T3-E1 cells TRPM3 mRNA expression levels were assessed by real-time PCR after treatment with puerarin for 48 h.*P < 0.05 vs control |
|
| Fig 5 Effect of puerarin on intracellular Ca2+ concentration in MC3T3-E1 cells A:The intracellular calcium concentration was measured by flow cytometry; B:Calcium positive ratio of MC3T3-E1 cells was detected after treatment with puerarin for 48 h.*P < 0.05 vs control; C:Fluorescence value of calcium in MC3T3-E1 cells was measured after treatment with puerarin for 48 h.*P < 0.05 vs control |
成骨细胞的发育过程可分为细胞增殖、细胞外基质成熟及矿化3个阶段[8]。在细胞增殖阶段,调控细胞周期和生长的基因表达增强;细胞外基质成熟阶段,ALP的合成和分泌增加,ALP是由成骨细胞分泌的同型二聚体糖蛋白,是成骨细胞分化的早期标志,也是矿化的先决条件[9];矿化是成骨细胞分化的最后阶段,也是成骨细胞体外成骨的早期标志。成骨细胞数量不足或活性功能低下是骨质疏松的主要病理基础之一,促进成骨细胞的增殖、分化和矿化,改善成骨细胞功能,对防治骨质疏松有重要意义。
MC3T3-E1细胞是来源于小鼠颅盖骨细胞的前体细胞,具有成骨细胞形成过程中的生物学特性,包括ALP活性和基质成熟及矿化等,已成为体外研究骨质疏松比较有价值的细胞模型[10]。葛根素是从葛根中提取的异黄酮类植物雌激素,研究表明异黄酮类植物雌激素能够增加骨矿物质密度,减少更年期妇女的骨流失[11]。本实验研究发现,低浓度葛根素可以促进MC3T3-E1细胞增殖,促使细胞G1期向S和G2期转化,其中0.1 μmol·L-1为最佳作用浓度,与葛根素在较低浓度下对骨有明显促进作用,在高浓度下促进作用不明显,甚至抑制骨形成的研究结果相一致[12]。诱导48 h后葛根素组细胞ALP活性增强,表明葛根素可以促进MC3T3-E1细胞分化。葛根素组矿化结节面积明显高于对照组,提示葛根素具有促进MC3T3-E1细胞矿化的作用。
我们前期研究发现葛根素能下调MC3T3-E1细胞中miR-204的表达[5],生物学信息表明,miR-204编码基因位于TRPM3的第6个内含子中[6]。研究发现,miR-204的表达在体内[13]和体外[14]与TRPM3基因的表达呈线性相关,表明miR-204和TRPM3可能具有共同的调节机制。TRPM3是钙通透性离子通道TRP家族中M亚家族的一员,可编码对钙离子通透的离子通道蛋白质[15],而细胞内钙离子浓度的变化对成骨细胞活性功能有重要影响[16]。有研究发现,葛根素可降低海马神经元、HaCaT细胞以及人脐静脉内皮细胞内钙离子的浓度[17-19];雌激素受体拮抗剂可增加细胞内钙离子浓度,抑制成骨细胞的矿化能力[20]。本实验结果发现0.1 μmol·L-1葛根素和0.01 μmol·L-1雌激素都能降低MC3T3-E1细胞内的钙离子浓度,分析认为可能是通过减少细胞内钙离子浓度增加细胞外间隙钙离子浓度,从而增强了MC3T3-E1细胞的矿化能力。
总之,本实验结果表明葛根素可促进MC3T3-E1细胞的增值、分化和矿化,可降低TRPM3 mRNA表达水平和细胞内钙离子浓度,为葛根素用于骨质疏松的防治以及全面研究葛根素的药理作用提供实验依据。
(致谢: 本实验在南京中医药大学基础医学院实验室完成,感谢导师詹秀琴教授、感谢实验室赵凤鸣老师的帮助与指导! )
| [1] | Marie P J, Kassem M. Osteoblasts in osteoporosis: past, emerging, and future anabolic targets[J]. Eur J Endocrinol, 2011, 165(1): 1-10. doi:10.1530/EJE-11-0132 |
| [2] | Shibata S, Murakami T, Nishkawa Y, et al. The constituents of Pueraria root[J]. Chem Pharm Bull, 1959, 7(1): 134-6. doi:10.1248/cpb.7.134 |
| [3] | Wei S Y, Chen Y, Xu X Y. Progress on the pharmacological research of puerarin: a review[J]. Chin J Nat Med, 2014, 12(6): 407-14. |
| [4] | Liu H, Li W, Ge X, et al. Coadministration of puerarin(low dose) and zinc attenuates bone loss and suppresses bone marrow adiposity in ovariectomized rats[J]. Life Sci, 2016, 166: 20-6. doi:10.1016/j.lfs.2016.09.024 |
| [5] | 张莹莹, 周建斌, 曾祥伟, 等. 葛根素对成骨细胞增殖能力及靶向Runx2的miRNA的影响[J]. 中国药理学通报, 2016, 32(10): 1457-62. Zhang Y Y, Zhou J B, Zeng X W, et al. Effects of puerarin on proliferation of osteoblasts and Runx2-targeting miRNAs[J]. Chin Pharmacol Bull, 2016, 32(10): 1457-62. doi:10.3969/j.issn.1001-1978.2016.10.024 |
| [6] | Cost N G, Czyzykkrzeska M F. Regulation of autophagy by two products of one gene: TRPM3 and miR-204[J]. Mol Cell Oncol, 2015, 2(4): e1002712. doi:10.1080/23723556.2014.1002712 |
| [7] | Abed E, Labelle D, Martineau C, et al. Expression of transient receptor potential(TRP) channels in human and murine osteoblast-like cells[J]. Mol Membr Biol, 2009, 26(3): 146-58. doi:10.1080/09687680802612721 |
| [8] | Addison W N, Azari F, Sørensen E S, et al. Pyrophosphate Inhibits mineralization of osteoblast cultures by binding to mineral, up-regulating osteopontin, and inhibiting alkaline Phosphatase activity[J]. J Biol Chem, 2007, 282(21): 15872-83. doi:10.1074/jbc.M701116200 |
| [9] | Hoac B, Kiffer-Moreira T, Millán J L, et al. Polyphosphates inhibit extracellular matrix mineralization in MC3T3-E1 osteoblast cultures[J]. Bone, 2013, 53(2): 478-86. doi:10.1016/j.bone.2013.01.020 |
| [10] | Lee Y S, Choi E M. Costunolide stimulates the function of osteoblastic MC3T3-E1 cells[J]. Int Immunopharmacol, 2011, 11(6): 712-8. doi:10.1016/j.intimp.2011.01.018 |
| [11] | Abdi F, Alimoradi Z, Haqi P, et al. Effects of phytoestrogens on bone mineral density during the menopause transition: a systematic review of randomized, controlled trials[J]. Climacteric, 2016, 19(6): 535-45. doi:10.1080/13697137.2016.1238451 |
| [12] | Wang C, Meng M X, Tang X L, et al. The proliferation, differentiation, and mineralization effects of puerarin on osteoblasts in vitro[J]. Chin J Nat Med, 2014, 12(6): 436-42. |
| [13] | Ding M, Lin B, Li T, et al. A dual yet opposite growth-regulating function of miR-204 and its target XRN1 in prostate adenocarcinoma cells and neuroendocrine-like prostate cancer cells[J]. Oncotarget, 2015, 6(10): 7686-700. doi:10.18632/oncotarget |
| [14] | Ying Z, Li Y, Wu J, et al. Loss of miR-204 expression enhances glioma migration and stem cell-like phenotype[J]. Cancer Res, 2013, 73(2): 990-9. doi:10.1158/0008-5472.CAN-12-2895 |
| [15] | Lee N, Chen J, Sun L, et al. Expression and characterization of human transient receptor potential melastatin 3(hTRPM3)[J]. J Biol Chem, 2003, 278(23): 20890-7. doi:10.1074/jbc.M211232200 |
| [16] | Zayzafoon M. Calcium/calmodulin signaling controls osteoblast growth and differentiation[J]. J Cell Biochem, 2006, 97(1): 56-70. doi:10.1002/(ISSN)1097-4644 |
| [17] | 徐晓虹, 郑筱祥. 葛根素对氧糖剥夺大鼠海马神经细胞Ca2+和NO的影响[J]. 中国药学杂志, 2008, 43(17): 1308-12. Xu X H, Zheng X X. Effects of puerarin on the levels of Calcium and Nitric Oxide in cultured hippocampal neurons during oxygen-glucose deprivation[J]. Chin Pharm J, 2008, 43(17): 1308-12. doi:10.3321/j.issn:1001-2494.2008.17.007 |
| [18] | 黄绵庆, 杨照新, 姚茂忠, 等. 葛根素通过神经酰胺通路抑制UVB诱导的HaCaT细胞DNA损伤[J]. 药学学报, 2012, 47(5): 609-13. Huang M Q, Yang Z X, Yao M Z, et al. Puerarin inhibits DNA damage of HaCaT cells induced by UVB via ceramide pathway[J]. Acta Pharm Sin, 2012, 47(5): 609-13. |
| [19] | 肖桂凤, 宁钢民, 葛亚坤, 等. 葛根素对培养人脐静脉内皮细胞钙超载的影响[J]. 中国药理学通报, 2005, 21(11): 1388-92. Xiao G F, Ning G M, Ge Y K, et al. Effect of Puerarin on calcium overload in cultured human umbilical vascular endothelial cells[J]. Chin Pharmacol Bull, 2005, 21(11): 1388-92. doi:10.3321/j.issn:1001-1978.2005.11.027 |
| [20] | 杨冰, 谭彤燕, 梁笃, 等. 雌激素相关受体α特异性抑制剂XCT-790对成骨细胞株MG-63增殖分化的影响[J]. 广州中医药大学学报, 2011, 28(1): 43-5. Yang B, Tan T Y, Liang D, et al. Effect of estrogen-related receptor-alpha specific antagonist XCT-790 on proliferation and differentiation of osteoblast-like cell line MG-63[J]. J Guangzhou Univer Tradit Chin Med, 2011, 28(1): 43-5. |

