


2. 湖北科技学院糖尿病心脑血管病变湖北省重点实验室,湖北 咸宁 437100
2. Hubei Province Key Lab on Cardiovascular, Cerebrovascular, and Metabolic Disorders, Hubei University of Science and Technology, Xianning Hubei 437100, China
在糖尿病并发症中最常见且发病率最高的是心血管疾病[1-3],很大一部分患者最后死因为心血管疾病。但是,糖尿病与心血管疾病之间到底存在什么样的关联目前尚不完全清楚,可以明确的是除了血糖的升高以外,血管功能异常、脂肪酸等因素都对糖尿病患者出现心血管疾病发挥了一定作用,尤其脂肪酸非常有害[4]。相关研究表明,肝脏、心脏等器官摄取脂肪酸后出现氧化,可诱发脂肪肝、心脏病,最终使糖尿病加重。可以说,2型糖尿病一般是糖脂代谢异常联合作用下的结果,而脂肪的危害并不小于血糖升高的危害[5],往往在糖尿病的初期便产生负面作用,也是出现糖尿病并发症的关键因素之一[6]。近年来许多研究者围绕脂代谢异常所致机体损伤及其机制进行了研究,发现脂代谢调控与内质网应激(endoplasmic reticulum stress,ERS)调控有密切关系[7-8]。有文献指出,高浓度的游离脂肪酸可诱导内质网应激反应,最终使胰岛β细胞出现凋亡, 但内质网应激信号通路在高脂诱导的心肌细胞损伤中的作用及其机制目前尚未完全阐明,且仅有一些少量文献中提到相关性报道。基于此,本研究拟评价高脂对心肌细胞生长状态、内质网应激信号通路相关蛋白表达水平、凋亡相关蛋白表达水平的影响,进一步明确高脂刺激诱导的心肌细胞的损伤或凋亡与内质网应激通路之间的相关性。
1 材料与方法 1.1 材料 1.1.1 细胞系H9C2心肌细胞购自上海通派生物有限公司。
1.1.2 试剂GRP78(ab21685)、CHOP(ab11419)、PERKphos(ab192591)、IRE1phos(ab48187)、ATF6(ab11909)、Bcl-2(ab32124) 及Bax(ab32503) 抗体均购自美国Abcam公司;胎牛血清(16000-044) 及细胞培养相关DMEM培养基(12100-046) 均购自美国Gibco公司;普伐他汀(pravastatin,P4498) 购自美国Sigma公司。
1.1.3 仪器超净工作台(苏州佳宝净化工程设备有限公司)、二氧化碳培养箱(上海楚柏实验室设备有限公司)、倒置相差显微镜(日本OLYMPUS公司)、紫外分光光度计(上海谱元仪器有限公司)、酶标仪(美国MD公司)、高速冷冻离心机(德国Sigma公司)、电泳槽(美国伯乐公司)、电转膜仪(美国伯乐公司)、化学发光凝胶成像系统(英国Syngene公司)等。
1.2 方法 1.2.1 棕榈酸的配制在70℃中,用氢氧化钠溶液(0.1 mol·L-1)溶解棕榈酸(palmitic acid,PA),振荡混匀10 min后过滤,制备棕榈酸母液(100 mmol·L-1)。在55℃中用去离子水制备BSA溶液(50 g·L-1),过滤后以1 :19比例将两种液体混匀制备棕榈酸/BSA复合液,振荡10 s后继续水浴10 min,取出后冷却至室温,过滤。然后将上述复合液分别用DMEM培养基进行稀释。
1.2.2 细胞培养H9C2心肌细胞培养于低糖DMEM培养基(含有10 mL·L-1抗生素[2]、55 μmol·L-1的β巯基乙醇、2 mmol·L-1的L-谷氨酰胺、10 mmol·L-1的HEPES、10 mmol·L-1的丙酮酸钠及5 mmol·L-1葡萄糖)中,在37℃培养箱中培养细胞至70%融合时,消化细胞,进行传代,并进行进一步实验。
1.2.3 实验分组① 为了评估高脂刺激强度对心肌损伤的影响,分为对照组、棕榈酸低浓度(0.1 mol·L-1)组、棕榈酸中浓度(0.2 mol·L-1)组、棕榈酸高浓度组(0.4 mol·L-1);② 为了评估高脂刺激时间对心肌损伤的影响,分为对照组、棕榈酸(0.2 mol·L-1)组,棕榈酸刺激时间分别为0、12、24、48 h;③ 为了评估内质网应激抑制剂对逆转脂毒性心肌损伤的影响,分为对照组、棕榈酸(0.2 mol·L-1)组、棕榈酸(0.2 mol·L-1)+抑制剂组,刺激时间为24 h。
1.2.4 CCK-8检测H9C2心肌细胞增殖将对数生长期的细胞,用0.25%胰蛋白酶消化单细胞,重悬于新鲜生长培养液中;细胞2×103~2×104·well-1(即2×107~2×108·L-1)接种于96孔培养板,每孔100 μL;置37 ℃、5% CO2培养箱中培养过夜;根据实验设计,处理96孔板中的细胞,继续置37℃、5% CO2培养箱中培养;设空白对照(仅含培养液)、阴性对照(细胞、培养液、不含药物);药物处理后,直接于每孔中加入CCK-8溶液(每孔10 μL),37℃孵育2~4 h小心吸出孔中的培养液后,每孔再加入100 μL的DMSO;室温静置至沉淀完全溶解(约10 min);用酶标仪经行双波长(检测波长570 nm,参考波长630 nm)检测各孔OD值。取复孔平均值,各孔OD值为:(OD570nm-OD630nm)-(OD570nm-OD630nm)空白孔。细胞死亡率计算:各孔细胞死亡率/%=(OD阴性对照孔-OD处理孔)/ OD阴性对照孔×100%;各孔细胞存活率/%=OD处理孔/OD阴性对照孔×100%。
1.2.5 免疫印迹法检测细胞内蛋白表达水平心肌细胞37℃下培养24 h后,经PBS清洗并裂解刮净,收集到离心管中,13 000 r·min-1下进行离心分离15 min,经蛋白定量后,进行SDS-PAGE凝胶电泳,并转膜,用5%脱脂牛奶封闭1 h,内质网应激通路相关蛋白及凋亡相关蛋白一抗4 ℃孵育过夜,TBST洗3次后,二抗37℃孵育1 h,用ECL显影液处理,经凝胶成像仪检测GRP78、CHOP、PERKphos、IRE1phos、ATF6、Bcl-2及Bax的表达水平。
1.3 统计学方法采用GraphPad软件进行统计学分析,以x±s表示数据,组间比较采用单因素方差分析,两组比较采用t检验。
2 结果 2.1 高脂刺激对H9C2心肌细胞增殖率的影响Fig 1A结果表明,含0.1、0.2、0.4 mmol·L-1棕榈酸的DMEM培养基刺激H9C2心肌细胞24 h,0.2、0.4 mmol·L-1组细胞增殖率与对照组相比,均出现明显下降(P值均<0.05);0.2、0.4 mmol·L-1组之间差异无显著性(P>0.05)。Fig 1B结果表明,含0.2 mmol·L-1棕榈酸的DMEM培养基刺激H9C2心肌细胞0、12、24、48 h后,高脂所致的心肌细胞增殖率呈现时间依赖性降低趋势,与0 h组相比,24、48 h组细胞增殖率均出现明显下降(P<0.05)。因此,下一步实验中我们将棕榈酸[4]浓度设为0.2 mmol·L-1,刺激时间设为24 h。
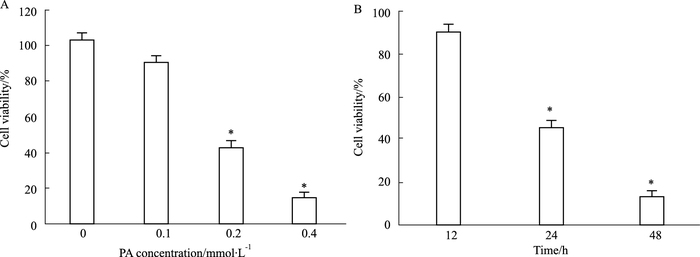
|
| Fig 1 Influence of high palmitic acid (PA) on cell viability in H9C2 cells(x±s, n=5) A: Cell viability was significantly suppressed when PA concentration increased to 0.4 mmol·L-1; B: Cell viability was significantly suppressed when incubated time exceeded 48 h in 0.2 mmol·L-1 PA. *P < 0.05 vs 0 mmol·L-1 group (A) or 12 h group (B). |
Fig 2结果表明,用含0.2 mmol·L-1棕榈酸的DMEM培养基刺激H9C2心肌细胞0、12、24、48 h后,GRP78、CHOP、PERKphos、IRE1phos及ATF6等内质网应激通路相关蛋白的表达在棕榈酸(0.2 mmol·L-1)刺激24、48 h后均出现持续高水平,高于正常对照组(P<0.05),而24 h刺激组及48 h刺激组之间差异无显著性(P>0.05)。
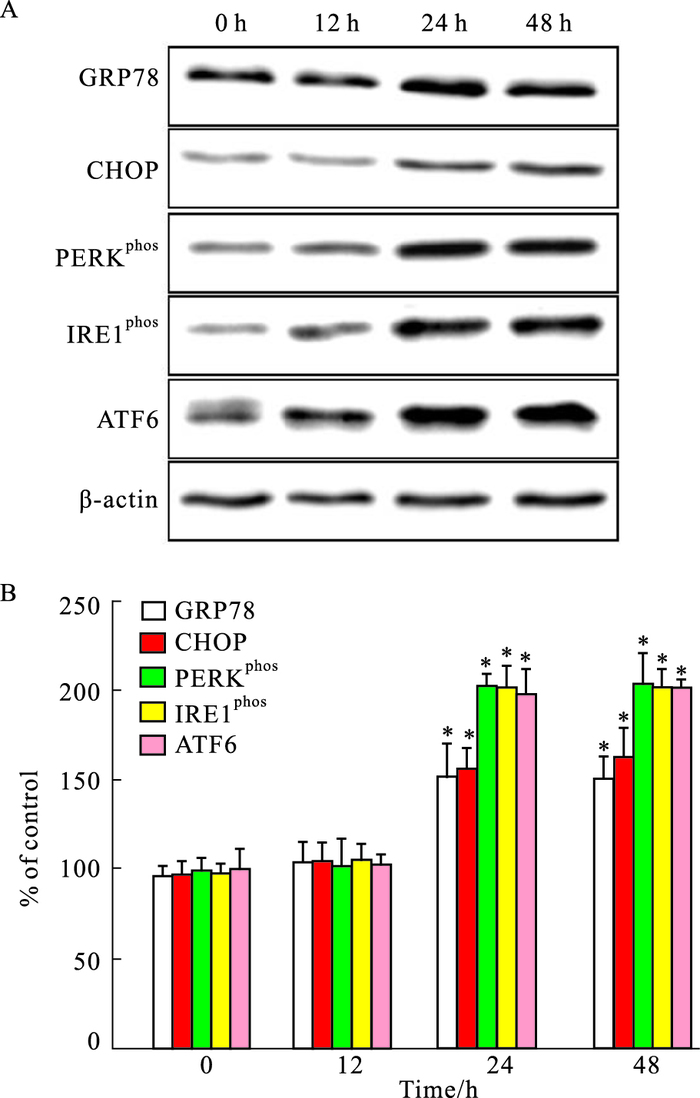
|
| Fig 2 Influence of palmitic acid (0.2 mmol·L-1) on expression of endoplasmic reticulum stress in H9C2 cells (x±s, n=3) A: Representative images of GRP78, CHOP, phos-PERK, phos-IRE1 and ATF6 expression by Western blot; B: Quantitative analysis of GRP78, CHOP, phos-PERK, phos-IRE1 and ATF6 expression. *P < 0.05 vs 0 h group. |
Fig 3结果表明,用含0.2 mmol·L-1棕榈酸的DMEM培养基刺激H9C2心肌细胞0、12、24、48 h后,Bcl-2的表达在棕榈酸(0.2 mmol·L-1)刺激24、48 h后均出现持续高水平,且Bax的表达出现持续低水平,与正常对照组相比差异均有显著性(P<0.05),而24 h刺激组及48 h刺激组之间差异无显著性(P>0.05)。
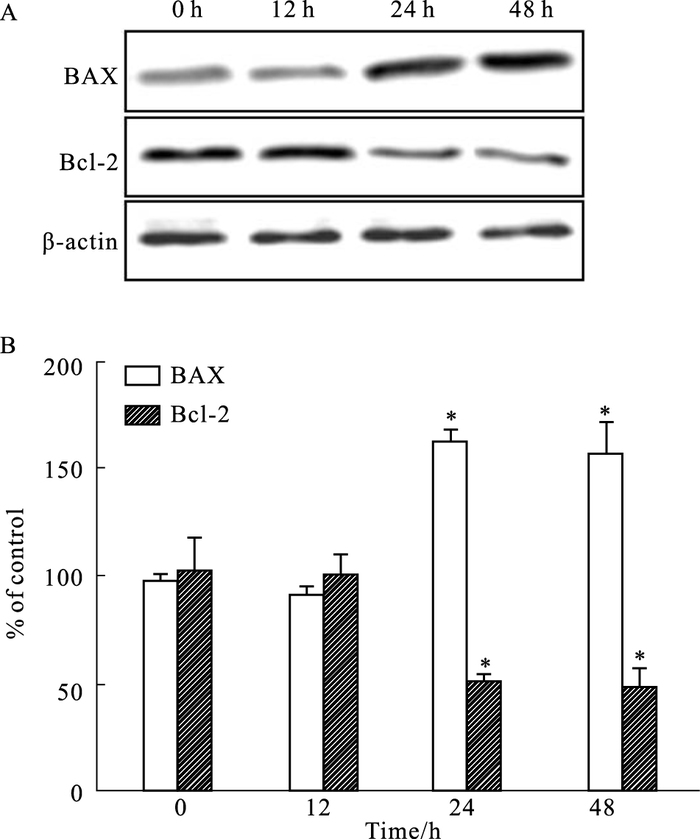
|
| Fig 3 Influence of palmitic acid (0.2 mmol·L-1) on expression of Bax and Bcl-2 in H9C2 cells(x±s, n=3) A: Representative images of Bax and Bcl-2 expression by Western blot; B: Quantitative analysis of Bax and Bcl-2 expression. *P < 0.05 vs 0 h group. |
由Fig 4可见,预处理内质网应激抑制剂pravastatin(10 mol·L-1)组与棕榈酸(0.2 mmol·L-1)刺激组相比,Bcl-2及Bax的表达均恢复至对照组水平(P<0.05)。
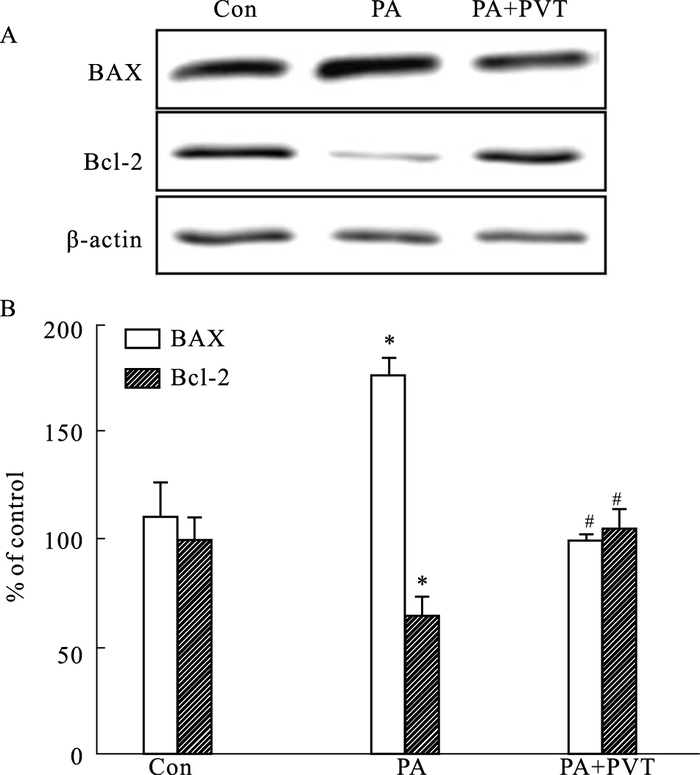
|
| Fig 4 Influence of endoplasmic reticulum stress inhibitor (pravastatin, PVT) on expression of Bax and Bcl-2 in H9C2 cells exposed to PA 0.2 mmol·L-1 for 24 h (x±s, n=3) A: Representative images of Bax and Bcl-2 expression by Western blot; B: Quantitative analysis of Bax and Bcl-2 expression. *P < 0.05 vs control group; #P < 0.05 vs PA group. |
临床上,心肌病共有原发性和继发性两大类。因糖尿病引起的心肌细胞受损而致的心脏称为糖尿病心肌病,又称为糖尿病特异性心肌病,属于继发性心肌病[9-11]。糖脂毒性是2型糖尿病患者发展为糖尿病心肌病的关键因素。近几年,许多研究发现脂毒性可以严重损伤细胞功能甚至出现凋亡,其原因在于过度的营养积累导致脂肪细胞变大,功能出现异常,游离脂肪酸随之升高;但是,脂肪细胞变大却无法增加细胞的脂肪储备功能,甚至降低正常的储脂能力,导致过多的脂肪无处储存,多余的甘油三酯只能流入包括心肌、肝脏、肌肉等非脂肪细胞,而大量脂质累积在心肌中便会导致心脏功能出现异常,也就是脂毒性心肌病[12]。本研究结果显示,高脂刺激心肌细胞时,细胞增殖率出现明显下降,此结果符合文献报道。
糖尿病性心肌病作为一个慢性复杂的病理过程, 如上所述造成细胞糖脂代谢紊乱,并影响到细胞器如线粒体、内质网、肌纤维内膜等的正常功能,尤其内质网应激是近年来新发现的介导糖尿病心肌细胞凋亡的途径之一[13]。内质网是多种重要细胞功能的中心场所,当基因或环境因素改变引起内质网功能受损,未折叠蛋白大量聚集,导致ERS发生[5, 14]。ERS发生时,分子伴侣免疫球蛋白结合蛋白(glucose regulated protein 78,GRP78) 解离,激活内质网跨膜蛋白肌醇需求蛋白1(inositol requiring enzyme 1,IRE1)、RNA依赖的蛋白激酶样激酶(PKR like ER kinase,PERK)和活化的转录因子6(activating transcription factor 6,ATF6),触发未折叠蛋白反应(unfolded protein response,UPR),通过内质网膨胀,蛋白折叠能力增强,抑制转录和翻译减少蛋白质合成及未折叠和(或)错误折叠的蛋白质清除增加等,恢复内质网稳态。若这些仍然不能恢复内质网稳态,则将触发细胞凋亡程序[15]。ERS过强时,促凋亡机制占主导,能够独立地诱导细胞凋亡,其主要机制之一就是诱导CCAAT/增强子结合蛋白(CCAAT/enhancer-binding protein-homologous protein,CHOP)表达。由此认为,内质网应激信号通路的激活及其相关蛋白的表达调控可成为糖尿病性心肌细胞损伤的机制之一,减轻心肌细胞内质网应激有望延缓糖尿病心肌病的发生发展。本研究结果显示,高脂刺激心肌细胞24 h后GRP78、PERKphos、IRE1phos、ATF6、CHOP等内质网应激信号通路表达明显增高,此结果说明,高脂刺激下内质网应激信号通路被激活导致相关信号通路蛋白的表达出现了一定升高,但其升高是否与心肌细胞脂毒性凋亡有明显相关性需要进一步研究。
目前在细胞凋亡领域中,Bcl-2家族是备受瞩目的核心调控体系,发挥着“开关”的枢纽作用,Bcl-2家族包含促凋亡因子和抗凋亡因子,其中代表性的促凋亡因子有Bax,代表性的抗凋亡因子有Bcl-2。生理状态下,Bax与Bcl-2保持促凋亡和抗凋亡的动态平衡,从而使细胞的状态趋于稳定。病理状态时,促凋亡蛋白Bax表达升高、抗凋亡蛋白Bcl-2表达降低,出现凋亡。本研究结果显示,用含高脂DMEM刺激H9C2心肌细胞,Bax的表达在高脂刺激24、48 h后均出现持续高水平,而Bcl-2的表达出现持续低水平,均与0 h刺激组差异有显著性(P<0.05),而24 h刺激组及48 h刺激组之间差异均无显著性(P>0.05)。本研究另一组数据表明,预处理内质网应激抑制剂pravastatin的高脂组与单纯高脂组相比,Bcl-2及Bax的表达均恢复至对照组水平(P<0.05)。此数据提示内质网应激抑制剂可以成功逆转高脂所致的心肌细胞损伤或凋亡,也又一次证明了内质网应激信号通路是高脂刺激导致心肌损伤的关键机制。
综上所述,高脂刺激能有效抑制心肌细胞的生长,诱发内质网应激相关蛋白的表达,同时使促凋亡蛋白Bax及抗凋亡蛋白Bcl-2的表达出现异常,并有效被内质网应激抑制剂所逆转。这提示调控内质网应激所致的细胞凋亡对糖尿病性心肌损伤的防治有指导意义。
| [1] | Caroline S F, Sherita H G, Cheryl A. Update on prevention of cardiovascular disease in adults with type 2 diabetes mellitus in light of recent evidence: a scientific statement from the american heart association and the american aiabetes association[J]. Diabetes Care, 2015, 38(9): 1777-803. doi:10.2337/dci15-0012 |
| [2] | Yeun S C, Jung S L, Woocheol K. Pulmonary langerhans cell histiocytosis in an adult male presenting with central diabetes insipidus and diabetes mellitus: a case report[J]. Tuberc Respir Dis (Seoul), 2015, 78(4): 463-8. doi:10.4046/trd.2015.78.4.463 |
| [3] | 吴佳蕾, 许惠琴, 沈存思. 山茱萸配伍组分对糖尿病大鼠心血管病变的保护作用[J]. 中国药理学通报, 2013, 29(3): 382-6. Wu J L, Xu H Q, Shen C S. Protective effects of the Cornus of ficinalis compatibility of components on cardiovascular lesion in diabetic rats[J]. Chin Pharmacol Bull, 2013, 29(3): 382-6. |
| [4] | 李哲, 王瑞英, 张志成. 血清游离脂肪酸代谢及成分变化与2型糖尿病患者大血管并发症的关系[J]. 转化医学杂志, 2016, 5(4): 219-23. Li Z, Wang R Y, Zhang Z C. The relationship between serum free fatty acid metabolism and changes of components and macrovascular complications in patients with type 2 diabetes mellitus[J]. J Transl Med, 2016, 5(4): 219-23. |
| [5] | 陈名道. 胰岛β细胞的"糖毒性"、"脂毒性"与"糖脂毒性"[J]. 中华内分泌代谢杂志, 2009, 25(1): 5-8. Chen M D. The "carbohydrate toxicity", "lipid toxicity" and "glycolipid toxicity" of islet β cells[J]. Chin J Endocr Metab, 2009, 25(1): 5-8. |
| [6] | 莫雷同, 吴铿. 脂毒性在糖尿病心肌病发病机制中的作用研究进展[J]. 现代医药卫生, 2015, 31(10): 1489-91. Mo L T, Wu J. Advances in studies on the role of lipid toxicity in the pathogenesis of diabetic cardiomyopathy[J]. Mod Med Health, 2015, 31(10): 1489-91. doi:10.3969/j.issn.1009-5519.2015.10.018 |
| [7] | 吴斌, 张玫, 吕瑞雪. 表氧化二十碳三烯酸对游离脂肪酸诱导胰岛β细胞凋亡的抑制作用[J]. 世界华人消化杂志, 2012, 20(13): 1088-93. Wu B, Zhang M, Lyu R X. Inhibitory effect of epoxidized eicosatrienoic acid on apoptosis induced by free fatty acid in[J]. World Chin J Digestol, 2012, 20(13): 1088-93. |
| [8] | 吉慧珍, 杨静, 邢小平. 内质网应激、miR-375在高糖高脂介导胰岛β细胞凋亡中的作用[J]. 中国卫生检验杂志, 2016, 26(14): 2065-7. Gu H Z, Yang J, Xing X P. Endoplasmic reticulum stress, miR-375 in high glucose and high fat mediated pancreatic β-cell apoptosis in the role[J]. Chin J Health Lab Technol, 2016, 26(14): 2065-7. |
| [9] | Zoltán V V, Zoltán G, Lucas L. Interplay of oxidative, nitrosative/nitrative stress, inflammation, cell death and autophagy in diabetic cardiomyopathy[J]. Biochim Biophys Acta, 2015, 1852(2): 232-42. doi:10.1016/j.bbadis.2014.06.030 |
| [10] | Guanghong J, Vincent G D, James R S. Insulin resistance and hyperinsulinaemia in diabetic cardiomyopathy[J]. Nat Rev Endocrinol, 2016, 12(3): 144-53. |
| [11] | Yan X Q, Chen J, Zhang C. FGF21 deletion exacerbates diabetic cardiomyopathy by aggravating cardiac lipid accumulation[J]. J Cell Mol Med, 2015, 19(7): 1557-68. doi:10.1111/jcmm.12530 |
| [12] | Raffay S K, Aalap C, Konstantinos D. Fish oil selectively improves heart function in a mouse model of lipid-induced cardiomyopathy[J]. J Cardiovasc Pharmacol, 2013, 61(4): 345-54. doi:10.1097/FJC.0b013e318283d845 |
| [13] | Xu J C, Zhou Q, Xu W. Endoplasmic reticulum stress and diabetic cardiomyopathy[J]. Exp Diabetes Res, 2012, 2012(1687-5214): 827971. |
| [14] | 李赫宁, 李兰芳, 陈临溪. 内质网自噬—疾病防治的新靶标[J]. 中国药理学通报, 2015, 31(3): 302-8. Li H N, Li L F, Chen L X. Reticulophagy-a new target for diseases prevention and treatment[J]. Chin Pharmacol Bull, 2015, 31(3): 302-8. |
| [15] | Liu M Q, Chen Z, Chen L X. Endoplasmic reticulum stress: a novel mechanism and therapeutic target for cardiovascular diseases[J]. Acta Pharmacol Sin, 2016, 37(4): 425-43. doi:10.1038/aps.2015.145 |

