


2. 敦煌医学与转化省部共建教育部重点实验室,甘肃 兰州 730000;
3. 甘肃省空间辐射生物学重点实验室,中国科学院近代物理研究所,甘肃 兰州 730000
 ,
WANG Lei1,
ZHANG Li-ying1,
HE Jin-peng3,
DING Nan3,
REN Chun-zhen1,
LI Ling1,
WANG Feng-mei1,
LIU Yong-qi1,2
,
WANG Lei1,
ZHANG Li-ying1,
HE Jin-peng3,
DING Nan3,
REN Chun-zhen1,
LI Ling1,
WANG Feng-mei1,
LIU Yong-qi1,2

2. Key Laboratory of Dunhuang Medicine and Transformation at Provincial and Ministerial Level, Lanzhou 730000, China;
3. Gansu Key Laboratory of Space Radiobiology, Institute of Modern Physics, Chinese Academy of Sciences, Lanzhou 730000, China
骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)是干细胞家族的重要成员,来源于发育早期的中胚层和外胚层,属于多能干细胞,因其具有多向分化潜能、造血支持和促进干细胞植入、免疫调控和自我复制及参与损伤组织的修复等能力已成为治疗骨科、心血管、神经、肿瘤、组织退化、炎症损伤等领域强有力的工具[1-3]。在体内或体外特定的诱导条件下,可分化为骨、软骨、神经、心肌、脂肪、内皮等细胞。因此,目前BMSCs已广泛地应用于临床作为组织损伤修复的理想种子细胞。然而,目前随着辐射医学在临床诊断及临床治疗中的应用,BMSCs受电离辐射损伤后是否影响其分化潜能的研究较少。黄芪多糖(Astragalus polysaccharide,APS)作为黄芪的主要成分之一,研究发现具有抗癌、抗辐射、抗应激、抗氧化、减轻化疗药物的毒副等作用[4-7]。所以本实验主要研究辐射损伤后对骨髓间充质干细胞向神经细胞分化的影响,以及黄芪多糖对此过程的防护作用,为骨髓间充质干细胞的正常应用于临床提供防护依据。
1 材料与方法 1.1 仪器及试剂二氧化碳培养箱(美国Thermo公司,型号:SKYJH-1112);X-ray(美国Faxitron公司,型号:Cabinet X-ray system);infinite m200 pro型全波长酶标仪(瑞士TECAN公司);0.25%胰蛋白酶(美国Hyclone公司,批号:J150037);CCK-8试剂盒(上海东仁公司,批号:JQ702);黄芪多糖(上海源叶生物科技有限公司,批号:ZD1219LA13);NSE抗体(Abcam,批号:ab79757);Nestin抗体(Proteintech,批号:66259-1-Ig);兔抗人GAPDH多克隆抗体(abcam, 批号:ab9485);山羊抗兔IgG辣根过氧化物酶标记(北京中杉金桥,货号:ZB-2301);山羊抗小鼠IgG辣根过氧化物酶标记(北京中杉金桥,货号:ZB-2305);甲苯胺蓝染液(北京索来宝公司,货号:T8240)。
1.2 细胞来源及培养HMSC-bm(赛业生物科技有限公司,批号:7500)。细胞培养液为BMSCs专用培养基(赛业生物科技有限公司),内含440 mL成人骨髓间质干细胞基础培养基、50mL成人骨髓间质干细胞专用胎牛血清、5 mL青霉素链霉素(双抗)和5 mL谷氨酰胺(批号:HUXMA-90011)。
黄芪多糖用BMSCs专用培养基溶解,浓度为1 g·L-1。细胞用60 mm培养皿,置于37 ℃、5% CO2孵箱中培养。每3 d换液1次,待细胞融合度约达到90%后,0.25%胰蛋白酶对其消化传代,第5代细胞用于实验。
1.3 照射条件和实验分组RX-650 X射线辐照装置由中国科学院近代物理研究所提供,剂量率为0.4 Gy·min-1(100 keV,5 mA),总剂量2 Gy,时间5 min,距辐射源高度70 cm,实验分对照组(CTRL),单纯加药组(APS),单纯照射组(IR),加药照射组(IR+APS)。
1.4 实验方法 1.4.1 CCK-8法检测不同浓度的APS对辐射细胞增殖的影响BMSCS培养到90%的融合度时用胰酶消化后制成单细胞悬液,分别接种于96孔板(每孔2×103/100 μL),培养至细胞贴壁。贴壁后加入不同浓度为的APS 100 μL,对照孔和模型孔加入100 μL的BMSCs专用培养基,每组设6个复孔,其余孔加入200 μL PBS。继续培养3 d,照射前弃掉50 μL培养基,空白组用0.3 mm厚的铅板进行遮挡,其余孔进行X射线2.0 Gy剂量辐照, 辐射后弃掉剩余的培养基,加入100 μL的BMSCs专用培养基。放入培养箱中继续培养,分别于1~5 d进行CCK-8法检测各组细胞增殖水平。
1.4.2 经典的化学药物诱导人骨髓间充质干细胞向神经分化及成神经细胞数量BMSCS细胞培养到90%的融合度时用胰酶消化,用细胞计数仪计数,并以1×108·L-1接种于35 mm的培养皿中,待细胞贴壁后,单纯加药组和辐射加药组加入50 mg·L-1的APS 2 mL,其余组加入等体积的BMSCs专用培养基,放入培养箱中继续培养3 d,并用2 Gy的X射线进行辐射,辐射后弃去剩余的培养基,加入含1 mmol·L-1 β-巯基乙醇的无血清培养液,放入培养箱中继续培养5 h,显微镜下观察细胞形态的变化,计数成神经细胞的数量。
1.4.3 甲苯胺蓝染色观察BMSCs分化为神经细胞尼氏体的表达变化BMSCs细胞培养到90%的融合度时用胰酶消化,用细胞计数仪计数,并以1×108·L-1接种于35 mm的培养皿中,待细胞贴壁后,单纯加药组和辐射加药组加入50 mg·L-1的APS 2 mL,其余组加入等体积的BMSCs专用培养基,放入培养箱中继续培养3 d,并用2 Gy的X射线进行辐射,辐射后弃去剩余的培养基,加入含1 mmol·L-1 β-巯基乙醇的无血清培养液,放入培养箱中继续培养5 h,弃去培养基,用PBS洗2次,加入1 mL 4%的中性多聚甲醛固定20 min,弃去多聚甲醛,用双蒸水冲洗2次,加入甲苯胺蓝染色2 mL,放入37℃孵育30 min,弃去甲苯胺蓝用流水冲洗2次,放入显微镜下观察并拍照。使用Image Pro6.0软件对阳性表达尼氏体的密度进行分析,每组选取4张图片,计算每组尼氏体的平均密度,平均密度越大,说明尼氏体的表达量越多。
1.4.4 Western blot检测神经相关蛋白NSE和Nestin的表达收集各组细胞后提取各组细胞蛋白,BCA法检测蛋白浓度,并用RIPA调整蛋白浓度。各组取50 μg蛋白上样,并经5%、12%的凝胶电泳分离,转膜,5%的脱脂奶粉室温封闭2 h后,放在4 ℃冷库分别与相应的一抗(1 :1 000) 相结合,摇床过夜; 次日分别与山羊抗兔和山羊抗小鼠辣根酶标记的二抗(1 :4 000) 结合反应,ECL发光显色后,X曝光机进行显影,并用扫描仪扫描相应的条带,采用Image J软件对图像进行光灰度分析,以GAPDH作内参,计算各组蛋白的相对表达量。
2 结果 2.1 不同浓度黄芪多糖对辐射后BMSCs细胞增殖的影响与对照组相比较,辐射后各组BMSCs增殖明显降低(P<0.05), 与辐射组相比较,12.5 mg·L-1的黄芪多糖在辐射后d 4和d 5可以明显促进BMSCs的增殖(P<0.05);25 mg·L-1的黄芪多糖在辐射后d 3、4和d 5时可以明显促进BMSCs的增殖(P<0.05);50和100 mg·L-1的黄芪多糖具有明显的促进辐射后BMSCs的增殖(P<0.05);当黄芪多糖在50 mg·L-1,与其它浓度在同一时间点相比细胞的OD值最大,故选50 mg·L-1黄芪多糖作为最佳药物浓度,见Tab 1。
| Group | A450 nm(OD values) | ||||
| 24 h | 48 h | 72 h | 96 h | 120 h | |
| CTRL | 0.327±0.013 | 0.402±0.014 | 0.514±0.019 | 0.625±0.007 | 0.755±0.011 |
| 0+IR | 0.209±0.016* | 0.295±0.009* | 0.394±0.016* | 0.461±0.010* | 0.489±0.007* |
| 12.5mg·L-1+IR | 0.224±0.015* | 0.310±0.016* | 0.397±0.022* | 0.499±0.011*# | 0.550±0.016*# |
| 25 mg·L-1+IR | 0.254±0.026* | 0.328±0.019*# | 0.406±0.013*# | 0.528±0.012*# | 0.576±0.015*# |
| 50 mg·L-1+IR | 0.284±0.013*# | 0.377±0.012*# | 0.460±0.017*# | 0.576±0.010*# | 0.664±0.020*# |
| 100 mg·L-1+IR | 0.287±0.007*# | 0.352±0.024*# | 0.450±0.024*# | 0.556±0.011*# | 0.629±0.018*# |
| *P<0.05 vs CTRL;#P<0.05 vs IR | |||||
加入成神经诱导液诱导5h后,倒置显微镜下观察,对照组和单纯加药组中见胞体成纤维样细胞的BMSCs中部分细胞胞体变小、变圆,折光性增加,并伸出了细长的突触,呈典型的双极和多极,部分突触联合成网;辐射后胞体变小、变圆,折光性增强的细胞变少,分化为神经细胞的突触也变短,而黄芪多糖干预组胞体变小、变圆,折光性增强的细胞变多。见Fig 1。
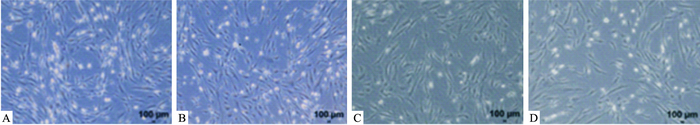
|
| Fig 1 Changes of cell morphology in each group(5 h, ×50) A:CTRL; B:APS; C:IR; D:IR+APS |
对照组和单纯加药组诱导后可见部分细胞分化为神经细胞,而经2 Gy的X射线辐射后,分化为神经细胞的数量明显减少(P<0.05),照射前3 d加入50 mg·L-1黄芪多糖干预后,分化为神经细胞的数量增多(P<0.05)。见Fig 3。
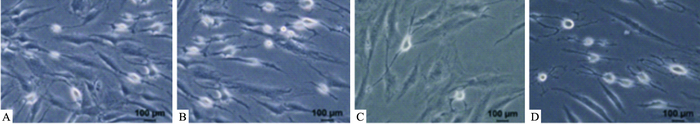
|
| Fig 2 Number of cells differentiated into nerve cells in each group(5 h, ×200) A:CTRL; B:APS; C:IR; D:IR+APS |
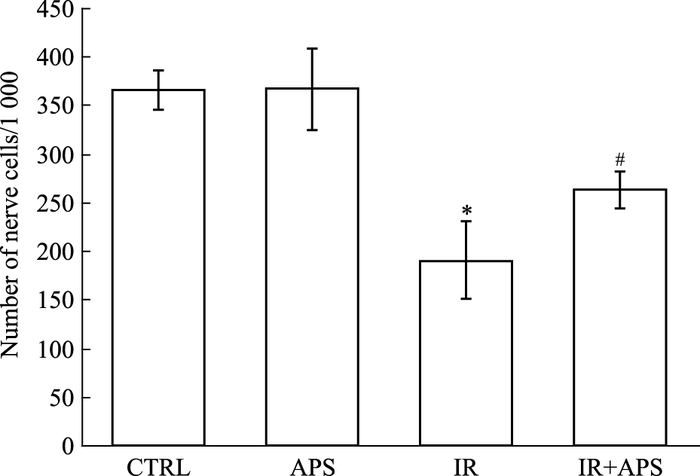
|
| Fig 3 Effects of APS on differentiation of BMSCs into neuron cells after X irradiation(n=3) *P < 0.05 vs Control; #P < 0.05 vs IR |
甲苯胺蓝染色见对照组和单纯加药组细胞分化为神经细胞的胞质中被染成蓝色的尼氏体,而未分化的BMSCs未着色,辐射组的细胞的胞质中被染成蓝色的尼氏体的密度明显减少,照射前3 d加入50 mg·L-1黄芪多糖干预后细胞的胞质中被染成蓝色的尼氏体的密度明显增加。见Fig 4。Fig 5中,与对照组相比,辐射后分化为神经细胞的胞质中尼氏体的密度明显降低(P<0.05),而当给予黄芪多糖干预后,分化为神经细胞的胞质中尼氏体的密度明显增加(P<0.05)。

|
| Fig 4 Cells differentiated into neurons after staining with Toluidine blue(5 h, ×200) A:CTRL; B:APS; C:IR; D:IR+APS |
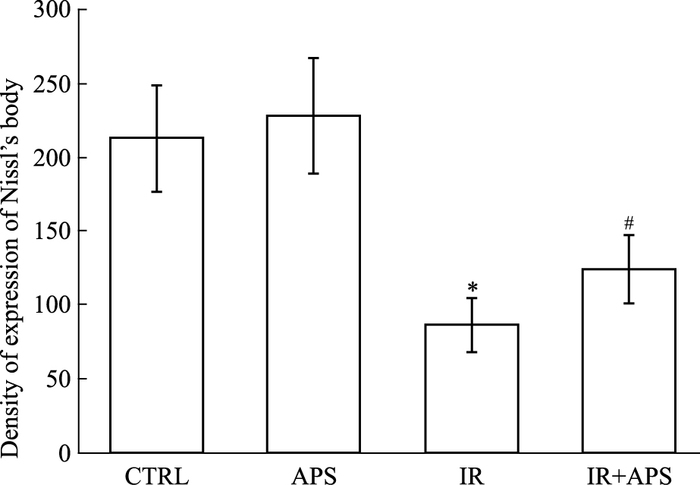
|
| Fig 5 Effect of APS on Nissl body with differentiation of BMSCs into neuronal cells after irradiation(n=4) *P < 0.05 vs CTRL; #P < 0.05 vs IR |
与对照组相比,辐射后诱导分化为神经细胞特异性标志蛋白NSE和Nestin的表达明显降低(P<0.05),黄芪多糖干预后,诱导分化为神经细胞特异性标志蛋白NSE和Nestin的表达明显升高(P<0.05)。见Fig 6、7。
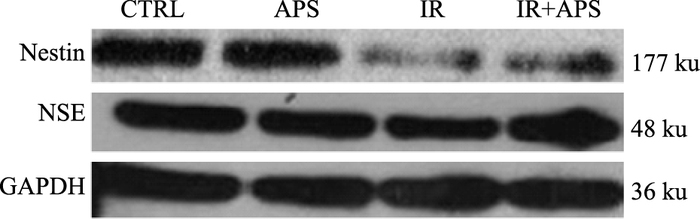
|
| Fig 6 Expression of neuron specific marker protein NSE and Nestin in each group |
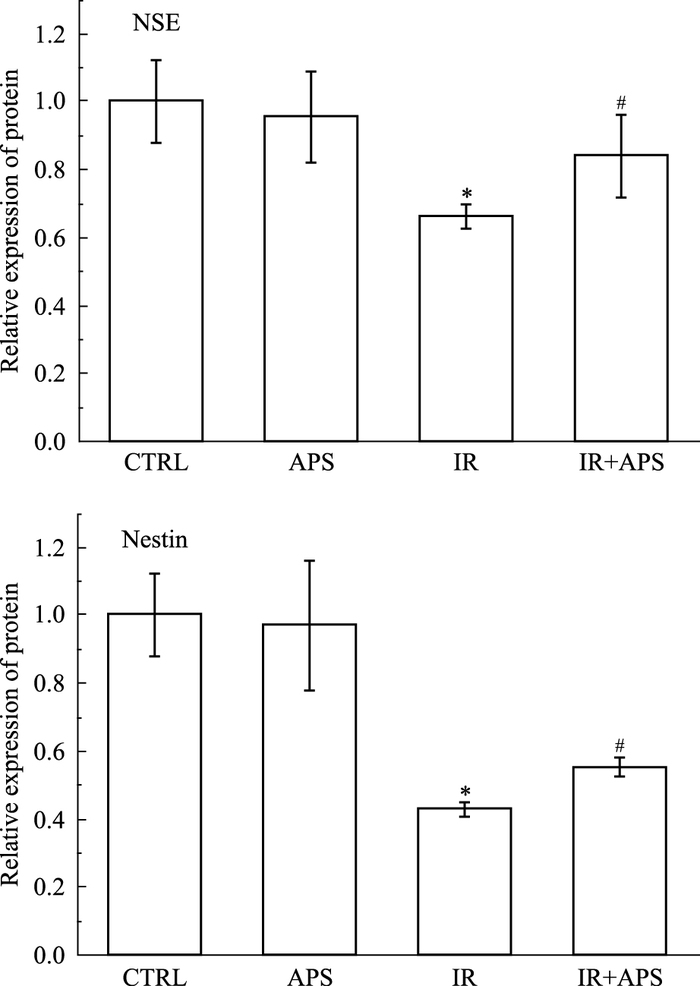
|
| Fig 7 Relative expression of protein *P < 0.05 vs CTRL; #P < 0.05 vs IR |
骨髓间充质干细胞是具有分化潜能的多能干细胞,可分化为成骨细胞、软骨细胞、心肌细胞及神经细胞等,可以为组织器官的修复和重建提供良好的细胞来源[8]。在分化过程中,表型特异的转录因子激活决定BMSCs的分化方向[9]。当骨髓间充质干细胞分化为悬浮生长的细胞球时,典型的神经球细胞形态可不断分裂增殖,并表达神经干细胞特异性标记物Nestin、NSE[10-11]。NSE主要存在于神经元以及神经内分泌细胞内,是神经元的特异性标志物;而Nestin作为未分化完全状态的神经干细胞的抗原标志。研究表明神经元受辐射后因受到自由基的攻击而使NSE的表达量降低,说明了NSE是反映神经元早期损伤的一个灵敏指标[12]。骨髓作为辐射的敏感组织,研究表明,当接受到辐射刺激时会抑制骨髓间充质干细胞的增殖[13]。周妮娜等[14]研究表明当骨髓间充质干细胞受到X射线辐射后,引起骨髓间充质干细胞增殖抑制,染色体及DNA的损伤。本实验中发现提前给予不同浓度的APS干预后,可以促进X射线辐射损伤后BMSCs的增殖,其中以50 mg·L-1的APS的作用最明显。辐射损伤后可以降低BMSCs分化的相关基因[15],而相关表型特异基因决定了其分化能力。辐射损伤后,分化为神经细胞的数量明显减少,其表达神经细胞特异性标记物Nestin、NSE蛋白表达降低,说明辐射可以损伤BMSCs向神经分化的潜能。尼氏体是神经元的重要结构成分,尼氏体的表达量可以反映出神经元的生长发育、物质转运及功能状态,是神经元细胞的标志性物质。辐射损伤后,分化为神经细胞的尼氏体表达降低,严重影响了BMSCs向神经细胞的分化及分化为神经细胞的功能。研究发现,中医中药的有效成分可以促进BMSCs分化的相关基因及蛋白的表达,促进BMSCs向神经、成骨等细胞的分化[16-17]。本研究中提前给予50 mg·L-1的APS干预后,可以促进辐射损伤后BMSCs向神经细胞分化的数量,增加了成神经分化后标记物Nestin、NSE和尼氏体的表达量。
综上所述,电离辐射可以影响人骨髓间充质干细胞向神经细胞分化的能力,而黄芪多糖可以减轻电离辐射对骨髓间充质干细胞向神经细胞分化的影响,从而为BMSCs移植联合黄芪多糖在治疗神经系统疾病提供了有力的实验依据。
(致谢: 本研究在甘肃省空间辐射生物学重点实验室和甘肃省高校重大疾病分子医学与中医药防治研究省级重点实验室完成 )
| [1] | Liu X, Chen T, Wu Y, et al. Role and mechanism of PTEN in adiponectin-induced osteogenesis in human bone marrow mesenchymal stem cells[J]. Biochem Biophys Res Commun, 2016, 12(29): 712-7. |
| [2] | 周晨慧, 张雪, 徐道华. 牡荆苷对大鼠骨髓间充质干细胞成骨分化的影响[J]. 中国现代应用药学, 2014, 31(4): 405-8. Zhou C H, Zhang X, Xu D H. Effect of vitexin on the osteogenic differentiation of rat bone marrow mesenchymal stem cells[J]. Chin J Mod Appl Pharm, 2014, 31(4): 405-8. |
| [3] | Viganò M, Sansone V, d′Agostino M C, et al. Mesenchymal stem cells as therapeutic target of biophysical stimulation for the treatment of musculoskeletal disorders[J]. J Orthop Surgery Res, 2016, 11(1): 1-8. doi:10.1186/s13018-015-0338-x |
| [4] | Dun C, Liu J, Qiu F, et al. Effects of Astragalus polysaccharides on memory impairment in a diabetic rat model[J]. Neuropsychiatr Dis Treat, 2016, 12(1): 1617-21. |
| [5] | 王金磊, 李承德, 孙宏伟, 等. 黄芪多糖抑制NF-κB/MAPK信号通路和改善哮喘大鼠气道炎症的作用[J]. 中国药理学通报, 2016, 32(4): 489-93. Wang J L, Li C D, Sun H W, et al. Astragalus polysaccharide regulates NF-κB /MAPK signaling pathway and attenuates airway inflammation in OVA-induced asthmatic rats[J]. Chin Pharmacol Bull, 2016, 32(4): 489-93. |
| [6] | 李承德, 周文宾, 孙艳, 等. 黄芪多糖对哮喘大鼠Th17/Treg细胞因子及肺部炎症的影响[J]. 中国药理学通报, 2013, 29(9): 1275-8. Li C D, Zhou W B, Sun Y, et al. Effects of astragalus polysaccharide on Th17/Treg associated cytokines and airway inflammation in OVA-induced asthmatic rats[J]. Chin Pharmacol Bull, 2013, 29(9): 1275-8. |
| [7] | Liu Y, Liu F, Yang Y, et al. Astragalus polysaccharide ameliorates ionizing radiation-induced oxidative stress in mice[J]. Int J Biol Macromol, 2014, 68(7): 209-14. |
| [8] | Mezey E. The therapeutic potential of bone marrow-derived stromal cells[J]. J Cell Biochem, 2011, 112(10): 2683-7. doi:10.1002/jcb.23216 |
| [9] | 徐小雅, 金慰芳, 高建军, 等. 体外局部大剂量辐射对大鼠骨髓间充质干细胞分化的影响[J]. 核技术, 2009, 10(32): 769-73. Xu X Y, Jin W F, Gao J J, et al. Radiation effect on the differentiation of bone marrow stromal cells of rat[J]. Nucl Techniq, 2009, 10(32): 769-73. |
| [10] | Ramasamy S, Narayanan G, Sankaran S, et al. Neural stem cell survival factors[J]. Arch Biochem Biophys, 2013, 534(1): 71-87. |
| [11] | Zhang G Y, Wang J, Jia Y J, et al. MicroRNA-9 promotes the neuronal differentiation of rat bone marrow mesenchymal stem cells by activating autophagy[J]. Neural Regen Res, 2015, 10(2): 314-20. doi:10.4103/1673-5374.143439 |
| [12] | 涂彧, 王利利, 周菊英, 等. 电离辐射对大鼠脑组织中稀醇化酶、S-100蛋白表达的影响[J]. 辐射研究与辐射工艺学报, 2007, 25(3): 185-8. Tu Y, Wang L L, Zhou J Y, et al. Expression of neuro-specific enolase and S-100 protein in sprague-dawle rat brain tissue irradiated by 6MeV electron beam[J]. J Radiat Res Radiat Process, 2007, 25(3): 185-8. |
| [13] | 徐小雅, 金慰芳, 高建军, 等. 辐射对骨髓间充质干细胞增殖分化及相关基因表达的影响[J]. 辐射研究与辐射工艺报, 2009, 27(2): 111-4. Xu X Y, Jin W F, Gao J J, et al. Radiation effect on the generation and expression of bone marrow stromal cells[J]. J Radiat Res Radiat Process, 2009, 27(2): 111-4. |
| [14] | 周妮娜, 张利英, 刘永琦, 等. 黄芪多糖对电离辐射诱发间充质干细胞基因DNA损伤的保护作用[J]. 中国现代应用药学, 2016, 33(2): 139-43. Zhou N N, Zhang L Y, Liu Y Q, et al. Radioprotection of astragalus polysaccharide against genomic DNA damage of mesenchymal stem cell induced by ionizing radiation[J]. Chin J Mod Appl Pharm, 2016, 33(2): 139-43. |
| [15] | 徐小雅, 金慰芳, 高建军, 等. 辐射对骨髓间充质干细胞增殖分化及相关基因表达的影响[J]. 辐射研究与辐射工艺学报, 2009, 27(2): 111-4. Xu X Y, Jin W F, Gao J J, et al. Radiation effect on the generation and expression of bone marrow stromal cells[J]. Radiat Res Radiat Process, 2009, 27(2): 111-4. |
| [16] | 刘永琦, 李静雅, 蔡玲, 等. 黄芪多糖诱导大鼠骨髓间充质干细胞分化的特性[J]. 中国中医药信息杂志, 2014, 21(6): 60-4. Liu Y Q, Li J Y, Cai L, et al. Induction of astragalus polysaccharides on differentiation of rat bone marrow mesenchymal stem cells[J]. Chin J Inform TCM, 2014, 21(6): 60-4. |
| [17] | 明磊国, 葛宝丰, 陈克明, 等. 蛇床子素对体外培养骨髓基质干细胞增殖与成骨性分化的影响[J]. 中国药理学通报, 2010, 26(8): 1098-103. Ming L G, Ge B F, Chen K M, et al. Effects of osthol on bone marrow stromal stem cell differentiation and proliferation in vitro[J]. Chin Pharmacol Bull, 2010, 26(8): 1098-103. |