


2. 西藏民族大学医学部,陕西 咸阳 712000
 ,
CHEN Yi-chun2,
Wang Xiao-lu1,
ZHANG Yu-qi1,
XUE Xiao-yan1,
FENG Qi-long1
,
CHEN Yi-chun2,
Wang Xiao-lu1,
ZHANG Yu-qi1,
XUE Xiao-yan1,
FENG Qi-long1
 ,
WU Bo-wei1
,
WU Bo-wei1
2. Dept of Medicine, Tibet Nationalities University, Xianyang Shanxi 712000, China
据国家心血管病中心发布的《中国心血管病报告2015》,近年来我国心血管病(CVD)死亡率仍居疾病死亡构成的首位,其中心力衰竭、心肌缺血、缺氧等急慢性心脏疾病并发的恶性心律失常(室性心动过速、心室颤动等)是心血管疾病致死的主要原因之一[1-2]。然而,目前抗心律失常药物的临床治疗效果并不理想,且大多数药物本身又具有致心律失常的风险,因此探寻安全有效且副作用小的新型抗心律失常药物仍亟待解决。
研究表明,多种室性心律失常的发生与细胞内钙转运异常有关。在调节心肌细胞钙稳态的诸多结构中,钠-钙交换体(Sodium-calcium exchanger,NCX)就是一种关键的钙调节蛋白。在生理状态下,钠-钙交换体(NCX)通过正向(Na+入胞,Ca2+外排)和反向(Ca2+入胞,Na+外排)两种转运模式对胞内的Ca2+进行快速精准的调控,并广泛参与或调节细胞电活动、肌肉收缩、神经和腺体分泌、细胞的生长发育等多种生理活动[3-4]。在病理状态下,NCX与心律失常、心力衰竭等多种心脏疾病密切相关。有研究表明,在心肌缺血/再灌注损伤、心力衰竭等情况下,心肌细胞NCX表达增加、功能上调,反向模式的钠-钙交换活动(即Ca2+入胞,Na+外排)增强,并有可能参与了心肌钙超载及心律失常的发生[5-6]。
既然多种心脏疾病并发的心律失常与NCX活动异常有关,那么就有可能通过对NCX的功能活动进行干预以抑制心律失常的发生。对NCX结构-功能关系的研究证实,α肽段(包括α-1和α-2) 是NCX发挥作用的关键肽段[7-9],因此,本研究选取钠-钙交换体分子中起关键作用的α-2肽段为抗原制备获得NCX单克隆抗体,利用全细胞膜片钳技术,观察了该抗体对成年大鼠心室肌细胞Na+/Ca2+交换电流(INa/Ca)及其他主要离子电流的作用,并进一步研究了该抗体对缺血/再灌注性心律失常的影响。
1 材料与方法 1.1 实验动物健康SPF级成年Sprague-Dawley(SD)大鼠,体质量(220~230) g,由中国人民解放军军事医学科学院实验动物中心提供,许可证号:SCK-(军)2014-0013。自由进食、饮水,饲养环境室温控制在(25±2)℃,每天光照12~14 h。
1.2 药品与试剂5′-三磷酸腺苷二钠(Na2-ATP)、三磷酸腺苷镁盐(Mg-ATP)、4-氨基吡啶(4-AP)、5′-三磷酸腺苷二钾(K2-ATP)、牛磺酸(Taurine)、HEPES、L-谷氨酸(L-Glutamic)、氢氧化铯(CsOH)、氯化钡(BaCl2)、氯化四乙胺(TEA-Cl)、氯化铯(CsCl)、乙二胺四乙酸(EGTA)、哇巴因(Ouabain)、尼非地平(Nifedipine)、磷酸肌酸二钠盐(Na2-phosphocreatine)、二甲基亚砜(DMSO)、Fura-2AM均购自美国Sigma公司;NaCl、KCl、NaH2PO4、KH2PO4、MgSO4、CaCl2、KCl、MgCl2均购自Sangon Biotech公司;其余试剂均为国产分析纯产品。能稳定分泌NCX-3F10抗体的细胞株由NCX α-2第840~877位氨基酸残基肽段免疫小鼠脾细胞与SP2/0骨髓瘤细胞融合而成,由美国Invitrogen公司完成;NCX-3F10抗体的纯化由北京华大蛋白质研发中心有限公司完成。
1.3 主要仪器与设备膜片钳放大器(Axopatch200B)和数模转换器(Digidate1440A)(美国Axon Instruments公司);Langendorff心脏灌流系统(澳大利亚AD Instruments公司); BL-420F生物机能实验系统(成都泰盟科技有限公司); BPS-4灌流装置(美国Ala Scientific Instruments Inc公司)。
1.4 主要溶液配制 1.4.1 台氏液(mmol·L-1)NaH2PO4 0.33,NaCl 140,KCl 5.4,MgCl2 1.0,glucose 10.0,HEPES 5.0,CaCl2 1.8,使用NaOH调节pH至7.38。
1.4.2 KB液(mmol·L-1)HEPES 10.0,KCl 40.0,Taurine 20.0,KH2PO4 25.0,EGTA 1.0,glucose 10.0,MgSO4 3.0,L-谷氨酸50.0,使用KOH调节pH至7.38。
1.4.3 Na+/Ca2+交换电流(INa/Ca)电极内液(mmol·L-1)4-AP 20.0,HEPES 5.0,磷酸肌酸钠盐5.0,MgCl2 13.0,天门冬氨酸钾42.0,K2-ATP 10.0,EGTA 42.0,CaCl2 29.0,使用CsOH调节pH至7.30。细胞外液(mmol·L-1):BaCl2 1.0,glucose 10.0,CaCl2 1.8,NaCl 140.0,MgCl2 2.0,HEPES 5.0,CsCl 2.0,使用CsOH调节pH至7.38。分别加入尼非地平1.0 μmol·L-1,哇巴因20 μmol·L-1,BaCl2 1.0 mmol·L-1,CsCl 2.0 mmol·L-1分别阻断L-型钙通道、钠-钾泵和钾通道。
1.4.4 L-型钙电流(ICa-L)电极内液(mmol·L-1)MgCl2 1.0,EGTA 1.0,Na2-ATP 4.0,CsCl 130.0,TEA-Cl 10.0,HEPES 20.0,CaCl2 0.4,使用CsOH调节pH至7.20。细胞外液为台氏液。
1.4.5 内向整流钾电流(IK1)电极内液(mmol·L-1)K2-ATP 3.0,KCl 150.0,EGTA 5.0,MgCl2 1.0,4-AP 5.0,HEPES 5.0,Mg-ATP 1.0,使用KOH调节pH至7.30。细胞外液为加入0.5 mmol·L-1 CdCl2的台氏液,以阻断L-型钙通道。
1.4.6 瞬时外向钾电流(Ito)电极内液(mmol·L-1)KCl 150.0,MgCl2 1.0,EGTA 5.0,ATP-K2 3.0,HEPES 5.0,使用KOH调节pH至7.30。细胞外液为加入0.2 mmol·L-1 BaCl2,0.1 mmol·L-1 CdCl2的台氏液,以分别阻断L-型钙通道及内向整流钾通道。
1.4.7 钠电流(INa)电极内液(mmol·L-1)EGTA 11.0,KCl 130.0,Na2ATP 5.0,HEPES 10.0,MgCl2 2.0,CaCl2 1.0,4-AP 5.0,使用CsOH调节pH至7.20。细胞外液(mmol·L-1):NaCl 60.0,MgCl2 2.5,glucose 10.0,4-AP 5.0,HEPES 5.0,蔗糖80.0,CsCl 5.0,CdCl2 0.1,使用NaOH调节pH至7.40。
1.5 全细胞膜片钳记录 1.5.1 大鼠单个心室肌细胞急性分离取健康SD大鼠,断头颈动脉放血后,快速开胸取心脏,修剪后经主动脉逆行插管悬挂于Langendorff灌流装置上,以100%氧气充灌的无钙台氏液恒压(75 cm H2O)、恒温(37℃)灌流心脏8 min后改为酶液(含胶原酶P 0.07~0.1 g·L-1)循环灌流15~20 min,待心脏变大、变软后剪取心室肌组织置于KB液中剪碎,轻轻吹打5 min,过滤得到单个细胞,KB液中保存,室温下静置3 h。
1.5.2 电压钳模式记录大鼠单个心肌细胞INa/Ca、ICa-L、IK1、Ito、INaINa/Ca记录:运用斜坡电压刺激程序记录INa/Ca。全细胞记录状态下,以钳制电位-40 mV,给予从+60 mV~-120 mV的斜坡电压刺激(90 mV·s-1),用5.0 mmol·L-1的NiCl2特异性阻断Na+/Ca2+交换电流,NiCl2阻断前后的电流差即为Ni2+敏感Na+/Ca2+交换电流。
ICa-L记录:记录L-型钙电流(ICa-L)的电极内液用CsCl取代KCl,TEA-Cl取代NaCl分别排除钾、钠电流的干扰。钳制在-40 mV以失活T-型钙通道和钠通道。给予细胞0.2 Hz、500 ms、跃阶10 mV从-40 mV~+60 mV的去极化脉冲刺激激活L-型钙电流,即可产生一组内向电流。利用钙通道阻断剂维拉帕米(0.1 mmol·L-1)可完全阻断L-型钙电流的特性,证明记录到的是ICa-L。为了防止L-型钙电流“rundown(衰减)”现象的发生,在全细胞记录模式形成5~20 min内记录。膜电流大小使用电流密度表示,即单细胞电流值(pA)/细胞膜电容值(Cm),pA/pF。
IK1记录:记录内向整流钾电流(IK1)的细胞外液为加入0.5 mmol·L-1 CdCl2(用以阻断ICa-L)的台氏液。钳制电位-40 mV,给予细胞0.5 Hz、500 ms、跃阶10 mV从-120 mV~+20 mV的去极化脉冲刺激激活IK1。膜电流大小使用电流密度表示,即单细胞电流值(pA)/细胞膜电容值(Cm),pA/pF。
Ito记录:测定瞬时外向钾电流时,维持电压-40 mV,给予阶跃脉冲至+50 mV,持续1 000 ms激活Ito。膜电流大小使用电流密度表示,即单细胞电流值(pA)/细胞膜电容值(Cm),pA/pF。
INa记录:测定钠电流时,维持电位-80 mV,给予去极化至-10 mV,以持续50 ms的跃阶脉冲激活INa。膜电流大小使用电流密度表示,即单细胞电流值(pA)/细胞膜电容值(Cm),pA/pF。
1.6 大鼠缺血/再灌注心律失常的记录 1.6.1 大鼠离体心脏缺血/再灌注心律失常的记录取SD大鼠,用40 mg·kg-1戊巴比妥钠腹腔注射麻醉,开胸离体心脏后,悬挂于Langendorff装置上主动脉逆行灌流,记录心电图,待心脏稳定后,结扎冠状动脉左前降支(LAD),造成局部缺血30 min,松扎后再灌注30 min。统计再灌注后30 min内期前收缩个数、室速的发生率及持续时间、室颤的发生率及持续时间。实验分组如下:① 假手术组(sham):台氏液持续灌流,LAD下只穿线不结扎;② I/R组:台氏液持续灌流,结扎LAD 30 min后,松扎再灌注30 min;③ NCX-3F10抗体+再灌注组:台氏液持续灌流,结扎LAD 30 min,再灌注前5 min用含10 mg·L-1 NCX-3F10抗体的台氏液灌流。
1.6.2 大鼠在体心脏缺血/再灌注心律失常的记录取SD大鼠用水合氯醛(30 mg·kg-1)腹腔注射麻醉,仰卧位固定于鼠板上,BL-420F生物机能实验系统记录大鼠Ⅱ导联心电图,除去颈部、胸部皮毛,做气管插管,沿3~4肋做纵向切口分离皮肤、肌层,暴露心脏,打开心包膜,轻掀左心耳,于左心耳根部下方肺动脉圆锥旁以无创缝合线穿过冠状动脉左前降支,取双线头共同套过一约0.6 cm长塑料管,沿双线向下压塑料管至心脏表面,以蚊式止血钳固定,阻断血流,心电图显示ST段抬高(≥0.15 mV)为缺血结扎成功,放松蚊式止血钳使冠脉血流再通为再灌注。结扎冠脉左前降支,局部缺血15 min,松扎后再灌注15 min,给药时间为再灌注前5 min由尾静脉注射。观察再灌注15 min内室性心律失常的发生率及持续时间、室性期前收缩(VPB)个数。实验分组如下:① 假手术组(sham):LAD只穿线,其他操作同模型组,尾静脉注射1 mL生理盐水(NS);② I/R组:结扎LAD 15 min,松扎再灌注15 min;③ NCX-3F10抗体+再灌注组:再灌注前5 min尾静脉注射NCX-3F10抗体50 μg·kg-1;④ 利多卡因(lidocaine)+再灌注组:再灌注前5 min尾静脉注射Lidocaine 7.5 mg·kg-1。
1.7 大鼠单个心室肌细胞钙瞬变测定取1 mL酶解好的大鼠心室肌细胞悬液于试管中,加入5 μmol·L-1荧光染料Fura2-AM,室温下避光孵育30 min;孵育完毕后弃上清,加入台氏液混匀后静置8~10 min,弃上清,重复清洗3次。将负载有荧光染料的细胞制成细胞悬液,用吸管吸取1~2滴细胞悬液滴入倒置显微镜的细胞槽内贴壁10 min后,用台氏液持续灌流10 min,速度为1~2 ml·min-1;用10 V电压以0.5 Hz的频率给予场刺激触发细胞收缩,在高倍镜下选取长杆状、纹理清晰、表面光滑,随刺激稳定收缩的心室肌细胞作为观察对象。用IonOptix离子影像分析系统同步记录测量单个心室肌细胞钙瞬变。待细胞收缩稳定后可以开始给药干预。钙瞬变用F340/F380比值的变化幅度ΔCa表示。
1.8 数据统计分析采用SPSS 16.0统计软件处理数据。以x±s表示。多个样本间比较使用方差分析(ANOVA)。IC50值的计算采用GraphPad prism 5.0软件。
2 结果 2.1 NCX-3F10抗体对大鼠心室肌细胞离子电流的影响 2.1.1 NCX-3F10抗体对大鼠心室肌细胞INa/Ca的影响 2.1.1.1 正常成年大鼠心室肌细胞INa/CaINa/Ca的测定是在电压钳模式下,以钳制电位-40 mV,给予从+60 mV~-120 mV的斜坡电压刺激(90 mV·s-1),用5.0 mmol·L-1的NiCl2特异性地阻断钠-钙交换电流,NiCl2阻断前后的电流差即为Ni2+敏感钠-钙交换电流(Fig 1)。
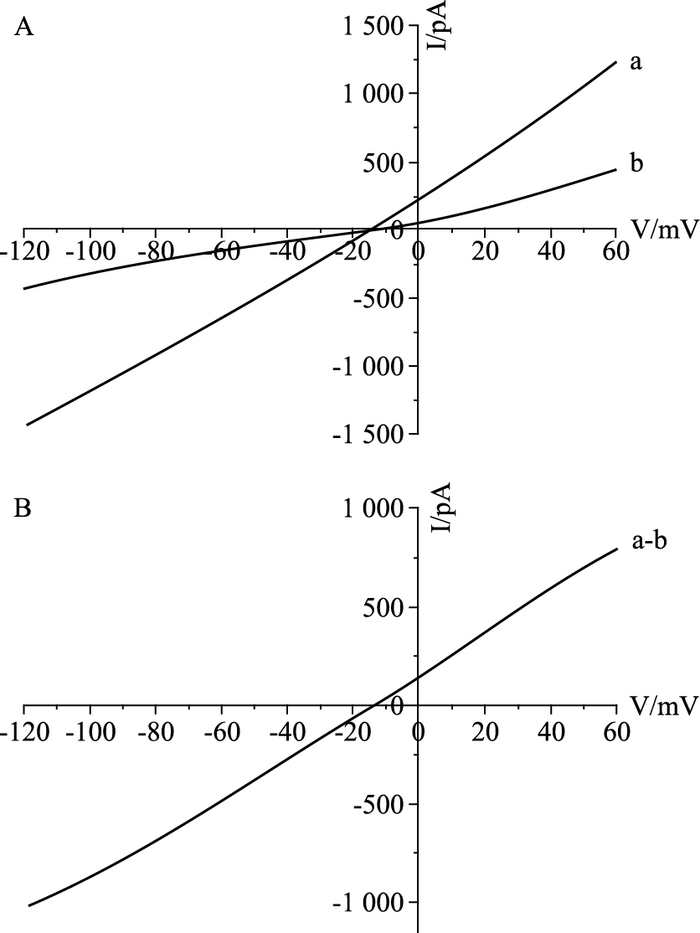
|
| Fig 1 Measurement of Ni2+ sensitive Na+-Ca2+ exchange current(INa/Ca) in rat ventricular myocytes A:current-voltage relationship before(a) and after(b) application of 5.0 mmol·L-1 NiCl2; B:Ni2+-sensitive INa/Ca a-b |
研究结果显示,5~40 mg·L-1浓度范围内NCX-3F10抗体对INa/Ca呈现出剂量依赖性抑制作用(n=8,P<0.05)。在钳制电位为+50 mV和-100 mV时,NCX-3F10抗体抑制外向和内向钠-钙交换电流的IC50分别为11.15和11.69 mg·L-1,最大抑制率分别达到61%,62%(Tab 1,Fig 2)。
| NCX-3F10/mg·L-1 | INa/Ca(pA/pF) | |||
| +50mV | Decrement/% | -100mV | Decrement/% | |
| 0(control) | 4.28±0.08 | -4.12±0.11 | ||
| 5 | 3.68±0.15* | 14 | -3.63±0.08* | 12 |
| 10 | 2.95±0.13* | 31 | -2.97±0.23* | 28 |
| 20 | 2.18±0.10* | 49 | -2.02±0.18* | 51 |
| 40 | 1.67±0.10* | 61 | -1.57±0.16* | 62 |
| Membrane current density is expressed as membrane current(pA) per cell capacitance(pF). *P<0.05 vs control | ||||
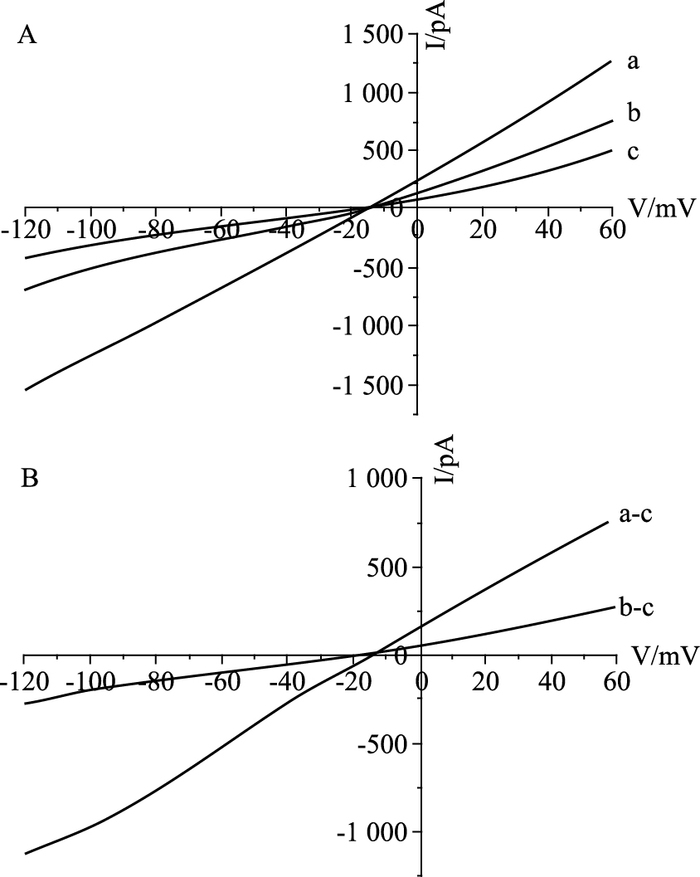
|
| Fig 2 Inhibitory effect of NCX-3F10 antibody on Na+/Ca2+exchange current in ventricular myocytes of rats A:Current-voltage relationship before(a, control) and after application of 40 mg·L-1 antibody against NCX-3F10(b), respectively. Trace c, after application of 5.0 mmol·L-1 NiCl2; B:Ni2+-sensitive INa/Ca before(a-c) and after(b-c) application of NCX-3F10 antibody at 40 mg·L-1, respectively |
在电压钳模式下测定ICa-L,ICa-L峰值电压均在10 mV。在5~40 mg·L-1浓度范围内,随着NCX-3F10抗体浓度增大,ICa-L密度由-4.22±0.18减小到-3.03±0.15,经台氏液灌流洗脱后,电流密度部分恢复(Tab 2,Fig 3)。
| NCX-3F10/mg·L-1 | ICa-L(pA/pF) | Decrement/% |
| 0(control) | -4.22±0.18 | |
| 5 | -3.93±0.33* | 5.18 |
| 10 | -3.70±0.33* | 10.59 |
| 20 | -3.22±0.15* | 12.47 |
| 40 | -3.03±0.15* | 14.12 |
| Membrane current density is expressed as membrane current(pA) per cell capacitance(pF). *P<0.05 vs control | ||
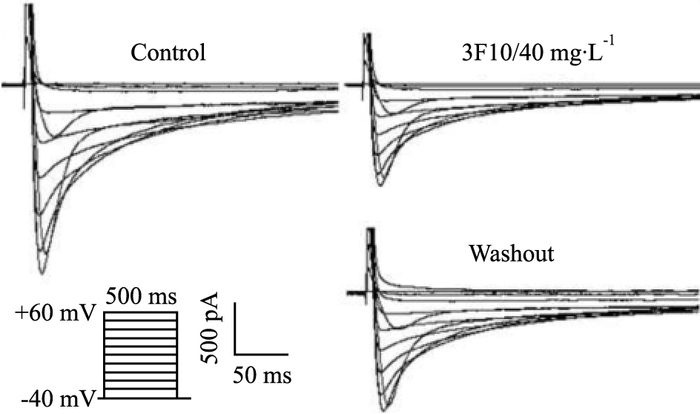
|
| Fig 3 Inhibitory effect of NCX-3F10 antibody on L-type calcium current in ventricular myocytes of rats |
NCX-3F10抗体干预后结果显示:在5~40 mg·L-1浓度范围内,NCX-3F10抗体对IK1、Ito、INa均无明显影响。
2.2 NCX-3F10抗体对离体及在体大鼠心脏缺血/再灌注诱发心律失常的影响 2.2.1 NCX-3F10抗体对离体大鼠心脏缺血/再灌注性心律失常的影响研究结果显示,10 mg·L-1的NCX-3F10抗体即可明显抑制大鼠离体心脏缺血/再灌注性心律失常的发生。在I/R组,100%大鼠发生室速,88.89%大鼠出现室颤,在再灌注前5 min给予NCX-3F10抗体干预后,大鼠的期前收缩个数、室速室颤发生率及持续时间均明显降低(P<0.05)(Tab 3,Fig 4)。
| Group | Total of VPB | Duration of VT/s | Incidence of VT/% | Duration of VF/s | Incidence of VF/% |
| sham | 12±3 | 0 | 0 | 0 | 0 |
| I/R | 186±44* | 72.90±6.62* | 100* | 52.88±11.12* | 88.89* |
| 3F10(10 mg·L-1)+R | 52±10*# | 22.51±3.22*# | 44.43*# | 18.81±2.32*# | 11.11*# |
| VPB:ventricular premature beats; VT:ventricular tachycardia; VF:ventricular fibrillation. 3F10:NCX-3F10.*P<0.05 vs sham; #P<0.05 vs reperfusion | |||||
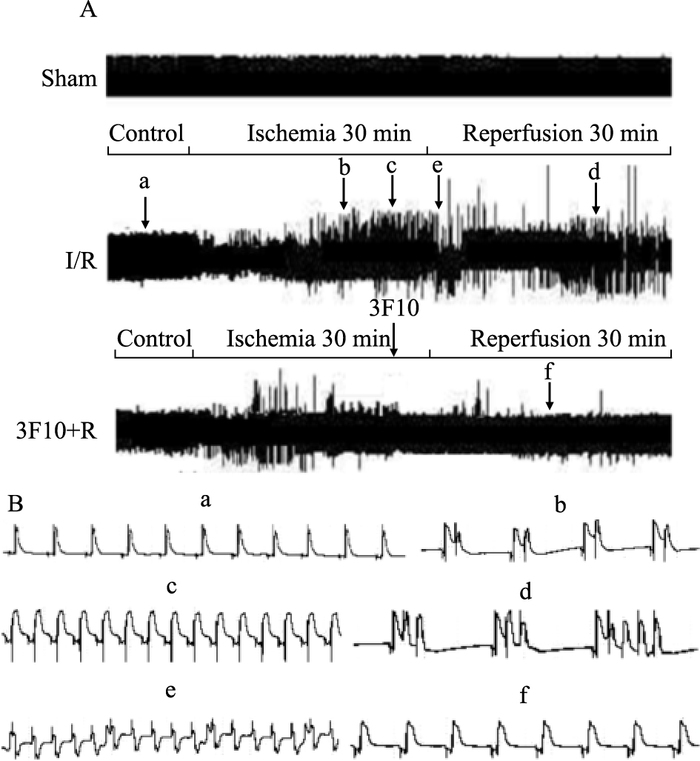
|
| Fig 4 Effects of NCX-3F10 antibody on ischemia-reperfusion induced arrhythmias in ex vivo rat hearts A:Representative ECG traces in rats of different groups; B:a: Normal ECG trace; b:Premature ventricular contraction bigeminies; c:Ventricular tachycardia(VT); d: Premature ventricular contraction trigrminies; e: Ventricular fibrillation(VF); f: Recovered ECG trace |
结果显示,对照组大鼠偶见室性早搏,并未见其他类型的心律失常发生。I/R组大鼠100%发生室性心律失常,以频发的室早、室速、室颤为主,并伴随有ST段的明显抬高,与对照组相比有明显差异,再灌注前5 min给予50 μg·kg-1的NCX-3F10抗体预处理后,发现再灌注期室早的个数、室速的发生率及持续时间、室颤的发生率及持续时间均明显降低(P<0.05)(Tab 4)。
| Group | Total of VPB | Duration of VT/s | Incidence of VT/% | Duration of VF/s | Incidence of VF/% |
| sham | 28±9 | 0 | 0 | 0 | 0 |
| I/R | 186±44* | 32.90±6.62* | 100* | 52.88±11.12* | 83.3* |
| 3F10(50 μg·kg-1)+R | 92±21*#△ | 10.51±3.22*#△ | 33.3*#△ | 18.81±2.32*#△ | 16.67*# |
| Lidocaine(7.5 mg·kg-1)+R | 67±18*# | 6.86±1.72*# | 16.67*# | 13.96±2.54*# | 16.67*# |
| VPB:ventricular premature beats; VT:ventricular tachycardia; VF:ventricular fibrillation.3F10:NCX-3F10.*P<0.05 vs sham; #P<0.05 vs reperfusion; ΔP<0.05 vs lidocaine | |||||
在5~40 mg·L-1浓度范围内,随着NCX-3F10抗体浓度增大,钙瞬变幅度(ΔCa)由0.42±0.13减小到0.27±0.11(P<0.05)(Tab 5,Fig 5)。
| NCX-3F10/mg·L-1 | F340/F380 | ΔCa |
| 0(control) | 188.35±8.72 | 0.42±0.13 |
| 5 | 159.15±11.66* | 0.39±0.11* |
| 10 | 132.43±9.28* | 0.34±0.12* |
| 20 | 114.44±4.20* | 0.30±0.09* |
| 40 | 103.47±6.73* | 0.27±0.11* |
| ΔCa:amplitude of calcium transient.*P<0.05 vs control | ||
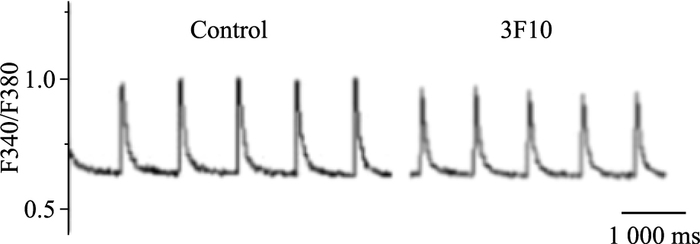
|
| Fig 5 Effect of NCX-3F10 antibody on calcium transients in rat ventricular myocytes 3F10: NCX-3F10(40 mg·L-1) |
本研究首次选取NCX α-2(840-877) 肽段作为抗原制备获得NCX-3F10单克隆抗体,利用全细胞膜片钳技术记录观测了该抗体对INa/Ca、ICa-L、IK1、Ito和INa的作用,并进一步观察了该抗体对大鼠离体和在体缺血/再灌注性心律失常的影响及其对单个心室肌细胞钙瞬变的作用。结果表明,NCX-3F10抗体对心肌钠-钙交换电流和钙瞬变幅度呈剂量依赖性抑制作用,对钙电流也有一定的抑制作用,对其他离子电流均无影响。此外,该抗体对大鼠缺血/再灌注性心律失常具有明显的抑制作用。
缺血性心脏病是临床常见疾病,在缺血早期最有效的治疗措施是使堵塞的冠脉血管再通,但恢复血流灌注后常会出现心肌顿抑、代谢障碍等一系列改变,其中以室性心律失常(室性期前收缩、室性心动过速、心室颤动等)最为严重。大量研究表明,缺血/再灌注损伤的发生与钙超载、氧自由基增多、心肌纤维能量代谢障碍、炎症反应、酸中毒等机制相关[10-13],其中各种原因导致的钙超载是引发心律失常的重要机制。NCX作为维持心肌细胞钙稳态的重要结构,与心肌细胞钙超载密切相关[14]。本研究离体和在体实验均证实,NCX-3F10抗体对大鼠缺血/再灌注性心律失常具有明显的抑制作用。结合膜片钳和细胞内钙瞬变实验结果,我们推测,NCX-3F10抗体的抗心律失常效应与其抑制NCX和L-型钙通道,减轻细胞内钙超载有关。
本研究还发现,NCX-3F10单克隆抗体对ICa-L也表现出一定程度的抑制作用。为阐明这一现象,我们利用DNAstar软件对NCX α-2(840~877) 肽段氨基酸序列和L-型钙通道α-1C亚基的氨基酸序列进行了比对。通过序列比对发现,NCX α-2(840~877) 肽段与构成L-型钙通道第三结构域孔环的第1 411~1 485氨基酸序列具有20%的相似性(Fig 6)。我们推测,二者之间的序列相似性,可能是NCX-3F10抗体对L-型钙通道产生交叉反应的基础。
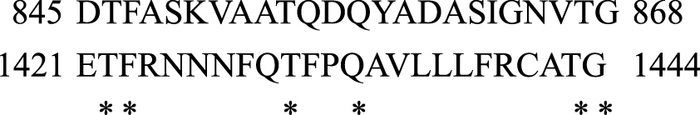
|
| Fig 6 Amino acid alignments of α-2 of Na+/Ca2+exchanger(upper) and pore region of L-type Ca2+ channel(lower) Residues identical between two segments are in bold and indicated with asterisks |
按照NCX的9次跨膜二级结构模型[15],位于NCX分子第7~8跨膜段之间的α-2肽段主要在胞内侧。那么,本研究NCX-3F10抗体是如何从胞外侧发挥作用的?近年来基于NCX晶体结构的研究,有人提出了NCX 10次跨膜的新结构模型[16-17]。与以往相比,二者主要区别在于第7跨膜段之后肽链的空间排列,根据新的NCX结构模型,α-2序列则可能暴露于细胞外侧。我们推测,本研究所用NCX抗体可能通过与α-2上暴露于膜外侧的某些氨基酸位点结合而产生效应。有关抗体与α-2结合的确切氨基酸位点,将是我们今后进一步研究的课题。
综上,本研究证实,NCX-3F10抗体可明显抑制缺血/再灌注性心律失常的发生,我们推测,其抗心律失常机制与该抗体抑制NCX和L-型钙通道、减轻胞内钙超载有关。
(致谢: 本研究在山西医科大学生理学系、细胞生理学省部共建教育部重点实验室完成,感谢实验室提供的仪器及技术支持;感谢赵录英老师在实验技术方面给予的指导。 )
| [1] | 隋辉, 陈伟伟, 王文. 《中国心血管病报告2015》要点解读[J]. 中国心血管杂志, 2016, 21(4): 259-61. Sui H, Chen W W, Wang W. Interpretation of report on cardiovascular diseases in China(2015)[J]. Chin J Cardiovasc Med, 2016, 21(4): 259-61. |
| [2] | 王文, 刘明波, 隋辉, 等. 中国心血管病的流行状况与防治对策[J]. 中国心血管病杂志, 2012, 17(5): 321-3. Wang W, Liu M B, Sui H, et al. The trend of cardiovascular disease in China and strategy of prevention[J]. Chin J Cardiovasc Med, 2012, 17(5): 321-3. |
| [3] | Boscia F, D′Avanzo C, Pannaccione A, et al. Silencing or Knocking out the Na+/Ca2+ exchanger-3(NCX3) impairs oligodendrocyte differentiation[J]. Cell Death Differ, 2012, 19(4): 562-72. doi:10.1038/cdd.2011.125 |
| [4] | Parnis J, Montana V, Delgado-Martinez I, et al. Mitochondrial exchanger NCLX plays a major role in the intracellular Ca2+ signaling, gliotransmission, and proliferation of astrocytes[J]. J Neurosci, 2013, 33(17): 7206-19. doi:10.1523/JNEUROSCI.5721-12.2013 |
| [5] | Antoons G, Willems R, Sipido K R. Alternative strategies in arrhythmia therapy: evaluation of Na/Ca exchange as an anti-arrhythmic target[J]. Pharmacol Ther, 2012, 134(1): 26-42. doi:10.1016/j.pharmthera.2011.12.001 |
| [6] | Feng Q L, Wu D M, Cui X L, et al. Inhibitory effects of purified antibody against α-1 repeat(117-137) on Na+/Ca2+ exchange and L-type Ca2+ currents in rat cardio myocytes[J]. Acta Physiol Sin, 2010, 62(5): 407-14. |
| [7] | Ottolia M, Nicoll D A, Philipson K D. Mutational analysis of the alpha-1 repeat of the cardiac Na+-Ca2+ exchanger[J]. J Biol Chem, 2005, 280(2): 1061-9. doi:10.1074/jbc.M411899200 |
| [8] | Shigekawa M, Iwamoto T, Uehara A, Kita S. Probing ion binding sites in the Na+/Ca2+ exchanger[J]. Ann NY Acad Sci, 2002, 976: 19-30. |
| [9] | Schwarz E M, Benzer S. Calx, a Na-Ca exchanger gene of Drosophila melanogaster[J]. Proc Natl Acad Sci USA, 1997, 94(19): 10249-54. doi:10.1073/pnas.94.19.10249 |
| [10] | 王波. 钠钙交换体对心肌保护作用的研究进展[J]. 西安文理学院学报:自然科学版, 2009, 12(3): 46-8. Wang B. New research progress of sodium/calcium exchanger in cardio protection[J]. J Xi′an Univer Arts Sci (Nat Sci Md), 2009, 12(3): 46-8. |
| [11] | 邵莹, 吴启南, 周婧, 等. 淡竹叶黄酮对大鼠心肌缺血/再灌注损伤的保护作用[J]. 中国药理学通报, 2013, 29(2): 241-7. Shao Y, Wu Q N, Zhou J, et al. Protective effects of total flavones from Lophatherum gracile on myocardial ischemia-reperfusion injury in rats[J]. Chin Pharmacol Bull, 2013, 29(2): 241-7. |
| [12] | 孙瑶, 张婵, 简洁. 九龙藤总黄酮调控自噬对抗心肌缺血/再灌注损伤的实验研究[J]. 中国药理学通报, 2015, 31(2): 232-6. Sun Y, Zhang C, Jian J. Effects of Bauhinia championii flavones on adjusting autophagy against myocardial ischemia/reperfusion injury[J]. Chin Pharmacol Bull, 2015, 31(2): 232-6. |
| [13] | 贺永贵, 李王芳, 尹红丽, 等. 黄芪甲苷抑制GSK-3β活性介导大鼠心肌缺血/再灌注损伤作用的线粒体机制研究[J]. 中国药理学通报, 2014, 30(3): 402-6. He Y G, Li W F, Yin H L, et al. Mitochondrial mechanism of Astragaloside IV induced inhibition of GSK-3β in myocardial ischemia/reperfusion injury in rats[J]. Chin Pharmacol Bull, 2014, 30(3): 402-6. |
| [14] | Goldhaber J I. Philipson K D. Cardiac sodium-calcium exchange and efficient excitation-contraction coupling: implications for heart disease[J]. Adv Exp Med Biol, 2013, 961: 355-64. doi:10.1007/978-1-4614-4756-6 |
| [15] | Nicoll D A, Ottolia M, Lu L, et al. A new topological model of the cardiac sarcolemmal Na+-Ca2+ exchanger[J]. J Biol Chem, 1999, 274(2): 910-7. doi:10.1074/jbc.274.2.910 |
| [16] | Ren X, Philipson K D. The topology of the cardiac Na+/Ca2+ exchanger, NCX1[J]. J Mol Cell Cardiol, 2013, 57: 68-71. doi:10.1016/j.yjmcc.2013.01.010 |
| [17] | Szerencsei R T, Kinjo T G, Schnetkamp P P. The topology of the C-terminal sections of the NCX1 Na(+)/Ca(2+) exchanger and the NCKX2 Na(+)/Ca(2+)-K(+)exchanger[J]. Channels, 2013, 7(2): 109-14. doi:10.4161/chan.23898 |