


肉苁蓉为列当科植物肉苁蓉Cistanche deserticola Y.C.Ma或管花肉苁蓉Cistanche Tubulosa(schrenk)R.Wight的干燥带鳞叶的肉质茎。[1]肉苁蓉多糖(CDPS)是肉苁蓉的主要活性成分,研究发现,肉苁蓉多糖可通过增加Bcl-2及降低caspase-3的表达,抑制海马神经元凋亡从而改善阿尔茨海默病(AD)模型大鼠的学习记忆能力。本课题组前期实验研究表明,肉苁蓉多糖可明显提高东莨菪碱所致学习记忆障碍模型小鼠突触素(SYP)和生长相关蛋白43(GAP-43) 的表达,增多海马区突触数量,恢复神经突触的可塑性,改善学习记忆能力[2]。
衰老是机体在退化时期生理功能下降和紊乱的综合表现, 是不可逆的生命过程。记忆力减退是机体衰老的反映,是脑老化的标志。学习记忆功能是大脑的一项重要神经功能,研究发现影响学习记忆的信号通路有很多,其中CREB是核心蛋白之一,多种相关蛋白会通过CREB产生对学习记忆的影响,其在神经元的存活、修复、再生及分化方面扮演着重要的角色。另外,CREB磷酸化对学习记忆的影响也从多种学习记忆检测手段中得到证实,一些研究者通过果蝇、海兔、啮齿类动物等动物实验中验证了CREB磷酸化对学习记忆的重要性[3-4]。
经典的理论认为,BDNF可以促进神经元的分化,维持神经元的生长,修复神经元的损伤,被认为是记忆形成过程中的关键蛋白之一,是在脑内合成的一种蛋白质,其作用主要体现在对各种神经元尤其是DA能神经元的发育分化与生长再生具有维持和促进作用,如果神经营养不足可引起脑区功能受损。大量研究表明,cAMP/PKA-CREB-BDNF信号转导通路参与了抑郁症等神经系统疾病所导致的认知功能障碍[5]。
D-半乳糖作为促老剂已经在国内外得到普遍的应用,研究发现,体外原代心肌细胞在D-半乳糖诱导后有拟衰老作用,D-半乳糖可对PC12细胞造成氧化损伤建立急性衰老细胞模型,为本实验造模提供了理论依据[6-7]。以往研究证实,肉苁蓉多糖对衰老小鼠学习记忆能力有改善作用,但肉苁蓉多糖对于D-半乳糖造模后的作用尚未见文献报道,针对这一空白,本文从体内以及体外角度,共同探讨肉苁蓉多糖对于急性衰老模型的保护作用,为今后肉苁蓉多糖对于学习记忆作用的进一步研究奠定了基础。
1 材料与方法 1.1 药品与试剂DMEM培养基、FBS(Gibco),MTT(Sigma),BDNF、cAMP及PKA酶联免疫试剂盒(武汉新启迪生物科技有限公司),吡拉西坦(上海华源安徽仁济制药有限公司,国药准字H34020141),D-半乳糖、H-89(Sigma), p-CREB (S133) 多克隆抗体(Abcam),CREB多克隆抗体(Abcam), β-actin多克隆抗体、HRP-羊抗兔二抗(北京中杉生物技术有限公司),彩色预染蛋白分子量标准(Sigma),ECL显色液(Theromo Fisher Scientific),核蛋白提取试剂盒、蛋白磷酸酶抑制剂混合物(康为世纪生物科技有限公司),谷氨酸对照品、多巴胺对照品(中国食品药品检定研究院),重酒石去甲肾上腺素注射液[远大医药(中国)有限公司]。
1.2 主要仪器Morris水迷宫、跳台、穿梭动物行为测试系统(上海吉量软件科技有限公司);酶标仪(680,BIO-RAD,日本);电子天平(PL-203,梅特勒-托利多仪器上海有限公司);超低温离心机(TGL-16,长沙平凡仪器仪表有限公司);紫外分光光度计(TU-1901,上海精密仪器仪表有限公司);电泳仪电源(DYY-6C,北京市六一仪器厂);Western blot电泳、转膜装置(Bio-RAD, 美国);Dionex UltiMate3000快速超高效液相色谱仪(Rapid Resolution Liquid Chromatography, Thermo-Fisher公司,美国),包括二极管阵列检测器、双三元梯度泵、在线脱气机、自动进样器、柱温箱、4~40 ℃恒温箱;Q Exactive四极杆-静电场轨道阱高分辨质谱系统(Thermo-Fisher公司,美国),配有ESI源及Analyst QS2.0数据处理系统;Hypersil GOLD(100 mm×2.1 mm. 9 μm, Thermo-Fisher公司,美国);wH-1微型旋涡混合器(上海沪西分析仪器厂),十万分之一电子天平(Mettler Toledo公司,美国);移液枪(Rainin Instrument公司,美国,10,100、200、1 000 μL);低温冰箱(三洋公司,日本);SB2200-T超声波清洗器(上海必能信超声有限公司)。
1.3 实验动物昆明小鼠,SPF级,体质量(20±2) g,♀♂各半,购自内蒙古大学实验动物中心,动物质量合格证号:SCXK(蒙) 2002-0001,饲养于内蒙古医科大学动物实验室,自由摄食饮水,12 h明暗交替照明。
1.4 肉苁蓉多糖的制备及鉴定肉苁蓉生药材,经热乙醇浸泡3 h后,用纱布过滤,弃滤液。药渣加水煎煮3次,每次1~2 h,过滤,合并滤液(呈棕红色)。蒸发浓缩后离心去沉淀,上清液加2~3倍体积的95%乙醇沉淀,4℃静置24 h,次日,于4℃离心20 min(6 000 r·min-1),收集沉淀。沉淀经水复溶、脱蛋白、透析、冷冻干燥后获粗多糖(灰棕红色)。通过紫外分光光度法测定多糖含量大于90%。
1.5 细胞PC12细胞株(北京协和细胞资源中心)
1.6 动物模型的建立动物按体重随机分为6组(每组32只),即空白组、模型组、CDPS(25、50、100 mg·kg-1)剂量组、阳性对照组。阳性对照组给予303 mg·kg-1吡拉西坦,空白组和模型组给予等体积蒸馏水;模型组、各给药组和阳性对照组皮下注射D-半乳糖150 mg·kg-1,空白组皮下注射等体积生理盐水,每天给药1次,连续6周,最后1 d给药2 h后进行行为学实验。
1.7 Morris水迷宫行为测试Morris水迷宫主要由恒温游泳池(直径120 cm)及站台(直径8 cm)组成,其内部被分为4个大小相等的象限,站台放置在其中的一个象限中央,此站台位置一旦被确定将在整个实验中保持不变。实验过程中控制水温在(22±2) ℃。从训练d 1开始进行定位航行实验,连续训练4 d,每天训练两次,d 1将站台所在象限作为入水点,d 2、3将站台旁边的象限作为入水点,d 4将站台对侧象限作为入水点。记录小鼠在60 s内到达站台所需要的时间即逃避潜伏期,若小鼠在60 s内未寻找到站台则其逃避潜伏期记为60 s。定位航行实验完成后,将站台撤去,小鼠从站台对侧象限面向池壁放入水中,测其在60 s内第1次到达原站台的时间和跨原站台所在位置的次数(即穿梭次数)。
1.8 细胞模型建立取对数生长期的PC12细胞,按照3×107个·L-1的密度接种到96孔培养板中,每孔0.1 mL,培养48 h后,用16 g·L-1 D-半乳糖处理40 h。CDPS大、小剂量组分别给予150、200 mg·L-1肉苁蓉多糖,作用24 h,CDPS大剂量组+H-89组给药,100 mg·L-1 H-89作用0.5 h,收集细胞进行实验。
1.9 酶联免疫法测定环磷酸腺苷(cAMP)、蛋白激酶A(PKA)和脑源性神经营养因子(BDNF)药物处理后,收集PC12细胞培养液,2 500 r·min-1离心10 min,取上清测试。制作标准曲线,按照试剂盒操作步骤,加入规定体积的检测试剂,避光孵育30 min后,在酶标仪上测定450 nm处的吸光度值(A450nm)并计算BDNF的含量,各实验组设置3个复孔,实验重复3次。
1.10 聚丙烯酰胺凝胶电泳(Westernblot) RIAP缓冲液裂解PC12细胞,提取核蛋白,BCA法进行蛋白质含量定量。加上样缓冲液调到各组蛋白量一致。SDS-PAGE电泳直至溴酚蓝到达分离胶底部,转移至NC膜(100 V, 2 h),预染蛋白Marker确定蛋白分子质量标准位置。用50 g·L-1脱脂奶粉封闭1 h。一抗p-CREB(1 :1 000) 和β-actin(1 :200) 多克隆抗体分别用封闭液按比例稀释后,4℃孵育过夜, 再用TBS脱色3次,每次10 min。辣根过氧化物标记的山羊抗兔多克隆抗体(1 :5 000) 室温孵育1 h, 加DAB显色后用Bandscan分析软件分析条带灰度, 进行半定量比较分析, 均采用自身灰度值校正, 以目的基因的条带灰度与管家基因β-actin的灰度比值表示蛋白的表达水平。
1.11 UPLC/Q Exactive MS法测定PC12细胞分泌的谷氨酸、多巴胺和去甲肾上腺素的含量将分化的PC12细胞按照3×108个·L-1接种于4孔板,培养48 h后用于实验。色谱检测条件为:流动相为乙腈-水(1 g·L-1甲酸,10 mmol·L-1醋酸铵)=4 :96;流速为0.2 mL·min-1;柱温为30℃;进样量为5 μL。电喷雾离子化源(ESI),扫描模式为Full MS/SIM,采集质量范围为140~200 Da,正离子检测模式;一级质谱分辨率为70000FWHM。选择离子检测(SIM):m/z154.08(DA),m/z 170.08(NE),m/z 148.05(Glu)。
1.12 统计学处理所有数据均以x±s表示。采用SPSS软件进行统计分析,多个实验组比较采用单因素方差分析。
2 结果 2.1 肉苁蓉多糖对衰老模型小鼠学习记忆能力的影响在Morris水迷宫定位航行实验测试中,与空白组比较,模型组小鼠逃避潜伏期明显延长,而肉苁蓉多糖各剂量组与模型组比较逃避潜伏期均明显缩短(P<0.05);在空间探索实验中,肉苁蓉多糖组与模型组比较,小鼠第1次到达站台时间明显缩短而穿越站台次数增加(P<0.05),见Tab 1。表明肉苁蓉多糖对D-半乳糖所致衰老模型小鼠的学习记忆能力有明显的改善作用。
| Group | Dose /mg·kg-1 | escape latencies /s | Swimming time to each platform/s | Numbers of crossing platform/n |
| Control group | — | 23.83±13.35 | 19.50±13.11 | 2.69±1.38 |
| D-gal group | 150 | 41.09±19.67# | 34.36±21.51# | 1.46±1.33# |
| CDPS | 25 | 20.50±12.36* | 18.79±16.48* | 2.67±1.76* |
| CDPS | 50 | 14.15±10.12* | 13.00±9.04* | 3.15±1.28* |
| CDPS | 100 | 19.18±13.44* | 18.00±13.44* | 2.70±0.67* |
| Piracetaml group | 303 | 16.86±10.21* | 11.55±8.42* | 2.67±1.61* |
| #P<0.05 vs control; *P<0.05 vs model. | ||||
空白组中cAMP含量为(8.080±0.349) μg·L-1,模型组与空白组比较,cAMP含量明显下至(4.017±0.286) μg·L-1,差异具有统计学意义(P<0.05)。CDPS给药组(150、200 mg·L-1)组与模型组比较,cAMP含量有所上升,且随剂量增加有升高趋势,CDPS大剂量组cAMP含量恢复至正常水平(P<0.05),为(9.713±0.350) μg·L-1。CDPS大剂量组经过PKA抑制剂H-89干预后,cAMP含量有所下降(P<0.05),差异与各给药大剂量组相比有统计学意义。如Tab 2。
| Group | Dose/mg·L-1 | PKA/mg·L-1 | cAMP/μg·L-1 |
| Control group | - | 8.420±0.126 | 8.080±0.349 |
| D-gal group | - | 4.237±0.109# | 4.017±0.286# |
| CDPS | 150 | 4.901±0.124 | 3.768±0.256 |
| CDPS | 200 | 9.527±0.181* | 9.713±0.350* |
| CDPS+H89 | 200+100 | 5.859±0.167△ | 7.098±0.345△ |
| #P<0.05 vs control; *P<0.05 vs model; △P<0.05 vs COPS 200 mg·L-1. | |||
空白组中PKA含量为(8.420±0.126) μg·L-1,模型组与空白组比较,PKA含量明显下至(4.237±0.109) μg·L-1,差异具有统计学意义(P<0.05)。CDPS给药组(150、200 mg·L-1)与模型组比较,PKA含量有所上升,且随剂量依增加有升高趋势,CDPS大剂量组PKA含量均可以恢复至正常水平(P<0.05),分别为(9.527±0.181) μg·L-1。CDPS大剂量组经过PKA抑制剂H-89干预后,PKA含量有所下降(P<0.05),差异与各给药大剂量组相比有统计学意义。如Tab 2。
2.4 肉苁蓉多糖对衰老PC12细胞中p-CREB的表达影响结果显示,模型组与空白组比较,D-半乳糖处理PC12细胞后导致p-CREB的入核减少(P<0.05),CDPS给药组(150、200 mg·L-1)与模型组比较,CDPS上调了D-半乳糖所致急性衰老模型中p-CREB的表达,并且随剂量依增加有升高趋势(P<0.05)。大剂量给药组经过阻断剂H-89干预后,细胞核内p-CREB的表达明显下调(P<0.05)。
2.5 肉苁蓉多糖对于衰老PC12细胞分泌的BDNF的影响模型组与空白组对比,PC12细胞分泌BDNF含量明显下降至(0.710±0.026) μg·L-1(P<0.05),差异具有统计学意义。CDPS给药组(150、200 mg·L-1)与模型组比较,BDNF含量明显上升(P<0.05),分别为(1.175±0.024) μg·L-1和(1.280±0.016) μg·L-1,差异具有统计学意义。CDPS大剂量组经阻断剂H-89干预后,BDNF水平均有明显的下降至(0.653±0.031) μg·L-1(P<0.05)。见Tab 3。
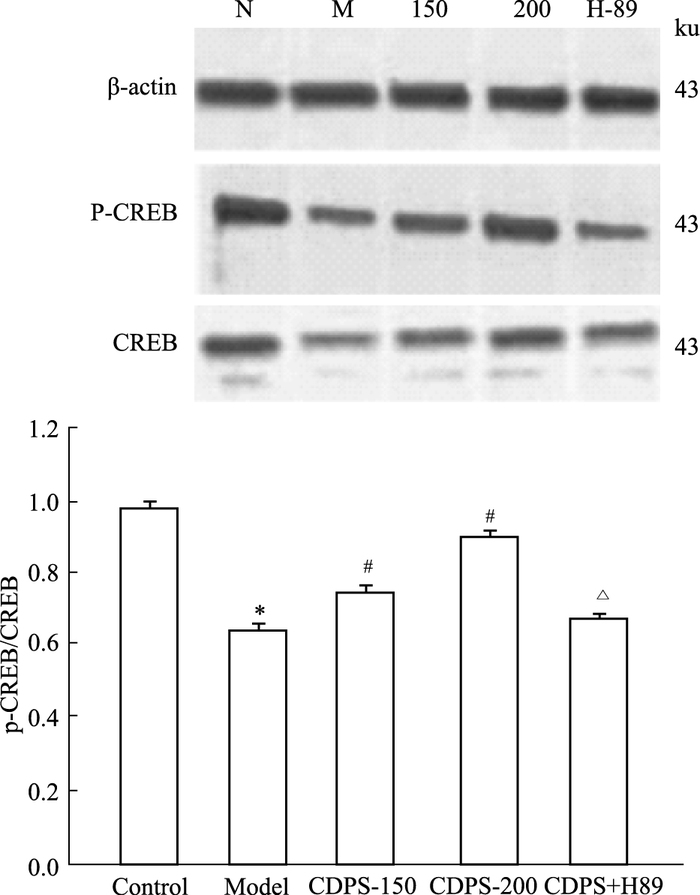
|
| Fig 1 Expression of p-CREB in the cells of acute aging model CDPS #P < 0.05 vs Model; *P < 0.05 vs control; △P < 0.05 vs large dose |
| Group | Dose/mg·L-1 | BDNF/μg·L-1 |
| Control group | - | 1.653±0.030 |
| D-gal group | - | 0.710±0.026# |
| CDPS | 150 | 1.175±0.024* |
| CDPS | 200 | 1.280±0.016* |
| CDPS+H89 | 200+100 | 0.653±0.031△ |
| #P<0.05 vs control; *P<0.05 vs model; △P<0.05 vs 200 mg·L-1 | ||
基于以上实验结果,我们决定进一步采用UPLC/Q Exactive MS技术检测肉苁蓉多糖对PC12细胞中多巴胺、去甲肾上腺素以及谷氨酸3种递质释放的影响。实验中采用CDPS(200 mg·L-1)与PC12细胞共同孵育,分别在以下时间点10 s、30 s、1 min、3 min、4 min、5 min、6 min、7 min、9 min、20 min、30 min取样,每个时间点设置3个复孔,按照样品处理方法,处理样品,立即检测,进样量5 μL。结果显示:在CDPS处理PC12细胞后,可以迅速的增加多巴胺、去甲肾上腺素及谷氨酸等神经递质的释放,并随着时间的延长逐步回复到初始水平。各个神经递质达峰值时间,多巴胺在7min时达到峰值,去甲肾上腺素5min达到峰值,谷氨酸在6min达到峰值。见Tab 4及Fig 2。
| Time point/min | DA/μg·L-1 | NE/μg·L-1 | Glu/μg·L-1 |
| 0.167 | 18.94±1.87 | 244.89±12.36 | 541.32±66.98 |
| 0.5 | 21.53±1.96 | 251.48±18.36 | 669.15±68.74 |
| 1 | 26.52±1.64 | 260.32±19.33 | 762.48±89.63 |
| 3 | 28.44±1.86 | 274.56±17.45 | 854.75±78.51 |
| 4 | 30.96±1.54 | 280.16±17.77 | 953.42±77.45 |
| 5 | 31.56±1.87 | 300.84±16.59 | 1074.41±89.56 |
| 6 | 34.18±1.68 | 289.32±18.54 | 1182.36±79.69 |
| 7 | 36.52±1.81 | 265.47±17.42 | 998.98±84.51 |
| 9 | 31.25±1.77 | 250.14±19.66 | 841.58±88.36 |
| 20 | 28.56±1.65 | 243.17±12.39 | 621.66±84.75 |
| 30 | 25.17±1.42 | 239.56±13.69 | 609.28±69.68 |
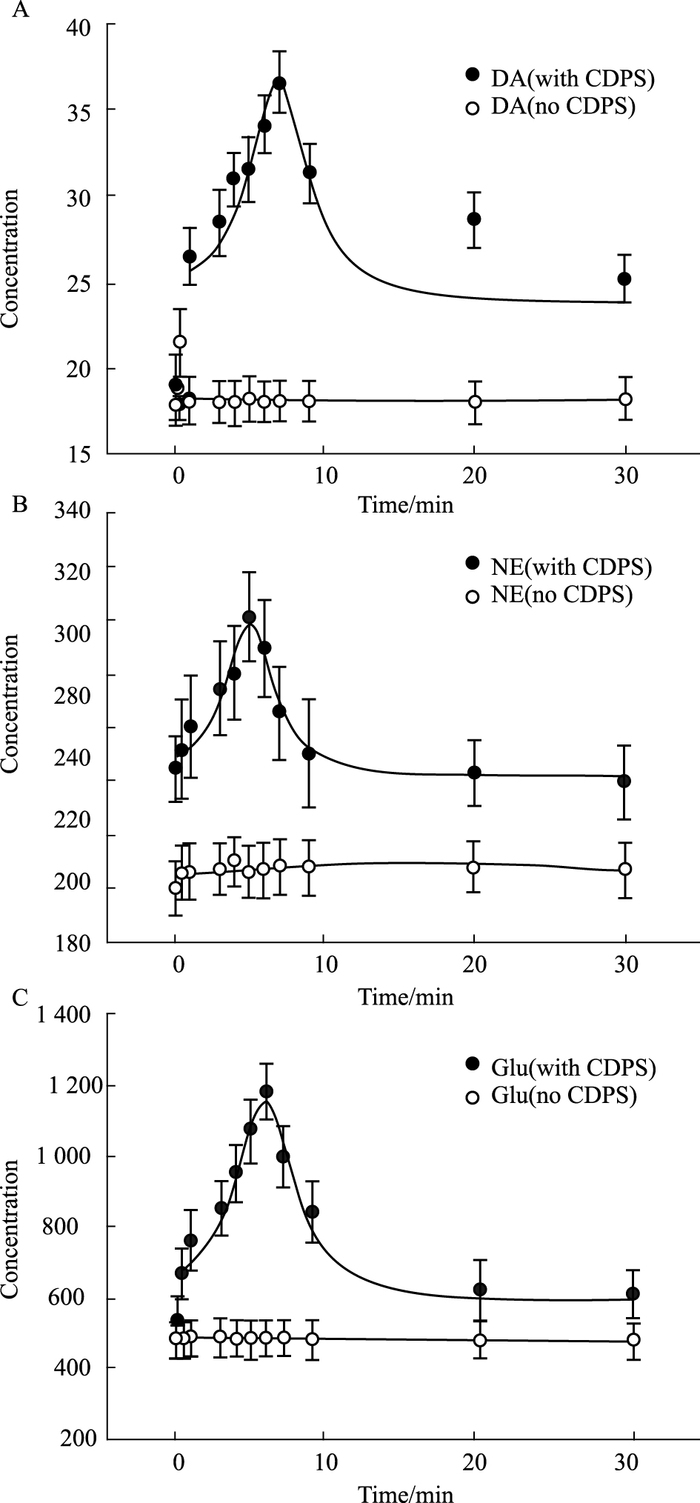
|
| Fig 2 Effect of CDPS on excitatory neurotransmitter (n=5) A: CDPS on the release of DA; B: the effect of CDPS on NE release; C: the effect of CDPS on Glu release |
本文是在前期CDPS对于抗衰老保护作用研究基础上,探讨CDPS对于衰老过程中学习记忆功能衰退的改善作用及可能的作用机制。
实验中我们采用D-半乳糖建立体内及体外急性衰老模型,研究表明[8],D-半乳糖亚急性中毒状态下,体内产生大量超氧阴离子自由基,对组织产生过氧化损害,这种生化和组织结构的改变与自然衰老表现基本吻合,伴随着衰老过程中各项生理机能的衰退,学习记忆能力也发生了明显的降低。本实验中D-半乳糖导致实验动物学习记忆功能的降低,行为学实验结果表明,D-半乳糖模型组在水迷宫实验中定位航行潜伏期明显长于空白组,Morris实验结果空间探索实验结果显示,模型组动物与空白组比较,第一次到达站台时间明显延长,同时穿梭次数明显减少(P<0.05),此外在D-半乳糖模型组动物脑组织SOD活性下降,MDA含量增加。提示D-半乳糖通过过氧化损害产生神经毒性,可模拟衰老所致的记忆障碍特征,提示本实验动物模型造模成功。给予CDPS治疗后,与模型组比较,小鼠空间记忆能力得到了恢复,学习记忆能力得到明显改善,脑组织SOD活性增加、MDA含量下降,说明CDPS具有改善衰老模型小鼠学习记忆障碍的作用,并推测这种作用是通过CDPS的抗氧化作用来实现的,该部分已经在前期结果中证实。
本实验中希望进一步深入探讨CDPS对于衰老模型中学习记忆功能改善作用信号通路,选择PC12细胞建立体外衰老模型,研究CDPS可能的信号通路。细胞实验中,D-gal可以明显的抑制cAMP/PKA/CREB信号通路,可以明显的抑制该信号通路的正常功能,而CDPS对于急性衰老模型的cAMP/PKA/CREB信号通路水平有上调作用,H-89是一种常用的PKA抑制剂,它可以通透细胞,可以选择性抑制cAMP、cGMP依赖的蛋白激酶PKA、PKG和PKCμ,对于PKA的选择性抑制作用最强。在使用H89后可以明显的阻断CDPS对于该信号通路的激活作用。研究发现细胞内cAMP或钙浓度的升高可以使CREB的Ser133位发生磷酸化作用而活化,p-CREB与真核基因转录调控区TATA框上游的cAMP反应元件结合,启动下游基因的转录,影响蛋白质的表达水平,从而调节多种生物学功能,影响个体神经元直至整个神经网络的功能[9-12]。在本实验中,D-半乳糖模型组cAMP和PKA水平降低,p-CREB表达减少,而各给药组与模型组比较,cAMP/PKA/CREB信号通路水平上调,提示肉苁蓉有效成分改善D-半乳糖急性衰老模型的作用与调节cAMP/PKA/CREB信号通路水平有关[12]。
经典的理论认为,BDNF可以促进神经元的分化,维持神经元的生长,修复神经元的损伤,即BDNF可调节神经系统的生长、发育、分化、成熟以及再生。近来,有许多学者发现BDNF参与神经系统疾病的发病及治疗过程[13]。大量研究表明,cAMP/PKA/CREB/BDNF信号转导通路参与到许多神经系统疾病所导致的认知功能障碍的过程中。离体实验中D-gal可以明显的降低PC12细胞BDNF的分泌,这可能是导致D-gal引起小鼠学习记忆功能减退的非自由基机制之一,而CDPS可以逆转D-gal所引起的cAMP/PKA/CREB抑制作用,在细胞水平可以明显提高D-gal所致的BDNF分泌降低作用,而CDPS对于BDNF增加分泌作用与体内实验中CDPS改善学习记忆作用相一致,这也提示了CDPS在衰老动物模型中学习记忆改善作用除了被报道的抗氧化作用外,也可能通过提高cAMP/PKA/CREB/通路的活性,促进脑内神经元BDNF的表达和分泌有关,这种促释放作用也可以被H89所阻断,提示肉苁蓉中多糖成分通过cAMP/PKA/CREB信号通路影响BDNF的分泌,进而参与到衰老过程中,对学习记忆改善作用的非抗脂质过氧化机制。研究报道[14],急性BDNF刺激可以通过增强海马突触前去极化,引起谷氨酸释放来调节突触转运。同时,在突触后位置,BDNF快速激活包括Na+、K+通道在内的离子通道,也增强NMDA受体和AMPA受体。这些快速的突触前、突触后调节过程主要通过磷酸化激活蛋白实现,但这些激活大部分都是瞬时的。长时间BDNF处理,最初的作用是持续性的突触调节,包括增强突触前神经递质释放,增加突触后树突棘密度,促进树突棘成熟。因此,在本实验中为了进一步验证CDPS对于BDNF的分泌促进作用,实验中检测了CDPS对于神经递质多巴胺、谷氨酸以及去甲肾上腺素分泌的影响,建立了基于UPLC-Q Exactive 3种神经递质的检测技术(该部分研究工作正在整理发表中),在细胞水平研究CDPS对于多巴胺、谷氨酸以及去甲肾上腺素分泌。结果我们发现,给予CDPS后可以明显提高PC12细胞增加多巴胺、谷氨酸以及去甲肾上腺素的释放,然而这种释放作用是适度的,随着时间的延长这三种递质释放基本恢复到基础水平,该调解作用提示CDPS可以增加突触间隙的递质的释放,但是不会影响递质的摄取或酶解。
综上所述,本课题研究中发现了CDPS对于衰老过程中学习记忆的改善作用的非抗氧化作用机制,CDPS通过激活cAMP/PKA/CREB信号通路提高脑内的BDNF分泌,并通过影响突触可塑性,提高脑内兴奋性神经递质多巴胺、谷氨酸以及去甲肾上腺素的释放有关,而这种适度提高递质释放作用,可能是CDPS对于改善衰老过程中学习记忆改善作用的药理学基础之一。另一个重要的神经递质乙酰胆碱作为影响学习记忆的重要递质之一,课题组正在进行深入研究中,将在后续工作中进行汇报。
(致谢: 本文所涉及的实验所有内容均在内蒙古医科大学药理实验室完成,本实验的参与人员有李刚、布仁、武燕、张弘、马慧和郭敏,感谢参与人员的付出。 )
| [1] | 李佳蔚, 周婉, 李俊松. 《中华人民共和国药典》中肉苁蓉的基源考证[J]. 中华中医药学刊, 2014(7): 1756-60. Li J W, Zhou W, Li J S. "People's Republic of China" in the Pharmacopoeia of Cistanche source based[J]. Chin Arch Tradit Chin Med, 2014(7): 1756-60. |
| [2] | 尹若熙, 李刚, 俞腾飞, 等. CDPS对东莨菪碱所致学习记忆障碍模型小鼠在突触可塑性方面的保护作用[J]. 中国药理学通报, 2014, 30(6): 801-7. Yin R X, Li G, Yu T F, et al. CDPS scopolamine-induced learning and memory impairment Protective effect in mice with synaptic plasticity[J]. Chin Pharmacol Bull, 2014, 30(6): 801-7. |
| [3] | Siu W K. Genetics of monoamine neurotransmitter disorders[J]. Transl Pediatr, 2015, 4(2): 175-80. |
| [4] | Manuel Collado, Maria A. Blasco, Manuel Serrano[J]. Cell, 2007, 130(2): 223-33. doi:10.1016/j.cell.2007.07.003 |
| [5] | Benito E, Barco A. CREB's control of intrinsic and synaptic plasticity: implications for CREB-dependent memory models[J]. Trends Neurosci, 2010, 33(5): 230-40. doi:10.1016/j.tins.2010.02.001 |
| [6] | Kuhla A, Eipel C, Abshagen K, et al. Role of the perforin/granzyme cell death pathway in D-Gal/LPS-induced inflammatory liver injury[J]. Am J Physiol Gastrointest Liver Physiol, 2009, 296(5): G1069-76. doi:10.1152/ajpgi.90689.2008 |
| [7] | Lee K W, Kim H J, Lee Y S, et al. Acteoside inhibits human promyelocytic HL-60 leukemia cell proliferation via inducing cell cycle arrest at G0/G1 phase and differentiation into monocyte[J]. Carcinogenesis, 2007, 28(9): 1928-36. doi:10.1093/carcin/bgm126 |
| [8] | 王琳. 肿瘤坏死因子α对D-半乳糖预处理心肌细胞的作用[D]. 中国人民解放军总医院, 2002. Wang Lin Tumor necrosis factor α role D-galactose pretreated cardiomyocytes of [D].Chinese PLA Postgraduate Medical School of PLA Postgraduate Medical School, 2002. |
| [9] | 陈微. 褪黑素对D-半乳糖和β-淀粉样蛋白所引起的过氧化损伤的保护机制研究[D]. 吉林大学, 2004. Chen Wei.Melatonin researchon the protection D-galactose and β-amyloid induced peroxidation damage [D].Jilin University, 2004. |
| [10] | 马天宇, 布仁, 俞腾飞, 等. UPLC/Q Exactive MS检测家兔血浆中乌头碱、次乌头碱、新乌头碱血药浓度的方法研究[J]. 中药材, 2015(9): 1886-9. Ma T Y, Bu R, Yut T F, et al. UPLC/Q Exactive MS detection rabbit plasma aconitine, aconitine times, study new aconitine blood concentration method[J]. J Chin Med Mater, 2015(9): 1886-9. |
| [11] | Liu H, Garrett T, Gu L. Profiling the metabolome changes caused by cranberry proanthocyanidins in female rats using a UPLC-Q exactive-MS based global metabolomics approach[J]. Faseb J, 2015, 29(1): 1-19. doi:10.1096/fj.15-0101ufm |
| [12] | 冯明飞, 刘俊辉, 卢斌斌, 等. UPLC-Q Exactive轨道阱高分辨质谱法测定小鼠血液中的NNN及其7种代谢物[J]. 烟草科技, 2015, 48(6): 40-4. Feng M F, Liu J H, Lu B B, et al. Determination NNN mouse blood and its metabolites seven kinds of UPLC-Q Exactive Orbitrap high resolution mass spectrometry[J]. Tobacco Sci Technol, 2015, 48(6): 40-4. |
| [13] | Chen D W, Gao J, Bing L, et al. Rapid screening and confirmation of pesticide residues in potato by high-resolution benchtop Q exactive LC-MS[J]. Chin J Anal Chem, 2014, 42(4): 579-84. |
| [14] | 马新良. BDNF增加JIP3表达促进神经递质释放的机制研究[D]. 山东大学, 2015. Ma X L. Up-regulation of c-Jun NH2-terminal kinaseinteracting protein 3(JIP3) contributes to BDNF enhanced neurotransmitter release [D]. Shan Dong University, 2015. |

