


2. 中国中医科学院西苑医院实验研究中心,北京 100091
 ,
LI Lin1,
GE Zheng-yan2,
ZHOU Li-dong1,
GUO Yu-jie2,
JIN Long2,
REN Ye2,
LI Yan-lin1,
SUN Lan1,
XU Yang1
,
LI Lin1,
GE Zheng-yan2,
ZHOU Li-dong1,
GUO Yu-jie2,
JIN Long2,
REN Ye2,
LI Yan-lin1,
SUN Lan1,
XU Yang1

2. Experiment Research Center of Xiyuan Hospital, China Academy of Chinese Medical Sciences, Beijing 100091, China
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病患者最严重的微血管并发症之一。DR能导致不可逆的视力丧失,已经成为致盲的主要疾病[1],DR与自由基介导的氧化损伤有关,氧化应激反应可调节细胞的生理功能和生化反应,在细胞增殖分化过程中发挥重要作用,并可导致细胞凋亡。视网膜色素上皮细胞(retinal pigment epithelium,RPE)位于富含血管的脉络膜和视网膜神经上皮层之间,是视网膜重要的营养、维护和代谢组织,也是外血-视网膜屏障的重要组成部分,RPE因其特殊的位置和功能在DR的发生发展中扮演重要的角色[2]。甲基乙二醛(methylglyoxal,MGO)是糖酵解生成的活性二羰基化合物,在糖尿病患者血浆中大量积累[3],MGO可以通过与氨基酸残基结合,经过复杂反应产生晚期糖基化终末产物(advanced glycation end products, AGEs),作为AGEs最具活性的前体物质,MGO被认为是引发糖尿病并发症的关键物质[4]。在糖尿病患者中,血糖升高导致AGEs在RPE基底膜中聚集,从而引起RPE的损伤[5]。
黄芪甲苷(astragaloside Ⅳ,AS-Ⅳ)是中药黄芪的主要活性成分之一,现代药理学研究证明,AS-Ⅳ具有抗肿瘤、抗炎、抗氧化、降糖和改善心血管疾病等药理作用[6],并且AS-Ⅳ对糖尿病周围神经病变和糖尿病大鼠肾脏病变具有改善和治疗效果[7-8],对糖尿病大鼠心肌细胞和糖尿病大鼠视网膜Müller细胞具有保护作用[9-10]。目前尚未见AS-Ⅳ对DR中RPE损伤保护作用的研究报道,本研究采用MGO诱导的ARPE-19细胞损伤为模型,探讨AS-Ⅳ对ARPE-19细胞的保护作用及分子机制,为AS-Ⅳ用于防治DR提供参考。
1 材料与方法 1.1 材料ARPE-19细胞株购自赛百慷(上海)生物技术股份有限公司;AS-Ⅳ购自成都曼斯特生物科技有限公司,以二甲基亚砜(dimethyl sulfoxide, DMSO)溶解,配制成50 mmol·L-1的贮备液,-20℃保存,用时以无血清培养基稀释至所需浓度,实验中DMSO浓度小于0.1%。DMEM/F12(1 :1) 培养基、胎牛血清、胰蛋白酶购自美国Gibco公司,青链霉素混合液(100×)购自北京索莱宝科技有限公司,Hoechst 33342、MGO购自美国Sigma公司,CCK-8由日本同仁化学研究所提供,超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)测试盒由南京建成生物工程研究所提供,线粒体膜电位和活性氧检测试剂盒购自碧云天生物技术研究所,caspase-3、caspase-9检测试剂盒购自凯基生物技术股份有限公司,FITC Annexin Ⅴ凋亡检测试剂盒购自美国BD公司,抗Bcl-2抗体、抗Bax抗体购自英国Abcam公司,抗PARP抗体购自美国CST公司,SDS-PAGE凝胶制备试剂盒、BCA蛋白定量试剂盒、山羊抗兔二抗(HRP结合)购自康为世纪生物科技有限公司。
1.2 ARPE-19细胞培养ARPE-19细胞生长于含有10%胎牛血清、1×105 U·L-1青霉素和100 mg·L-1链霉素的DMEM/F12培养基中,置于37℃、5%CO2细胞培养箱中培养,每天换液,每3 d传代1次,选取对数期生长的细胞进行实验。
1.3 实验分组及药物处理 1.3.1 MGO最佳造模浓度的确定将处于对数期的细胞接种于96孔板中,每组5个复孔,每孔1×104个细胞,接种24 h后,将细胞分为对照组和不同浓度MGO组,弃去完全培养基,分别加入无血清培养基稀释的0.5、0.75、1、2 mmol·L-1 MGO溶液,对照组加入无血清培养基,孵育16 h。
1.3.2 AS-Ⅳ最佳作用浓度的确定将处于对数期的细胞接种于96孔板中,每组5个复孔,每孔1×104个细胞,接种24 h后,将细胞分为对照组、MGO组、MGO+5 μmol·L-1 AS-Ⅳ组、MGO+10 μmol·L-1 AS-Ⅳ组和MGO+20 μmol·L-1 AS-Ⅳ组,弃去完全培养基。对照组和MGO组加入无血清培养基,MGO+不同浓度AS-Ⅳ组加入含不同浓度AS-Ⅳ(5、10、20 μmol·L-1)的无血清培养基,孵育6 h后,MGO组和MGO+不同浓度AS-Ⅳ组加入MGO使其终浓度为1 mmol·L-1,孵育16 h。
1.4 CCK-8检测细胞活力选取对数期生长的ARPE-19细胞,接种于96孔板中(每孔1×104个),培养24 h后,按以上分组进行实验,然后弃去完全培养基,加入含CCK-8(CCK-8 :无血清培养基=1 :9) 的无血清培养基100 μL,孵育2 h,用酶标仪在450 nm处检测吸光度值,计算细胞活力,每个实验重复3次。
1.5 细胞凋亡检测 1.5.1 Hoechst 33342细胞核荧光染色细胞经处理后,PBS洗2次,加入无血清培养基稀释的Hoechst 33342染色液,37℃避光染色15 min,PBS洗3次,每次5 min,然后利用高内涵成像系统拍照。
1.5.2 Annexin Ⅴ-FITC/PI双染将处于对数生长期的细胞接种于6孔板中,每孔1.5×105个,细胞长满板底约80%时,按上述方法处理细胞,经胰酶消化后离心,用冷PBS洗细胞2次,将细胞重悬于100 μL 1×Binding Buffer中,加入5 μL Annexin Ⅴ-FITC和5 μL PI,室温避光孵育15 min,加入400 μL 1×Binding Buffer轻弹混匀,上机检测。
1.6 细胞内氧化应激水平检测 1.6.1 ROS染色细胞经处理后,用PBS洗2次,加入以无血清培基1 :1000稀释的DCFH-DA,37℃避光染色40 min后,无血清培基洗3次,然后加入Hoechst 33342每孔200 μL,染色15 min,PBS洗3次后利用高内涵成像系统拍照。
1.6.2 细胞内SOD和MDA检测细胞经处理后,消化收集细胞,利用超声破碎细胞,4℃、12 000 r·min-1离心5 min,取上清,按照试剂盒说明进行SOD和MDA的检测。
1.7 线粒体膜电位检测细胞经处理后,用PBS洗2次,加入JC-1染色工作液37℃避光染色30 min,1×JC-1染色缓冲液洗3次,然后利用高内涵成像体统拍照。
1.8 Western blot检测蛋白表达细胞经处理后,胰蛋白酶消化并收集细胞,加入含有蛋白酶抑制剂和磷酸酶抑制剂的哺乳动物蛋白抽提试剂(体积比为1 :1 :98),冰上裂解30 min;4℃、12 000 r·min-1离心15 min,取上清稀释10倍进行蛋白定量;将SDS-PAGE上样缓冲液与蛋白样品按照1 :4混匀,煮沸5 min,使蛋白充分变性,-20℃保存待用。取等量蛋白样品进行SDS-PAGE电泳3 h,转膜105 V,55 min,然后将NC膜用5%脱脂奶粉封闭2 h,一抗孵育过夜,用TBST洗3次,每次15 min,二抗室温孵育2 h,TBST洗3次,每次15 min,显色后使用凝胶成像仪进行成像。使用Photoshop图像处理软件对蛋白条带的灰度值进行分析。
1.9 统计学分析实验结果以x±s表示,采用SPSS17.0进行统计学处理,以单因素方差分析(One-way ANOVA)方法进行分析。
2 结果 2.1 MGO造模浓度及AS-Ⅳ作用浓度的确定随着MGO浓度的增加,ARPE-19细胞活力逐渐下降,当MGO浓度为1 mmol·L-1时细胞存活率为(64.75±6.00)%(Fig 1A),故选择1 mmol·L-1 MGO孵育16 h作为最佳造模条件;在不同浓度AS-Ⅳ预给药6 h后给予MGO(1 mmol·L-1)孵育16 h,结果显示,AS-Ⅳ浓度为10 μmol·L-1时,细胞存活率为(78.45±5.90)%,与MGO组相比细胞活力明显提高(P < 0.05),最终确定AS-Ⅳ的给药浓度为10 μmol·L-1,并且在AS-Ⅳ浓度为10 μmol·L-1时对ARPE-19的细胞活力无明显影响(Fig 1B,P > 0.05)。
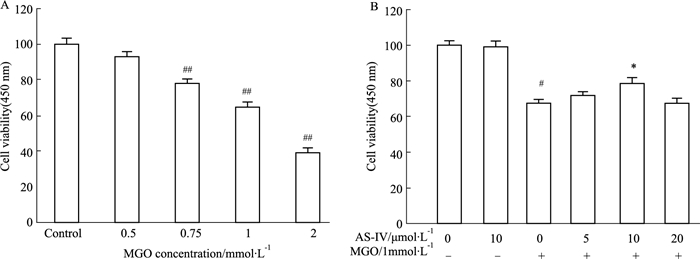
|
| Fig 1 Effect of AS-Ⅳ on cell viability of ARPE-19 cells A: MGO can reduce ARPE-19 cell viability in a dose-dependent manner; B:AS-Ⅳ can inhibit the reduction of ARPE-19 cell viability induced by MGO. #P < 0.05, ##P < 0.01 vs control group; *P < 0.05 vs MGO group |
利用Hoechst 33342对细胞核染色发现,正常组细胞核呈圆形或椭圆形,完整无皱缩,呈均匀淡蓝色;MGO组细胞核着色不均匀,部分细胞核固缩呈致密亮蓝着色,表现出凋亡的典型特征;AS-Ⅳ给药后细胞核染色较为均匀,与MGO组比较有明显改善(Fig 2A)。Annexin Ⅴ-FITC/PI双染结果显示,正常组细胞凋亡率为(3.18± 0.30)%,MGO组细胞凋亡率为(19.47±2.48)%,与正常组相比凋亡率明显增加(P < 0.05),AS-Ⅳ给药后细胞凋亡率为(7.57±0.81)%,与MGO组相比凋亡率明显降低(Fig 2B、2C,P < 0.05)。
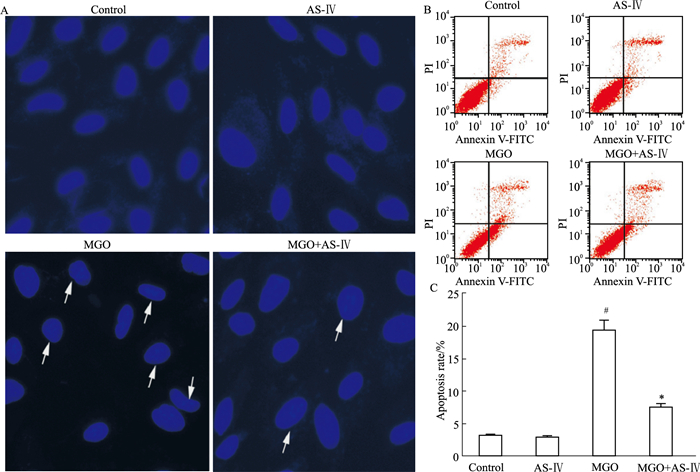
|
| Fig 2 Effect of AS-Ⅳ on ARPE-19 cell apoptosis by MGO A: Morphology of cell nucleus observed by Hoechst 33342 staining; B, C: Results of induced cell apoptosis rates examined by Annexin Ⅴ-FITC/PI with flow cytometry. #P < 0.05 vs control group; *P < 0.05 vs MGO group |
荧光探针DCFH-DA本身没有荧光,可以自由穿过细胞膜,可被细胞内的酯酶水解成DCFH,而DCFH不能通过细胞膜,细胞内的ROS可以将无荧光的DCFH氧化成有绿色荧光的DCF,因而绿色荧光的强度代表细胞内ROS的含量。由Fig 3A、3B可见,与对照组相比,MGO能增加ARPE-19细胞氧化应激反应,细胞绿色加深,荧光强度是对照组的(2.69±0.56) 倍,有显著性差异(P < 0.05),AS-Ⅳ能够明显减少ROS的产生(P < 0.05);且与对照组相比,MGO组细胞内SOD含量明显降低,MDA含量明显增加,AS-Ⅳ能明显增加SOD水平,减少MDA含量(Fig 3C、3D,P < 0.05)。
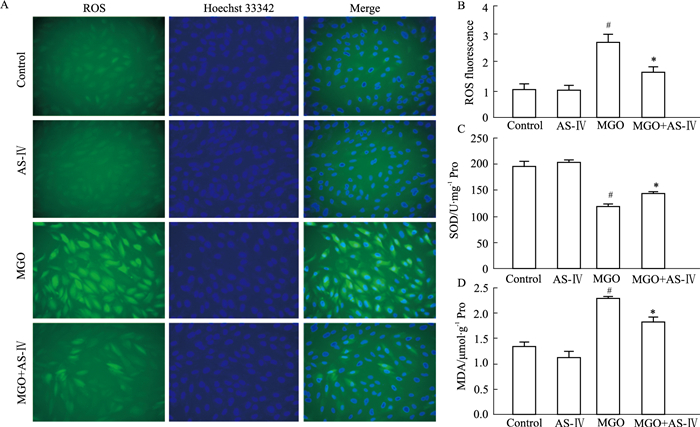
|
| Fig 3 Effect of AS-Ⅳ on MGO-induced oxidative stress in ARPE-19 cells A, B: AS-Ⅳ can significantly inhibit MGO-induced increase of ROS; C: AS-Ⅳ can significantly inhibit MGO-induced decrease of SOD activity; D: AS-Ⅳ can significantly inhibit MGO induced increase of MDA content. #P < 0.05 vs control group; *P < 0.05 vs MGO group |
JC-1荧光探针能够快速灵敏的检测线粒体膜电位的变化,正常细胞线粒体膜电位较高,JC-1以聚合物的形式存在于线粒体基质中,产生红色荧光;细胞受到损伤时线粒体膜电位降低,JC-1以单体形式存在,呈现绿色荧光。由Fig 4A、4B可见,对照组细胞红色荧光较强,线粒体膜电位较高,而MGO组细胞受损,线粒体膜电位下降,绿色荧光增强,Red/Green比值为(0.66±0.11),明显低于正常组,AS-Ⅳ能够提高线粒体膜电位,红色荧光增加,绿色荧光减少,与MGO组相比Red/Green比值明显提高(P < 0.05)。
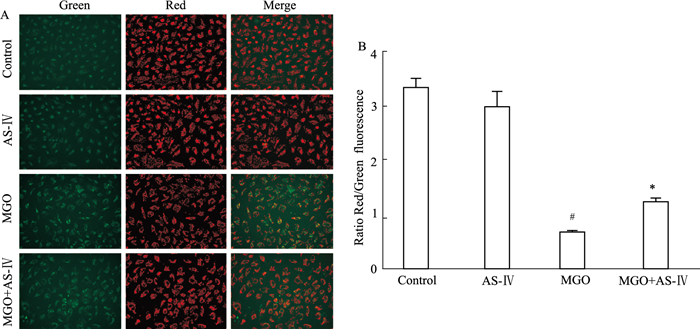
|
| Fig 4 Effect of AS-Ⅳ on mitochondrial membrane potential in ARPE-19 cells A, B: AS-Ⅳ can significantly inhibit MGO-induced decrease of mitochondrial membrane potential in ARPE-19 cells. #P < 0.05 vs control group; *P < 0.05 vs MGO group |
Western blot法检测凋亡蛋白Bcl-2和Bax的表达发现,MGO能明显减少Bcl-2/Bax比值,AS-Ⅳ给药后Bcl-2/Bax比值和PARP的表达明显增加(Fig 5A~5C,P < 0.05)。经荧光酶标法检测发现,MGO组caspase-9、caspase-3活力明显增加,AS-Ⅳ能明显降低caspase-9、caspase-3的活化水平(Fig 5D、5E,P < 0.05)。
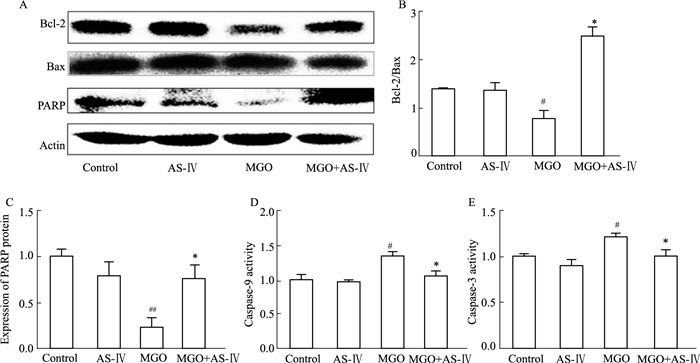
|
| Fig 5 Effect of AS-Ⅳ on expression of apoptosis related protein in ARPE-19 cells A ~ C: AS-Ⅳ up-regulates ratio of Bcl-2/Bax and expression of PARP detected by Western blot; D, E: AS-Ⅳ down-regulates activity of caspase-9 and caspase-3. #P < 0.05, ##P < 0.01 vs control group; *P < 0.05 vs MGO group |
MGO是机体产生的生理代谢产物,健康人体内MGO的浓度约为1 μmol·L-1。糖尿病患者因长期处于高糖状态,体内MGO大量产生并蓄积,MGO浓度为正常人的2 ~ 4倍,并且与血糖水平呈正相关,MGO成为加速DR进展的有害物质[11]。
MGO通过与蛋白质、磷脂和核苷酸形成AGE加合物改变细胞结构和功能[12]。本研究采用MGO损伤的ARPE-19作为细胞模型,研究AS-Ⅳ对ARPE-19细胞的保护作用。结果表明,AS-Ⅳ能够明显抑制MGO诱导的ARPE-19细胞活力的下降;对细胞进行Hoechst 33342染色和Annexin Ⅴ-FITC/PI双染,发现AS-Ⅳ对细胞核的形态有明显的改善作用,能够减少细胞核皱缩,使细胞核呈均匀蓝染,并且能够明显抑制MGO引起的细胞凋亡。
氧化应激水平的增强在糖尿病并发症(如DR)的发生中起着重要作用[13],ROS的大量产生,破坏了机体内抗氧化防御系统的平衡,导致脂质过氧化物的产生。已有研究显示[14-15],MGO能诱导成骨细胞和内皮细胞氧化应激的产生。本研究发现,MGO通过升高ARPE-19细胞的氧化应激水平而引起细胞损伤,AS-Ⅳ给药后能够减少ROS产生,提高SOD活力,降低MDA水平,从而减轻MGO对ARPE-19细胞造成的损害。由此表明AS-Ⅳ通过抗氧化作用减少氧自由基的产生,提高细胞内的抗氧化酶活性减少脂质过氧化物的产生,从而增强细胞的抗氧化能力。
线粒体的完整性对于细胞的生存至关重要,正常的线粒体膜电位是维持线粒体进行氧化磷酸化、产生三磷酸腺苷的先决条件[16]。活性氧自由基的异常升高能够引起线粒体内膜发生变化,一方面引起线粒体通透性转换孔(mitochondrial permeablity transition pore, MPTP)开放,促凋亡蛋白细胞色素C等被释放至胞质中;另一方面导致线粒体膜电位降低,线粒体膜电位下降是细胞凋亡的早期信号[12]。胞质中的细胞色素C结合并激活APAF-1和caspase-9前体,形成凋亡体,caspase-9前体以这种方式聚集并导致caspas-9的激活,继而活化caspas-3启动caspase级联反应,引发细胞凋亡[17]。Bcl-2家族蛋白对线粒体通路有重要的调控作用,抗凋亡蛋白Bcl-2能够抑制MPTP的开放,减少细胞色素C及凋亡诱导因子的释放,阻止凋亡的发生;促凋亡蛋白Bax正常情况下以单体形式存在于细胞质中,受到凋亡刺激时构象发生变化,导致Bax寡聚体形成并整合到线粒体外膜上,促进细胞色素C的释放,诱导凋亡的发生[18]。通常用Bcl-2和Bax蛋白表达的比率(Bcl-2/Bax)来表示细胞的凋亡情况。本研究发现,MGO可影响Bcl-2家族蛋白的表达,明显降低Bcl-2/Bax比率,提高caspase家族蛋白caspase-9和caspase-3的表达水平,减少caspase-3裂解底物PARP的表达,从而促进ARPE-19细胞凋亡。而AS-Ⅳ能逆转MGO能引起的ARPE-19细胞线粒体膜电位的下降。明显提高Bcl-2/Bax率,下调caspase-9和caspase-3的表达,提高PARP的水平,抑制ARPE-19细胞凋亡。表明AS-Ⅳ通过调节线粒体通路蛋白的表达发挥保护细胞的作用,至于AS-Ⅳ是否通过其他途径如内质网通路和MAPK通路对ARPE-19细胞起保护作用仍需要进一步的研究。
综上所述,AS-Ⅳ能够通过增强细胞的抗氧化能力,提高线粒体膜电位,调节线粒体通路中相关蛋白的表达,从而抑制MGO引起的氧化应激和细胞凋亡,对ARPE-19细胞起到保护作用,并可能在DR中发挥治疗作用。
(致谢: 本研究所有实验均在中国医学科学院&北京协和医学院药用植物研究所中药(天然药物)创新药物研发北京市重点实验室进行,感谢中国中医科学院西苑医院实验中心老师们的倾力协助,感谢陈阳老师对实验及文章撰写提供的帮助。 )
| [1] | Wang P, Xing Y, Chen C, et al. Advanced glycation end-product (AGE) induces apoptosis in human retinal ARPE-19 cells via promoting mitochondrial dysfunction and activating the Fas-FasL signaling[J]. Biosci Biotechnol Biochem, 2016, 80(2): 250-6. doi:10.1080/09168451.2015.1095065 |
| [2] | Simó R, Villarroel M, Corraliza L, et al. The retinal pigment epithelium: something more than a constituent of the blood-retinal barrier--implications for the pathogenesis of diabetic retinopathy[J]. J Biomed Biotechnol, 2010, 2010: 190724. |
| [3] | Kilhovd B K, Giardino I, Torjesen P A, et al. Increased serum levels of the specific AGE-compound methylglyoxal-derived hydroimidazolone in patients with type 2 diabetes[J]. Metabolism, 2003, 52(2): 163-7. doi:10.1053/meta.2003.50035 |
| [4] | 陈玉静, 李林, 黄小波, 等. 脑康Ⅱ号对甲基乙二醛诱导的海马神经元凋亡的影响[J]. 中华中医药杂志, 2010, 25(12): 2317-20. Chen Y J, Li L, Huang X B, et al. Effects of NaoKang Ⅱ on apoptosis of hippocampal neurons induced by methylglyoxal[J]. Chin J TCMP, 2010, 25(12): 2317-20. |
| [5] | Stitt A W. AGEs and diabetic retinopathy[J]. Invest Ophthalmol Vis Sci, 2010, 51(10): 4867-74. doi:10.1167/iovs.10-5881 |
| [6] | 靳晓飞, 张颖, 周晓红, 等. 黄芪甲苷对缺氧缺糖/复氧复糖PC12细胞凋亡的影响[J]. 中国药理学通报, 2016, 32(10): 1411-5. Jin X F, Zhang Y, Zhou X H, et al. Effects of astragaloside Ⅳ on apoptosis of PC12 cells induced by hypoxia/hypoglycemia and reoxygenation[J]. Chin Pharmacol Bull, 2016, 32(10): 1411-5. doi:10.3969/j.issn.1001-1978.2016.10.016 |
| [7] | 丁瑜芝, 袁松涛, 刘云. 糖尿病周围神经病变及黄芪甲苷对其治疗作用的研究进展[J]. 江苏医药, 2013, 39(15): 1817-9. Ding Y Z, Yuan S T, Liu Y. The research progress of diabetic peripheral neuropathy and the therapeutical effect of astragaloside Ⅳ[J]. Jiangsu Med J, 2013, 39(15): 1817-9. |
| [8] | 陈博南, 陈刚毅. 黄芪甲苷对糖尿病肾病大鼠肾脏的保护机制初步研究[J]. 云南中医中药杂志, 2016, 37(2): 58-60. Chen B N, Chen G Y. A preliminary study on the protection mechanism of astragaloside Ⅳ for diatebic nephropathy rats[J]. Yunnan J TCM Mate Med, 2016, 37(2): 58-60. |
| [9] | 曹琼丹, 杨育红, 于胜男, 等. 黄芪甲苷对Ⅰ型糖尿病大鼠心肌细胞PGC-1α和NRF-1表达的影响[J]. 中国药理学通报, 2015, 31(8): 1096-101. Cao Q D, Yang Y H, Yu S N, et al. Effect of astragaloside Ⅳ on expression of PGC-1α and NRF-1 in myocardial cells of type Ⅰ diatebic rat[J]. Chin Pharmacol Bull, 2015, 31(8): 1096-101. |
| [10] | 焦伟炜, 刘学政. 黄芪甲苷对糖尿病大鼠视网膜Müller细胞的影响[J]. 解剖科学进展, 2015, 21(5): 512-4. Jiao W W, Liu X Z. Effect of astragaloside Ⅳ on retinal müller cell in diabetic rats[J]. Prog Anat Sci, 2015, 21(5): 512-4. |
| [11] | Wang H, Meng Q H, Gordon J R, et al. Proinflammatory and proapoptotic effects of methylglyoxal on neutrophils from patients with type 2 diabetes mellitus[J]. Clin Biochem, 2007, 40(16-17): 1232-9. doi:10.1016/j.clinbiochem.2007.07.016 |
| [12] | Chan C M, Huang D Y, Huang Y P, et al. Methylglyoxal induces cell death through endoplasmic reticulum stress-associated ROS production and mitochondrial dysfunction[J]. J Cell Mol Med, 2016, 20(9): 1749-60. doi:10.1111/jcmm.2016.20.issue-9 |
| [13] | Giordano C R, Roberts R, Krentz K A, et al. Catalase therapy corrects oxidative stress-induced pathophysiology in incipient diabetic retinopathy[J]. Invest Ophthalmol Vis Sci, 2015, 56(5): 3095-102. doi:10.1167/iovs.14-16194 |
| [14] | Suh K S, Choi E M, Rhee S Y, et al. Methylglyoxal induces oxidative stress and mitochondrial dysfunction in osteoblastic MC3T3-E1 cells[J]. Free Radic Res, 2014, 48(2): 206-17. doi:10.3109/10715762.2013.859387 |
| [15] | Miyazawa N, Abe M, Souma T, et al. Methylglyoxal augments intracellular oxidative stress in human aortic endothelial cells[J]. Free Radic Res, 2010, 44(1): 101-7. doi:10.3109/10715760903321788 |
| [16] | 石静, 卿晨. 线粒体膜电位改变与细胞凋亡[J]. 中国民族民间医药, 2011, 20(7): 20-1. Shi J, Qing C. The change of mitochondrial membrane potential and apoptosis[J]. Chin J Ethnomed Ethnopha, 2011, 20(7): 20-1. |
| [17] | 梁凯, 曹秉振, 陈建魁. 线粒体调控的细胞凋亡研究进展[J]. 生物医学工程与临床, 2014, 18(5): 501-5. Liang K, Cao B Z, Chen J K. Progress on cell apoptosis of mitochondrial reguation[J]. BME Clin Med, 2014, 18(5): 501-5. |
| [18] | 周春燕, 冯作化. 医学分子生物学[M]. 第2版. 北京: 人民卫生出版社, 2014: 181-96. Zhou C Y, Feng Z H. Medical Molcular Biology[M]. 2nd ed. Beijing: People's Medical Publishing House, 2014: 181-96. |