


2. 邢台医学高等专科学校药学系,河北 邢台 054031;
3. 华北理工大学基础医学院,河北 唐山 063000
2. College of Pharmacy, Xingtai Medical College, Xingtai Heibei 054031, China;
3. School of Basic Medical Science, North China University of Science and Technology, Tangshan Heibei 063000, China
近年来,环氧合酶-2(cyclooxygenase-2,COX-2) 在颅脑损伤中所起的作用受到学术界的普遍关注,研究发现,颅脑损伤后COX-2表达改变与神经细胞凋亡有关,COX-2作为一种重要的炎症介质,可将花生四烯酸转化成血栓素和前列腺素,从而使炎性因子和氧自由基产生过多,进一步造成代谢紊乱、细胞损伤和细胞凋亡[1]。本课题组前期已证实塞来昔布可通过降低COX-2和Caspase-3、Apaf-1的表达,抑制脑损伤后的炎症反应和神经细胞凋亡,具有保护脑组织的作用[2-3]。本研究继续以COX-2为药物作用靶点,选用塞来昔布干预,观察药物治疗对颅脑创伤后凋亡Caspase-9因子及运动能力的影响,以探讨塞来昔布的神经保护效应,为临床防治颅脑创伤时应用新的非甾体类抗炎药提供实验依据。也为探索并实施颅脑创伤后抗细胞凋亡脑保护治疗策略提供部分参考依据。
1 材料与方法 1.1 实验动物与试剂72只SPF级6周龄成年SD大鼠,体质量(280±20) g,订购于北京华维通利华实验动物科技股份有限公司,许可证号:SCXX(京)2013-0008,常规饲养于华北理工大学医学实验动物中心SPF屏障环境(动物合格证号:医动字第410117号)。塞来昔布(250 mg·kg-1)购置于美国辉瑞制药有限生物公司;PCR试剂盒购、组织裂解液于美国Invitrogen公司;兔抗大鼠COX-2和Caspase-9多克隆抗体及生物素标记二抗均购置于北京中杉金桥生物有限公司。
1.2 方法 1.2.1 实验分组与动物模型制备依照随机数字表法将实验动物分为治疗组、创伤组、假手术组和对照组,每组12只,用于qPCR和免疫组织化学染色法检测使用。另取24只SD大鼠每组6只进行NSS评分。用10%水合氯醛腹腔注射大鼠,麻醉成功后,75%乙醇消毒手术区,治疗组和创伤组参考Marmarou等[4]操作构造大鼠重型弥漫性颅脑创伤模型,伤后立即给予人工辅助呼吸及伤口清创缝合;假手术组仅给予头皮切开缝合,不做其他处理;对照组不给予任何处置。术后SPF级环境正常饲养,治疗组创伤后即刻给予塞来昔布腹腔内注射1次,以后每6 h给药1次。同时,对照组、假手术组和创伤组给于同等量的PBS腹腔注射。
1.2.2 标本制备各组大鼠模型制备完成后,于72 h后给予10%水合氯醛腹腔注射麻醉,用250 mL生理盐水行心脏灌注,然后继续用500 mL 4%多聚甲醛进行灌注,可见大鼠出现强直僵硬,然后断头取脑,以视交叉为中心,冠状位水平切5 mm左右脑片,取出脑组织海马区,部分入4%多聚甲醛固定,组织经梯度乙醇脱水,二甲苯透明后进行石蜡包埋,石蜡横切片,片厚5 μm,贴附于载玻片至37℃恒温箱烘烤后常温保存。另将取部分脑组织放置于冻存管中,投入液氮速冻,以备qPCR检测使用。
1.2.3 实时定量荧光PCR检测COX-2和Caspase-9基因表达水平取80 mg制备的大鼠脑组织,加入400 μL ERSR裂解液,用匀浆机匀浆之后,参照TRIzol说明书一步法提取组织总RNA,于紫外分光光度计测定RNA纯度及浓度复合实验要求后,用M-MLV试剂盒将RNA样品逆转录反应合成cDNA后,再使用SYBR试剂盒进行PCR扩增反应,COX-2引物上游:5′-CTTTTGGACTGCTGCTTTGCTG-3′;下游:5′-GTCCCCTGAAAGGTTTGGAAT-3′,Caspase-9引物上游:5′-CTGTTGGACTGCTGCTTTGCTG-3′,下游:5′-GTCTCCTGAAAGGTTTGGAAT-3′;β-actin为上5′-GTTGGGACCTGAGAGACTA-3′;下游:5′-TGGCGATGTCCAGTCACACT-3′。扩增条件:96℃预变性10 min,96℃变性30 s,56℃退火30 s,72℃延伸30 s,30个循环后再72℃延伸10 min。实验结果采用相对定量的方法进行分析。
1.2.4 免疫组织化学染色法检测COX-2和Caspase-9蛋白的表达组织载玻片常规脱蜡至水,枸橼酸钠缓冲液(SSC)高压抗原修复2 min,PBS洗3次,每次8 min,滴加适量3% H2O2至盖玻片上,室温孵育15 min,达到阻断内源性过氧化物酶的作用,然后用蒸馏水洗3次,每次5 min。滴加5% BSA封闭液,室温20 min,并将多余液体甩去,滴加稀释(1 :100) 的COX-2和Caspase-9一抗,4℃冰箱过夜,然后PBS洗3次,每次2 min,滴加生物素标记羊抗兔IgG,37℃,20 min,PBS洗3次,每次2 min。滴加SABC试剂,37℃,20 min,PBS洗4次,每次5 min。室温下DAB显色,并在镜下控制反应时间,用蒸馏水洗涤。苏木精复染2 min,脱水,透明,封片,显微镜观察并拍照进行图像分析。
1.2.5 神经功能损害评分(NSS)SD大鼠颅脑损伤后,于创伤后d 10开始对其进行神经运动障碍评分检测,按照Teng等[5]操作方法,检测内容包括对大鼠运动、反应、感觉以及平衡能力等评估。分值越低表示神经运动功能越正常,严重神经功能障碍(≥15分),神经状态接近正常(≤10分),共25分。
1.2.6 统计学方法实验数据用x±s表示,SPSS17.0软件进行数据分析,统计学方法采用单因素方差分析,组间两两比较采用SNK检验。
2 结果 2.1 实时荧光定量PCR检测结果各组COX-2和Caspase-9的mRNA表达量(Tab 1)。经统计学分析:创伤组COX-2和Caspase-9的mRNA表达量明显高于其他各组(P<0.05);治疗组与创伤组相比较COX-2和Caspase-9的mRNA表达量有所降低(P<0.05),但仍高于对照组及假手术组(P<0.05);假手术组与对照组之间两者的表达量比较差异无统计学意义(P>0.05)。
| Group | COX-2 | Caspase-9 |
| Treatment | 1.69±4.62* | 1.60±1.27* |
| Trauma | 2.18±5.24# | 2.08±8.02# |
| Sham operation | 1.27±2.10 | 1.20±6.14 |
| Control | 1.10±6.96 | 1.12±4.83 |
| F | 15.73 | 14.02 |
| P | 0.01 | 0.00 |
| #P<0.05 vs control, sham operation treatment; *P<0.05 vs trauma, sham operation and control | ||
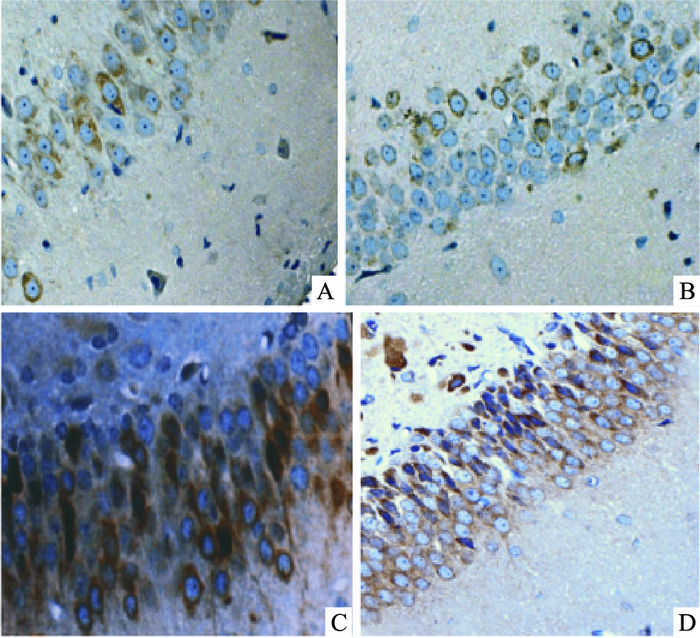
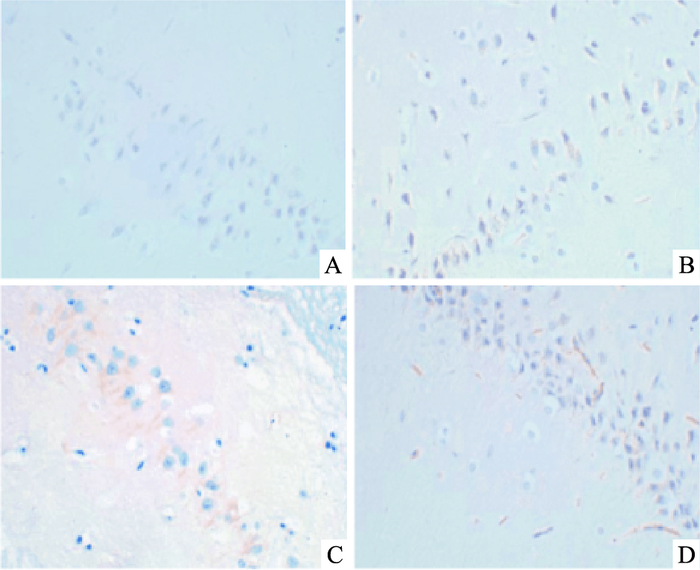
脑组织海马区COX-2和Caspase-9蛋白表达于神经细胞胞质,阳性反应呈棕黄色颗粒。各组COX-2和Caspase-9蛋白表达(Tab 2,Fig 1、2),经统计学分析:创伤组COX-2和Caspase-9的蛋白表达量明显高于其他3组(P<0.05);治疗组与创伤组相比较,COX-2和Caspase-9的蛋白表达量有所降低(P<0.05),但仍高于对照组及假手术组(P<0.05),对照组和假手术组之间两者的表达量差异无统计学意义(P>0.05)。
| Group | COX-2 | Caspase-9 |
| Treatment | 79.46±5.62* | 25.70±1.27* |
| Trauma | 95.98±6.24# | 34.70±6.02# |
| Sham operation | 70.27±3.10 | 23.39±8.14 |
| Control | 68.16±2.96 | 18.31±4.53 |
| F | 28.73 | 16.52 |
| P | 0.00 | 0.01 |
| #P<0.05 vs control, sham operation and treatment; *P<0.05 vs trauma, sham operation and control | ||
|
| Fig 1 Expression of COX-2 protein detected by immunohistochemical staining(×200) A:Control group; B:Sham operation group; C:Trauma group; D:treatment group |
|
| Fig 2 Expression of Caspase-9 protein detected by immunohistochemical staining(×200) A:Control group; B:Sham operation group; C:Trauma group; D:treatment group |
神经运动障碍评分检测发现,治疗组、创伤组、假手术组、对照组NSS评分分别为7.97±3.49、17.26±4.56、1.13±0.24、0.96±0.37(F=56.28,P<0.05),创伤组相较于其他各组NNS评分明显增加(P<0.05),治疗组较创伤组NNS评分有所降低(P<0.05),但仍高于对照组及假手术组(P<0.05),对照组与假手术组相比较差异无统计学意义(P>0.05)。
3 讨论COX-2通过炎症反应在继发性神经元死亡过程中发挥着极其重要的作用,炎症反应是引发神经元继发性损伤的重要原因之一,因此减少炎症反应所引发的继发性脑损伤显得尤为重要[6-7]。COX-2是前列腺素合成过程中的重要限速酶,其可将花生四烯酸转化为血管活性前列腺素前体物质,使NO、IL-1及TNF-α等增加,进而引起脂质过氧化,DNA损伤和细胞膜破坏,减弱血管内皮细胞的血管舒张反应性,造成细胞损伤、代谢紊乱、血管功能障碍,从而引发神经细胞丢凋亡[8-10]。一些学者认为,COX-2在脑创伤后继发的炎症反应和促进神经细胞凋亡过程中起关键作用[11]。本研究也发现创伤组COX-2 mRNA和蛋白的表达明显高于其它各组(P<0.05),塞来昔布药物治疗组较创伤组能明显降低COX-2 mRNA和蛋白的表达(P<0.05),创伤组相较于其他各组NNS评分明显增加(P<0.05),塞来昔布药物治疗组较创伤组NNS评分有所降低(P<0.05)。前期研究发现,脑创伤后COX-2明显增高,COX-2抑制剂可以降低COX-2的表达,COX-2与脑创伤后引发的继发性脑损伤密切相关,COX-2抑制剂能够明显改善大鼠重型颅脑创伤后学习记忆障碍[12]。Strauss等[13]研究发现颅脑创伤后COX-2的持续性高表达会导致大量氧自由基产物的堆积,进而导致神经细胞死亡。
半胱氨酸天冬氨酸蛋白酶-9(Cysteine aspartate protease-9,Caspase-9) 是Caspase凋亡蛋白级联反应的启动性蛋白酶,位于Caspase级联反应的上游,Caspases与细胞凋亡关系密切。在颅脑创伤后缺血缺氧性脑损伤的过程中发挥着极其重要的作用。Caspase-9调节细胞内源性凋亡途径,由细胞线粒体中的细胞色素氧化酶C在dATP或ATP参与下,其释放到细胞胞质,与Caspase-9、凋亡激活因子(Apaf-1) 及dATP形成凋亡体,从而介导激活caspase级联反应[14-15]。激活Caspase-3,进一步激活DNA酶,导致DNA降解和染色体浓缩,引起细胞凋亡[16]。由此可见Caspase-9是Caspase级联瀑布反应的启动蛋白酶,在颅脑损伤后的细胞凋亡中起重要作用。Li等[17]发现Caspase-9在大鼠颅脑缺氧缺血损伤后24 h的海马和皮质区呈高表达状态;同样,Yakovlev等[18]在大鼠液压颅脑损伤模型中发现,Caspase-9在大脑海马和皮层区高表达,并持续达48 h以上。李志恒等[19]采用免疫组织化学SP方法、ELISA和图像分析技术观测大鼠颅脑外伤后不同时间段血清中Caspase-9的变化,结果发现Caspase-9的表达呈现出上升-高峰-逐渐下降的规律性变化。
本研究采用实时荧光定量PCR和免疫组织化学法同样发现,创伤组Caspase-9 mRNA和蛋白表达明显高于其他各组,同时给予选择性COX-2的特异剂塞来昔布药物治疗能有效降低Caspase-9 mRNA和蛋白的表达,并且神经功能损害评分(NSS)检测发现治疗组能有效改善大鼠的运动功能障碍,说明塞来昔布可通过对COX-2的特异性抑制,减少由其引发的炎症反应,进一步降低Caspase-9的表达,从而减少神经细胞的凋亡,并改善大鼠脑创伤后的运动功能障碍。同时前期本课题前期研究发现塞来昔布通过降低COX-2、Caspase-3的表达,抑制脑损伤后的炎症反应和细胞凋亡,能够改善脑创伤后的学习记忆障碍[3]。余娟等[20]在大鼠脑动脉闭塞模型实验中发现,罗非昔布可通过促进脑缺血区神经元Bcl-2过量表达,同时减少Bax的表达,抑制神经细胞凋亡。
COX-2通过多种途径介导继发性颅脑损伤后的炎症反应和细胞凋亡等的病理过程,但其确切机制尚不十分清楚。因此,进一步研究COX-2在继发性颅脑创伤后炎症反应以及神经细胞凋亡的作用机制,以及COX-2抑制剂对脑损伤的保护作用,可为创伤性脑损伤等神经系统疾病的临床诊治提供新的参考。
| [1] | Das P, De T, Chakraborti T, et al. Leishmania donovani secretory serine protease alters macrophage inflammatory response via COX-2 mediated PGE-2 production[J]. Indian J Biochem Biophys, 2014, 51(6): 542-51. |
| [2] | 张涛, 国建飞, 邢琳琳, 等. 塞来昔布对大鼠重型颅脑创伤后运动功能及Apaf-1蛋白表达的影响[J]. 天津医药, 2016, 44(6): 716-9. Zhang T, Guo J F, Xing L L, et al. Effects of celecoxib on expression of protein Apaf-1 and function of mobility after severe craniocerebral injury in rats[J]. Tianjin Med J, 2016, 44(6): 716-9. doi:10.11958/20150231 |
| [3] | 张涛. 塞来昔布对颅脑创伤后学习记忆功能及Caspase-3蛋白表达的影响[J]. 天津医药, 2012, 40(6): 590-3. Zhang T. The effect of celecoxib on memory function and expression of caspase-3 protein following traumatic brain Injury in rats[J]. Tianjin Med J, 2012, 40(6): 590-3. |
| [4] | Marmarou A, Foda M A, van den Brink W, et al. A new model of diffuse brain injury in rats. Part I:Pathophysiology and biomechanics[J]. J Neurosurg, 1994, 80(2): 291-300. doi:10.3171/jns.1994.80.2.0291 |
| [5] | Teng S X, Katz P S, Maxi J K, et al. Alcohol exposure after mild focal traumatic brain injury impairs neurological recovery and exacerbates localized neuro inflammation[J]. Brain Behav Immun, 2015, 45: 145-56. doi:10.1016/j.bbi.2014.11.006 |
| [6] | Covey M V, Loporchio D, Buono K D, et al. Opposite effect of inflammation on subventricular zone versus hippocampal precursors in brain injury[J]. Ann Neurol, 2011, 70(4): 616-26. doi:10.1002/ana.v70.4 |
| [7] | Kim M J, Kim H S, Lee S H, et al. NDRG2 normals COX-2/PGE(2)-mediated breast cancer cell migration and invasion[J]. Mol Cells, 2014, 37(10): 759-65. doi:10.14348/molcells.2014.0232 |
| [8] | Gunther M, Plantman S, Davidsson J, et al. COX-2 regulation and tunel-positive cell death differ between genders in the secondary inflammatory response following experimental penetrating focal brain injury in rats[J]. Acta Neurochir, 2015, 157(4): 649-59. doi:10.1007/s00701-014-2331-2 |
| [9] | Moon Y J, Lee J Y, Oh M S, et al. Inhibition of inflammation and oxi-dative stress by Angelica dahuricae radix extract decreases apoptotic cell death and improves functional recovery after spinal cord injury[J]. Neurosci Res, 2012, 90(1): 243-56. doi:10.1002/jnr.v90.1 |
| [10] | Kuper C, Bartels H, Beck F X, et al. Cyclooxygenase-2-dependent-phosphorylation of the pro-apoptotic protein Bad inhibits tonicity-induced apoptosis in renal medullary cells[J]. Kidney Int, 2011, 80(9): 938-45. doi:10.1038/ki.2011.199 |
| [11] | Gunther M, Plantman S, Davidsson J, et al. COX-2 regulation and TUNEL-positive cell death differ between genders in the secondary inflammatory response following experimental penetrating focal brain injury in rats[J]. Acta Neurochir, 2015, 157(4): 649-59. doi:10.1007/s00701-014-2331-2 |
| [12] | 张涛, 朱军, 刘清军, 等. 大鼠重型颅脑创伤后COX-2蛋白表达对学习记忆功能的影响[J]. 第四军医大学学报, 2007, 28(11): 995-8. Zhang T, Zhu J, Liu Q J, et al. Effect of COX-2 protein expression on learn ing and memory function after severe traumatic brain injury in rats[J]. J Fourth Mil Med Univ, 2007, 28(11): 995-8. doi:10.3321/j.issn:1000-2790.2007.11.010 |
| [13] | Strauss K I, Barbe M F, Marshall R M, et al. Prolonged cyclooxygenase-2 induction in neurons and glia following traumatic brain injury in the rat[J]. J Neurotrauma, 2000, 17(8): 695-711. doi:10.1089/089771500415436 |
| [14] | Chen M, Guerrero A D, Huang L, et al. Caspase-9 induced mitochondrial disruption through cleavage of antiapoptotic Bcl-2 family members[J]. J Biolchem Chem, 2007, 282(46): 33888-95. doi:10.1074/jbc.M702969200 |
| [15] | Tschoeke S K, Drogies T, Meyer B, et al. Severe head injury promotes early caspase-dependent apoptosis in peripheral blood monocytes from multiply injured patients[J]. J Organ Dysfunction, 2009, 5(4): 261-72. doi:10.3109/17471060902968526 |
| [16] | Darwish R S, Amiridze N S. Detectable levels of cytochromec and activated Caspase-9 in cerebrospinal fluid after human Traumatic Brain Injury[J]. Neurocrit Care, 2010, 12(3): 337-41. doi:10.1007/s12028-009-9328-3 |
| [17] | Li Y, Zhou C, Calvert J W. Multiple effects of hyperbaric oxygen on the expression of HIF-1 alpha and apoptotic genes in a global ischemia-hypotension rat model[J]. Exp Neurol, 2005, 191(1): 198-210. doi:10.1016/j.expneurol.2004.08.036 |
| [18] | Yakovlev A G, Faden A I. Caspase-dependent apoptotic pathways in CNS injury[J]. Mol Neurobiol, 2001, 24(1): 131-44. |
| [19] | 李志恒, 胡雪峰, 金茂强, 等. 大鼠颅脑损伤后Caspase-9的表达变化及其法医学意义[J]. 新疆医科大学学报, 2012, 35(3): 354-8. Li Z H, Hu X F, Jin M Q., et al. The expression of Caspase-9 in rats after traumatic brain injury and its forensic significance[J]. J Xinjiang Med Univ,, 2012, 35(3): 354-8. |
| [20] | 余涓, 邱丽颖, 周宇, 等. 脑缺血再灌注损伤后神经细胞凋亡及Bcl-2、Bax蛋白表达与罗非昔布的影响[J]. 中国药理学通报, 2005, 21(5): 572-5. Yu J, Qiu L Y, Zhou Y, et al. Apoptosis of the neurocytes and the expression of Bcl-2 and Bax proteins after focal cerebral ischemia-reperfusion injury in rats and the effects of Rofecoxib[J]. Chin Pharmacol Bull, 2005, 21(5): 572-5. |

