


心肌梗死(myocardial infarction,MI)后心室重构是MI后心肌实质和间质发生的一系列病理变化,引起心肌肥厚、扩张,心功能进行性恶化,严重影响患者的预后。交感神经的过度激活以及前列腺素(prostaglandin,PG)为主的炎症介质释放在心室重构中发挥着举足轻重的作用[1-2]。环氧合酶-2(cyclooxygenase-2,COX-2) 是合成前列腺素的关键酶。既往部分研究[3-5]认为抑制COX-2的活性,降低前列腺素的表达,可延缓心室重构,对心脏具有保护作用。然而,也有观点[6-7]认为抑制COX-2的活性,降低前列腺素的合成,可加重心脏重构,对心脏功能有一定的损害作用。Timmers等[8]报道了长期使用塞来昔布可增加猪心肌梗死后的死亡率,降低心脏功能,加重心室重构。以上这些相互矛盾的研究结果使COX-2抑制剂对心脏的作用难以被明确解释,增加了临床使用COX-2抑制剂治疗心脏疾病的难度。因此,本实验探索不同剂量的COX-2高选择性抑制剂帕瑞昔布对心肌梗死后心室重构的影响。磷脂酰肌醇3激酶(phosphatidylinositol-3 kinase, PI3K)/Akt信号通路是细胞内最重要的生存通路,可调节细胞凋亡过程,能够明显抑制细胞凋亡[9]。研究发现,PI3K/Akt信号途径对缺血缺氧诱发的心肌细胞凋亡可产生心肌保护作用[10-11]。因此,本实验采用结扎大鼠左冠状动脉前降支建立急性心肌梗死模型,观察不同剂量的帕瑞昔布对心梗后心室重构的影响及PI3K/Akt信号通路在其中的作用。
1 材料与方法 1.1 实验动物与分组健康SPF级成年♂ SD大鼠40只,体质量230~250 g, 由重庆医科大学实验动物中心提供,合格证: SCXK(渝2012-0001)。采用随机数字表法将大鼠分为5组(n=8):假手术组(S组)、心室重构模型组(R组)、帕瑞昔布低剂量组(P1组)、中剂量组(P2组)、高剂量组(P3组)。
1.2 药物与仪器注射用帕瑞昔布钠(辉瑞制药有限公司, 批号:L61449);TUNEL试剂盒(瑞士Roche公司);Masson试剂盒(北京雷根生物技术有限公司);β-actin抗体(美国Proteintech公司);PI3K、Akt、p-Akt、caspase-3抗体(沈阳万类生物科技有限公司);小动物呼吸机(浙江医科大学医学仪器实验厂);RT-PCR反应仪(美国应用生物系统中国分公司);电泳仪、凝胶成像仪(美国BIO-RAD公司)。
1.3 动物模型制备及分组处理参照文献[12]的方法,建立急性心肌梗死模型。大鼠禁食12 h后,质量浓度为35 g·L-1的水合氯醛(10 mL·kg-1)腹腔注射麻醉。气管插管后连接小动物呼吸机行正压通气,监测ECG。常规备皮消毒后,左外侧切口经第3肋间隙进入胸腔,暴露心脏,在左心耳下缘与肺动脉圆锥交界下方3~4 mm处结扎左冠状动脉前降支。观察到左室前壁颜色变白且心电图ST-T弓背向上抬,心肌梗死模型建立成功。严格止血后,逐层关闭胸腔并保持负压,待大鼠自主呼吸恢复后拔出气管导管。S组前降支只穿缝线,不结扎。P1组、P2组、P3组大鼠于手术后24 h开始分别给予4、8、12 mg·kg-1的帕瑞昔布腹腔注射,余2组给予等量的生理盐水,共2周。
1.4 观测指标 1.4.1 血流动力学监测建模4周后,大鼠称重并麻醉,仰卧固定,暴露右颈总动脉,将充满浓度为50 kU·L-1肝素生理盐水的心导管经右颈总动脉插入左心室,连接压力换能器及BL-420F生物机能实验系统,待稳定后监测左心室收缩压(LVSP)、左心室舒张末期压(LVEDP)、左心室收缩压最大上升速率(+dp/dtmax)和左心室收缩压最大下降速率(-dp/dtmax),重复3次,记录平均值。
1.4.2 左心室肥厚指数测定血流动力学监测结束后,处死大鼠,取心脏,减去左右心耳及大血管,用4℃ PBS磷酸缓冲液冲洗干净,滤纸吸干后置于电子天平上称重并记录。再沿室间隔边沿剪去左右心房及右心室。将取下的左心室及室间隔置于电子天平上称重并记录。分别计算心脏重量/体质量(HW/BW)、(左心室+室间隔质量)/体质量(LV+S)/BW、(左心室+室间隔质量)/心脏重量(LV+S)/HW。
1.4.3 大鼠心肌组织HE染色、Masson染色、TUNEL染色心脏左室常规清洗后,经甲醛固定制成石蜡切片(4 μm)。HE染色,高倍镜下观察心肌梗死周边区心肌细胞形态学变化。Masson染色,高倍镜下观察心肌梗死周边区纤维增生情况,每张玻片随机取4个视野,应用IPP6.0图像分析软件,心肌胶原容积分数(CVF)=心肌胶原面积/所测视野面积×100%。TUNEL染色,高倍显微镜下观察心肌细胞凋亡情况,每张玻片任选4个视野,应用IPP6.0图像分析软件,计算心肌细胞凋亡率/%=TUNEL阳性细胞核数/细胞核总数×100%。
1.4.4 RT-PCR法测定心肌ANP mRNA及BNP mRNA的表达将左室梗死与非梗死交界区的心肌组织取下,置于液氮中保存。取适量组织用TRIzol法提取总RNA,参照逆转录试剂盒说明书逆转录为cDNA。以β-actin为内参。β-actin上游引物:5′-TTGGCATAGAGGTCTTTA-3′,下游引物:5′-AGATGACCCAGATCATGTTTGA-3′;ANP上游引物:5′-GCTCCTTCTCCATCACCAAG-3′,下游引物:5′-AGCCCTCAGTTTGCTTTTCA-3′;BNP上游引物:5′-TTCTGCTCCTGCTTTTCCTT-3′,下游引物: 5′-CGATCCGGTCTATCTTCTGC-3′。扩增条件为94℃ 5 min、94℃ 15 s、58℃ 30 s、72℃ 45 s,循环35次,72℃ 7 min, 4℃ 5 min。将扩增产物行琼脂糖凝胶电泳,Quantity one软件分析目的基因与内参基因吸光度。
1.4.5 Western blot法测定心肌PI3K、Akt、p-Akt及caspase-3蛋白表达全蛋白提取法提取心肌组织蛋白,BCA法测定蛋白浓度,各组蛋白质均50 μg上样,行SDS-PAGE电泳分离蛋白质,电转膜后分别加入稀释的PI3K抗体(1 :800)、Akt抗体(1 :700)、p-Akt抗体(1 :600)、caspase-3抗体(1 :600)、β-actin抗体(1 :4 000), 4℃过夜,d 2用TBST液漂洗膜,并用1 :4 000的荧光二抗37℃孵育1h,结果应用Fusion生物凝胶图像分析系统进行扫描定量,计算各样品的相对密度值作为各蛋白质的相对含量。
1.5 统计学处理采用SPSS 22.0软件进行统计学分析,计量资料均以x±s表示。组间比较采用单因素方差分析,组内比较采用重复测量方差分析。
2 结果 2.1 帕瑞昔布对心室重构模型大鼠血流动力学的影响帕瑞昔布对心室重构模型大鼠血流动力学的改善作用如Tab 1所示,帕瑞昔布剂量在8~12 mg·kg-1范围内能明显提高LVSP、+dp/dtmax,降低LVEDP、-dp/dtmax,且随着剂量的增加,改善作用越明显(P<0.05)。帕瑞昔布剂量低于8 mg·kg-1时对心室重构模型大鼠的血流动力学无明显改善作用(P >0.05)。
| Group | Dosage/mg·kg-1 | LVSP/kPa | LVEDP/kPa | +dp/dtmax/kPa·s-1 | -dp/dtmax/kPa·s-1 |
| Group S | - | 17.341±0.580 | -0.634±0.206 | 754.98±10.30 | -523.31±10.15 |
| Group R | - | 12.494±0.128* | 0.620±0.037* | 445.78±15.82* | -502.39±9.94* |
| Group P1 | 4 | 12.772±1.265 | 0.613±0.032 | 451.49±19.65 | -511.98±8.74 |
| Group P2 | 8 | 14.537±0.239# | -0.031±0.004# | 511.83±10.56# | -539.80±13.21# |
| Group P3 | 12 | 15.359±0.395#Δ | -0.037±0.004#Δ | 543.30±6.28#Δ | -556.61±12.49#Δ |
| *P<0.05 vs group S; #P<0.05 vs group R; ΔP<0.05 vs group P2 | |||||
帕瑞昔布对心室重构模型大鼠左心室肥厚指数的改善作用如Tab 2所示,帕瑞昔布剂量在8~12 mg·kg-1范围内能明显增加体重,降低HW/BW、(LV+S)/BW、(LV+S)/HW,且随着剂量的增加,改善作用越明显(P<0.05)。帕瑞昔布剂量低于8 mg·kg-1时对心室重构模型大鼠的左心室肥厚指数无明显改善作用(P>0.05)。
| Group | Dosage/mg·kg-1 | BW/g | HW/BW(×10-4) | (LV+S)/BW(×10-4) | (LV+S)/HW(×10-2) |
| Group S | - | 358.50±5.48 | 24.54±0.48 | 19.35±0.71 | 78.83±2.67 |
| Group R | - | 306.88±5.06* | 31.65±0.56* | 26.08±0.46* | 82.52±1.00* |
| Group P1 | 4 | 310.75±3.69 | 31.23±0.24 | 25.64±0.48 | 82.07±1.06 |
| Group P2 | 8 | 322.00±3.12# | 28.31±0.32# | 22.84±0.30# | 80.67±1.17# |
| Group P3 | 12 | 328.63±1.60#Δ | 27.65±0.28#Δ | 21.75±0.30#Δ | 78.67±1.15#Δ |
| *P<0.05 vs group S; #P<0.05 vs group R; ΔP<0.05 vs group P2 | |||||
光镜下观察Masson染色显示心肌细胞呈红色,胶原纤维呈蓝色。假手术组心肌细胞排列较均匀,无断裂,示正常心肌细胞形态,可见少量胶原纤维及炎性细胞浸润;心室重构模型组心肌细胞肿胀增粗最明显,形态极不规则,排列紊乱,细胞间隙可见大量胶原纤维增生,呈网状分布,并且炎性细胞浸润明显,与假手术组比较,胶原容积分数CVF明显升高(P<0.05)。经帕瑞昔布治疗后细胞肥大、排列紊乱及心肌间质纤维化程度有明显减轻,胶原容积分数CVF较心室重构组明显降低,且随着剂量的增加,改善效果越明显(P<0.05,Fig 1、2,Tab 3)。
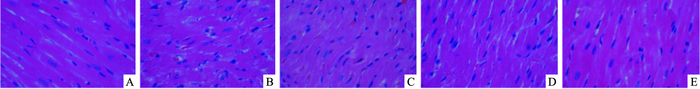
|
| Fig 1 Pathomorphological variance of myocardial tissues(HE staining, ×400) A:Group S; B:Group R; C:Group P1; D:Group P2; E:Group P3 |

|
| Fig 2 Interstitial fibrosis of myocardial tissues(Masson staining, ×400) A:Group S; B:Group R; C:Group P1;D:Group P2;E:Group P3 |
| Group | CVF | AI |
| Group S | 1.92±0.62 | 3.67±1.07 |
| Group R | 30.01±0.08* | 41.50±1.18* |
| Group P1 | 28.88±1.01 | 39.93±0.67 |
| Group P2 | 23.38±0.96#▲ | 34.57±1.31#▲ |
| Group P3 | 20.02±1.92#▲△ | 30.97±0.70#▲△ |
| *P<0.05 vs group S; #P<0.05 vs group R; ▲P<0.05 vs group P1;ΔP<0.05 vs group P2 | ||
TUNEL法检测5组梗死周边区心肌细胞凋亡情况。细胞核中有棕黄色颗粒者为凋亡阳性细胞。与假手术组比较,心室重构模型组在梗死周边区有大量的心肌细胞发生凋亡,凋亡指数AI明显增加(P<0.05);与心室重构模型组比较,经帕瑞昔布治疗后梗死周边区心肌细胞凋亡发生明显减少,凋亡指数AI降低(P<0.05),且随着剂量的增加,下降程度越明显(P<0.05,Fig 3,Tab 3)。
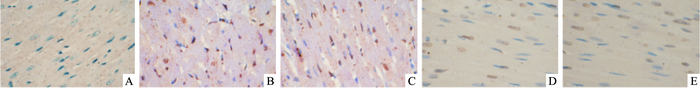
|
| Fig 3 Cardiac myocyte apoptosis of myocardial tissues(TUNEL staining, ×400) A:Group S; B:Group R; C:Group P1;D:Group P2; E:Group P3 |
mRNA、BNP mRNA表达的影响与假手术组比较,心室重构模型组的心肌肥厚标志基因ANP mRNA、BNP mRNA表达增加(P<0.05)。与心室重构组比较,帕瑞昔布各剂量组心肌肥厚标志基因ANP mRNA、BNP mRNA的表达降低,且随着剂量的增加,下降程度越明显(P<0.05,Fig 4,Tab 4)。
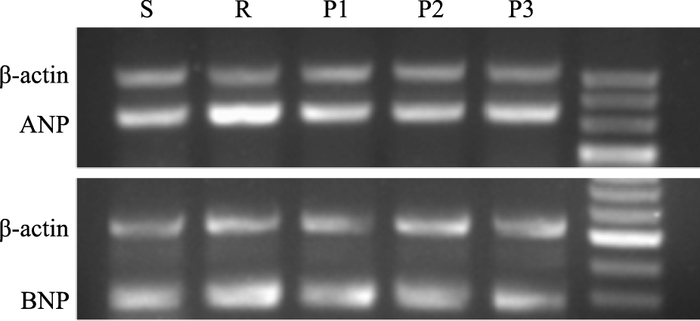
|
| Fig 4 Expressions of ANP mRNA and BNP mRNA in five groups |
| Group | ANP mRNA | BNP mRNA |
| Group S | 1.59±0.06 | 2.27±0.03 |
| Group R | 3.04±0.10* | 3.81±0.11* |
| Group P1 | 2.16±0.67# | 2.88±0.07# |
| Group P2 | 1.72±0.12#▲ | 2.59±0.02#▲ |
| Group P3 | 1.57±0.07#▲△ | 2.48±0.05#▲△ |
| *P<0.05 vs group S; #P<0.05 vs group R; ▲P<0.05 vs group P1;△P<0.05 vs group P2 | ||
各组Akt蛋白表达差异无显著性(P>0.05)。与假手术组比较,心室重构模型组的PI3K、p-Akt的蛋白表达降低,caspase-3的蛋白表达增加(P<0.05);与心室重构组比较,帕瑞昔布各剂量组PI3K、p-Akt的蛋白表达升高,caspase-3的蛋白表达降低(P<0.05),其中以高剂量帕瑞昔布组蛋白表达改变最明显,中剂量帕瑞昔布组次之(P<0.05,Fig 5,Tab 5)。
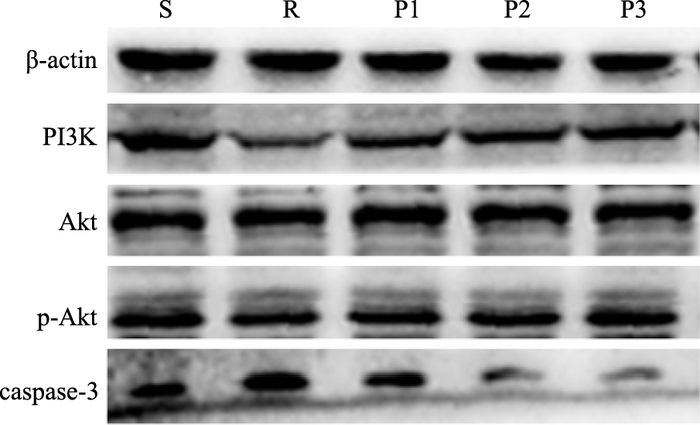
|
| Fig 5 Expressions of PI3K, Akt, p-Akt and caspase-3 in five groups |
| Group | PI3K/β-actin | p-Akt/ Akt | caspase-3/β-actin |
| Group S | 4.22±0.06 | 0.77±0.01 | 1.88±0.02 |
| Group R | 2.23±0.07* | 0.62±0.01* | 2.90±0.04* |
| Group P1 | 3.03±0.09# | 0.65±0.01# | 1.93±0.01# |
| Group P2 | 3.26±0.09#▲ | 0.71±0.01#▲ | 1.12±0.03#▲ |
| Group P3 | 3.61±0.08#▲△ | 0.77±0.03#▲△ | 0.79±0.04#▲△ |
| *P<0.05 vs group S; #P<0.05 vs group R; ▲P<0.05 vs group P1;△P<0.05 vs group P2 | |||
随着人们生活方式的改变及人口老龄化, 心肌梗死的发病率逐年提高[13]。心室重构是心肌梗死发展为心衰过程中最重要的病理过程,严重影响心肌梗死患者近晚期预后,因此如何及时有效的预防和逆转心室重构过程是改善心肌梗死转归的关键所在。本实验采用结扎大鼠左冠状动脉前降支后饲养28 d的方法建立心室重构模型,于结扎成功后24 h开始腹腔注射低(4 mg·kg-1)、中(8 mg·kg-1)、高(12 mg·kg-1)剂量的帕瑞昔布(相当于正常成人用药40~80 mg,即临床等效剂量),观察帕瑞昔布能否改善心肌梗死后心室重构,以及是否具有剂量依赖关系。结果显示,低剂量帕瑞昔布(4 mg·kg-1)对心肌梗死后心脏的改善作用仅限于微观病理形态学的改变,可抑制心肌细胞肥大及间质胶原纤维的增生,对心脏功能及左室肥厚的改善没有明显作用。当帕瑞昔布达到中剂量(8 mg·kg-1)时对心室舒缩功能(LVSP、+dp/dtmax、LVEDP、-dp/dtmax)及左室肥厚均有不同程度的改善,并随着药物剂量的增大,对心室舒缩功能及左室肥厚的改善效果更明显。而Straino等[14]的实验中,发现短期(5 d)应用超低剂量的帕瑞昔布(0.7 mg·kg-1)可提高大鼠心脏功能。本实验结果与此具有明显差异,可能与其研究中只探讨了帕瑞昔布的短期效用,未探究长期作用有关。
心钠肽(atrial natriuretic peptide, ANP)、脑钠肽(brain natriuretic peptide,BNP)是一类重要的心脏内分泌激素,正常生理状态下少量分泌。急性心肌梗死后由于心室的收缩和舒张功能急剧减退,容量和压力负荷相对过重,导致心肌细胞尤其是梗死区与非梗死区交界处受到的牵拉刺激最大,产生并释放的ANP、BNP增多。因此,梗死交界区ANP、BNP的含量可反映梗死局部张力的变化,是心肌细胞病理性肥大的可靠指标,对评价心室重构有重要指导意义[15]。本研究结果显示,心室重构组ANP mRNA、BNP mRNA的含量明显增高,帕瑞昔布可明显降低ANP mRNA、BNP mRNA的表达,且随着剂量的增加,降低程度越明显,这在我们前期研究的基础上进一步表明,帕瑞昔布可抑制心肌梗死后心肌细胞肥大,延缓心室重构,且具有剂量依赖关系。
心肌梗死后由于缺血缺氧,心肌细胞首先启动凋亡相关机制,形成凋亡复合体,通过多种蛋白酶的活化诱导细胞凋亡。由于心肌细胞再生能力有限,加之平滑肌细胞异常增生,极大的损害了心脏正常结构及功能。探究启动细胞抗凋亡作用的机制,可为减少缺血缺氧引起的心脏损伤提供有效的途径。PI3K/Akt信号传导途径是促使抗细胞凋亡发生的重要调控因子[16],PI3K可直接激活Akt发生磷酸化,p-Akt能够进一步通过抑制促凋亡蛋白caspase-3、Bax等的形成发挥保护心肌的作用[17]。研究发现,PI3K/Akt信号途径对缺血缺氧诱发的心肌细胞凋亡,可产生心肌保护作用[11, 18]。本研究采用帕瑞昔布长期治疗后发现,梗死周边区心肌细胞的凋亡及caspase-3蛋白表达降低,PI3K、p-Akt蛋白表达增加,且以高剂量的帕瑞昔布降低细胞凋亡、改善蛋白表达最明显。因此,上述研究结果表明,帕瑞昔布可能通过上调磷酸化Akt的表达,抑制心肌细胞凋亡,发挥延缓心室重构的保护作用,但其下游的具体机制还需要深入研究。
综上所述,帕瑞昔布可提高大鼠心肌梗死后心脏功能,延缓心室重构,该心肌保护作用的产生可能与PI3K/Akt信号通路的激活有关。但本实验仅研究了帕瑞昔布对大鼠心梗后心脏功能和左室肥厚的改善作用,未明确功能的改善能否转化为整体预后的提高,因此其临床实用性有待进一步研究。
( 致谢: 本实验动物饲养、建模、血流动力学的监测以及左室肥厚指数的测定主要在重庆医科大学动物实验中心完成,病理切片、RT-PCR以及Western blot主要在重庆医科大学附属第一医院中心实验室完成,感谢各位老师和同学对本实验的指导和帮助! )
| [1] | 李昊, 张幼怡. 促炎细胞因子在交感/儿茶酚胺介导心脏重塑中的作用[J]. 北京大学学报(医学版), 2014, 46(6): 1001-4. Li H, Zhang Y Y. Roles of proinflammatory cytokines incardiac remodeling induced by sympathetic nervoussystem/catecholamine[J]. J Peking Univ(Health Sci), 2014, 46(6): 1001-4. |
| [2] | Frangogiannis N G. The immune system and the remodeling infarcted heart: cell biological insights and therapeutic opportunities[J]. J Cardiovasc Pharmacol, 2014, 63(3): 185-95. doi:10.1097/FJC.0000000000000003 |
| [3] | Streicher J M, Kamei K, Ishikawa T O, et al. Compensatory hypertrophy induced by ventricular cardiomyocyte-specific COX-2 expression in mice[J]. J Mol Cell Cardiol, 2010, 49: 88-94. doi:10.1016/j.yjmcc.2010.01.021 |
| [4] | Li H, Gao S, Ye J, et al. COX-2 is involved in ET-1-induced hypertrophy of neonatal rat cardiomyocytes: Role of NFATc3[J]. Mol Cell Endocrinol, 2014, 382: 998-1006. doi:10.1016/j.mce.2013.11.012 |
| [5] | 成宁宁, 高进, 文婷婷, 等. 帕瑞昔布钠对急性心肌梗死大鼠心功能的影响[J]. 中华麻醉学杂志, 2010, 30(8): 956-8. Cheng N N, Gao J, Wen T T, et al. Effect of parecoxib on cardiac function after acute myocardial infarction in rats[J]. Chin J Anesthesiol, 2010, 30(8): 956-8. |
| [6] | Wang D, Patel VV, Ricciotti E, et al. Cardiomyocyte cyclooxygenase-2 influences cardiac rhythm and function[J]. Proc Natl Acad Sci USA, 2009, 106: 7548-52. doi:10.1073/pnas.0805806106 |
| [7] | Inserte J, Molla B, Aguilar R, et al. Constitutive COX-2 activity in cardiomyocytes confers permanent cardioprotection: Constitutive COX-2 expression and cardioprotection[J]. J Mol Cell Cardiol, 2009, 46: 160-8. doi:10.1016/j.yjmcc.2008.11.011 |
| [8] | Timmers L, Sluijter J P, Verlaan C W, et al. Cyclooxygenase-2 inhibition increases mortality, enhances left ventricular remodeling and impairs systolic function after myocardial infarction in the pig[J]. Circulation, 2007, 115(3): 326-32. doi:10.1161/CIRCULATIONAHA.106.647230 |
| [9] | Xu J, Tian W, Ma X, et al. The molecular mechanism underlying morphine-induced Akt activation: roles of protein phosphatases and reactive oxygen species[J]. Cell Biochem Biophys, 2011, 61(2): 303-11. doi:10.1007/s12013-011-9213-5 |
| [10] | 禤霏霏, 黄建春, 唐静芝, 等. 玉郎伞查尔酮调控PI3K/Akt信号通路抗心肌缺血/再灌注损伤的作用及机制研究[J]. 中国药理学通报, 2015, 31(12): 1730-5. Xuan F F, Huang J C, Tang J Z, et al. 17-methoxyl-7-hydroxyl-benzofuranchalcone alleviates myocardial ischemia/reperfusion injury via PI3K/Akt signal pathway[J]. Chin Pharmacol Bull, 2015, 31(12): 1730-5. doi:10.3969/j.issn.1001-1978.2015.12.020 |
| [11] | 宋华培, 黄跃生, 党永明, 等. PI3K/Akt信号途径抑制烧伤后大鼠缺血缺氧心肌细胞凋亡[J]. 第三军医大学学报, 2009, 31(1): 52-5. Song H P, Huang Y S, Dang Y M, et al. PI3K/Akt signal pathway in hibits ischemia and hypoxia-induced myocardial apoptosis in rats[J]. J Third Mil Med Univ, 2009, 31(1): 52-5. |
| [12] | Tang Y L, Zhao Q, Qin X, et al. Paracrine action enhances the effects of autologous mesenchymal stem cell transplantation on vascular regeneration in rat model of myocardial infarction[J]. Ann Thorac Surg, 2005, 80(1): 229-36. doi:10.1016/j.athoracsur.2005.02.072 |
| [13] | Lloyd-Jones D, Adams R J, Brown T M, et al. Executive summary: heart disease and stroke statistics—2010 update:a report from the American Heart Association[J]. Circulation, 2010, 121(7): 948-54. doi:10.1161/CIRCULATIONAHA.109.192666 |
| [14] | Straino S, Salloum F N, Baldi A. Protective effects of parecoxib, a cyclo-oxygenase-2 inhibitor, in post infarction remodeling in the rat[J]. J Cardiovasc Pharmacol, 2007, 50(5): 571-7. doi:10.1097/FJC.0b013e31814b91cb |
| [15] | Jaubert M P, Armero S, Bonello L, et al. Predictors of B-type natriuretic peptide and left atrial volume index in patients with preserved left ventricular systolic function: an echocardiographic-catheterization study[J]. Arch Cardiovasc Dis, 2010, 103(1): 3-9. doi:10.1016/j.acvd.2009.10.005 |
| [16] | d′Anglemont de Tassigny A, Berdeaux A, Souktani R, et al. The volume-sensitive chloride channel inhibitors prevent both contractile dysfunction and apoptosis induced by doxorubicin through PI3 kinase, Akt and Erk 1/2[J]. Eur J Heart Fail, 2008, 10(1): 39-46. doi:10.1016/j.ejheart.2007.11.002 |
| [17] | Sami A, Karsy M. Targeting the PI3K /AKT /mTOR signaling pathway in glioblastoma: novel therapeutic agents and advances in understanding[J]. Tumour Biol, 2013, 34: 1991-2002. doi:10.1007/s13277-013-0800-5 |
| [18] | 于水, 杨海扣, 米琰, 等. PI3K/Akt信号通路在外源性硫化氢后处理大鼠离体心肌中的作用[J]. 中国药理学通报, 2010, 26(6): 759-64. Yu S, Yang H K, Mi Y, et al. Function of PI3/Akt signaling pathway in exogenous hydrogen sulfide post conditioning on isolated rat hearts[J]. Chin Pharmacol Bull, 2010, 26(6): 759-64. |

