


黄芪甲苷(Astragaloside Ⅳ, Ast-Ⅳ)是中药黄芪的重要活性成分之一[1],广泛应用于用于临床心血管疾病的治疗,对于脓毒症,糖尿病等也能起到很好的治疗作用[2-3]。我们的前期研究显示,黄芪甲苷通过NO激活cGMP/PKG使GSK-3β失活进而抑制mPTP开放,发挥心肌线粒体保护作用[4];心肌缺血/再灌注可以引起内质网生理功能发生紊乱,引起内质网应激反应[5],本研究探讨黄芪甲苷的心肌保护作用是否与内质网应激相关及其可能的信号转导机制。
1 材料 1.1 药品及试剂黄芪甲苷(天津马克生物技术有限公司,纯度>99%,批号:HQJG-20110507);GRP78、GRP 94、IRE1、Tubulin等一抗以及辣根过氧化物酶标记山羊抗兔IgG二抗(美国Cell Signaling Technology公司);2-Deoxy-D-Glucose(2-DG)、Atractyloside、Cyclosporin A(美国Sigma公司);TMRE荧光染料(Molecular Probes公司);BCA蛋白浓度检测试剂盒、ECL发光检测试剂盒(碧云天生物技术研究所)。
1.2 仪器FV 1000激光扫描共聚焦显微镜(日本OLYMPUS公司);37℃二氧化碳孵育箱(美国Forma公司);JY200C电泳仪(北京君意电泳设备公司)。
2 方法 2.1 H9c2大鼠心肌细胞培养H9c2大鼠心肌细胞常规培养,在DMEM(Gibco公司)中加入双抗(青霉素、链霉素)和胎牛血清(Hyclone公司),培养至瓶内细胞达到90%左右,用浓度为0.25%胰蛋白酶消化细胞,改变其贴壁状态,加入培养基终止消化,传至相应培养皿。
2.2 实验分组将培养状态良好的H9c2心肌细胞(细胞含量至90%),用PBS冲洗2~3次,细胞用标准Tyrode液(5 mmol·L-1 HEPES, 140 mmol·L-1 NaCl, 6 mmol·L-1 KCL, 8 mmol·L-1 glucose, 1 mmol·L-1 MgCl2, 1 mmol·L-1 CaCl2, pH 7.4) 孵育2 h。① 共聚焦显微镜2-DG浓度实验:加入线粒体荧光染料TMRE,置于37℃二氧化碳孵育箱10~30 min,PBS冲洗2~3次,随机分为对照组、不同浓度2-DG组(10、50、100、500、1 000 μmol·L-1),mPTP开放剂Atractyloside组和mPTP抑制剂Cyclosporin A组。② 蛋白检测、电镜观察:细胞随机分为对照组(未经过任何处理的细胞,置于37℃二氧化碳孵箱50 min)、2-DG组(静置20 min,加入100 μmol·L-1 2-DG孵育30 min)、黄芪甲苷+2-DG组(50 μmol·L-1黄芪甲苷处理20 min,加入100 μmol·L-1 2-DG孵育30 min)、黄芪甲苷组(静置30 min,再50 μmol·L-1黄芪甲苷处理20 min)。
2.3 Western blot法检测GRP 78、GRP 94、IRE1蛋白的表达将细胞用PBS冲洗2~3次,利用Tyrode孵育2 h,按实验分组处理细胞,加入蛋白裂解液,使其裂解10~30 min(在冰上进行),把细胞刮下,置于EP管中,超声波破碎,4℃ 15 000 r·min-1,弃沉淀,加入96孔板进行蛋白浓度测量,根据标准曲线上样,制胶,转膜,10%脱脂牛奶室温封闭,一抗4℃摇床过夜。隔日二抗,利用ECL荧光显色,并用Image J软件图像分析。
2.4 共聚焦显微镜观察TMRE荧光强度的变化将90%融合的细胞,传代于共聚焦小皿,TMRE 37℃孵育箱10~30 min,选择543 nm激发光激发其产生560 nm发射波,共聚焦显微镜观察。正常情况下,线粒体内膜带负电荷,外膜带正电荷,荧光探针TMPE带正电荷,它可以自由进入并聚集于线粒体中,共聚焦观察为红色荧光;当mPTP开放时线粒体膜电位减少或消失,TMRE从线粒体中释放,共聚焦观察红色减少或消失。TMRE荧光强度的改变可以判断线粒体膜电位的变化,进而推测mPTP的开放程度。
2.5 电镜观察细胞超微结构培养细胞至85%~90%融合,消化离心,戊二醛固定24 h,PBS洗3次,每次15 min,PBS浸泡过夜,依次用50%,70%,90%,100%的乙醇脱水15 min,乙醇与丙酮1 :1的混合液15 min,丙酮15 min去乙醇,加树脂与丙酮1 :1的混合液37℃ 2~3 h,树脂低温紫外聚合2~3 d,56℃ 2~3 d,电镜扫描图像。
2.6 统计学分析实验数据采用SPSS(版本为22.0) 统计软件进行统计学处理,所有实验数据均用x±s表示。显著性差异采用完全随机设计的单因素方差分析(one-way ANOVA)。
3 结果 3.1 内质网应激对线粒体膜电位(mPTP开放)的影响与对照组相比,不同浓度内质网应激诱导剂2-DG可以模拟mPTP开放剂Atractyloside,明显减少线粒体TMRE的红色荧光强度,差异具有统计学意义(P<0.05)。因为100 μmol·L-1减弱荧光强度最明显,既能诱导mPTP开放又具有相对较小细胞毒性,故后续实验以此作为2-DG作用浓度。mPTP抑制剂Cyclosporin A没有明显影响荧光强度变化(Fig 1)。

|
| Fig 1 Effect of ERS on mPTP opening in H9c2 cardiac cells Different doses of 2-DG could mimic the mPTP opener atractyloside(Atr), significantly decreased TMRE fluorescence compared to the normal with the peak at 100 μmol·L-1. The mPTP inhibitor cyclosporin A(CsA) was not able to change the fluorescence intensity.*P < 0.05 vs normal (Scale bar, 20 μm) |
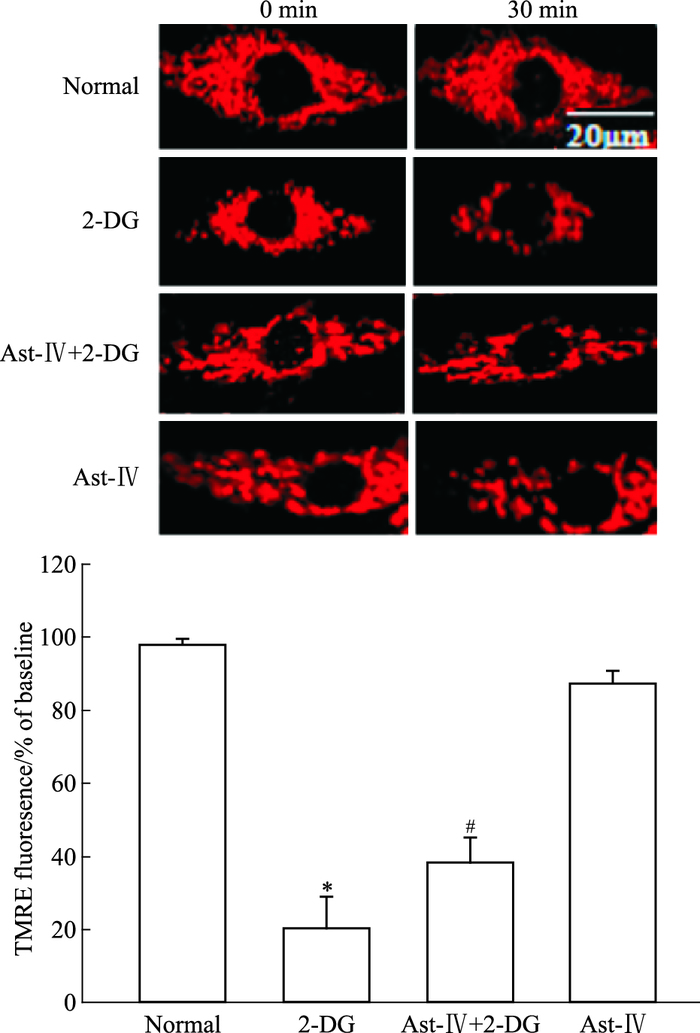
与对照组相比,2-DG处理30 min后,TMRE荧光强度明显降低,黄芪甲苷预处理明显抑制TMRE荧光强度的降低,黄芪甲苷本身无明显变化(Fig 2)。
|
| Fig 2 Effect of Astragaloside Ⅳ on mPTP opening in H9c2 cardiac cells 2-DG significantly decreased TMRE fluorescence compared to the normal. Astragaloside Ⅳ prevented 2-DG-induced TMRE fluorescence reduction. Astragaloside Ⅳ did not change the fluorescence intensity.*P < 0.05 vs normal; #P < 0.05 vs 2-DG(Scale bar, 20 μm) |
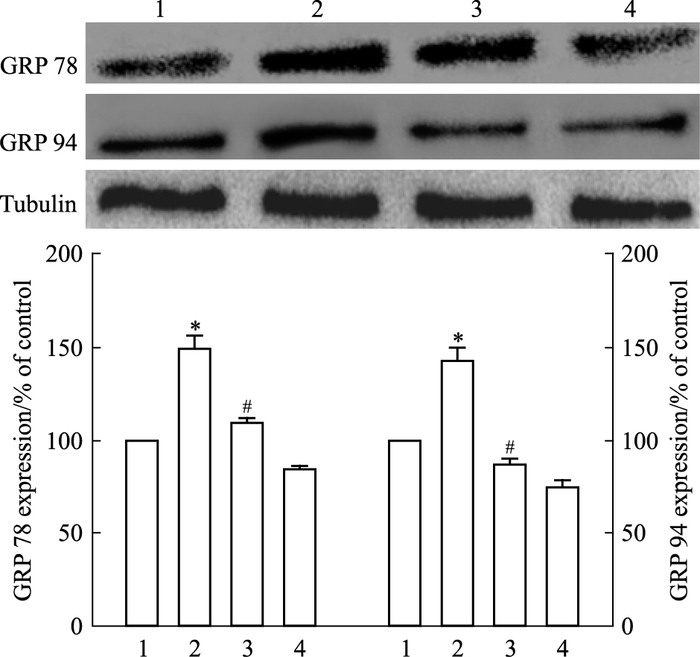
与对照组相比,2-DG使GRP 78和GRP 94表达明显增多,黄芪甲苷抑制此过程,差异具有统计学意义(P<0.05)(Fig 3)。
|
| Fig 3 Effect of Astragaloside Ⅳ on GRP 78 and GRP 94 expression in H9c2 cardiac cells 1:Control; 2:2-DG; 3:Ast-Ⅳ+2-DG; 4:Ast-Ⅳ.2-DG significantly increased GRP 78 and GRP 94 expression compared to control, Astragaloside Ⅳ significantly reduced GRP 78 and GRP 94 expression in H9c2 cardiac cells.*P < 0.05 vs control; #P < 0.05 vs 2-DG |
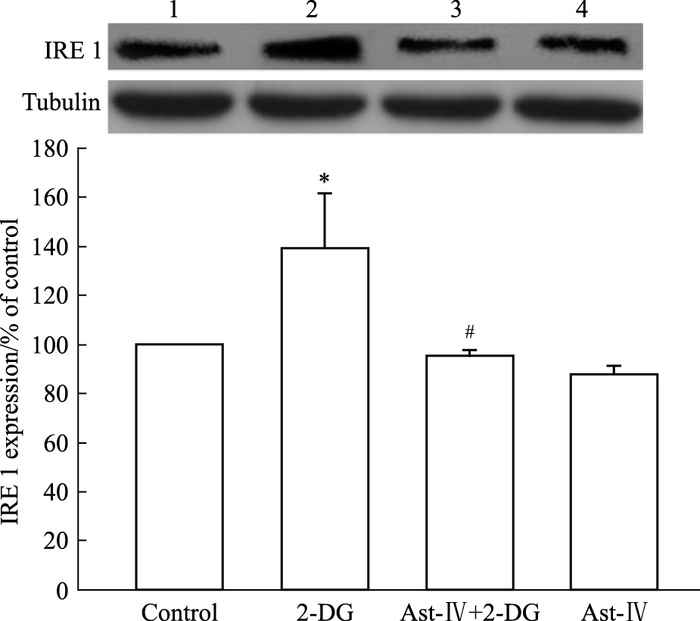
与对照组相比,2-DG使IRE1的表达明显增多,而黄芪甲苷明显抑制IRE1此过程,差异具有统计学意义(P<0.05)(Fig 4)。
|
| Fig 4 Effect of Astragaloside Ⅳ on IRE1 expression in H9c2 cardiac cells 1:Control; 2:2-DG; 3:Ast-Ⅳ+2-OG; 4:Ast-Ⅳ. 2-DG significantly increased IRE1 expression compared to control, Astragaloside Ⅳ significantly reduced IRE1 expression in H9c2 cardiac cells.*P < 0.05 vs control; #P < 0.05 vs 2-DG |
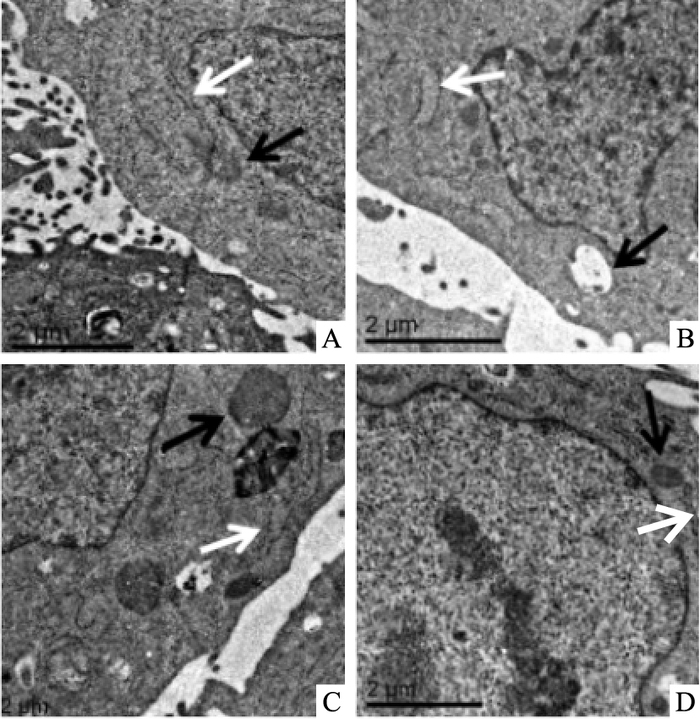
白色箭头所指为内质网,黑色箭头所指为线粒体。电镜下观察,正常细胞结构完整,线粒体嵴较致密,内质网分布在细胞核周围,管腔狭窄细长;2-DG组线粒体成空泡状,嵴断裂、溶解;内质网腔扩大,部分脱颗粒等发生明显的损伤;黄芪甲苷+2DG组损伤程度明显减轻,说明黄芪甲苷能减轻内质网和线粒体的损伤(Fig 5)。
|
| Fig 5 Effect of Astragaloside Ⅳ on ultrastructure with transmission electron microscopy in H9c2 cardiac cells A:Control; B: 2-DG; C: Ast-Ⅳ+2-DG; D:Ast-Ⅳ.2-DG induced mitochondrial swelling, cristae broken, dissolved or disappeared, endoplasmic reticulum swelling and degranulation compared to control; Astragaloside Ⅳ significantly prevented injury of mitochondria and endoplasmic reticulum. The white arrow marks the endoplasmic reticulum and the black arrow marks the mitochondria(Scale bar, 2 μm) |
急性心肌梗死(acute myocardial infarction,AMI)严重危害人类健康,发病急、预后差,即使经过溶栓、介入等手段改善了缺血的心肌,但是在冠脉急性再通的过程中仍会引起缺血心肌的炎症、坏死、心律失常,也就是心肌缺血/再灌注损伤(myocardial ischemic/reperfusion injury, MIRI)。详细探讨MIRI机制具有非常重要的基础和临床意义。内质网应激是指各种原因导致细胞内质网内稳态失衡、生理功能发生紊乱的一种病理过程。心肌缺血/再灌注损伤过程中的自由基损伤、细胞内Ca2+超载等均可以引起内质网功能障碍,触发内质网应激[6-7]。
黄芪甲苷是从中药黄芪中所提炼的一种重要活性成分之一,广泛用于临床心血管疾病的治疗。线粒体是真核细胞的重要细胞器,其主要功能是通过氧化磷酸化生成三磷酸腺苷(ATP),供给生物体可以直接利用的能量。近年来的研究表明,许多疾病的发生发展过程都与线粒体有关。研究证实,线粒体在心肌再灌注损伤中起关键性的作用,这主要是因为粒线体内、外膜上存在线粒体通透性转移孔(mitochondrial permeability transition pore, mPTP)[5, 8]。正常生理状况下,mPTP处于保持关闭。当机体受到应激刺激时可使mPTP开放,分子量少于1.5 ku的物质可自由通过线粒体膜,致使内膜渗透压增高从而继发线粒体肿胀,ATP生成减少,线粒体膜电位减少或消失。我们的前期研究也显示,黄芪甲苷通过抑制mPTP开放发挥心肌线粒体保护作用[4, 9]。
为了研究黄芪甲苷的心肌线粒体保护作用是否与内质网应激相关,我们首先对H9c2大鼠心肌细胞进行常规传代培养,用内质网应激诱导剂2-脱氧-D-葡萄糖(2-DG)处理细胞。TMRE染色后利用激光扫描共聚焦显微镜,观察其对线粒体膜电位的影响,进而推测内质网应激与mPTP开放的关系。结果如Fig 1所示,与对照组相比,不同浓度2-DG能够模拟mPTP开放剂Atractyloside,使线粒体TMRE红色荧光强度明显减弱,mPTP抑制剂Cyclosporin A没有明显影响荧光强度的变化,说明2-DG诱导的内质网应激能够使mPTP开放。由于终浓度为100 μmol·L-1时效果最明显,故以此作为实验浓度。而黄芪甲苷能够明显抑制2-DG引起的TMRE荧光强度降低,说明黄芪甲苷通过抑制内质网应激阻止mPTP开放,发挥心肌线粒体保护作用(Fig 2)。
葡萄糖调节蛋白78和94(GRP 78和GRP 94) 是内质网应激早期伴侣分子,介导蛋白合成暂停等细胞反应,以恢复内质网内环境稳态以维持细胞存活,他们是内质网应激的关键调控分子[10]。在我们的实验中,2-DG使GRP 78和GRP 94表达明显增多,黄芪甲苷抑制此过程,说明2-DG可以诱发内质网应激反应,黄芪甲苷可能通过GRP 78和GRP 94抑制内质网应激。
肌醇必需酶1(IRE1) 是位于内质网的跨膜蛋白,在内质网应激引起高度保守的未折叠蛋白反应中,IRE1可以比作一个感受器,它在胞质端具有丝氨酸/苏氨酸激酶活性,当未折叠蛋白堆积、缺氧、钙失衡时,IRE1通过自身磷酸化驱动分子伴侣GRP 78以及很多未折叠蛋白应答相关的基因表达,在决定细胞最终生存或死亡上起着至关重要的作用[11-13]。在我们的实验中,2-DG使IRE1的蛋白量明显增高,而黄芪甲苷预处理可以明显抑制此过程(Fig 4),说明黄芪甲苷通过IRE1抑制内质网应激。
线粒体作为全身功能“中枢”,一旦受到损伤机体将陷入“瘫痪”状态,线粒体功能障碍在内质网损伤中扮演重要的角色[5]。我们的实验结果如Fig 5所示,正常细胞结构完整,线粒体形态正常,嵴较致密;内质网分布在细胞核周围,管腔狭窄细长。2-DG使线粒体变成空泡状,线粒体嵴断裂、溶解;内质网腔扩张,部分内质网脱颗粒。黄芪甲苷明显减轻以上损伤,说明黄芪甲苷对内质网、线粒体具有一定的保护作用。
综上所述,内质网应激诱导剂2-DG可以使mPTP开放,黄芪甲苷明显抑制2-DG引起的mPTP开放,同时增加GRP 78、GRP 94、IRE1的表达,减轻内质网和线粒体的损伤,提示黄芪甲苷可能通过GRP 78、GRP 94、IRE1抑制内质网应激阻止mPTP开放,发挥心肌线粒体保护作用。黄芪甲苷的“内质网-线粒体”交叉对话机制有待于我们进一步研究。
| [1] | 国家药典委员会. 中华人民共和国药典:一部[M]. 北京: 中国医药科技出版社, 2010: 283-4. National Pharmacopoeia Committee. People′s Republic of China Pharmacopoeia:[M]. Beijing: China Medical Science and technology press, 2010: 283-4. |
| [2] | Liu R, Jiang H, Tian Y, et al. Astragaloside Ⅳ protects against polymicrobial sepsis through inhibiting inflammatory response and apoptosis of lymphocytes[J]. J Surg Res, 2016, 200(1): 315-23. doi:10.1016/j.jss.2015.08.024 |
| [3] | Lv L, Wu S Y, Wang G F, et al. Effect of astragaloside Ⅳ on hepatic glucose-regulating enzymes in diabetic mice induced by a high-fat diet and streptozotocin[J]. Phytother Res, 2010, 24(2): 219-24. |
| [4] | 贺永贵, 郑桓, 张国彬, 等. 黄芪甲苷对H2O2所致大鼠心肌细胞线粒体损伤的保护作用及其机制[J]. 中国药学杂志, 2014, 49(17): 1519-23. He Y G, Zheng H, Zhang G B, et al. Effect of Astragaloside Ⅳ on H2O2-induced mitochondrial damage in rat myocardium and its molecular mechanism[J]. Chin Pharm J, 2014, 49(17): 1519-23. |
| [5] | Wang G, Huang H, Zheng H, et al. Zn2+ and mPTP mediate endoplasmic reticulum stress inhibition-induced cardioprotection against myocardial ischemia/reperfusion injury[J]. Biol Trace Elem Res, 2016, 174(1): 189-97. doi:10.1007/s12011-016-0707-2 |
| [6] | Guo X F, Yang X J. Endoplasmic reticulum stress response in spontaneously hypertensive rats is affected by myocardial ischemia reperfusion injury[J]. Exp Ther Med, 2015, 9(2): 319-26. |
| [7] | Matsunaga D, Sreekumar P G, Ishikawa K, et al. Humanin protects RPE cells from endoplasmic reticulum stress induced apoptosis by upregulation of mitochondrial glutathione[J]. PLoS One, 2016, 11(10): 1-22. |
| [8] | Miura T, Tanno M. The mPTP and its regulatory proteins: Final common targets of signaling pathways for protection against necrosis[J]. Cadiovasc Res, 2012, 94(2): 181-9. doi:10.1093/cvr/cvr302 |
| [9] | 贺永贵, 李王芳, 伊红丽, 等. 黄芪甲苷抑制GSK-3β活性介导大鼠心肌缺血/再灌注损伤作用的线粒体机制研究[J]. 中国药理学通报, 2014(03): 402-6. He Y G, Li W F, Yi H L, et al. Mitochondrial mechanism of Astragaloside Ⅳ induced inhibition of GSK-3β in myocardial ischemia/reperfusion injury in rats[J]. Chin Pharmacol Bull, 2014(03): 402-6. doi:10.3969/j.issn.1001-1978.2014.03.023 |
| [10] | Liu M Q, Chen Z, Chen L X. Endoplasmic reticulum stress: a novel mechanism and therapeutic target for cardiovascular diseases[J]. Acta Pharmacol Sin, 2016, 37(4): 425-43. doi:10.1038/aps.2015.145 |
| [11] | Jerry Chiang W C, Lin J H. The effects of IRE1, ATF6, and PERK signaling on adRP-linked rhodopsins[J]. Adv Exp Med Biol, 2014, 801: 661-7. doi:10.1007/978-1-4614-3209-8 |
| [12] | Mei Y, Thompson M D, Cohen R A, et al. Endoplasmic reticulum stress and related pathological processes[J]. J Pharmacol Biomed Anal, 2013, 1(2): 1000107. |
| [13] | Ranatunga S, Tang C H, Kang C W, et al. Synthesis of novel tricyclic chromenone-based inhibitors of IRE-1 RNase activity[J]. J Med Chem, 2014(10): 4289-301. |

