


2. 三峡大学 仁和医院,湖北 宜昌 443002
 ,
ZHANG Chang-cheng1,
LIU Chao-qi1,
WANG Ting1,
YUAN Cheng-fu1,
XU Cheng1,
YUAN Ding1,2
,
ZHANG Chang-cheng1,
LIU Chao-qi1,
WANG Ting1,
YUAN Cheng-fu1,
XU Cheng1,
YUAN Ding1,2

2. Renhe Hospital, Three Gorges University, Yichang Hubei 443002, China
衰老是生物体普遍的生理现象,是一个极其复杂和多因子的过程,以许多器官渐进的退行性变化为主要特征[1]。研究显示,随着衰老的进行,体内稳态并不能良好维持,而肝脏是最容易受到影响的器官之一。在人和实验动物肝脏中,与衰老相关的形态学和功能学的变化包括肝血流量、脂质积累、储存脂肪和产生细胞外基质的肝星状细胞的减少、肿胀以及炎性因子的增加[2]。慢性炎症已经被提议作为潜在的衰老以及与衰老相关的疾病的主要分子机制[3],炎症细胞因子在肝脏疾病中的作用受到密切关注。其中包括Th1类炎症因子如IL-1β、IL-12、IL-6、TNF-α、IFN-γ和Th17类炎症因子IL-17α,这些炎症因子直接反映了肝脏内的炎症状态[4]。
竹节参为五加科人参属植物竹节参Panax japonicus C.A. Mey的干燥呈竹鞭状根茎,具有滋补强壮、散瘀止痛、止血祛痰的功效。竹节参总皂苷(total saponins of Panax japonicus,TSPJ)是从竹节参块根中提取分离而得,是竹节参的主要活性成分之一。竹节参总皂苷包括人参皂苷Re、竹节参皂苷Ⅴ、竹节参皂苷Ⅳ、竹节参皂苷Ⅳa、竹节参皂苷2等[5],多以齐墩果烷型五环三萜为主,达玛烷型四环三萜(原人参二醇、原人参三醇型)相对较少。现代药理学研究显示,竹节参总皂苷具有抗炎[6]、抗肿瘤[7]、降血脂[8]等多种药理活性。前期研究显示,竹节参总皂苷可以保护异烟肼、利福平以及四氯化碳所致的小鼠肝损伤[9-10],竹节参对D-半乳糖所致的衰老具有保护效应[11]。基于此,本研究建立大鼠自然衰老模型,初步探讨竹节参总皂苷对自然衰老大鼠肝脏炎症的干预作用。
1 材料 1.1 实验动物SPF级♂ SD大鼠,购自三峡大学实验动物中心,动物分笼饲养于空调室内,室温(22±2)℃,湿度(60±5)%,喂标准颗粒饲料,自由饮水和摄食。
1.2 药物与试剂竹节参的块根购于湖北省恩施椿木营竹节参种植基地,经湖北省天然产物研究与开发重点实验室邹坤教授鉴定其为五加科人参属植物竹节参Panax japonicus C.A.Mey。TSPJ是由本研究团队提取分离,其提取分离方法参照前期研究基础,提取率为18.4%,纯度83.48%。总RNA提取试剂盒、逆转录试剂盒和PCR扩增试剂盒,大连宝生物科技有限公司;PCR引物,生工生物工程(上海)股份有限公司;羊抗β-actin、兔抗白介素-1β(IL-1β)、兔抗肿瘤坏死因子-α(TNF-α)抗体,美国Santa Cruz公司,批号依次为:sc-4778、sc-13968、sc-1351。羊抗兔及兔抗羊IgG-HRP,武汉科瑞有限公司;化学发光剂ECL,碧云天生物技术研究所。
1.3 仪器TP1020脱水机(Leica公司);ULTRACUTR型超薄切片机(奥地利莱卡公司);DMIRB光学显微镜(德国Leica公司);Bio-Rad电源、小型垂直电泳槽[Mini-PROTEAN Tetra(1.0 mm)]及其小型Trans-Blot转印槽(Mini Trans-Blot Electrophoretic)(Bio-Rad/伯乐公司); Veriti 96孔PCR热循环仪(美国Applied Biosystems);Gene Genius凝胶分析系统(美国SYNGNE公司)。
2 方法 2.1 分组与给药不同时间点购买3M大鼠,在三峡大学实验动物中心常规喂养至不同月龄进行实验。其中3 M(3月龄)大鼠12只、9 M(9月龄)大鼠12只、15 M(15月龄)大鼠12只、18 M(18月龄)大鼠48只,将18 M大鼠分为4组,每组12只,分别是衰老对照组、TSPJ低、中、高剂量组。18 M衰老对照组每天灌胃生理盐水,每周灌6 d停1 d, 至24个月;TSPJ低、中、高剂量组分别给予TSPJ 10、30、60 mg·kg-1灌胃至24个月,每周灌6 d停1 d。实验前12 h禁食,饮水不限制。实验过程、实验研究均遵循中国实验动物学会动物伦理委员会制定的指导原则和要求。
2.2 肝脏HE染色大鼠处死后,完整取出肝脏组织,称重后,用0.9%氯化钠注射液冲洗,用滤纸尽量沾干,快速切取肝中叶标本,置入4%多聚甲醛中固定,脱水、石蜡包埋、切片,按标准操作进行HE染色,光镜下观察结果。
2.3 Western blot检测蛋白的表达取50~100 mg肝组织于1.5 mL EP管中,每管加入1 mL PBS,冰上快速剪碎肝组织,1 000 r·min-1离心10 s,上清液,如此反复至上清液接近无色,上清液,然后每管加入适量蛋白裂解液和PMSF(100 :1),轻轻混匀,加至玻璃匀浆器中,迅速碾磨至呈乳白色无碎块即可,4℃ 12 000 r·min-1离心10 min,取上清,加入1/5上清体积的5×上样缓冲液,煮沸10 min,进行Western blot,检测肝组织IL-1β、TNF-α蛋白的表达,Image J软件进行分析。
2.4 RT-PCR检测基因的表达将提取RNA所需用品均用0.1% DEPC水处理,泡酸后洗净的玻璃匀浆器提前于150℃烘箱中放置6 h,用前取出放在超净台内。取30~70 mg肝组织于1.5 mL EP管中,加入适量TRIzol,在匀浆器中进行组织匀浆,4℃ 12 000 r·min-1离心10 min,取上清,将其转至1.5 mL EP管中,加入1/5上清体积的氯仿,震荡30 s,室温静置5 min,4℃ 12 000 r·min-1离心15 min,将其转至新的EP管中,加入同等体积的异丙醇,轻轻混匀,室温静置5 min,4℃ 12 000 r·min-1离心10 min,弃去上清,加入1 mL 75%乙醇于管中,洗涤沉淀,4℃ 12 000 r·min-1离心10 min,弃去上清,即得到RNA。按照反转录试剂盒操作,得到cDNA。按照PCR扩增试剂盒说明书进行扩增,扩增条件为:94℃ 5 min,94℃ 30 s、53℃ 30 s、72℃ 30 s循环34次,72℃ 5 min。产物经2%琼脂糖凝胶电泳检测mRNA的表达。PCR引物序列见Tab 1。
| Gene | sequence(5′→3′) | |
| Forward | Reverse | |
| IL-1β | TGCCTCGTGCTGTCTGAC | GGTGGGTGTGCCGTCTTTC |
| IL-6 | CAACTTCCAATGCTCTCCTSSTGG | TGCCGAGTAGACCTCATAGTGACC |
| IL-10 | GGAGTGAAGACCAAAGGC | GGAATCTGTCAGCAGTATGTTGTCC |
| IL-12 | GCTAATGCGGTCTCTGAATCACAG | TGACTCGGGTGCTGAAGGC |
| IL-17α | CTGAGCCGCAATGAGGACC | CCAGCATCTTCTCCACCCG |
| TNF-α | TCAGCCTCCTCTCTGCCATC | CAATGACTCCAAAGTAGACCTGCC |
| IFN-γ | GCTATGGAAGGAAAGAGCCTCC | GACACTTATGTTGTTGCTGATGGC |
| β-actin | GGTTGTCTCCTGTGACTTCAA | CCACCCTGTTGCTGTAGCC |
采用SPSS 18.0统计学软件进行分析。计量资料用x±s表示,多组样本间比较采用单因素方差分析,Western blot和RT-PCR数据采用Image J软件分析。
3 结果 3.1 活体动物观察实验期间,3M大鼠精神状态好,活动正常,毛发光泽,肤色红润,大小便正常;随着年龄的增长,9、15、24 M大鼠精神萎靡,喜静,活动明显减少,饲料消耗量比3 M少,体重增长较慢;TSPJ低、中、高剂量组大鼠比24 M大鼠活跃,进食有所增加。
3.2 肝脏大体观察3 M大鼠肝脏外观颜色呈鲜红色,边缘锐利,表面光滑;随着年龄的增长,9、15、24 M大鼠的肝脏体积逐渐增大,边缘变钝,与周围组织黏连增加,切面呈油腻状;TSPJ低、中、高剂量组大鼠肝脏体积略有减轻,外观色泽有所改善。见Fig 1、2。
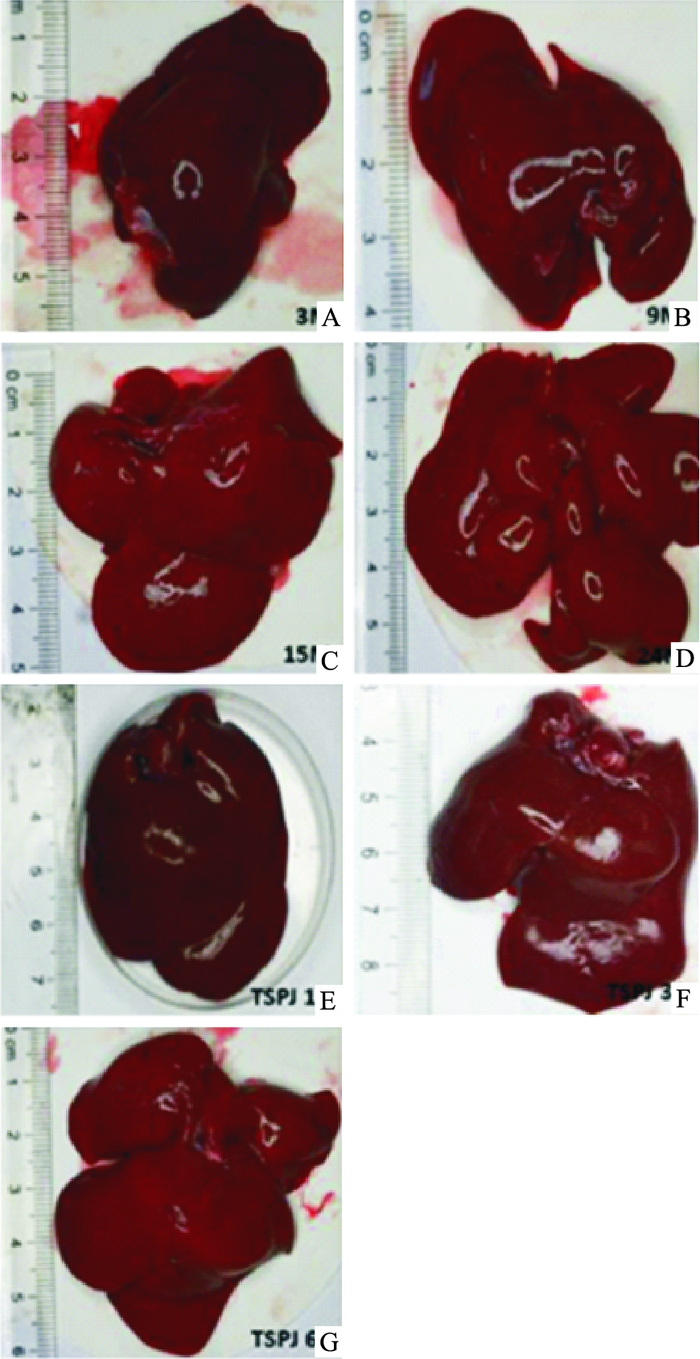
|
| Fig 1 Appearance in liver of rats in each group A:3 M; B:9 M; C:15 M; D:24 M; E:TSPJ 10 mg·kg-1; F:TSPJ 30 mg·kg-1; G:TSPJ 60 mg·kg-1 |
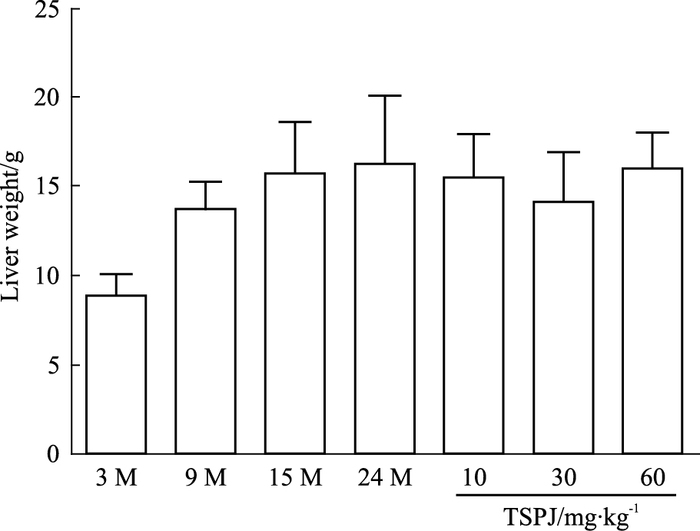
|
| Fig 2 Liver weight of rats in each group(x±s, n=6) |
3 M大鼠肝细胞排列紧密,镜下肝小叶结构完整,随着年龄的增长,9、15、24 M大鼠肝脏汇管区炎性细胞、坏死细胞明显增多,细胞索排列紊乱,脂滴和假小叶明显增加。TSPJ低、中、高剂量组在镜下观察发现TSPJ中剂量组的肝细胞和肝索的排列最为整齐,脂滴明显减少,炎性细胞和坏死细胞数量明显下降。见Fig 3。
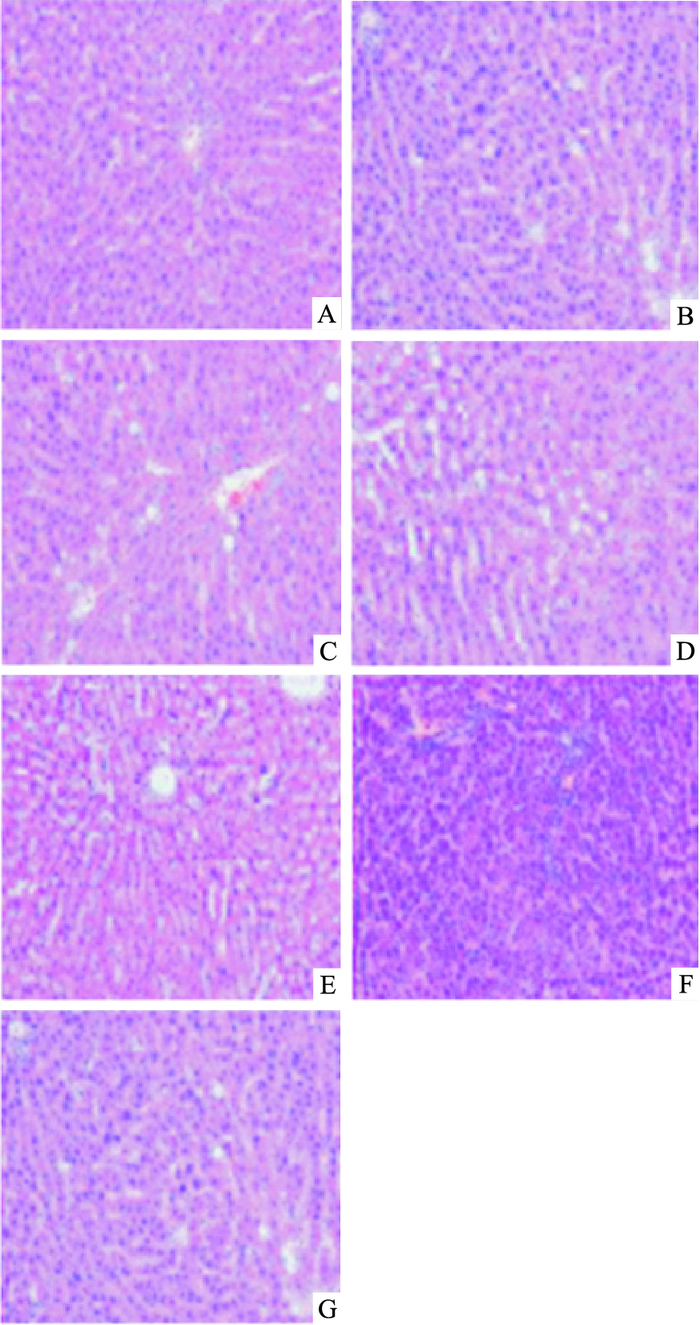
|
| Fig 3 Pathological morphology in liver of rats in each group A:3 M; B:9 M; C:15 M; D:24 M; E:TSPJ 10 mg·kg-1; F:TSPJ 30 mg·kg-1; G:TSPJ 60 mg·kg-1 |
如Fig 4显示,随着大鼠年龄的逐渐增长,肝脏组织IL-1β、TNF-α蛋白的表达逐渐增加,TSPJ低、中、高剂量组能够明显降低其表达。
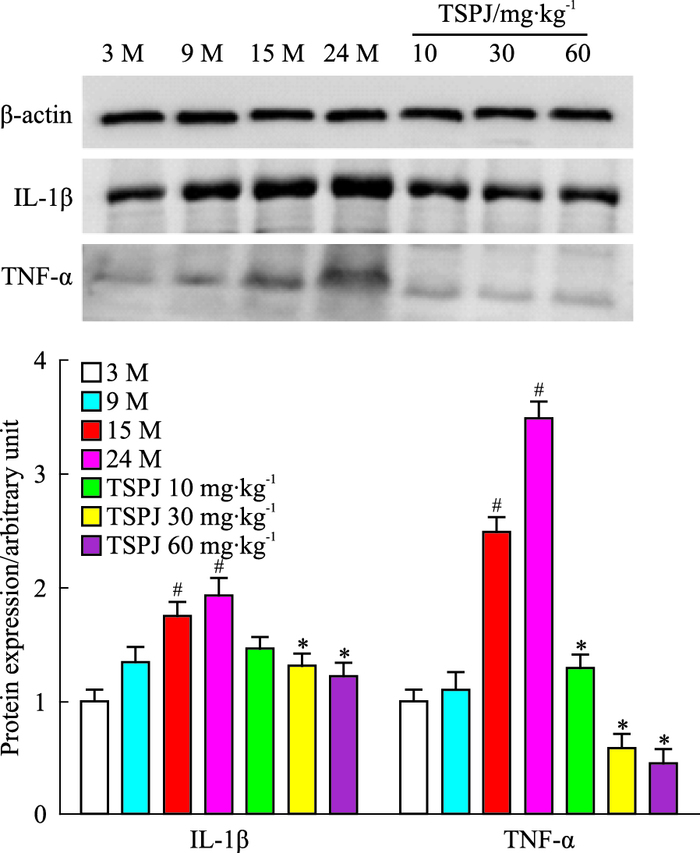
|
| Fig 4 Expressions of IL-1β, TNF-α protein in liver of rats of each group(x±s, n=6) #P < 0.05 vs three months group; *P < 0.05 vs twenty-four months group |
如Fig 5、6所示,与3M大鼠肝脏相比,随着年龄的增长,IL-1β、IL-6、IL-12、TNF-α、IL-17α和IFN-γ mRNA表达明显增加;与24 M相比,TSPJ低、中、高剂量组均能够降低其表达。
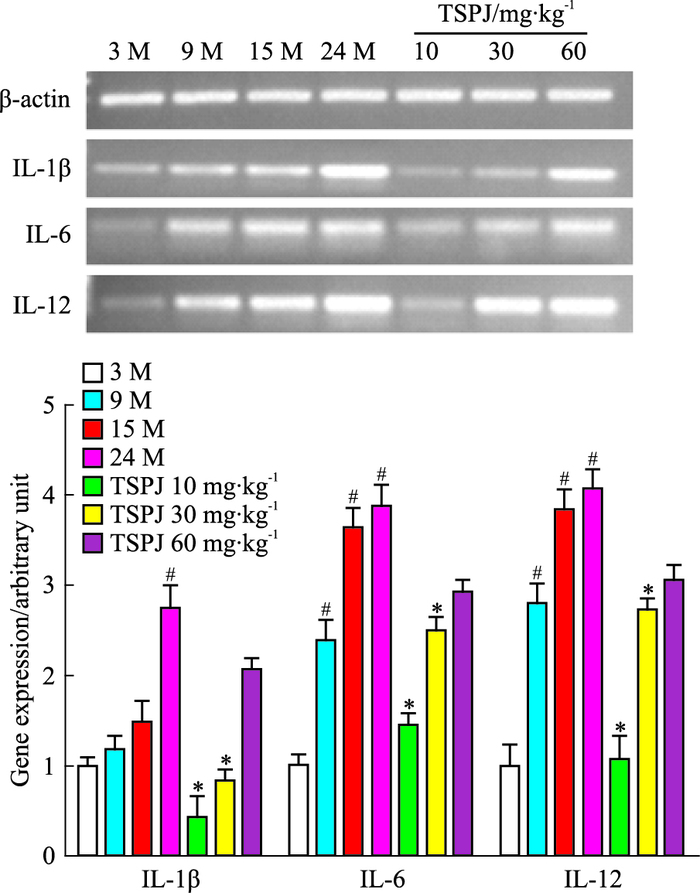
|
| Fig 5 Expressions of IL-1β, IL-6, IL-12 mRNA in liver of rats in each group(x±s, n=6) #P < 0.05 vs three months group; *P < 0.05 vs twenty-four months group |
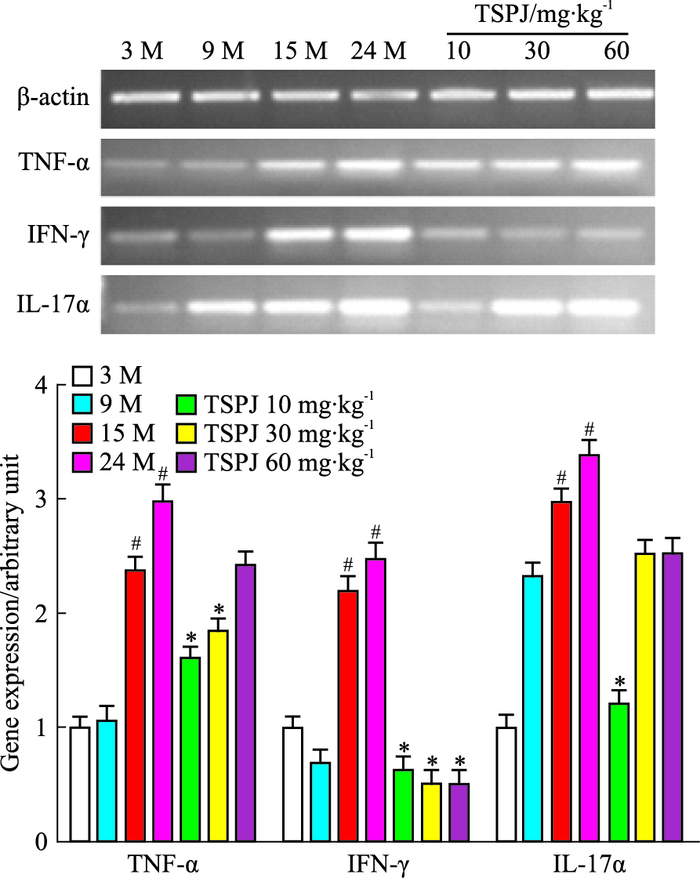
|
| Fig 6 Expressions of TNF-α, IL-17α, IFN-γ mRNA in liver of rats of each group(x±s, n=6) #P < 0.05 vs three months group; *P < 0.05 vs twenty-four months group |
衰老被广泛定义为生物体随着时间的推移,机体功能的逐渐衰退。研究发现,年龄的增长始终伴随着一定程度的炎症反应,这种炎症反应是一种持续的、低强度的状态[12-13]。肝脏是人体至关重要的代谢器官,不仅调节体内物质和能量的代谢,可以产生多种炎症因子,也是炎症介质的靶器官。肝脏炎症反应的变化会影响整个机体的炎症状态,在机体的炎症反应中占有举足轻重的地位。随着年龄的增长,肝脏的功能和病理变化已经被广泛研究,但随着增龄对其生理衰退的程度仍有争议。因此,在分子水平全面评估其变化,可能至少解决部分问题[14]。
随着年龄的增长,衰老大鼠炎症标记物,如IL-1β,TNF-α, IL-6和IFN-γ的水平逐渐升高。在D-半乳糖诱导的衰老大鼠模型中,肝脏的IL-1β,TNF-α,IL-6的基因和蛋白的表达水平均有明显的升高[14]。我们的研究发现,IL-1β、IL-6、IL-12、IL-17α、TNF-α、IFN-γ mRNA和IL-1β、TNF-α蛋白的表达随着大鼠年龄的增长,表达逐渐增加,提示增龄过程中肝组织的炎性因子表达的增加对机体的炎症反应可能具有重要作用。
我们前期的实验研究显示,竹节参总皂苷对四氯化碳诱导的小鼠肝损伤和异烟肼合用利福平所致的肝损伤具有保护作用[9-10]。此外,竹节参总皂苷能有效抑制脂多糖(LPS)刺激RAW264.7巨噬细胞引起的炎症反应,其机制与竹节参总皂苷能够调控NF-κB通路,进而抑制LPS诱导的RAW264.7细胞NO的释放,降低IL-1β、TNF-α和iNOS的表达有关[9];竹节参皂苷Ⅴ对LPS诱导的小鼠急性肝损伤具有一定的抗炎作用,可能是抑制了NF-κB和MAPK信号通路[15]。
通过比较3、9、15、24 M和竹节参总皂苷不同剂量组大鼠的体重,我们发现,随着年龄的增长,大鼠肝脏重量逐渐增加,而竹节参各剂量组均能一定程度上降低其肝脏重量,其中竹节参中剂量组降低的最为明显。
本实验通过HE染色,观察到随着年龄的增长,大鼠肝脏组织中脂肪空泡和炎性细胞增加明显,肝细胞由原先的放射状排列到排列紊乱加重,肝索之间间隔变大,竹节参低、中剂量组可以明显改善其病变程度,脂肪空泡和炎性细胞数量明显降低,肝细胞排列趋近整齐。竹节参高剂量组肝索间距没有很大的变化,但是脂肪空泡和炎性细胞明显减少,说明竹节参各剂量组在一定程度上可以降低肝脏组织病变的程度,其中竹节参低、中剂量组效果更为明显。
我们的研究发现,竹节参总皂苷各剂量组均在一定程度上降低了衰老大鼠肝脏炎性因子表达,使IL-1β、IL-6、IL-12、IL-17α、TNF-α、IFN-γ mRNA和IL-1β、TNF-α蛋白表达降低。因此,竹节参总皂苷可能是通过改善大鼠肝脏组织炎症反应来保护自然衰老大鼠的肝脏功能。本研究将为衰老中炎症反应的分子机制及相应的干预措施提供实验依据。
( 致谢: 本实验在三峡大学医学院国家中医药管理局中药药理科研三级实验室完成。感谢实验室中心、动物实验中心以及三峡大学肿瘤微环境与免疫治疗湖北省重点实验室提供的帮助和支持,同时感谢本课题组老师和同学们在实验过程中的指导和帮助。 )
| [1] | Frisina R D, Walton J P. Age-related structural and functional changes in the cochlear nucleus[J]. Hear Res, 2006, 216-217: 216-23. doi:10.1016/j.heares.2006.02.003 |
| [2] | Cao S X, Dhahbi J M, Mote P L, Spindler S R. Genomic profiling of short-and long-term caloric restriction effects in the liver of aging mice[J]. Proc Natl Acad Sci USA, 2001, 98(19): 10630-5. doi:10.1073/pnas.191313598 |
| [3] | 郭慧宁, 凌霜, 刘俊, 等. 衰老相关分泌表型的研究进展[J]. 中国药理学通报, 2016, 32(11): 1505-9. Guo H N, Ling S, Liu J, et al. The research progress of senescence-associated secretory phenotype[J]. Chin Pharmacol Bull, 2016, 32(11): 1505-9. doi:10.3969/j.issn.1001-1978.2016.11.006 |
| [4] | Cawthorn W P, Sethi J K. TNF-alpha and adipocyte biology[J]. FEBS Lett, 2008, 582(1): 117-31. doi:10.1016/j.febslet.2007.11.051 |
| [5] | Li S, Tang Y, Liu C, Zhang Y. Development of a method to screen and isolate potential α-glucosidase inhibitors from Panax japonicus C.A. Meyer by ultrafiltration, liquid chromatography, and counter-current chromatography[J]. J Sep Sci, 2015, 38(12): 2014-23. doi:10.1002/jssc.v38.12 |
| [6] | 代艳文, 袁丁, 万静枝, 等. 竹节参总皂苷通过NF-κB通路对LPS致RAW264.7细胞炎症的保护作用[J]. 中国中药杂志, 2014, 39(11): 2076-80. Dai Y W, Yuan D, Wan J Z, et al. Study on protective effect of total saponins of Panax japonicus on LPS-induced RAW264.7 cell inflammation through NF-kappaB pathway[J]. Chin J Chin Mater Med, 2014, 39(11): 2076-80. |
| [7] | 袁丁, 左锐, 张长城. 竹节参总皂苷对人白血病细胞株HL-60的作用[J]. 中西医结合学报, 2007, 5(5): 570-2. Yuan D, Zuo R, Zhang C C. Effects of total saponins of Panax japonicus on human leukemic HL-60 cells[J]. Chin J Integr Med, 2007, 5(5): 570-2. |
| [8] | 贾银芝, 杨中林. 竹节参总皂苷对Triton WR-1339诱发的高脂血症小鼠降血脂作用研究[J]. 亚太传统医药, 2015, 11(12): 9-11. Jia Y Z, Yang Z L. Hypolipidemic action of total saponins of Panax japonicus on Triton WR-1339 induced hyperlipidemic mice[J]. Asia-Pacific Tradit Med, 2015, 11(12): 9-11. |
| [9] | 霍元秀, 张长城, 王玮琦, 等. 竹节参总皂苷对异烟肼和利福平致小鼠肝损伤的保护作用[J]. 中国药房, 2013, 24(47): 4417-21. Huo Y X, Zhang C C, Wang W Q, et al. Protective effects of total saponins of Panax japonicus on mice liver injury induced by isoniazid and rifampicin[J]. China Pharm, 2013, 24(47): 4417-21. doi:10.6039/j.issn.1001-0408.2013.47.01 |
| [10] | 覃玉娥, 崔倩倩, 张长城, 等. 竹节参总皂苷对四氯化碳诱导小鼠肝损伤的影响[J]. 中国中医药信息杂志, 2014, 21(10): 47-9. Qin Y E, Cui Q Q, Zhang C C, et al. Effects of total saponins from Panax japonicus on acute hepatic injury induced by carbon tetrachloride[J]. Chin J Inf Tradit Chin Med, 2014, 21(10): 47-9. doi:10.3969/j.issn.1005-5304.2014.10.014 |
| [11] | Wang T, Di G J, Yang L, et al. Saponins from Panax japonicus attenuate D-galactose-induced cognitive impairment through its anti-oxidative and anti-apoptotic effects in rats[J]. J Pharm Pharmacol, 2015, 67(9): 1284-96. doi:10.1111/jphp.2015.67.issue-9 |
| [12] | Bruunsgaard H, Andersen-Ranberg K, Hjelmborg Jv, et al. Elevated levels of tumor necrosis factor alpha and mortality in centenarians[J]. Am J Med, 2003, 115(4): 278-83. doi:10.1016/S0002-9343(03)00329-2 |
| [13] | Lang C H, Silvis C, Deshpande N, et al. Endotoxin stimulates in vivo expression of inflammatory cytokines tumor necrosis factor alpha, interleukin-1 beta, -6, and high-mobility-group protein-1 in skeletal muscle[J]. Shock, 2003, 19(6): 538-46. doi:10.1097/01.shk.0000055237.25446.80 |
| [14] | Ruan Q W, Liu F, Gao Z J, et al. The anti-inflamm-aging and hepatoprotective effects of huperzine A in D-galactose-treated rats[J]. Mech Ageing Dev, 2013, 134(3-4): 89-97. doi:10.1016/j.mad.2012.12.005 |
| [15] | Dai Y W, Zhang C C, Zhao H X, et al. Chikusetsusaponin V attenuates lipopolysaccharide-induced liver injury in mice[J]. Immunopharmacol Immunotoxicol, 2016, 38(3): 167-74. doi:10.3109/08923973.2016.1153109 |