


2. 徐州医科大学 附属医院麻醉科, 江苏 徐州 221000;
3. 徐州医科大学 附属医院消化科江苏 徐州 221000;
4. 徐州医科大学 第二附属医院肿瘤内科,江苏 徐州 221000
2. Dept of Anesthesiology, the Affiliated Hospital, Xuzhou Jiangsu 221000, China;
3. Dept of Gastroenterology, the Affiliated Hospital, Xuzhou Jiangsu 221000, China;
4. Dept of Medical Oncology, the Second Affiliated Hospital, Xuzhou Medical University, Xuzhou Jiangsu 221000, China
癌症骨转移引起的疼痛是一种常见的病理性疼痛,以往研究显示,85%的肺癌、乳腺癌、前列腺癌患者都存在骨转移,其中约三分之一的患者伴有骨痛症状[1]。然而,目前骨癌痛的发生机制尚未阐明,临床治疗效果不理想,长期的疼痛给患者带来巨大的身心痛苦,严重影响了患者的生活质量,因此,了解骨癌痛的发生和发展的机制及寻找有效的治疗药物,成为近年来研究的热点。
酪氨酸蛋白激酶2/信号转导子和转录激活子3(Janus kinase 2/signal transducers and activators of transcription 3,JAK2/STAT3) 信号通路是近年来发现的一条介导多种细胞因子和生长因子的胞内信号转导通路,参与了细胞生长、增殖、分化以及免疫调节,与炎症性疾病及肿瘤的发展有着密切联系[2-4]。细胞因子或生长因子与细胞表面的特异性受体结合后,受体发生二聚化,然后激活受体自身的酪氨酸激酶的活性或者与受体偶联的非受体型酪氨酸激酶的活性,继而使STAT3第705位酪氨酸磷酸化,磷酸化后的STAT3形成二聚体,然后进入细胞核内调控相关基因的转录[4]。近年来研究表明STAT3信号通路的激活在神经病理性疼痛的发生中起关键作用[5],但在骨癌痛中尚未见相关报道。
二甲双胍是一种广泛使用的口服降糖药物,近年来研究发现,二甲双胍可以减轻神经损伤、化疗、糖尿病引起的神经病理性疼痛模型大鼠痛敏反应[6, 12-13],二甲双胍的镇痛作用的机制尚未明了,其镇痛作用是否与STAT3信号通路有关也未见文献报道。本研究首次在骨癌痛大鼠模型上观察二甲双胍的镇痛作用及其对脊髓背角中磷酸化信号转导子与转录激活子3(phospho-signal transducers and activators of transcription 3,p-STAT3) 表达的影响,为进一步了解二甲双胍的镇痛机制提供理论基础。
1 材料与方法 1.1 实验动物健康成年♀SD大鼠,8周龄,体质量200~220 g,由山东省济宁市任城区鲁康动物饲料经销中心提供,清洁Ⅱ级, 动物使用许可证号:SCXK(鲁)20140007,常规饲养,保持室温(24±1)℃,湿度40%~60%,12 h周期光照7 :00~19 :00。大鼠自由饮水摄食。所有大鼠实验前适应性饲养1周,实验遵守国际实验动物使用准则对动物进行处理。
1.2 实验分组及处理将SD大鼠随机分为4组进行行为学测试,每组12只。即假手术+生理盐水组(Sham+NS组)、假手术+二甲双胍组(Sham+Metformin组)、骨癌痛+生理盐水组(BCP+NS组)、骨癌痛+二甲双胍组(BCP+Metformin组)。BCP+NS组和BCP+Metformin组大鼠右侧胫骨骨髓腔注入Walker 256乳腺癌细胞5 μL(1×1011个·L-1);Sham+NS组和Sham+Metformin组大鼠右侧胫骨骨髓腔注入5 μL生理盐水。4组大鼠于术后d 7~14分别腹腔内注射溶媒生理盐水或5%二甲双胍200 mg·kg-1,1次/日。
1.3 仪器及药品Walker 256乳腺癌细胞株(上海生物医学工程研究所);兔抗p-STAT3一抗(Cell Signaling Technology公司,美国;Bioworld Technology公司,美国);兔抗GAPDH一抗(Bioworld Technology公司,美国),碱性磷酸酶标记的山羊抗兔二抗(碧云天公司,中国);NBT/BCIP显色试剂盒(碧云天公司,中国);BCA蛋白分析试剂盒(碧云天公司,中国);von Frey Hairs(Stoeling公司,美国);超敏二步法免疫组化试剂盒(北京中杉金桥生物公司,中国);DAB显色试剂盒(北京中杉金桥生物公司,中国)。
1.4 骨癌痛模型制备参照文献[7]中介绍的方法制备大鼠胫骨癌痛模型。将冻存于液氮中的Walker 256乳腺癌细胞种植于传代用♀ SD大鼠(80~100 g)腹腔内,饲养5~7 d,待大鼠腹腔内出现明显腹水,局部消毒后从腹腔抽取含肿瘤的腹水,经生理盐水洗涤后稀释细胞至浓度约为1×1011个·L-1,置于冰上备用。大鼠腹腔注射10%水合氯醛3 mL·kg-1麻醉后,在右侧胫骨中上1/3处暴露胫骨骨面,用25μL微量注射器刺入骨髓腔内注入5 μL肿瘤细胞,假手术组注入等体积生理盐水。针孔处使用医用胶水封闭,然后缝合伤口。
1.5 行为学测定通过测量机械缩足阈值(mechanical withdrawal threshold,MWT)来评估骨癌痛大鼠的疼痛程度。在安静恒温的环境中,将一有机玻璃箱(26 cm×20 cm×14 cm)置于金属筛网上,将大鼠置于有机玻璃箱中适应30 min,大鼠处于安静状态时,用von Frey纤维细丝(Stoehing公司,美国)垂直刺激大鼠手术侧后肢足底中部,大鼠出现抬足或舔足行为视为阳性反应,否则为阴性反应。参照文献[8]中介绍的up-down方法推算大鼠50%缩足阈值作为MWT。测定4组大鼠术前1 d及术后3、5、7、10、12、14 d的MWT值,d 10、12、14的行为学测定于给药后2h测量,行为学测量结束后,处死大鼠,用于Western blot检测及免疫组织化学染色。
1.6 Western blot法测p-STAT3的表达吸入1%异氟烷麻醉大鼠,迅速将其断头处死,冰上操作取L4~6脊髓背角,放入-80℃冰箱保存备用。蛋白提取:组织从冰箱取出,匀浆器冰上预冷,加入RIPA裂解液、酶抑制剂及磷酸酶抑制剂,用电动匀浆器充分匀浆后,进行离心15 min(4 ℃,12 000 r·min-1),取上清液,用BCA试剂盒测定样本蛋白浓度后,各组用裂解液配平。加入上样缓冲液后,沸水变性10 min。样本蛋白在10%的SDS-PAGE凝胶系统中上样,浓缩胶电压60 V,分离胶电压100 V电泳。湿转法将目的蛋白转移至PVDF膜上。3%牛血清室温封闭2 h后,分别用兔抗p-STAT3一抗(1 :300),兔抗GAPDH一抗(1 :2 000)4 ℃孵育过夜。第2日复温30 min后Washing Buffer漂洗3次×5 min,加入碱性磷酸酶标记的山羊抗兔二抗(1 :1 000),室温摇床孵育2 h。Washing Buffer漂洗3次×5 min,加入NBT/BCIP显色液,待反应达到要求后,流水洗涤终止反应。所得条带光密度分析,统计分析数据。
1.7 p-STAT3免疫组织化学染色各组大鼠造模后d 14,经腹腔注射10%水合氯醛(3 mL·kg-1)麻醉后,打开胸腔,暴露心脏,经升主动脉先灌注生理盐水200 mL,随即灌注4%多聚甲醛300 mL。取L4~6脊髓段,置于多聚甲醛中后固定4~6 h,再浸于30%蔗糖溶液中4℃过夜直至组织沉底。将沉底组织用包埋剂固定于冻台,进行冰冻横断切片,厚度为40 μm。切片于室温PBS冲洗5 min×3次,行超敏二步法免疫组织化学染色。组织切片经过3%过氧化氢及正常山羊血清孵育后,滴加兔抗p-STAT3一抗(1 :50) 孵育,4℃湿盒孵育24 h。滴加聚合物辅助剂常温下孵育30 min,PBS冲洗5 min×3次;然后滴加辣根酶标记抗兔IgG聚合物,常温下孵育30 min,PBS冲洗5 min×3次;DAB显色、贴片、脱水、透明、封片。用PBS代替一抗或二抗作阴性对照。切片拍照后,Image-Pro Plus 6.0软件分析脊髓背角染色阳性细胞数(number,Num)和平均光密度值(mean optical density,MOD)。
1.8 统计学处理用SPSS 13.0软件统计分析数据,计量资料以x±s表示,组间比较采用单因素方差分析,行为学检测不同时间点之间的数据比较采用重复测量设计的two-way ANOVA(时间为组内因素,处理为组间因素)。
2 结果 2.1 二甲双胍减轻骨癌痛大鼠机械痛各组大鼠MWT基础值无明显差异,Sham+NS组大鼠MWT值一直处于较高水平;Sham+NS组与Sham+Metformin组之间无明显差异;BCP+NS组大鼠接受肿瘤细胞植入后其MWT值逐渐降低,与Sham+NS组相比,自d 5开始差异有统计学意义(P<0.01);BCP+Metformin组大鼠从d 7起腹腔内连续注射二甲双胍后,MWT值明显升高,与BCP+NS组比较,在d 10、12、14有明显差异(P<0.01)。见Fig 1。
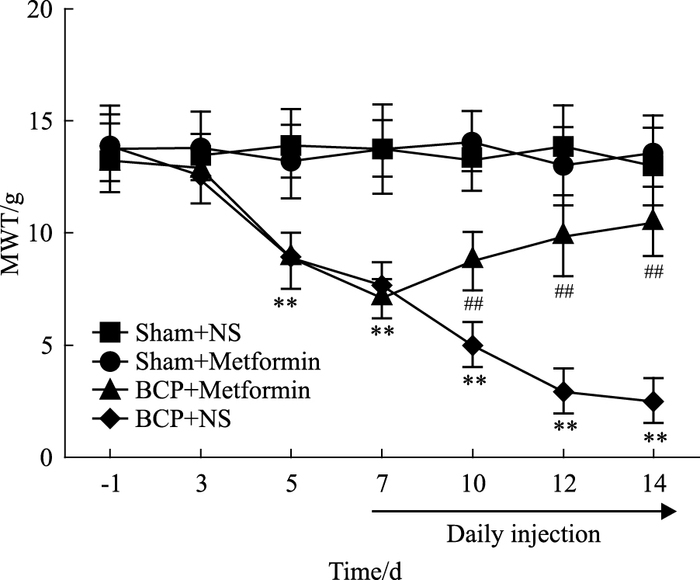
|
| Fig 1 Effects of metformin on MWT values of bone cancer pain in rats(x±s, n=12) **P < 0.01 vs Sham+NS; ##P < 0.01 vs BCP+NS |
为进一步探讨二甲双胍减轻BCP大鼠疼痛的分子机制,我们检测p-STAT3在大鼠脊髓背角中的表达。与Sham+NS组相比,BCP+NS组大鼠脊髓背角中p-STAT3的表达明显增多,差异有统计学意义(P<0.01);与BCP+NS组比较,BCP+Metformin组大鼠注射二甲双胍后,p-STAT3的表达明显减少,差异有统计学意义(P<0.05)。见Fig 2。
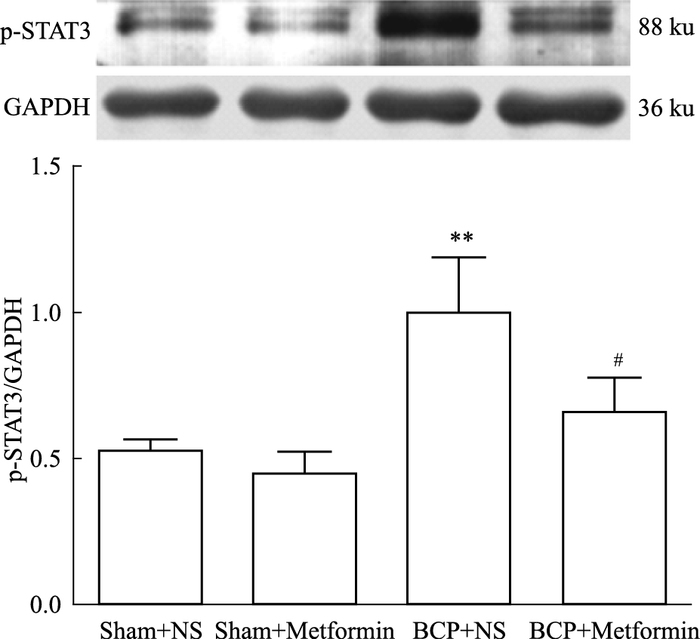
|
| Fig 2 Metformin inhibited expression of p-STAT3 in spinal dorsal horn in rats with BCP(x±s, n=6) Metformin decreased STAT3 phosphorylation levels in the spinal dorsal horn after bone cancer pain.**P < 0.01 vs Sham+NS; #P < 0.05 vs BCP+NS |
免疫组织化学染色结果显示,Sham+NS组大鼠脊髓背角中p-STAT3的表达很少,且集中于脊髓背角的第Ⅰ、Ⅱ板层。与Sham+NS组比较,术后d 14,BCP+NS组大鼠脊髓背角p-STAT3阳性细胞数及平均光密度值明显增加, 差异有统计学意义(P<0.01);与BCP+NS组比较,BCP+Metformin组大鼠注射二甲双胍后,脊髓背角p-STAT3阳性细胞数及平均光密度值明显减少,差异有统计学意义(P<0.01)。见Fig 3,Tab 1。
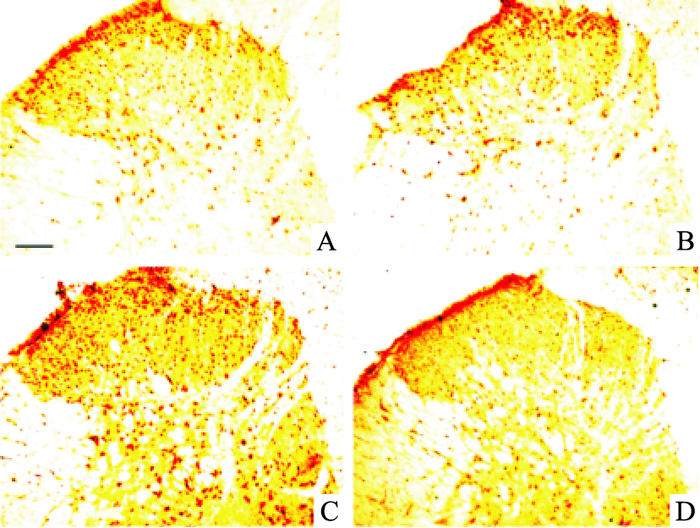
|
| Fig 3 Distribution and expression of p-STAT3 in spinal dorsal horn of different groups(x±s, n=6) A:Sham+NS; B:Sham+Metformin; C:BCP+NS; D:BCP+Metformin.The expression of p-STAT3 in the spinal dorsal horn significantly increased on the 14 day after operation in BCP+NS group, and p-STAT3 levels decreased after metformin treatment. Scale bar: 100 μm |
| Group | Num | MOD |
| Sham+NS | 595.67±139.51 | 0.020±0.0044 |
| Sham+Metformin | 586.67±136.77 | 0.018±0.0061 |
| BCP+NS | 3700.33±264.99** | 0.100±0.0088** |
| BCP+Metformin | 1945.00±261.61## | 0.064±0.0051## |
| **P<0.01 vs Sham+NS; ##P<0.01 vs BCP+NS | ||
癌症骨转移引起的疼痛是临床上常见的难治性慢性疼痛,其机制包含炎性疼痛和神经病理性疼痛成分,但并不是简单的这两种疼痛相加,骨癌痛不仅包括肿瘤自身的因素,还涉及炎症反应、外周敏化及中枢敏化等过程[9]。采用Walker 256乳腺癌腹水瘤细胞可成功制备与人类骨癌痛相似的大鼠胫骨骨癌痛模型[10]。本研究结果表明,在大鼠胫骨上段骨髓腔注入Walker 256大鼠乳腺癌细胞后,BCP+NS组大鼠机械缩足阈值从d 5起明显缩短,机械痛阈处于低值且逐渐稳定,提示模型建立成功。
二甲双胍作为一种双胍类的降糖药物,安全应用于2型糖尿病的治疗已经50余年。近年来,二甲双胍的镇痛作用成为研究热点。在SNL、SNI等模型中的研究发现,二甲双胍作为腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)的间接激活剂,与抑制神经病理性疼痛有关[11],有研究报道其对糖尿病神经病理性疼痛及化疗产生的神经病理性疼痛也具有缓解作用[12-13]。本实验首次研究二甲双胍对骨癌痛的影响,参照文献[11]中的给药剂量及预实验结果选择给药剂量及给药时间。BCP+Metformin组大鼠连续8 d腹腔内给予二甲双胍,其机械痛阈值逐渐升高,到d 14可以明显缓解骨癌痛大鼠的疼痛。说明二甲双胍可以有效减轻骨癌痛大鼠的疼痛。
脊髓背角是痛觉传递的初级中枢,从外周感受器传入的痛觉信息在脊髓背角处进行初步整合,进一步传递到大脑高级中枢,形成了具有意识的痛觉[14]。脊髓背角的中枢敏化在骨癌痛的发生和维持中起着重要作用。二甲双胍的镇痛机制尚不明确,以往研究仅集中在离体水平,本实验首次探讨了脊髓背角在其治疗中的作用。
JAK2/STAT3信号通路是近年来新发现的一条重要的信号转导途径。STAT3信号通路在外周神经损伤后脊髓的中枢敏化形成中起到重要作用,并与胶质细胞的激活和炎症因子的释放有关[5]。近年来研究发现,二甲双胍可以抑制STAT3信号通路激活,从而抑制肿瘤细胞的增殖[15],但在疼痛方面尚无相关研究。本研究首次发现,骨癌痛大鼠脊髓背角p-STAT3的表达明显增多,而连续应用二甲双胍后可以抑制脊髓背角中STAT3信号通路的活化,这可能为其抑制骨癌痛大鼠疼痛的重要机制。
该实验说明二甲双胍治疗骨癌痛安全、有效,加之其具有廉价、易获取的特点,研究二甲双胍的镇痛作用具有重大的临床意义。本实验为其在临床中的应用提供理论依据。随着对该药特点和骨癌痛机制的进一步探索,希望其在疼痛的治疗领域上的应用更具科学性、有效性。
( 致谢: 本实验在徐州医科大学江苏省麻醉学重点实验室完成,在此衷心地感谢所有作者的贡献及江苏省麻醉学重点实验室的老师和同学的帮助! )
| [1] | Middlemiss T, Laird B J, Fallon M T. Mechanisms of cancer-induced bone pain[J]. Clin Oncol, 2011, 23(6): 387-92. doi:10.1016/j.clon.2011.03.003 |
| [2] | O′Shea J J, Plenge R. JAK and STAT signaling molecules in immunoregulation and immune-mediated disease[J]. Immunity, 2012, 36(4): 542-50. doi:10.1016/j.immuni.2012.03.014 |
| [3] | Kim B H, Yi E H, Ye S K. Signal transducer and activator of transcription 3 as a therapeutic target for cancer and the tumor microenvironment[J]. Arch Pharm Res, 2016, 39(8): 1085-99. doi:10.1007/s12272-016-0795-8 |
| [4] | Yuan J, Zhang F, Niu R. Multiple regulation pathways and pivotal biological functions of STAT3 in cancer[J]. Sci Rep, 2015, 5: 17663. |
| [5] | Dominguez E, Rivat C, Pommier B, et al. JAK/STAT3 pathway is activated in spinal cord microglia after peripheral nerve injury and contributes to neuropathic pain development in rat[J]. J Neurochem, 2008, 107(1): 50-60. doi:10.1111/jnc.2008.107.issue-1 |
| [6] | Price T J, Das V, Dussor G. Adenosine monophosphate-activated protein kinase (AMPK) activators for the prevention, treatment and potential reversal of pathological pain[J]. Curr Drug Targets, 2016, 17(8): 908-20. doi:10.2174/1389450116666151102095046 |
| [7] | 贾晓明, 杨建平, 王丽娜, 等. 骨癌痛大鼠脊髓背角KCC2的表达及可能机制[J]. 中国药理学通报, 2010, 26(11): 1463-6. Jia X M, Yang J P, Wang L N, et al. Mechanism and expression of KCC2 in the spinal cord of bone cancer pain rats[J]. Chin Pharmacol Bull, 2010, 26(11): 1463-6. |
| [8] | Chaplan S R, Bach F W, Pogrel J W, et al. Quantitative assessment of tactile allodynia in the rat paw[J]. J Neurosci Methods, 1994, 53(1): 55-63. doi:10.1016/0165-0270(94)90144-9 |
| [9] | Jimenez-Andrade J M, Mantyh W G, Bloom A P, et al. Bone cancer pain[J]. Ann N Y Acad Sci, 2010, 1198: 173-81. doi:10.1111/j.1749-6632.2009.05429.x |
| [10] | 姚明, 杨建平, 王丽娜, 等. 腹水传代与体外培养Walker 256癌细胞系建立大鼠骨癌痛模型的可行性[J]. 中华医学杂志, 2008, 88(13): 880-4. Yao M, Yang J P, Wang L N, et al. Feasibility of establishment of rat model of bone cancer pain by using Walker 256 cells cultured in vitro or in vivo[J]. Natl Med J China, 2008, 88(13): 880-4. doi:10.3321/j.issn:0376-2491.2008.13.005 |
| [11] | Melemedjian O K, Asiedu M N, Tillu D V, et al. Targeting adenosinemonophosphate-activated protein kinase(AMPK) in preclinical models reveals a potential mechanism for the treatment of neuropathic pain[J]. Mol Pain, 2011, 7: 70. |
| [12] | Ma J, Yu H, Liu J, et al. Metformin attenuates hyperalgesia and allodynia in rats with painful diabetic neuropathy induced by streptozotocin[J]. Eur J Pharmacol, 2015, 764: 599-606. doi:10.1016/j.ejphar.2015.06.010 |
| [13] | Mao-Ying Q L, Kavelaars A, Krukowski K, et al. The anti-diabetic drug metformin protects against chemotherapy-induced peripheral neuropathy in a mouse model[J]. PLoS One, 2014, 9(6): e100701. doi:10.1371/journal.pone.0100701 |
| [14] | Todd A J. Neuronal circuitry for pain processing in the dorsal horn[J]. Nat Rev Neurosci, 2010, 11(12): 823-36. doi:10.1038/nrn2947 |
| [15] | Liu Q, Yuan W, Tong D, et al. Metformin represses bladder cancer progression by inhibiting stem cell repopulation via COX2/PGE2/STAT3 axis[J]. Oncotarget, 2016, 7(19): 28235-46. |

