


2. 中国医学科学院 & 北京协和医学院医药生物技术研究所微生物化学研究室,北京 100050
 ,
LI Xiao-jun2,
CHEN Jian-hong1,
JIANG Lian-xiu1,
HE Yu-lin1,
WEI Han-ning1,
SUN Cheng-hang2,
HUANG Da-lin1
,
LI Xiao-jun2,
CHEN Jian-hong1,
JIANG Lian-xiu1,
HE Yu-lin1,
WEI Han-ning1,
SUN Cheng-hang2,
HUANG Da-lin1

2. Microbiochemistry Laboratory, Institute of Medicinal Biotechnology, Chinese Academy of Medical Science & Peking Union Medical College, Beijing 100050, China
随着耐药病原菌的不断增多,以铜绿假单胞菌(Pseudomonas aeruginosa)、屎肠球菌(Enterococcus faecium)及肠杆菌属(Enterbacter sp)、肺炎克雷伯菌(Klebsiella pneumonia)、金黄色葡萄球菌(Staphyloccocus aureus)、鲍曼不动杆菌(Acinetobacter baumannii)为代表的ESKAPE耐药问题给临床治疗带来了极大困扰,迫切需要我们挖掘新型抗生素[1-3]。
放线菌是天然抗生素的重要来源[4]。临床上常用的抗生素大部分由放线菌产生,如链霉素(streptomycin)、土霉素(oxytetracycline)、卡那霉素(kanamycin)及丝裂霉素(mitomycin)等。应用于临床试验的800个微生物来源的天然化合物中,67%来源于放线菌,主要是链霉菌(52%)和稀有放线菌(15%)[5-6]。
放线菌分布广泛,在农田、湖泊等环境都有发现。随着研究不断深入,研究者们把目光从普通环境放大到如南极、沙漠、盐湖、荒漠和海洋等特殊环境,寻找新的微生物资源,以利于发现新型抗生素。特殊环境的微生物为适应高温、低温、高酸、高碱、高盐、高压、缺水干旱等恶劣的生存条件,形成了其独特的生理机能及其特有的代谢方式,并能够产生许多具有特殊功能的新型生物活性物质,是新抗生素极为丰富的来源[7-8]。
红树林是指生长在热带及亚热带海岸潮间带的一种特殊植物群落,是热带、亚热带海岸地带的一种珍贵湿地类型和生态系统。因为该地带处于海水、淡水交汇的特殊环境, 受潮汐作用影响,使土壤兼具海洋与陆地的特点, 加之红树林共生生物的供养, 该地区土壤蕴藏着极为丰富独特的放线菌微生物资源[9]。如Xie等[10]从我国各地采集约200份红树林根际土壤和植物组织样品,从中共分离放线菌2 000多株,并鉴定了放线异壁酸菌属、阿萨诺氏菌属、野野村菌属、小单孢菌属、小双孢菌属、链霉菌属和疣孢菌属等7个属中13个新种,并建立了继生菌新属。研究表明[11],生长在红树林这样一种特殊生态环境中的放线菌较其他生境有更好的抗菌、抗肿瘤活性,且结构新颖。从红树植物根际土中分离的放线菌对病原菌的拮抗活性,比例要高于分离自菜园土中放线菌的活性。Wang等[12]对8种不同生境的放线菌聚醚化合物合成基因的筛选也表明,红树林环境比其他环境有更多的阳性菌株。美国加州大学Scripps海洋研究所发现的盐孢菌属对其中一株菌CNB-392的发酵液进行化合物分离,从中分离鉴定出了一系列的结构新颖的化合物,命名为盐孢菌素(salinosporamides),并已进入临床Ⅰ期研究[13]。因此,红树林作为一种特殊的生态环境,其根系放线菌的种类和数量较为丰富,是一类尚未很好开发和利用的微生物资源库和新化合物库[14]。
红树林环境中的放线菌有巨大的开发潜力,我们发掘少之又少,加之抗生素耐药情况愈来愈严重,发现新型抗生素迫在眉睫。因此,我们对广西北仑河口国家级红树林自然保护区中红树林根际土壤样品研究,发现2株活性较强的菌株,对14种药敏试验测试菌均有抑制作用,最后又对其分类地位进行鉴定,为寻找新抗生素奠定了科学基础。
1 材料与方法 1.1 材料 1.1.1 土壤样品2014年7月采集广西北仑河口国家级红树林自然保护区真红树植物白骨壤、木榄根际10 cm以下土壤海泥,共2份样品,实验室4 ℃保藏备用。
1.1.2 培养基① 分离培养基:改良ISP2培养基:酵母粉4 g, 麦芽浸膏5 g, 葡萄糖4 g,琼脂18 g,蒸馏水1 L,pH 7.3~7.5。HL2培养基[15]:葡萄糖10 g,蛋白胨5 g,胰蛋白胨3 g,氯化钠5 g,琼脂18 g,蒸馏水1 L,pH 7.3~7.5。② 斜面培养基:改良ISP2固体培养基。③ 发酵培养基:改良ISP2液体培养基。④ 药敏试验菌株培养基:Mueller-Hinton (M-H)培养基(英国OXOID)。
1.1.3 抑制剂(mg·L -1)萘啶酮酸25,放线菌酮50,重铬酸钾25。
1.1.4 药敏试验测试菌株铜绿假单胞菌(Pseudomonas aeruginosa) ATCC 27853、铜绿假单胞菌耐药株2774、大肠埃希菌(Escherichia coli) ATCC 25922、大肠埃希菌耐药株2800、金黄色葡萄球菌(Staphyloccocus aureus) ATCC 25923、金黄色葡萄球菌耐药株ATCC43300、粪肠球菌(Enterococcus faecalis) ATCC 29212、粪肠球菌耐药株ATCC 33186、肺炎克雷伯菌(Klebsiella pneumonia) ATCC 10031、肺炎克雷伯菌耐药株ATCC 700603、鲍曼不动杆菌(Acinetobacter baumannii) ATCC 19606、鲍曼不动杆菌耐药株2799、白假丝酵母菌(Candida albicans) CCTCC 93025、罗伦隐球菌(Cryptococcus laurentii) CCTCC 91013,菌株均来自中国医学科学院医药生物技术研究所。
1.1.5 试剂与仪器Chelex100树脂,美国BioRad公司;2×Easy Taq SuperMix、放线菌酮,均购于北京全式金公司;重铬酸钾购于Sigma公司;萘啶酮酸、DNA Marker、引物(27F, 1492R)、GelGreen染料,购自上海生工生物工程股份有限公司;其他试剂为国产分析纯。
电泳仪DYY-6C型,北京市六一仪器厂;双人单面洁净工作台,新加坡ESCO;小型离心机Centrifuge 1-14购于德国Sigma公司;凝胶成像仪Gel DocTM XR+购自美国Bio-Rad公司;WZT-1M细菌比浊仪,上海劲佳;全恒温培养箱ZDP-2120、旋转式摇床ZHWY-211C, 上海智城分析仪器制造公司;台式压力蒸汽灭菌器LDZX-50KBS,上海申安医疗器械厂;PCR扩增仪Veriti 96 well fast thermal cycler,美国Applied Biosystems公司;旋转蒸发仪OSB-2100,日本EYELA公司。
1.2 方法 1.2.1 样品处理参照戴素娟等[16]土样处理办法,新鲜土样置无菌平皿中室温条件下自然风干,用无菌研钵研磨成粉面状。称取5 g土壤样品,45 mL无菌水溶解,28 ℃、180 r·min-1摇床振荡45 min;吸取1 mL土壤悬液至9 mL无菌水中,连续进行10倍梯度稀释,使其终浓度为10 g·L-1和1 g·L-1,各取200 μL,分别涂布于2种分离培养基平板上,置恒温培养箱28 ℃培养。
1.2.2 菌落的分离与保存培养2~4周后,根据菌落特征初步排重,挑取单菌落于改良ISP2固体培养基上进行分区划线菌落纯化,直至得到纯培养物。将长势良好的纯化菌株转接至改良ISP2斜面培养基,置4 ℃保存;同时用20%甘油作为保护剂,-20 ℃保藏。
1.2.3 16S rRNA基因序列的测定和系统发育分析① 采用Chelex -100法[17]提取基因组DNA。② 扩增引物为细菌通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)。50 μL PCR反应体系:2×Easy Taq SuperMix 25 μL;27F (20 μmol·L-1) 1.5 μL;1492R (20 μmol·L-1) 1.5 μL;模板2.5 μL;无菌水19.5 μL。PCR反应条件为:95 ℃ 5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 2 min,35个循环;72 ℃ 10 min。PCR产物用1%琼脂糖凝胶电泳检测;将所有阳性结果的PCR产物交由英淮捷基(上海)贸易有限公司测序。③ 所得序列利用BLAST程序和EzTaxon-e工具[18]进行相似性比对。从中选取相似性较高的有效发表菌株的16S rRNA基因序列作为参比对象,然后用BioEdit进行多序列比对,系统进化矩阵根据Kimura-2模型估算,用MEGA 5.0软件[19]采用邻接法(Neighbor-Joining)进行聚类分析,并构建系统进化树[20],重复取样1 000次进行自展值(Bootstrap value)分析来评估系统进化树拓扑结构的稳定性。
1.2.4 抗菌活性筛选① 将长势良好的菌株接种于装有100 mL发酵培养基的500 mL三角瓶中,180 r·min-1、28 ℃培养7 d,发酵液4 500 r·min-1离心30 min,上清液用等体积的乙酸乙酯萃取,酯相浓缩干燥后,用3 mL甲醇溶解于样品瓶中备用。水相留取60 mL挥发干燥后用3 mL甲醇水溶液溶解备用。用同样的方法对一定量的丙酮浸泡过夜菌体浸泡液进行制备。② 将斜面生长良好的药敏试验测试菌株接种于装有20 mL液体培养基的100 mL三角瓶中,180 r·min-1、37 ℃培养12 h,将0.5麦氏浓度单位菌悬液按1%比例加入冷却至55 ℃左右的无菌M-H琼脂培养基中,摇匀、倾注至培养皿内,每皿15~20 mL,置4 ℃备用。③ 采用纸片扩散法进行抗菌活性检测。分别吸取已制备得酯相、水层、菌体粗提物三类样品各60 μL至直径为6 mm、厚度为2 mm的圆形无菌滤纸片上,待其挥发干燥后,贴于含有药敏试验测试菌的平板上,平板于37 ℃培养24 h,观察并记录抑菌圈的大小。
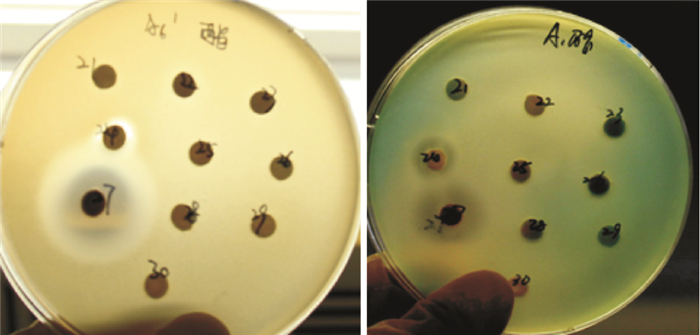
2 结果 2.1 抗菌活性纸片扩散法试验采用标准菌株进行抗菌试验,药敏试验结果显示菌株B200和B205对14株革兰阳性菌、革兰阴性菌包括敏感株和耐药株及真菌标准菌株均具有较好的活性(Tab 1),对敏感株抑菌活性高于耐药株,但B200对大肠埃希菌耐药株(耐β-内酰胺酶类复合药物)抑菌活性明显高于敏感株,B205对真菌、金黄色葡萄球菌、粪肠球菌及鲍曼不动杆菌表现出超强抑菌活性(Fig 1)。
| Strain | P.a | E.c | S.a | E.f | K.p | A.a | C.a | C.l | |||||||||||
| S | R | S | R | S | R | S | R | S | R | S | R | ||||||||
| B200 | 9 mm | 6.4 mm | 8 mm | 11 mm | 8 mm | 7 mm | 15 mm | 6 mm | 8 mm | 6.3 mm | 13 mm | 8 mm | 9 mm | 8 mm | |||||
| B205 | 12 mm | 6.5 mm | 15 mm | 7 mm | 21 mm | 6.5 mm | 21 mm | 13 mm | 14 mm | 6.5 mm | 23 mm | 19 mm | 19 mm | 18 mm | |||||
| P.a: Pseudomonas aeruginosa; E.c: Escherichia coli; S.a: Staphyloccocus aureus; E.f: Enterococcus faecalis; K.p: Klebsiella pneumonia; A.a: Acinetobacter baumannii; C.a: Candida albicans; C.l: Cryptococcus laurentii. S: Sensitive strain; R: Resistant strain | |||||||||||||||||||
|
| Fig 1 Result of antibacterial activities of some actinomycetes Left: Antibacterial activities of Acinetobacter baumannii; Right: Antibacterial activities of Pseudomonas aeruginosa. 24 represented strain B200, 27 represented strain B200. |
在改良的ISP2培养基上,菌株B200和B205生长良好,菌株B200表面光滑湿润,半透明,无褶皱,边缘整齐,细菌形态,产淡黄色色素。菌株B205表面干燥,有褶皱,生长缓慢,菌落质地致密紧实;所以菌落紧贴培养基生长,不易挑起,挑起后不易破碎;当孢子丝产生大量孢子并布满菌落表面后才形成颗粒状, 典型放线菌形态;产酒红色色素可使培养基变色(Fig 2)。

|
| Fig 2 Colony morphology of two actinomycetes |
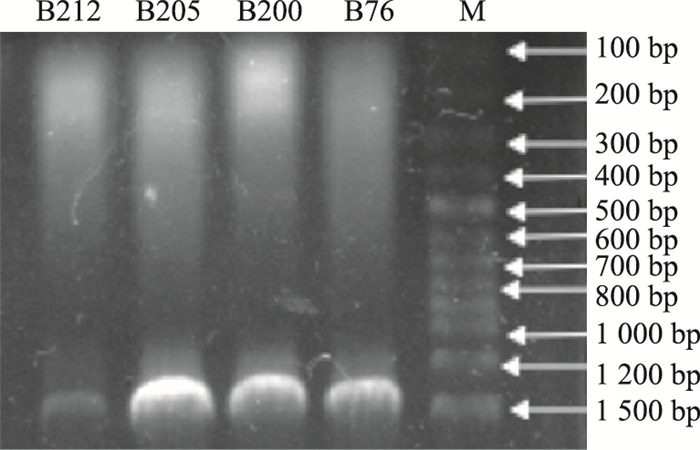
采用Chelex-100法提取基因组DNA, PCR成功扩增出放线菌样本的16S rRNA,扩增产物经1%琼脂糖凝胶电泳检测,扩增产物电泳条带清晰,特异性强,大小在1 500 bp左右(Fig 3)。
|
| Fig 3 PCR products of 16S rRNA gene |
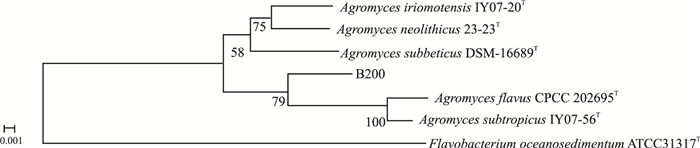
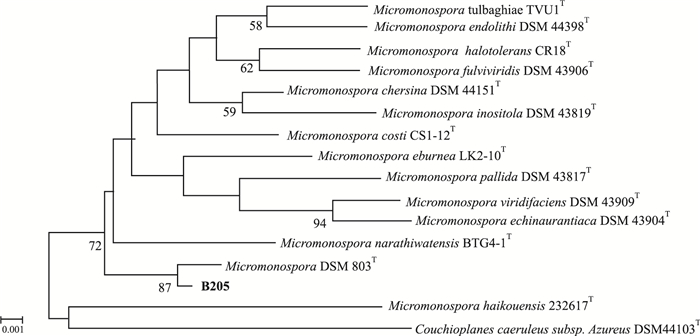
测得两株菌的16 S rRNA基因全长序列,登录EzTaxon,比对结果发现B200与Agromyces subbeticus DSM 16689T的相似率为98.01%,与该属的其他种相似率都在98%以下,而且在N-J系统进化树中,菌株B200与壤霉菌属部分有效发表菌株聚成一簇,且形成独立的进化分支(Fig 4),提示该菌株可能为壤霉菌属潜在新种,该菌株的多相分类还在研究中。B205采用邻接法构建其与相关菌株的系统发育树,发现其与Micromonospora rosaria DSM 803T最相似,相似率为99.73%,且在N-J树上与之为一簇,B205初步鉴定是小单孢菌Micromonospora rosaria DSM 803T的变种(Fig 5)。
|
| Fig 4 Neighbour-Joining tree showing phylogenetic relationships between strain B200 and representatives of family Agromyces based on 16S rRNA gene sequences |
|
| Fig 5 Neighbour-Joining tree showing phylogenetic relationships between strain B205 and representatives of family Micromonospora based on 16S rRNA gene sequences |
放线菌(actinomycetes)是一类具有重要药用价值和多种用途的微生物,广泛分布于自然界[21]。生长在红树林这种极端环境的放线菌,由于多样、特殊的生态系统,形成其独特的代谢方式和途径,其次级代谢产物在结构、类型以及生物活性等方面都呈现出与普通生境放线菌不同的特点。许琳雅等[22]从Streptomyces No.H74-18菌株的次级代谢产物中分离到抗霉素类(A1a和A1b等)化合物,并发现新化合物antimycinA18及A19。张慧敏等[23]从放线菌发酵液中高通量筛选端粒酶抑制剂,发现14株放线菌有较好的抑制作用。王淑霞等[24]从威海、福建沿海海泥土壤样品及广东红树林根部土壤样品中共分离到17株具抗肿瘤活性的放线菌,并从菌株WH1-216-6的次级代谢产物中分离出6个吡啶类生物碱,都具有较高抑制癌细胞活性,其中caerulomycineH、caerulomycineF、caerulomycineG鉴定为新化合物。因此,来源于红树林的放线菌有巨大的研究价值和开发潜力。
广西拥有丰富的红树林资源,是我国目前红树林分布最广的地区,达6 170公顷,占有全国红树林面积的37%。有红树林植物12种,分布于英罗港、丹兜海、铁山港、钦州湾、江平、北仑河口等地[25]。本实验采集广西北仑河口国家级红树林自然保护区红树植物根际土壤,分离得到的菌株B200、B205对14种药敏试验测试菌都表现出较好的活性,特别是菌株B200对革兰阳性、阴性致病菌及真菌均有较好的抗菌活性,且可能为壤霉菌属潜在新种。以往文献报道,产生生物活性代谢物质的红树林放线菌多为链霉菌属、小单孢菌属、诺卡氏菌属、拟诺卡氏菌属及马杜拉菌属等[26],该属的次级代谢产物相关文献较少,值得进一步探究,菌株B200的其他相关研究仍在进行。该研究结果表明广西红树林根际土壤药用放线菌资源丰富,为新药的研究与开发奠定了坚实基础。
( 致谢: 本实验在中国医学科学院医药生物技术研究所完成,感谢孙承航研究员及实验室老师对本实验的指导和帮助。 )
| [1] | 邱丽莉. ESKAPE 6种抗生素的耐药状况[J]. 中国误诊学杂志, 2011, 11(36): 8960-1. Qiu L L. Drug resistance of ESKAPE 6 antibiotics[J]. Chin J Misdiagn, 2011, 11(36): 8960-1. |
| [2] | Shirley D A, Heil E L, Johnson J K. Ceftarolinefosamil: a brief clinical review[J]. Infec Dis Ther, 2013, 2(2): 95-110. doi:10.1007/s40121-013-0010-x |
| [3] | Qin S, Xing K, Jiang J H, et al. Biodiversity, bioactive natural products and biotechnological potential of plant-associated endophytic actinobacteria[J]. Appl Microbiol Biotechnol, 2011, 89(3): 457-73. doi:10.1007/s00253-010-2923-6 |
| [4] | Berdy J. Thoughts and facts about antibiotics: where we are now and where we are heading[J]. J Antibiot, 2012, 65(8): 385-95. doi:10.1038/ja.2012.27 |
| [5] | 王长云, 邵长伦, 傅秀梅, 等. 中国海洋药物资源及其药用研究调查[J]. 中国海洋大学学报(自然科学版), 2009, 39(4): 669-75. Wang C Y, Shao C L, Fu X M, et al. Investigation on marine drug resources and its medicinal use in China[J]. Period Ocean Univ China, 2009, 39(4): 669-75. |
| [6] | Yang R Y, Li C Y, Lin Y C, et al. Lactones from a brown alga endo-phytic fungus (No.ZZF36) from the South China Sea and their antimicrobial activities[J]. Bioorg Med Chem Lett, 2006, 16(16): 4205-8. doi:10.1016/j.bmcl.2006.05.081 |
| [7] | 李蓉, 张京良, 江晓路, 管华诗. 红树林放线菌的筛选与抗真菌和抗肿瘤活性的测定[J]. 食品与生物技术学报, 2010, 29(1): 94-7. Li R, Zhang J L, Jiang X L, Guan H S. Screening of mangrove actinomycetes and determination of antifungal and antitumor activity[J]. J Food Sci Biotechnol, 2010, 29(1): 94-7. |
| [8] | 蔡超靖, 丁彦博, 单越琦, 穆云龙. 海洋放线菌-药物开发的新兴资源[J]. 国外医药抗生素分册, 2012, 33(1): 22-9. Cai C J, Ding Y B, Shan Y Q, Mu Y L. Emerging resources of marine actinomycetes drug development[J]. World Notes Antibiot, 2012, 33(1): 22-9. |
| [9] | 林鹏, 张瑜斌, 邓爱英, 庄铁诚. 九龙江口红树林土壤微生物类群及抗菌活性[J]. 海洋学报, 2005, 27(3): 133-41. Lin P, Zhang Y B, Deng A Y, Zhuang T C. Microflora and antimicrobial activities of soil microorganisms in mangrove forests in the Jiu-long Estuary, China[J]. Acta Oceanol Sin, 2005, 27(3): 133-41. |
| [10] | Xie Q Y, Wang C, Wang R, et al. Jishengella endophytica gen. nov., sp. Nov., a new member of the family Micromonosporaceae[J]. Int J Syst Evol Microbiol, 2011, 61(5): 1153-9. doi:10.1099/ijs.0.025288-0 |
| [11] | 郑志成, 周美英, 姚炳新. 红树林根际放线菌的组成及生物活性[J]. 厦门大学学报(自然科学版), 1989, 28(3): 306-10. Zheng Z C, Zhou M Y, Yao B X. Composition and biological activity of actinomycetes in mangrove rhizosphere[J]. J Xiamen Univ (Nat Sci), 1989, 28(3): 306-10. |
| [12] | Wang H, Liu N, Xi L, et al. Genetic screening strategy for rapid access to polyether ionophore producers and products in actinomycetes[J]. App Environ Microbiol, 2011, 77(10): 3433-42. doi:10.1128/AEM.02915-10 |
| [13] | Mayer A M, Glaser K B, Cuevas C, et al. The Odyssey of marine pharmaceuticals: a currentpipeline perspective[J]. Trends Pharmacol Sci, 2010, 31(6): 255-65. doi:10.1016/j.tips.2010.02.005 |
| [14] | 孙艺华, 冯鸽, 王超. 红树林放线菌多样性及新型糖苷类化合物合成潜力发掘[J]. 中国海洋药物, 2013, 32(1): 46-54. Sun Y H, Feng G, Wang C. Diversity and new glycosides synthesis of potential of actinomycetes in mangroves[J]. Chin J Mar Drugs, 2013, 32(1): 46-54. |
| [15] | 洪亮. 红树林环境稀有放线菌的分离、初步鉴定和活性评价[D]. 儋州: 华南热带农业大学, 2007. Hong L. Bioprospecting for mangrove rare actinomycetes [D].Danzhou:South China University of Tropical Agriculture, 2007. |
| [16] | 戴素娟, 李静, 刘少伟, 等. 河南神仙洞放线菌资源勘探及抗菌活性筛选[J]. 中国抗生素杂志, 2015, 40(9): 641-8. Dai S J, Li J, Liu S W, et al. Study on diversity and bioactivity of actinomycetes isolated from the Shenxiandong in Henan province[J]. Chin J Antibiot, 2015, 40(9): 641-8. |
| [17] | 周双清, 黄小龙, 黄东益, 等. Chelex-100快速提取放线菌RNA作为PCR扩增模板[J]. 生物技术通报, 2010, 24(2): 123-5. Zhou S Q, Huang X L, Huang D Y, et al. A rapid method for extracting RNA from actinomycetes by Chelex-100[J]. Biotechnol Bull, 2010, 24(2): 123-5. |
| [18] | Kim O S, Cho Y J, Lee K, et al. Introducing EzTaxon-e: a prokaryotic 16S rRNA gene sequence database with phylotypes that represent uncultured species[J]. Int J Syst Evol Microbiol, 2012, 62(3): 716-21. |
| [19] | Tamura K, Peterson D, Peterson N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Mol Biol Evol, 2011, 28(10): 2731-9. doi:10.1093/molbev/msr121 |
| [20] | Saitou N, Nei M. The neighbor-joining method: a new method for reconstructing phylogenetic trees[J]. Mol Biol Evol, 1987, 4(4): 406-25. |
| [21] | 李小俊, 吴越, 张伟铭, 等. 河北九莲城淖尔可培养放线菌多样性及抗菌活性筛选[J]. 微生物学通报, 2016, 43(7): 1473-84. Li X J, Wu Y, Zhang W M, et al. Biodiversity and antimicrobial activity of culturable actinobateria isolated from Jiuliancheng Nur in Hebei province[J]. Microbiol China, 2016, 43(7): 1473-84. |
| [22] | 许琳雅. 来源于南海红树林底泥抗菌放线菌的活性化学成分研究[D]. 广州: 暨南大学, 2010. Xu L Y. Research the active chemical constituents of antimicrobial actinomycetes from mangrove sediments of the South China Sea[D]. Guangzhou: Jinan University, 2010. |
| [23] | 张慧敏, 曹莹, 王卫国, 等. 从放线菌发酵液中高通量筛选端粒酶抑制剂[J]. 中国药理学通报, 2010, 26(1): 40-3. Zhang H M, Cao Y, Wang W G, et al. High -throughput screening of telomerase inhibitor from actinomycete fermentation broth[J]. Chin Pharmacol Bull, 2010, 26(1): 40-3. |
| [24] | 王淑霞. 细胞毒活性海洋放线菌的筛选及两株目标菌株次级代谢产物的研究[D]. 青岛: 中国海洋大学, 2007. Wang S X. Screening of cytotoxic marine actinomycetes and studies on secondary mtabolites of two strains[D]. Qingdao: Ocean University of China, 2007. |
| [25] | 石莉. 中国红树林的分布状况、生长环境及其环境适应性[J]. 海洋信息, 2002(4): 14-8. Shi L. Distribution, growth environment and environmental adaptability of mangrove species in China[J]. Ocean Inf, 2002(4): 14-8. |
| [26] | 蒋莲秀, 莫刚, 戴支凯, 等. 红树林放线菌生物多样性及其代谢产物的研究进展[J]. 贵州农业科学, 2014, 42(10): 158-63. Jiang L X, Mo G, Dai Z K, et al. Research progress in biodiversity and metaboliites of actinomycetes isolated from mangrove soils[J]. Guizhou Agric Sci, 2014, 42(10): 158-63. doi:10.3969/j.issn.1001-3601.2014.10.041 |