


2. 抗炎免疫药物教育部重点实验室,安徽 合肥 230032;
3. 安徽医科大学肝病研究所,安徽 合肥 230032
 ,
LIU Yan-hui1,2,3,
LIU Jun-da1,2,3,
XU Dan-dan1,2,3,
LI Xiao-feng1,2,3,
ZHANG Yi-long1,2,3,
MENG Xiao-ming1,2,3,
HUANG Cheng1,2,3,
LI Jun1,2,3
,
LIU Yan-hui1,2,3,
LIU Jun-da1,2,3,
XU Dan-dan1,2,3,
LI Xiao-feng1,2,3,
ZHANG Yi-long1,2,3,
MENG Xiao-ming1,2,3,
HUANG Cheng1,2,3,
LI Jun1,2,3

2. The Key Laboratory of Anti-inflammatory and Immune medicines, Ministry of Education, Hefei 230032, China;
3. Institute for Liver Diseases of Anhui Medical University, Hefei 230032, China
类风湿性关节炎(rheumatoid arthritis,RA)是一种自身免疫炎症疾病,其主要特征是关节肿胀与不可逆性的损坏,慢性的滑膜炎症[1]。成纤维滑膜细胞(fibroblast-like synoviocytes,FLS)在RA发病中显示出独特的特性,参与血管新生,免疫应答,关节损伤等过程,并产生炎性细胞因子促进炎症的发生[2],慢性炎症导致多种炎症因子异常并使关节损伤[3]。文献报道,特定基因的甲基化参与RA的发病[4],甲基CpG结合蛋白2(methyl CpG binding protein 2,MeCP2) 是MBD家族的成员,可以特异性的识别和绑定在甲基化的DNA序列上,从而抑制基因的转录,也可招募甲基化酶,组蛋白去乙酰化酶甲基化DNA[5]。
Hedgehog信号通路对组织的形态和生长给予调控,Patch1(PTCH1) 在此通路中是一个负调控基因[6]。目前研究表明[7-8],在胃癌、肝细胞癌等癌症中,癌细胞异常增殖,PTCH1基因发生高甲基化。RA中FLS呈肿瘤细胞样增殖[9],鉴于癌症与RA在细胞增殖方面的共性,靶向调控PTCH1基因的甲基化,可能成为治疗RA的新疗法。橙皮素是二氢黄酮的一种,有着抗氧化和抑制炎症介质产生的药理作用[10]。为了克服半衰期短,口服给药后失效快的问题,本课题组设计合成了橙皮素衍生物XIV号(hesperidin derivative-XIV,HDND-XIV),并进行抗炎筛选,其化学式为C34H32Cl2N2O6,分子质量为635.5380,结构如Fig 1。
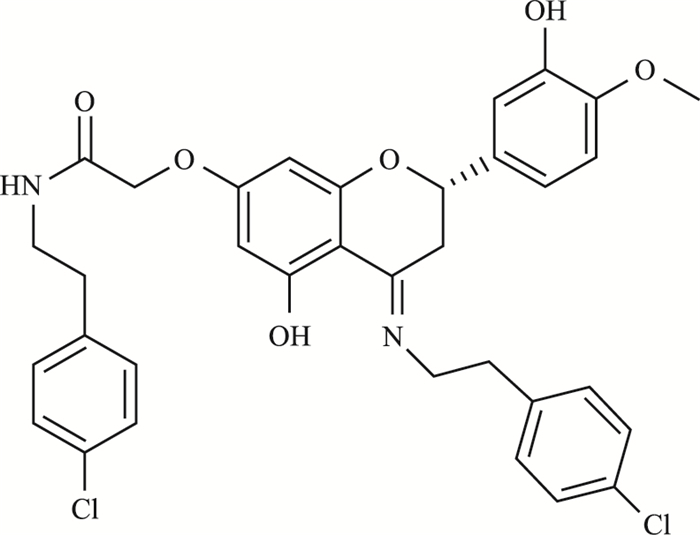
|
| Fig 1 Chemical formula |
因佐剂性关节炎(adjuvant arthritis,AA)大鼠模型具有与RA相似的病理学特征和免疫学变化,所以广泛用于研究RA的发病和筛选新药治疗风湿性疾病[11],本实验即采用AA大鼠为动物模型,重点研究HDND-XIV对PTCH1基因甲基化的调控。基于FLS在RA发病中的重要作用,以FLS为研究对象,通过观察HDND-XIV对AA FLS分泌白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-1β(interleukin-1β,IL-1β)的影响和对AA FLS表达MeCP2,PTCH1和Hedgehog信号通路相关蛋白Gli1和Shh的影响,以及HDND-XIV对PTCH1基因甲基化的调控,研究HDND-XIV抑制FLS炎症可能存在的机制,为防治RA提供理论依据。
1 材料 1.1 实验动物清洁级♂Sprague Dawley(SD)大鼠30只,体质量(200±20) g,购自安徽医科大学动物实验中心。温度:(25±1)℃,湿度:40%~75%,自由饮食饮水。
1.2 药物与试剂HDND-XIV由安徽医科大学药学院提供,浓度为0.1 mol·L-1;弗氏完全佐剂(Freund′s complete adjuvant,FCA)及噻唑蓝MTT购自美国Sigma公司;澳洲胎牛血清(FBS)购自Gibco公司;高糖DMEM购自Hyclone公司;lipofectamine 2000转染试剂盒及Opti-MEM购自Invitrogen公司;MeCP2抗体及Shh抗体购自Abcam公司;β-actin抗体购自北京中杉金桥公司;Gli1及PTCH1抗体购自北京Bioss公司;IL-6、TNF-α、IL-1β酶联免疫试剂盒(enzyme linked immunosorbent assay,ELISA)购自武汉Elabscience公司;辣根标记山羊抗兔IgG及辣根标记山羊抗鼠IgG购自北京中杉金桥公司。
1.3 仪器NAPCO-6100型细胞培养箱购自美国SHELLAB公司;Western blot电泳仪购自美国BIO-RAD公司;酶标仪购自BioTek公司。
2 方法 2.1 动物模型的制备实验动物随机分为正常组、AA组,每组15只。适应性喂养1周后,每只大鼠左后足趾皮内注射FCA(0.01 ml·kg-1),制备AA大鼠,即模型组大鼠。左后足趾皮内注射等量的PBS,作为正常对照组大鼠。
2.2 原代FLS的提取与培养造模24 d后将大鼠处死,在新洁尔灭溶液中浸泡约15 min,沿膝关节正中纵行切开并分离肌肉,关节囊的滑膜层和纤维层,取出滑膜组织,每只大鼠可采集15 mg~20 mg。将取出的滑膜组织用Hank′s液反复洗3次,洗至白色再在DMEM中清洗3次。剪成1 mm3的小块,剪的过程中保持组织块的湿润。将细胞培养瓶底板浸润DMEM培养基,用吸管分别将剪成小块的组织均匀地平铺在底板上,加入含FBS的DMEM培养基,FBS的体积分数为0.2。培养瓶倒置于37 ℃培养箱中培养6~8 h后,正置继续培养,3 d后可观察到个别组织周围出现稀少的滑膜细胞,此时换液。6 d后个别组织周围细胞生长紧密,即可除去组织。9 d后传代,为第1代FLS细胞,消化细胞并进行培养,实验所用FLS为3代~5代。
2.3 半抑制浓度(half maximal inhibitory concentration,IC50)的检测 2.3.1 MTT法检测HDND-XIV的IC50值实验分组,正常FLS组:与AA FLS做对照;AA FLS组:与HDND-XIV处理组作对照;HDND-XIV处理组:400、200、100、50、25、12.5 μmol·L-1。实验重复3次。
2.3.2 步骤将对数生长期的FLS消化成细胞悬液,以2×104个/孔的密度接种于96孔板中,37 ℃过夜。细胞贴壁后各浓度组加入HDND-XIV刺激,作用48 h后将孔内液体换成无血清的培养基,加入MTT(5 g·L-1),每孔20 μL,37℃作用4 h。然后将孔内液体吸净,每孔加入150 μL DMSO,室温震荡后,将96板放在酶标仪上检测吸光度(A),波长为490 nm。
2.4 ELISA分析IL-6、TNF-α、IL-1β水平将对数生长期FLS消化成细胞悬液并接种于24孔板内,每孔1×106个,待细胞长满时,分别加入不同浓度的HDND-XIV进行刺激,每组3个复孔。实验分组为正常组,AA组,AA加HDND-XIV组(80、40、20、10、5 μmol·L-1)。HDND-XIV作用24 h后,吸取细胞培养基上清,4℃,3 000 r·min-1,离心1 min, 收集上清液,ELISA法检测炎症细胞因子IL-6、TNF-α、IL-1β的含量。
2.5 Western blot检测MeCP2、PTCH1、Gli1和Shh将对数生长期FLS接种于6孔板中,待24 h贴壁后,每孔内加入2 mL DMEM,并在AA组上加HDND-XIV刺激,分正常组、AA组、AA加HDND-XIV组(10 μmol·L-1)。作用48 h后,每孔加250 μL RIPA裂解液(1 mL裂解液中加10 μL PMSF),冰上裂解30 min,将裂解的混合物移到EP管中。4℃,12 000 r·min-1,离心30 min,离心结束后移取上清至新的EP管中,加入蛋白上样缓冲液,100℃恒温10 min使蛋白变性。将提取的蛋白样品每孔上样15 μL,进行电泳分离,并转膜到PVDF膜上。在体积分数为0.05的脱脂奶粉下封闭2 h,TBST漂洗3次后,于4 ℃中孵一抗过夜。一抗稀释的比例为:PTCH1(1 :200)、MeCP2(1 :1 000)、Gli1(1 :200)、Shh(1 :1 000)、β-actin(1 :1 000)。在TBST漂洗3次后,加入和一抗匹配的二抗(1 :10 000),孵育1 h,再在TBST中漂洗3次,用ECL发光试剂盒进行显影。
2.6 焦磷酸测序分析使用Axygen DNA提取试剂盒提取出基因组DNA,并用亚硫酸盐对DNA进行修饰。PTCH1引物序列上游引物:5′-AGTTGGGAGTTTTTTAGATGATAGG-3′,下游引物:5′-CCAA AAAACCCCACCTTAATCTCTTTCA-3′,PTCH1测序引物:5′-GGAGTTTTTTAGATGATAGGTTTA-3′,扩增后,使用QIAGEN焦磷酸测序仪测序。
2.7 过表达质粒GV230-MeCP2的转染使用脂质体(lipofectamine 2000) 转染过表达质粒GV230-MeCP2入AA FLS,对照组AA FLS转染空载体GV230。转染前1天,将FLS接种于6孔板中,加入含FBS的DMEM培养基,在37℃培养箱中培养。待细胞快长满时,即可用于实验。取5 μL质粒与200 μL Opti-MEM轻柔混合,温室孵育5 min,同时另取5 μL脂质体同样与200 μL Opti-MEM轻柔混合并孵育5 min。将上述两种混合液轻柔混合,并在室温孵育25 min,形成复合体。取出6孔板,弃去原培养基并用PBS清洗3次,每孔加入1.6 mL Opti-MEM,将上述孵育好的复合体,轻揉均匀的加入相应的孔中并混合均匀,置于37℃培养箱中培养6 h后,换成含FBS的DMEM培养基继续培养。对照组操作方法同上。
2.8 统计学分析采用SPSS 16.0软件进行统计分析,数据以x±s表示,组间比较采用单因素方差分析,两两比较用q检验。
3 结果 3.1 不同浓度的HDND-XIV对FLS增殖的影响由Fig 2的MTT分析可知,AA组FLS的吸光度值大于正常组FLS,且差异具有统计学意义(P < 0.01),说明AA组的增殖速率大于正常组。加入不同浓度的HDND-XIV(400、200、100、50、25、12.5 μmol·L-1)刺激48 h后,随着HDND-XIV浓度的减小,吸光度值在增加(P < 0.01),说明HDND-XIV具有一定的毒性,并根据吸光度值计算出IC50值为161 μmol·L-1。
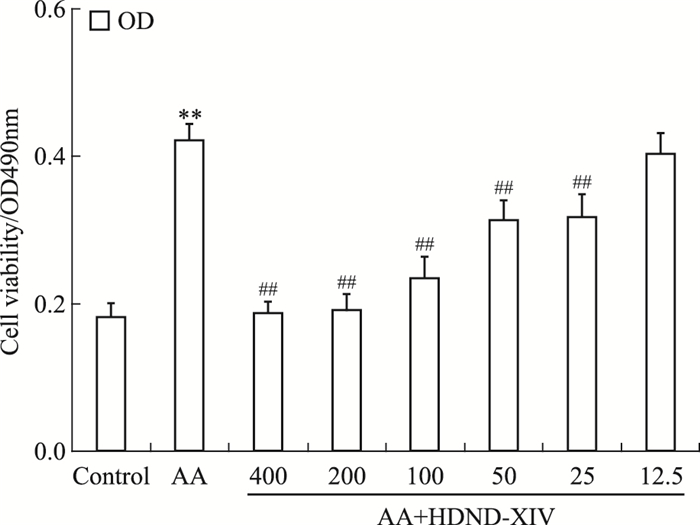
|
| Fig 2 Effect of HDND-XIV on proliferation in AA FLS(x±s, n=3) Lane 1:Control group; Lane 2:AA group; Lane 3~8:400, 200, 100, 50, 25, 12.5 μmol·L-1 HDND-XIV treated AA group.**P < 0.01 vs control group; ##P < 0.01 vs AA group |
鉴于HDND-XIV毒性,在小于0.5倍的IC50范围里,如Fig 3,选择5个浓度点(80、40、20、10、5 μmol·L-1),在AA组FLS上进行HDND-XIV抗炎活性的筛选,结果表明AA组FLS细胞上清中IL-6,TNF-α,IL-1β分泌大于正常组(P < 0.01),且差异具有统计学意义,随着HDND-XIV浓度的减小,其分泌在一定范围内呈下降的趋势(P < 0.01,P < 0.05),当HDND-XIV浓度为10 μmol·L-1时,含量最低。
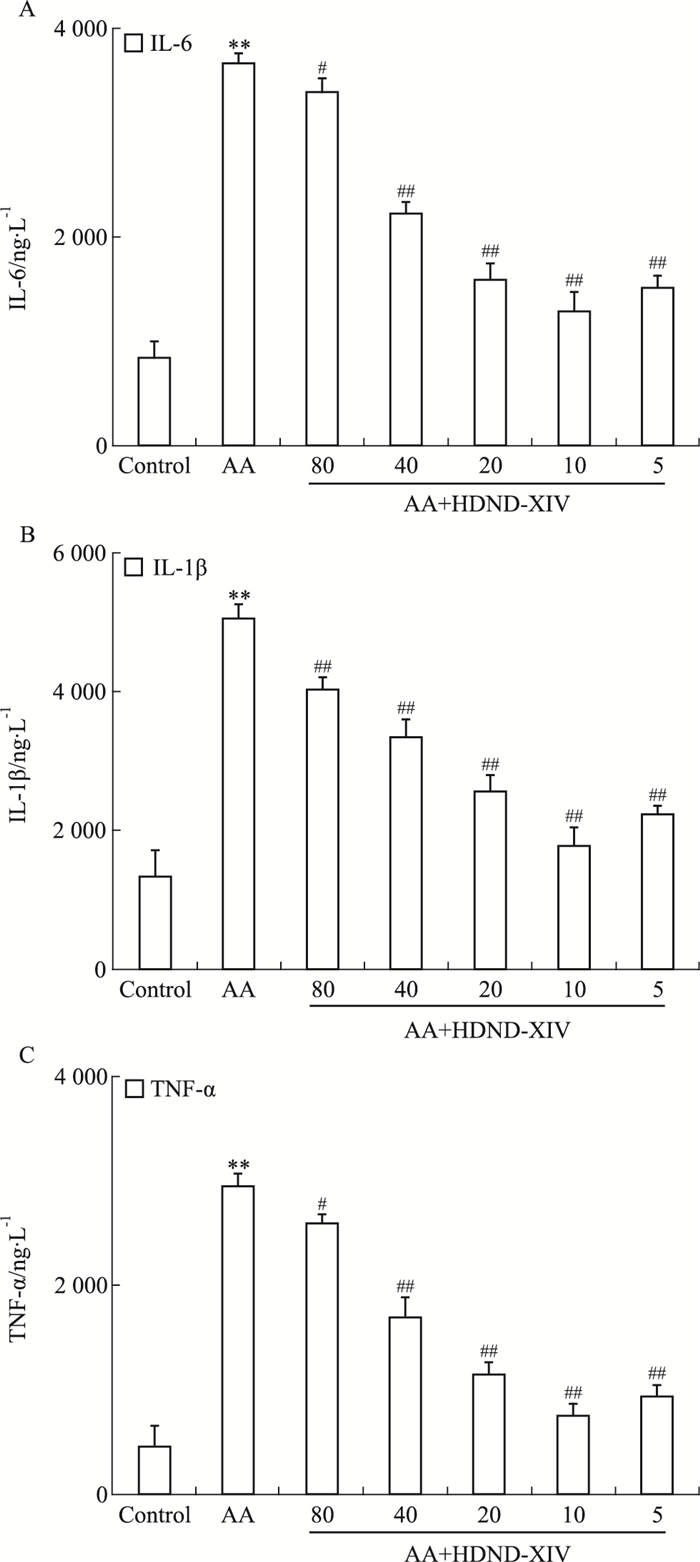
|
| Fig 3 Effect of HDND-XIV on level of IL-6(A), IL-1β(B), TNF-α(C)(x±s, n=3) Lane 1:Control group; Lane 2:AA group; Lane 3~7:80, 40, 20, 10, 5 μmol·L-1 HDND-XIV treated AA group.**P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs AA group |
根据ELISA筛选的结果,在AA组FLS上加HDND-XIV刺激,刺激浓度为10 μmol·L-1。如Fig 4所示,与正常组FLS相比,AA组FLS中PTCH1的表达下降(P < 0.01),MeCP2,Gli1和Shh蛋白表达升高(P < 0.01),并差异具有统计学意义。加入HDND-XIV以10 μmol·L-1浓度刺激48 h后,相比较AA组FLS,AA加HDND-XIV组中PTCH1蛋白表达升高(P < 0.01),MeCP2,Gli1和Shh蛋白表达下降(P < 0.01),差异具有统计学意义。
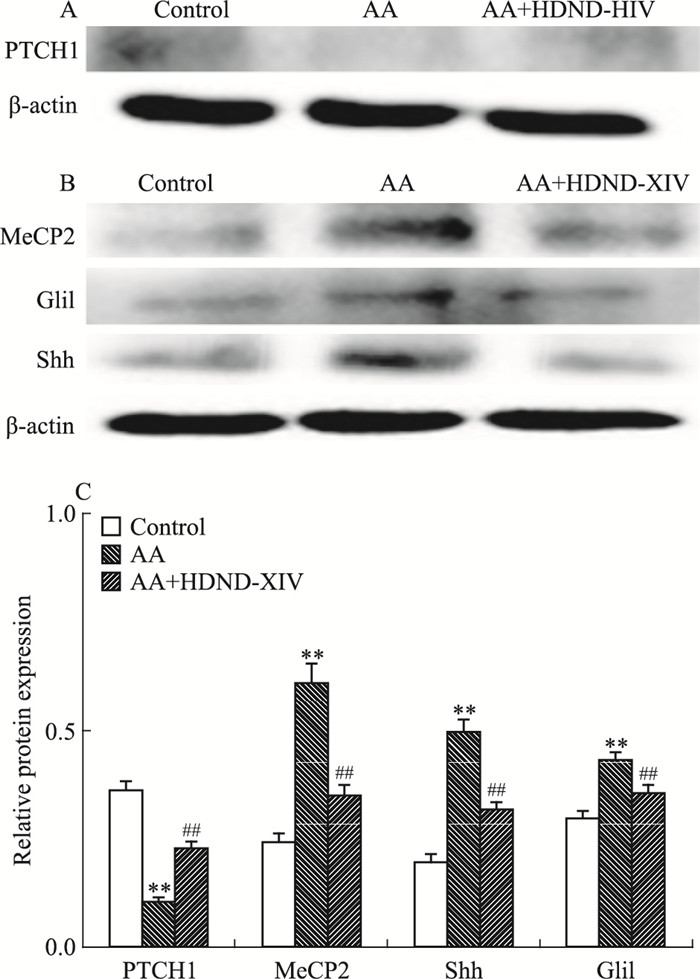
|
| Fig 4 Effect of HDND-XIV on PTCH1, MeCP2, Gli1 and Shh protein expression in AA FLS(x±s, n=3) A, B, C:the protein expression of PTCH1, MeCP2, Shh and Gli1;HDND-XIV(10 μmol·L-1) treated AA group.**P < 0.01 vs control group; ##P < 0.01 vs AA group |
以10 μmol·L-1的浓度,在AA组FLS上加HDND-XIV刺激,分正常组,AA组,AA加HDND-XIV组。刺激48 h后,提取FLS的基因组DNA,用焦磷酸测序进行检测,结果如Fig 5。每组均检测了4个位点,正常组PTCH1基因启动子4个位点Pos.1、Pos.2、Pos.3、Pos.4甲基化程度分别为0%、9%、41%、0%;AA组PTCH1基因启动子4个位点Pos.1、Pos.2、Pos.3、Pos.4甲基化程度分别为63%、67%、62%、63%;AA加HDND-XIV组PTCH1基因启动子4个位点Pos.1、Pos.2、Pos.3、Pos.4甲基化程度分别为28%、32%、48%、26%。根据文献指出[12],50%以上定义为高甲基化,20%~50%定义为低甲基化,20%以下定义为无甲基化。正常组Pos.1、Pos.2、Pos.4位点的甲基化程度分别为0%、9%、0%,视为无甲基化;AA组Pos.1、Pos.2、Pos.3、Pos.4位点均高于50%,视为高甲基化;AA加HDND-XIV组Pos.1、Pos.2、Pos.3、Pos.4位点均在20%~50%,视为低甲基化。说明AA组FLS甲基化程度高于正常组(P < 0.01),经HDND-XIV刺激后,AA组甲基化程度降低(P < 0.01)。
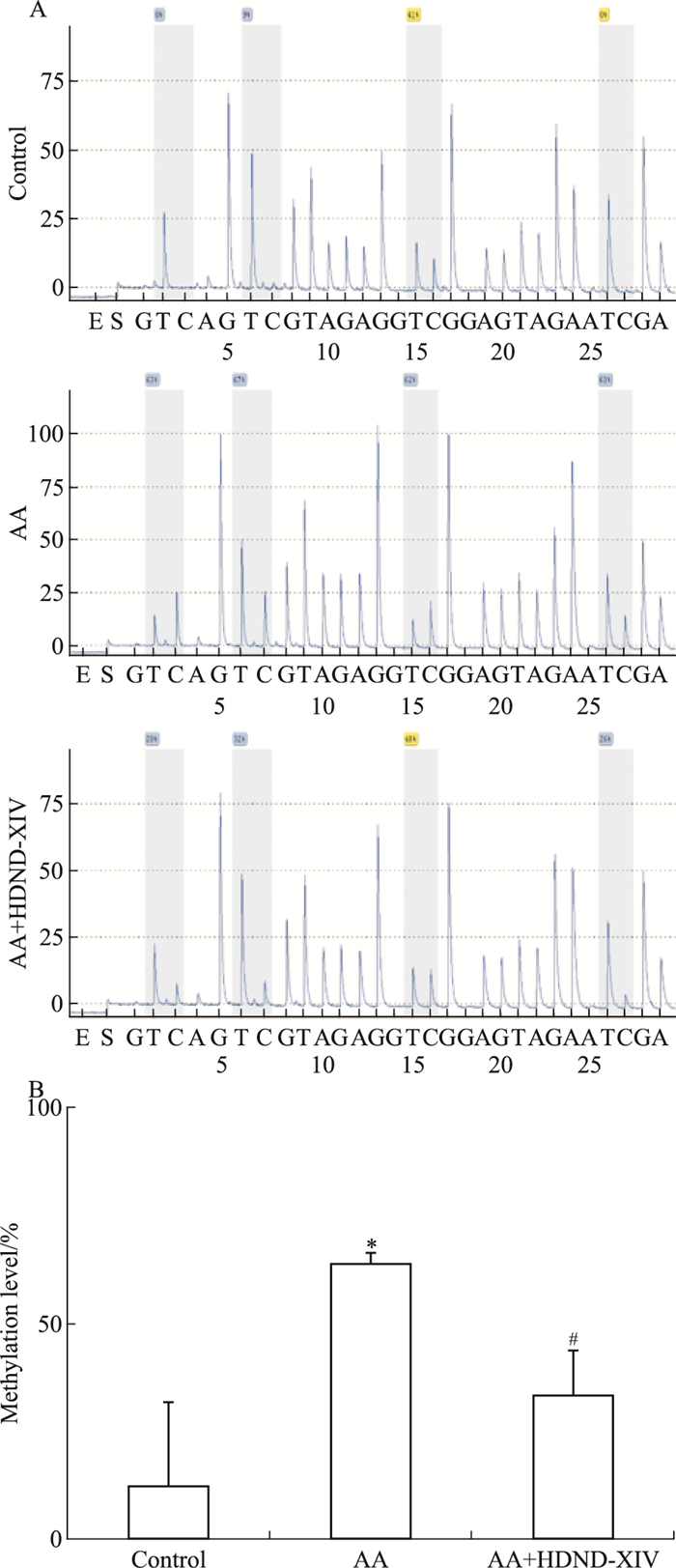
|
| Fig 5 PTCH1 gene promoter methylation level detected by pyrosequencing(x±s, n=3) A:PTCH1 gene promoter methylation level.B:Lane 1:Control group; Lane 2:AA group; Lane 3:HDND-XIV(10 μmol·L-1) treated AA group.**P < 0.01 vs control group; ##P < 0.01 vs AA group |
在AA FLS中转染GV230-MeCP2过表达质粒,对照AA FLS组转染GV230空载体,转染成功后均加入HDND-XIV,HDND-XIV的终浓度为10 μmol·L-1。分组如Fig 6,结果显示成功转染GV230-MeCP2,MeCP2表达上升,且与AA组MeCP2表达无差异,但与AA加HDND-XIV组相比差异具有统计学意义(P < 0.01),说明过表达成功。成功过表达MeCP2后,相比较AA加HDND-XIV组,PTCH1蛋白表达下降(P < 0.01),Gli1和Shh蛋白表达增加(P < 0.01),并且炎症因子IL-6、IL-1β、TNF-α的分泌也增加,差异具有统计学意义(P < 0.01)。
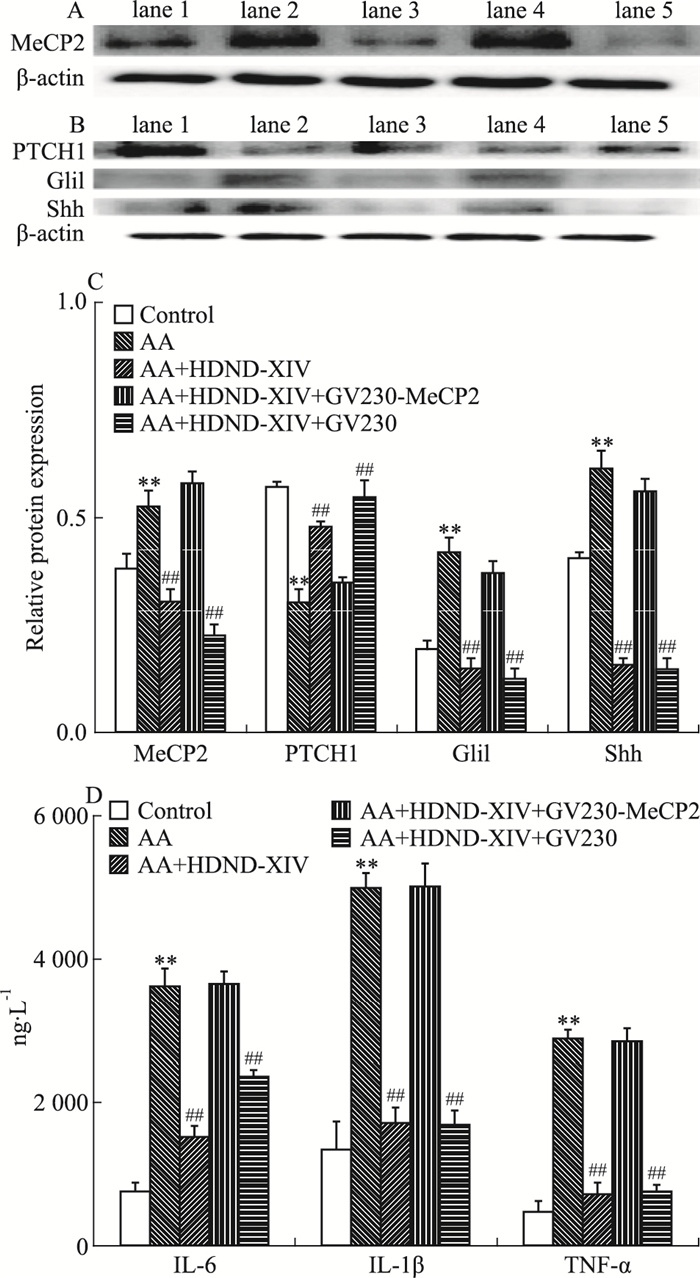
|
|
Fig 6 AA-FLS transfected with plasmid GV230-MeCP2(x±s, n=3)
The MeCP2, PTCH1, Gli1 and Shh protein expressions was detected by western blot(A, B, C) and the level of IL-6, IL-1β, TNF-α was detected by ELISA(D) Lane 1:Control group; Lane 2:AA group; Lane 3:HDND-XIV(10 μmol·L-1) treated AA group; Lane 4:HDND-XIV(10 μmol·L-1) and GV230-MeCP2 treated AA group; Lane 5:HDND-XIV(10 μmol·L-1) and GV230 treated AA group.**P < 0.01 vs control group; ##P < 0.01 vs AA group |
RA是一种滑膜炎症疾病,其发病机制尚不清楚。炎症因子被认为是发病不可缺少的一部分,其在类风湿关节炎中的紊乱会造成炎症性的关节损伤[13]。本实验在体外采用MTT和ELISA证明了HDND-XIV具有明显的抗炎活性,并对HDND-XIV产生抗炎作用的机制经行了探究。橙皮素是二氢黄酮的一种,为了克服其较低的生物利用度,本实验室合成了一系列橙皮素衍生物,前期预实验初步证明HDND-XIV可能具有良好的抗炎活性,MTT法检测6个不同HDND-XIV浓度点对AA FLS的影响,显示HDND-XIV具有一定的毒性。炎症指标的高低可以反映药物的抗炎活性,鉴于HDND-XIV的毒性,在小于0.5倍IC50范围里选择5个浓度点加药刺激,检测各组炎症因子IL-6、TNF-α、IL-1β的含量,显示随着HDND-XIV浓度的降低,细胞培养基中IL-6、TNF-α、IL-1β的浓度呈现下降的趋势,HDND-XIV浓度为10 μmol·L-1时含量最低,说明此时HDND-XIV的抗炎活性最强。
文献报道,Hedgehog信号通路在组织修复以及持续的慢性炎症中发挥着重要作用[14]。因此,实验中检测了Hedgehog信号通路相关蛋白的表达来探究HDND-XIV发挥抗炎作用的机制。Western blot(Fig 4)的结果显示,经HDND-XIV作用后,AA FLS中PTCH1蛋白表达增加,Gli1和Shh蛋白表达减少,说明AA FLS中Hedgehog信号通路可能受到了HDND-XIV的抑制。蛋白质的表达受到多种因素的影响,如转录、翻译等环节,其中DNA甲基化是表观遗传学修饰的一种,可以抑制基因的转录,阻止蛋白的表达。有研究表明特定基因的甲基化参与了RA的发病[4, 15]。在RA中,不同基因的甲基化状态和程度有所不同。一些基因,如凋亡诱导基因,抗炎因子基因发生高甲基化,导致其基因表达水平降低,促进了RA的发病。另外一些基因,如促炎因子基因甲基化水平降低,导致其表达水平上升,促进RA的发病。为了探究HDND-XIV是否通过调控PTCH1基因的甲基化,从而增加PTCH1蛋白的表达,产生抗炎作用。本研究采用了焦磷酸测序技术定量检测了各组PTCH1基因的甲基化程度。结果显示AA FLS中PTCH1基因的甲基化程度明显高于正常组FLS,表现为高甲基化状态,经HDND-XIV刺激后,PTCH1基因甲基化程度明显降低,表现为低甲基化状态。说明HDND-XIV可能是通过抑制PTCH1基因甲基化,增加PTCH1蛋白的表达产生抗炎作用。文献报道MeCP2与DNA甲基化密切相关,其可以特异性的识别和绑定在甲基化的DNA序列上, 从而抑制基因的表达[5]。MeCP2的增多反映甲基化水平发生整体的上调。为了探究HDND-XIV是否通过作用于MeCP2来调控PTCH1基因的甲基化,我们在AA FLS上转染过表达质粒GV230-MeCP2,然后再加入HDND-XIV,显示成功过表达MeCP2后,PTCH1蛋白表达明显减少,Gli1和Shh蛋白表达增加,说明Hedgehog信号通路被激活,同时该组的细胞培养基中IL-6、IL-1β、TNF-α的含量较AA FLS加HDND-XIV组也增加。说明HDND-XIV可能是通过下调MeCP2蛋白的表达,使PTCH1基因甲基化程度降低,增加了PTCH1蛋白的表达,抑制了炎症因子的释放。
综上所述,HDND-XIV可在体外抑制FLS的炎症,其抗炎的作用可能与抑制PTCH1基因甲基化有关,通过下调MeCP2蛋白的表达,使PTCH1基因的甲基化程度降低,增加PTCH1蛋白的表达,从而抑制了Hedgehog信号通路,下调了炎症指标。提示HDND-XIV可能是通过调控特定基因的甲基化缓解FLS的炎症,初步说明HDND-XIV治疗RA有一定的疗效。本实验探讨了HDND-XIV对AA大鼠FLS炎症的影响及可能的分子机制,使橙皮素类药物在临床的应用等方面具有积极的意义。
( 致谢: 本实验在安徽医科大学药学院科教大楼实验室完成,特别感谢我的导师李俊教授给予我细心的指导与教诲,感谢我的师兄师姐,在实验进展与论文撰写中给予我帮助,在此一并表达我诚挚的谢意。 )
| [1] | Li R, Cai L, Xie X F, et al. 7, 3′-dimethoxy hesperetin inhibits inflammation by inducing synovial apoptosis in rats with adjuvant-induced arthritis[J]. Immunopharmacol Immunotoxicol, 2013, 35(1): 139-46. doi:10.3109/08923973.2012.723010 |
| [2] | 高皖皎, 邓秋狄, 白殊同, 佟丽. 佐剂型关节炎大鼠滑膜成纤维细胞模型建立及特征分析[J]. 中国药理学通报, 2015, 31(12): 1693-8. Gao W J, Deng Q Q, Bai S T, Tong L. Establishment and characterization of synovial fibroblasts in adjuvant arthritis rats[J]. Chin Pharmacol Bull, 2015, 31(12): 1693-8. doi:10.3969/j.issn.1001-1978.2015.12.013 |
| [3] | Boissier M C. Cell and cytokine imbalances in rheumatoid synovitis[J]. Joint Bone Spine, 2011, 78(3): 230-4. doi:10.1016/j.jbspin.2010.08.017 |
| [4] | Trenkmann M, Brock M, Ospelt C, et al. Epigenetics in rheumatoid arthritis[J]. Clin Rev Allergy Immunol, 2010, 39(1): 10-9. doi:10.1007/s12016-009-8166-6 |
| [5] | Baubec T, Ivánek R, Lienert F, et al. Methylation-dependent and -independent genomic targeting principles of the MBD protein family[J]. Cell, 2013, 153(2): 480-92. doi:10.1016/j.cell.2013.03.011 |
| [6] | Wilson C W, Chuang P T. Mechanism and evolution of cytosolic Hedgehog signal transduction[J]. Development, 2010, 137(13): 2079-94. doi:10.1242/dev.045021 |
| [7] | Zuo Y, Song Y, Zhang M, et al. Role of PTCH1 gene methylation in gastric carcinogenesis[J]. Oncol Lett, 2014, 8(2): 679-82. |
| [8] | Wu X, Zhao B, Cheng Y, et al. Melittin induces PTCH1 expression by down-regulating MeCP2 in human hepatocellular carcinoma SMMC-7721 cells[J]. Toxicol Appl Pharmacol, 2015, 288(1): 74-83. doi:10.1016/j.taap.2015.07.010 |
| [9] | 张育, 张学增, 沈维干, 等. 金雀异黄素对CIA大鼠成纤维样滑膜细胞增殖、凋亡及其机制的研究[J]. 中国药理学通报, 2011, 27(8): 1161-5. Zhang Y, Zhang X Z, Shen W G, et al. Effect of genistein on proliferation, apoptosis and its mechanism of fibroblast-like synoviocytes in CIA rats[J]. Chin Pharmacol Bull, 2011, 27(8): 1161-5. |
| [10] | Ren D Y, Xu T, Li R, et al. 5, 7, 3′-Triacetyl hesperetin suppresses adjuvant-induced arthritis in rats through modulating JAK2/STAT3 pathway[J]. Am J Chin Med, 2013, 41(3): 601-14. doi:10.1142/S0192415X13500420 |
| [11] | 宋珊珊, 张玲玲, 魏伟. 实验性关节炎动物模型建立及病理机制研究进展[J]. 中国药理学通报, 2011, 27(12): 1648-53. Song S S, Zhang L L, Wei W. Advances in animal model of experimental arthritis and its pathogenesis[J]. Chin Pharmacol Bull, 2011, 27(12): 1648-53. doi:10.3969/j.issn.1001-1978.2011.12.006 |
| [12] | 杜传清, 毛平, 王艳茹, 羊乃康. 急性髓系白血病BCL2L10基因启动子区异常甲基化定量研究[J]. 实用医学杂志, 2012, 28(20): 3397-400. Du C Q, Mao P, Wang Y R, Yang N K. Quantitative analysis of abnormal methylation in the promoter region of BCL2L10 gene in acute myeloid leukemia[J]. J Pract Med, 2012, 28(20): 3397-400. doi:10.3969/j.issn.1006-5725.2012.20.030 |
| [13] | Li X F, Shen W W, Sun Y Y, et al. MicroRNA-20a negatively regulates expression of NLRP3-inflammasome by targeting TXNIP in adjuvant-induced arthritis fibroblast-like synoviocytes[J]. Joint Bone Spine, 2016, 83(6): 695-700. doi:10.1016/j.jbspin.2015.10.007 |
| [14] | Katoh Y, Katoh M. Hedgehog signaling pathway and gastrointestinal stem cell signaling network(Review)[J]. Int J Mol Med, 2006, 18(6): 1019-23. |
| [15] | 何俊锋, 刘剑平. 表观遗传学在类风湿关节炎发病机制中的研究进展[J]. 中华临床医师杂志, 2013, 7(13): 6021-4. He J F, Liu J P. Research progress of epigenetics in the pathogenesis of rheumatoid arthritis[J]. Chin J Clinicians, 2013, 7(13): 6021-4. doi:10.3969/cma.j.issn.1674-0785.2013.13.058 |