


随着静脉麻醉技术的完善和相关基础研究的进展,静脉麻醉药丙泊酚 (propofol) 由于具有快速起效、苏醒迅速、持续输注后无蓄积等优点,在婴幼儿麻醉和镇静中广泛应用[1]。丙泊酚通过与GABAA受体及钙离子通道结合,延长抑制性突触后电位,干扰突触间的信号传递,而产生镇静和麻醉作用[2]。研究表明,丙泊酚在临床麻醉浓度内可导致发育期大脑神经毒性[3],相关机制不明。现有研究报道主要集中在丙泊酚对神经元细胞的直接作用[4-5],对神经系统其他细胞的影响研究较少。本研究拟通过观察丙泊酚对星形胶质细胞 (astrocytes, AST) 的影响,进而分析其对神经系统的毒性作用机制。通过观察不同剂量的丙泊酚对新生大鼠脑皮层AST凋亡的影响,分析大鼠脑皮层AST线粒体细胞色素C (cytochrome C, cyt-C) 漏出量,促凋亡蛋白caspase-3和caspase-9活性,探讨丙泊酚诱发AST凋亡的作用机制。
1 材料与方法 1.1 实验材料新生1~3 d SD大鼠[上海斯莱克实验动物有限责任公司,动物合格证号:SCXK (沪)2007-0005],丙泊酚注射液 (10 g·L-1,阿斯利康), DMEM高糖培养液、胎牛血清和0.25%胰酶 (HyClone),免疫组化试剂盒 (福州迈新),一抗GFAP (N-18)-R、cyt-C (Santa Cruz),Annexin V/PI双染细胞凋亡检测试剂盒、caspase-3和caspase-9检测试剂盒 (Thermo)。
1.2 AST的原代培养和免疫组化鉴定 1.2.1 AST原代培养和纯化参照文献报道[6],将新生1~3 d的SD大鼠乳鼠,-20℃冰箱冷冻麻醉,取两侧大脑皮层组织,预冷的PBS液中漂洗4~5次,用眼科剪剪成糜状,0.25%胰蛋白酶消化10~15 min,期间用吹管轻轻吹打,使其成为细胞悬液,10%胎牛血清的高糖DMEM培养基终止消化,离心 (800 r·min-1)5 min弃上清,重新加入含有血清的培养基吹打后,静置10 min,离心 (800 r·min-1)5 min弃上清,加入含血清的培养基吹打制成初细胞悬液,用100目、200目筛网过滤,接种到培养皿,于37℃、5% CO2培养箱中培养30~60 min,翻转培养皿,吸出初细胞悬液,离心 (800 r·min-1)5 min弃上清,加入含血清的培养基吹打制成次细胞悬液,将过滤液以培养基稀释后接种于培养瓶中,接种密度约为1×104个/cm2,以后每隔2~3 d换液1次,连续培养9~14 d,换液时稍加震荡,并用倒置显微镜观察细胞生长情况,待细胞长满瓶底,将培养瓶置于37℃恒温摇床上,以260 r·min-1的速度振摇6 h,去除混杂的神经元细胞和小胶质细胞的上清液,后传代,重复差速贴壁培养纯化细胞,取传代培养第3次细胞进行实验。
1.2.2 GFAP免疫细胞化学ABC法鉴定AST制备细胞爬片,4%多聚甲醛固定,0.5% Triton X-100破膜,3% H2O2孵育去除内源性过氧化物酶,1 :10正常山羊血清封闭,滴加GFAP一抗 (1 :100),阴性对照片滴加PBS代替一抗,4℃孵育过夜,滴加羊抗兔IgG二抗 (1 :100) 孵育,滴加SABC液 (1 :100),孵育,DAB显色,苏木精复染,自来水冲洗,酒精脱水,二甲苯透明,中性树胶封片,显微镜下观察拍照[7]。
1.3 实验设计及分组将培养的AST细胞分为对照组和实验组。用10%脂肪乳溶解丙泊酚,实验组用不同浓度的丙泊酚处理 (10、30、90 μmol·L-1),对照组用相同体积10%脂肪乳处理。
1.4 MTT法检测AST细胞增殖细胞接种于96孔板,待其贴壁后,用不同浓度丙泊酚 (10、30、90 μmol·L-1) 处理8 h,检测细胞增殖情况。方法如下:每孔加MTT 50 μL (终浓度5 g·L-1),37℃孵育4 h;小心弃去MTT,每孔加DMSO 150 μL,震荡,充分溶解;用酶标仪在570 nm波长处读取各样本OD值。根据公式:细胞存活率/% =(实验组OD值/对照组OD值)×100%,计算细胞存活率。每组实验重复3次。
1.5 Annexin V/PI双染检测AST细胞凋亡细胞接种于6孔板,待其贴壁后,用不同浓度丙泊酚 (10、30、90 μmol·L-1) 处理8 h后收集细胞,用不含EDTA的胰酶消化收集细胞 (胰酶消化时间不易过长,否则容易引起假阳性),PBS洗涤细胞2次,加500 μL的Binding buffer悬浮细胞, 加5 μL Annexin V-FITC混匀后,加入5 μL PI混匀, 室温避光反应5~15 min, 1 h内用流式细胞仪检测,实验结果用流式分析软件FlowJo 7.6分析。每组实验重复3次。
1.6 Western blot检测AST线粒体cyt-C漏出情况细胞接种于培养皿,待其贴壁后,用不同浓度丙泊酚 (10、30、90 μmol·L-1) 处理8 h后收集细胞,按试剂盒方法分别提取AST细胞线粒体蛋白和线粒体外蛋白,用BCA蛋白浓度测定试剂盒测蛋白浓度。等量线粒体内外蛋白样品分别行电泳,转膜,抗cyto-C抗体室温孵育,TBST溶液洗涤后,HRP标记的二抗室温孵育,化学发光,显影定影,扫描后用图像处理软件Phoretix 1D分析目标条带的灰度值。每组实验重复3次。
1.7 分光光度法检测AST caspase-3和caspase-9活性细胞接种于培养皿,待其贴壁后,用不同浓度丙泊酚 (10、30、90 μmol·L-1) 处理8 h后收集细胞,预冷PBS洗涤3次, 4℃ Lysis buffer (每50 μL加入0.5 μL DTT),冰上裂解30 min, 离心取上清, 用BCA蛋白浓度测定试剂盒测蛋白浓度。等量对照组和处理组细胞裂解液与caspase-3或caspase-9底物37℃孵育4 h。催化产生的黄色产物用于定量caspase活性。用全自动酶标仪于405 nm波长测定各孔的吸光度 (A405) 值。Caspase相对活性/%=(处理组A405值/对照组A405值)×100%[8]。每组实验重复3次。
1.8 统计学分析实验数据以x±s表示,采用SPSS13.0统计分析。多组间均数比较采用单因素方差分析 (One-Way ANOVA), 两两组间均数比较采用LSD-t检验。
2 结果 2.1 AST细胞鉴定骨架蛋白GFAP为成熟AST的特异性标记物。GFAP免疫组织化学结果显示,阳性产物呈棕黄色,主要分布于胞质中,胞核未着色。随机选择6个视野,分别计数200个细胞,阳性细胞数95%以上,证实获得的为AST,且纯度较高,可用于后续实验 (Fig 1)。
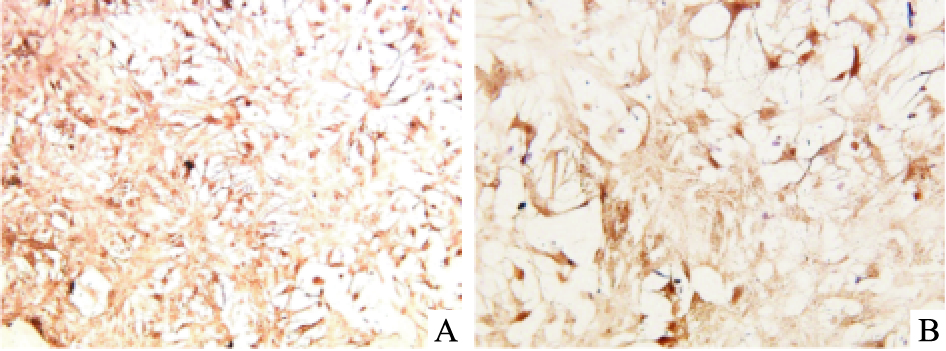
|
| Fig 1 GFAP stained astrocytes identified by immunohistochemistry A:×100; B:×200 |
运用MTT法测定细胞生存率。如Fig 2所示,10、30、90 μmol·L-1丙泊酚处理组细胞生存率呈剂量依赖性地降低,与对照组比较,30、90 μmol·L-1丙泊酚处理组细胞生存率明显下降 (P<0.01)。
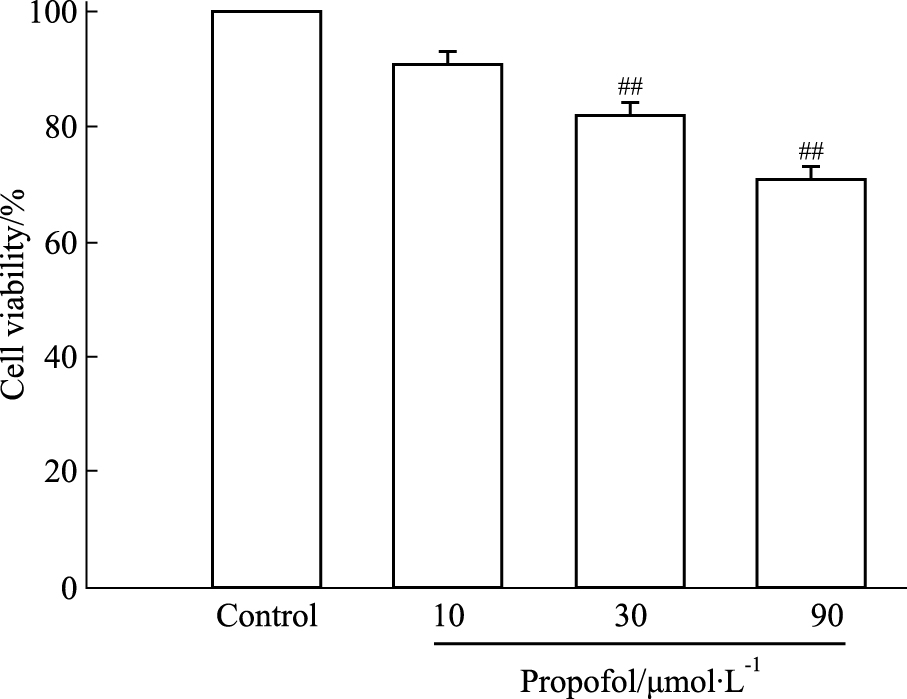
|
| Fig 2 Effect of propofol on cell viability of AST cells (x±s, n=3) ##P < 0.01 vs control |
Annexin V/PI双染检测AST细胞凋亡。如Fig 3所示,对照组细胞凋亡率仅为 (3.90±0.61)%; 10、30、90 μmol·L-1丙泊酚处理组细胞凋亡率逐渐升高,分别为 (5.11±0.87)%、(6.53±1.18)%(P<0.05)、(9.74±1.51)%(P<0.01)。
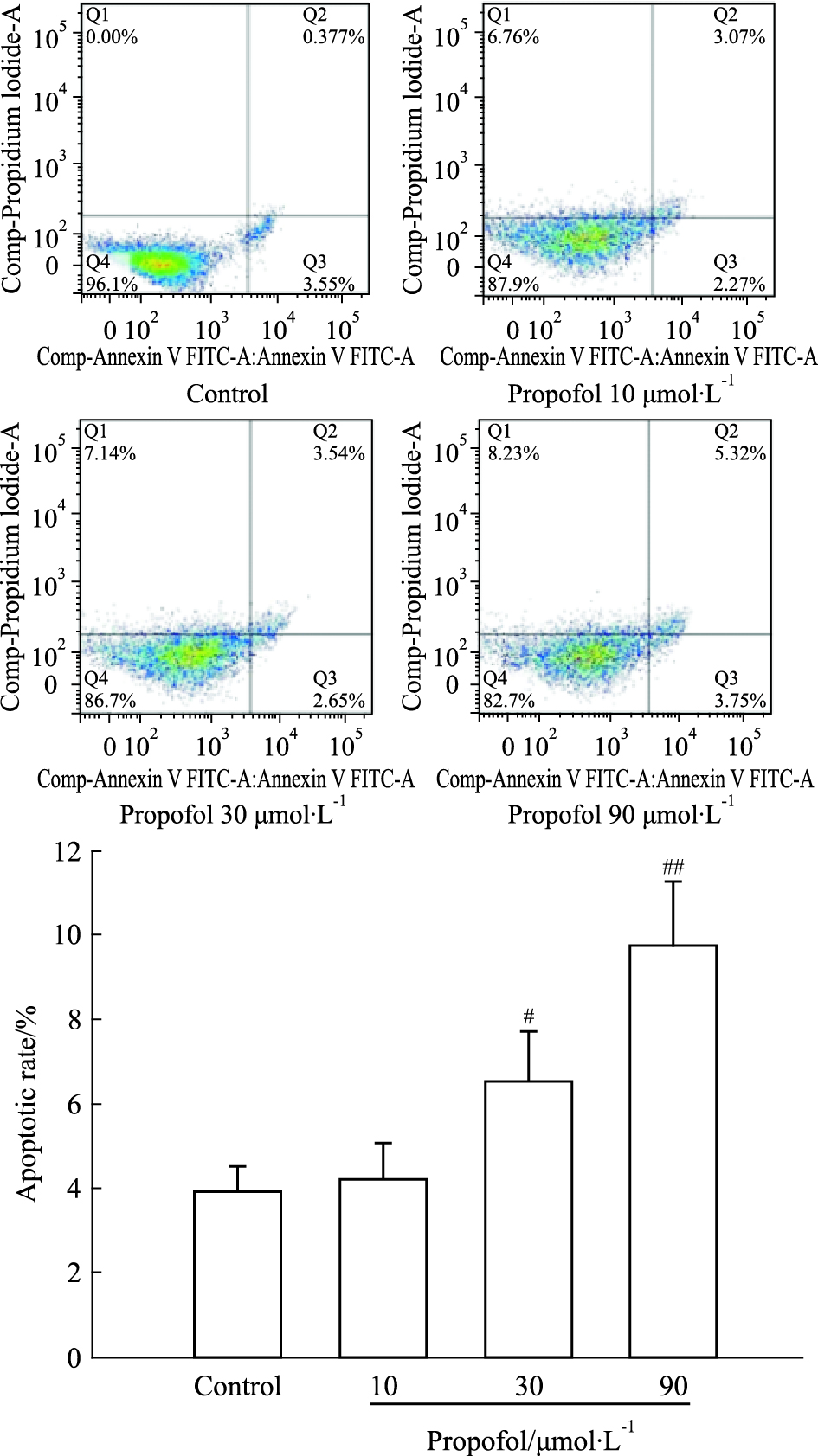
|
| Fig 3 AST cell apoptosis induced by propofol (x±s, n=3) #P < 0.05, ##P < 0.01 vs control |
蛋白免疫印迹结果如Fig 4所示,同对照组比较10、30、90 μmol·L-1丙泊酚处理组细胞线粒体cyt-C外漏逐渐增加。30、90 μmol·L-1丙泊酚处理组cyt-C外漏明显增加 (P<0.05)。
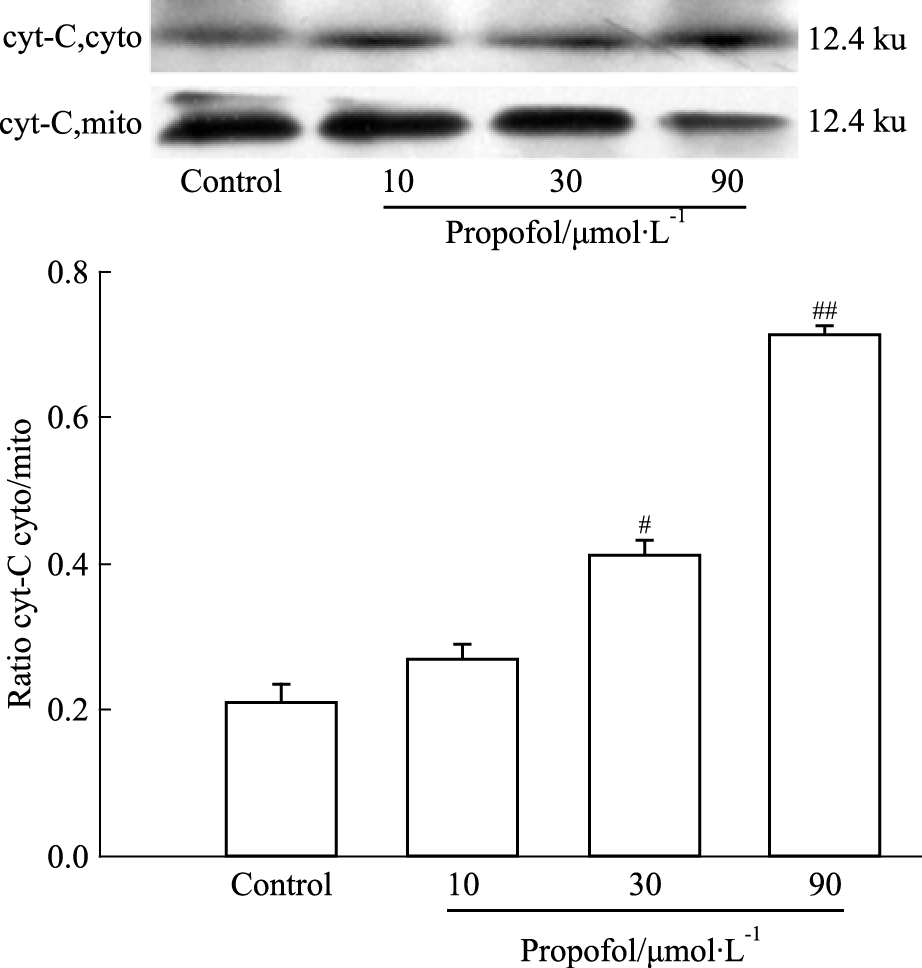
|
| Fig 4 Effects of propofol on cytochrome C release in AST cells (x±s, n=3) #P < 0.05, ##P < 0.01 vs control |
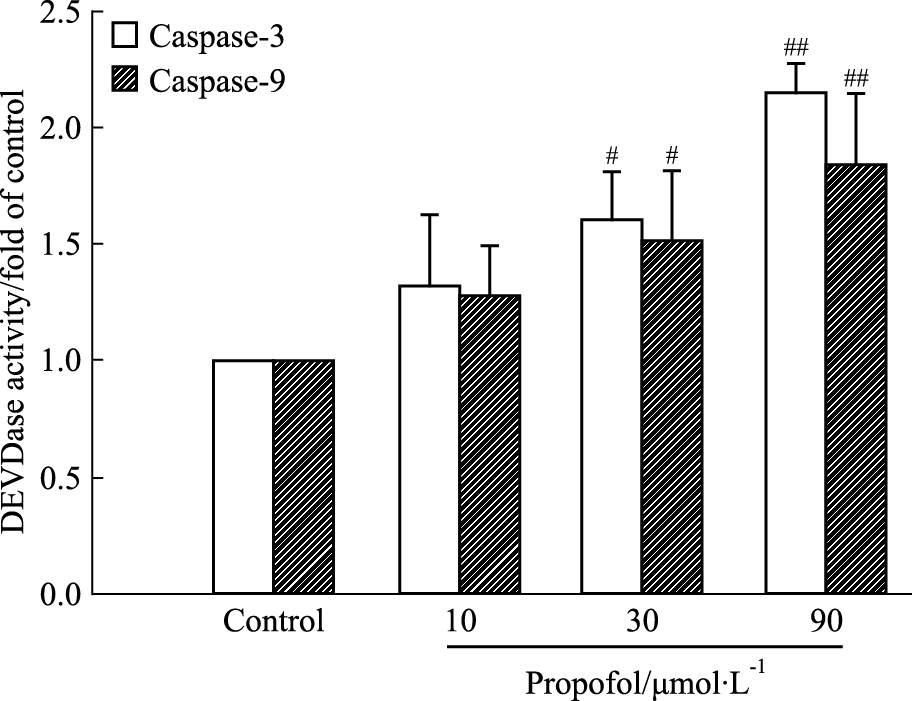
分光光度法检测AST caspase-3和caspase-9活性,结果如Fig 5所示,同对照组比较,10、30、90 μmol·L-1丙泊酚处理组细胞,促凋亡蛋白caspase-3和caspase-9活性逐渐增加。30、90 μmol·L-1丙泊酚处理组caspase-3和caspase-9活性明显增加 (P<0.05)。
|
| Fig 5 Effects of propofol on activity of caspase-3 and caspase-9 in AST cells (x±s, n=3) #P < 0.05, ##P < 0.01 vs control |
丙泊酚在婴幼儿麻醉和镇静中广泛应用,然而大脑在发育期对全麻药诱发神经系统损伤的敏感性明显增加[5],但其相关作用机制不明。丙泊酚通过与GABAA受体及钙离子通道结合,延长抑制性突触后电位,干扰突触间的信号传递,而产生镇静和麻醉作用,但研究认为GABAA受体激活与丙泊酚诱发的发育期大脑神经毒性无关[2]。临床研究表明,婴幼儿多次经历全麻可导致学习能力缺陷的风险增加[9];动物实验表明,丙泊酚在临床相关浓度内可损害其空间学习记忆能力[10],可能与丙泊酚诱发发育期大脑广泛神经元凋亡等神经毒性有关[11],但是其具体机制是什么?对神经系统还有怎样的影响?目前的研究多集中在丙泊酚对神经元的直接作用方面,对中枢神经系统 (CNS) 中其他细胞的影响研究不多。
在CNS中,胶质细胞的数量远远超过神经元,占细胞总数的90%以上。近年来研究发现,胶质细胞在CNS中不仅仅起支持、营养、修复和吞噬等作用,胶质细胞,尤其是星形胶质细胞 (AST) 和小胶质细胞,并非完全的辅助细胞,它们参与了神经元在脑内活动,在引导突触发生、促进突触生长、诱导突触凋亡、调节突触传递和维持突触的正常功能等方面具有重要作用[12-13]。特别是发育期大脑胶质细胞对于神经系统的发育起关键作用,但是在静脉麻醉药丙泊酚诱发的发育期大脑损伤中,丙泊酚对AST会产生什么样的影响,现有研究还不明确。
本研究选用出生1~3 d的新生SD大鼠,此时SD大鼠大脑皮层处于发育期,AST比例较大。实验过程中,通过将培养瓶置于37℃恒温摇床上,以260 r·min-1的速度振摇6 h,去除混杂的神经元细胞和小胶质细胞,后用反复差数贴壁培养的方法纯化去除混杂的成纤维细胞及其他细胞,以得到纯度较高的发育期AST后,用不同浓度丙泊酚 (10、30、90 μmol·L-1) 处理细胞8 h,发现丙泊酚在临床维持全麻状态的药物浓度 (30 μmol·L-1) 可明显抑制AST细胞增殖、诱导细胞凋亡。
脑正常发育过程中,神经胶质细胞发生生理性凋亡以适应脑功能和结构的变化。相关资料显示,内源性细胞凋亡机制有:① 线粒体途径诱导细胞凋亡:细胞在死亡诱导因子 (如氧化应激和钙超载) 作用下,线粒体细胞色素C漏出进入细胞质,Apaf-1与之结合活化,依次激活caspase-9与caspase-3,募集下游众多的caspase,导致内源性细胞凋亡[14];② 内质网应激诱导细胞凋亡:DNR损伤的心肌细胞内质网功能内稳态失衡, 形成内质网应激,活化caspase-12和caspase-3,募集下游众多的caspase,导致内源性细胞凋亡[15]。但本研究发现,丙泊酚在临床维持全麻状态的药物浓度 (30 μmol·L-1) 明显增加AST线粒体cyt-C外漏,增加caspase-9与caspase-3活性,提示丙泊酚可能通过诱导线粒体cyt-C外漏,诱发线粒体途径的AST凋亡,而影响了脑正常发育过程。
总之, 本研究结果表明体外临床麻醉剂量的丙泊酚可诱导AST凋亡增加,机制可能与丙泊酚诱发发育期大脑神经星形胶质细胞线粒体损伤,导致线粒体cyt-C外漏增加有关。
( 致谢: 感谢厦门大学实验动物中心和厦门大学附属第一医院中心实验室提供的实验条件和技术支持! )
| [1] | Ozturk T, Acikel A, Yilmaz O, et al. Effects of low-dose propofol vs ketamine on emergence cough in children undergoing flexible bronchoscopy with sevoflurane-remifentanil anesthesia: a randomized, double-blind, placebo-controlled trial[J]. J Clin Anesth, 2016, 35: 90-5. doi:10.1016/j.jclinane.2016.06.025 |
| [2] | Germann A L, Shin D J, Manion B D, et al. Activation and modulation of recombinant glycine and GABAA receptors by 4-halogenated analogues of propofol[J]. Br J Pharmacol, 2016, 173(21): 3110-20. doi:10.1111/bph.v173.21 |
| [3] | 赵施施, 张科学, 包素红, 等. 丙泊酚对幼小鼠自主活动和学习记忆行为的影响[J]. 中国药理学通报, 2013, 29(2): 198-201. Zhao S S, Zhang K X, Bao S H, et al. Effects of propofol on spontaneous motor activity and learning behaviors in juvenile mice[J]. Chin Pharmacol Bull, 2013, 29(2): 198-201. |
| [4] | 邓小园, 陈博, 刘红亮, 等. TNF-α在丙泊酚诱发的神经元凋亡及认知功能障碍中的作用[J]. 中国药理学通报, 2016, 32(7): 945-9. Deng X Y, Chen B, Liu H L, et al. Role of TNF-α in propofol-induced neuronal apoptosis and long-term cognitive impairment in neonatal rats[J]. Chin Pharmacol Bull, 2016, 32(7): 945-9. |
| [5] | 李建立, 庞鑫鑫, 郭洪霞, 等. 17β-雌二醇通过PI3K-Akt信号通路抑制丙泊酚诱导皮层神经元凋亡[J]. 中国病理生理杂志, 2016, 32(1): 58-63. Li J L, Pang X X, Guo H X, et al. 17β-estradiol protects cortical neurons from propofol-induced apoptosis by activating PI3K-Akt signaling pathway[J]. Chin J Pathophysiol, 2016, 32(1): 58-63. |
| [6] | 乔圆, 廖雁, 南方, 等. 组胺对星形胶质细胞Egr-1表达的调节作用[J]. 中国病理生理杂志, 2016, 32(4): 680-5. Qiao Y, Liao Y, Nan F, et al. Effects of histamine on mRNA expression of Egr-1 in astrocytes[J]. Chin J Pathophysiol, 2016, 32(4): 680-5. |
| [7] | Hansen D B, Garrido-Comas N, Salter M, et al. HCO3(-)-independent pH regulation in astrocytes in situ is dominated by V-ATPase[J]. J Biol Chem, 2015, 290(13): 8039-47. doi:10.1074/jbc.M115.636597 |
| [8] | Chen Z, Wang R, Wu J, et al. Low-dose carbon monoxide inhalation protects neuronal cells from apoptosis after optic nerve crush[J]. Biochem Biophys Res Commun, 2016, 469(4): 809-15. doi:10.1016/j.bbrc.2015.12.064 |
| [9] | Kim J, Kim S Y, Lee J H, et al. Low-dose dexmedetomidine reduces emergence agitation after desflurane anaesthesia in children undergoing strabismus surgery[J]. Yonsei Med J, 2014, 55(2): 508-16. doi:10.3349/ymj.2014.55.2.508 |
| [10] | 尚游, 吴艳, 姚尚龙, 等. 丙泊酚对大鼠空间学习记忆能力影响的实验研究[J]. 中国药理学通报, 2007, 23(6): 764-8. Shang Y, Wu Y, Yao S L, et al. Experimental research on the effect of propofol on spatial learning and memory in rats[J]. Chin Pharmacol Bull, 2007, 23(6): 764-8. |
| [11] | Chen B, Deng X, Wang B, et al. Etanercept, an inhibitor of TNF-α, prevents propofol-induced neurotoxicity in the developing brain[J]. Int J Dev Neurosci, 2016, 55: 91-100. doi:10.1016/j.ijdevneu.2016.10.002 |
| [12] | Reemst K, Noctor S C, Lucassen P J, et al. The indispensable roles of microglia and astrocytes during brain[J]. Front Hum Neurosci, 2016, 10: 566. |
| [13] | 杨慧, 关永源. 星型胶质细胞在脑缺血性疾病中的神经元保护机制[J]. 中国药理学通报, 2009, 25(3): 284-6. Yang H, Guan Y Y. Mechanisms of the neuroprotection of astrocyte during cerebral ischemic disease[J]. Chin Pharmacol Bull, 2009, 25(3): 284-6. |
| [14] | Yuan X, Zhang L, Wang S, et al. Mitochondrial apoptosis and autophagy in the process of adipose-derived stromal cell differentiation into astrocytes[J]. Cell Biol Int, 2016, 40(2): 156-65. doi:10.1002/cbin.v40.2 |
| [15] | Sun W C, Liang Z D, Pei L. Propofol-induced rno-miR-665 targets BCL2L1 and influences apoptosis in rodent developing hippocampal astrocytes[J]. Neurotoxicology, 2015, 51: 87-95. doi:10.1016/j.neuro.2015.08.001 |

