


2. 中山市人民医院 呼吸内科,广东 中山 528403;
3. 中国医科大学临床药理学教研室,辽宁 沈阳 110001
2. Dept of Respiration, Zhongshan People′s Hospital, Zhongshan Guangdong 528403, China;
3. Dept of Clinical Pharmacology, China Medical University, Shenyang Liaoning 110001, China
慢性阻塞性肺疾病 (chronic obstructive pulmonary disease, COPD) 是临床常见的以不完全可逆的气流受限为特征的慢性肺部疾病。随着病程缓慢发展,可出现外周气道阻塞、肺实质破坏及肺血管纤维化等病理改变,最终导致肺动脉高压 (pulmonary artery hypertension, PAH)、慢性肺源性心脏病及右心衰竭等恶性疾病。5-羟色胺 (5-hydroxytryptamine, 5-HT) 作为一种内源性血管活性物质,与呼吸系统疾病有密切关系。生理状态下,血液中5-HT主要储藏于血小板致密体中,当某些因素 (如炎症反应、低氧等) 刺激血小板大量释放5-HT,并与其转运体结合,引起肺血管收缩及血管平滑肌细胞增殖等病理反应[1-2]。研究表明,5-HT大量释放可促进COPD形成及诱发PAH[3]。
目前,研究发现5-HT转运体 (SERT) 启动子区存在LL、LS和SS 3种基因多态性。有研究认为白种人群中SERT基因多态性与COPD患者伴PAH的严重程度及预后相关,LL基因型比LS和SS基因型患PAH风险增高[4-5]。但是,对于患有COPD中国汉族人群,尚无SERT基因多态性与COPD及PAH相关性的研究。因此,本研究通过检测中国汉族COPD患者及健康对照人群SERT基因多态性分布及基因表达变化,探讨SERT基因多态性与COPD病程发展的相关性。
1 材料与方法 1.1 研究对象以在中山市人民医院呼吸内科就诊的COPD住院患者及健康体检的中国汉族人群为研究对象。确诊为COPD患者51例,均符合COPD诊断标准。其中男43例,女8例,平均年龄 (67.8±8.5) 岁,COPD病程平均 (9.5±7.4) 年。对照组为49例同期体检的健康对照者,其中男37例,女12例,平均年龄 (63.4±6.9) 岁,经超声多普勒及胸部X线显示心、肺正常,无肺动脉高压、慢性咳嗽、咳痰、气喘等呼吸系统疾病。
排除标准:患有可能影响5-HT水平疾病的患者,包括肠易激惹综合症、癌症、肝肾功能异常、血小板数量或功能异常;患有抑郁症、精神分裂、孤独症、躁狂症等精神系统疾病患者;近1个月服用过5-HT相关药物或使用过内皮素受体拮抗剂 (波生坦)、伊洛前列素、磷酸二酯酶-5抑制剂 (西地那非等)、一氧化氮的患者。
本研究所有入组者均遵循自愿参加原则,签署知情同意书,并经过中山市人民医院伦理委员会批准。
1.2 试剂PCR试剂盒由宝生物工程 (大连) 有限公司生产;DNA快速提取试剂盒由深圳益生堂生物有限公司生产;Real-time RT-PCR试剂盒由上海英潍捷基有限公司生产;SERT特异性引物序列由上海生工生物技术服务有限公司合成。
1.3 肺动脉高压的诊断用超声心动图测定研究对象安静状态下三尖瓣返流速度、肺动脉收缩压及其他超声心动图参数,结合临床症状,根据肺动脉高压诊疗指南要求诊断PAH。
1.4 肺功能检查对COPD组患者进行肺功能检查,记录第1秒用力呼气量 (FEV1)、用力肺活量 (FVC) 和FEV1/FVC。FEV1/FEV<70%判断为肺功能有损害。
1.5 SERT基因多态性检测按DNA快速提取试剂盒的要求,全血提取DAN,并且进行PCR反应。SERT反应条件为预变性98℃ 3 min;变性94℃ 40 s;退火60℃ 30 s;延伸72℃ 1 min;修复延伸72℃ 10 min;循环数35;引物序列为SERT-PF:5′-GGCGTTGCCGCTCTGAATGC-3′;SERT-PR:5′-GAGGGACTGAGCTGGACAACCAC-3′。将凝胶电泳图像输入凝胶分析系统进行分析。SERT基因可能有L型或S型,L为528 bp,S为484 bp,根据条带不同位置可能分为LL型、LS型和SS型。
1.6 SERT基因表达检测按Real-time RT-PCR试剂盒要求,全血提取SERT RNA基因、逆转录及PCR扩增。采用相对定量方法比较样品和内参样品转录之间的表达差异。即△△CT=AVERAGE (样本CT值)-AVERAGE (内参CT值)
1.7 统计学处理所有数据采用SPSS 13.0软件包进行统计学分析,数据以x±s表示,两组间比较用t检验,多组间比较用方差分析及最小显著差异 (LSD) 统计方法。SERT基因频率和等位基因频率以百分比表示,组间比较使用χ2检验。基因多态性采用Hardy-Weinberg平衡法则 (H-W定律) 吻合度检验。
2 结果 2.1 SERT基因多态位点PCR产物检测结果由Fig 1可见,共检出2个等位基因片段,即484 bp (S) 和528 bp (L),分为3种基因型L/L (528/528)、L/S (528/484) 和S/S (484/484)。
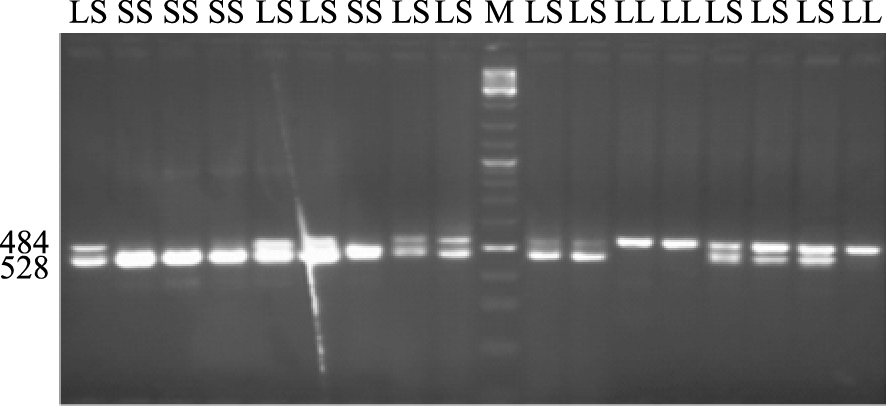
|
| Fig 1 PCR result of SERT gene expression M:Marker; LL:L/L (528/528);LS:L/S (528/484);SS:S/S (484/484) |
为考察资料的可靠性,对照组和COPD组人群进行Hardy-Weinhberg吻合度检验。结果显示,SERT基因多态性位点基因型期望值与观察值之间差异无显著性 (P>0.05),即研究人群均符合Hardy-Weinhberg遗传平衡法则,表明该研究对象来自总体样本,无明显的自然选择、迁移等因素对遗传平衡的影响,吻合度好,资料具有代表性。
2.3 不同组别SERT基因型及频率分布如Tab 1所示,无论对照组还是COPD组,SS基因型所占比例最大,其次是LS型,而LL型最少。将COPD组分为COPD伴PAH组[PAH (+)]和COPD不伴PAH组[PAH (-)],分别与对照组比较,结果显示,伴有PAH组的L等位基因频率高于对照组 (P<0.05)。
| n | LL/% | LS/% | SS/% | L/% | S/% | ||
| Control | 49 | 1(2.0%) | 16(32.7%) | 32(65.3%) | 18(18.4%) | 80(81.6%) | |
| COPD | PAH (-) | 31 | 1(3.2%) | 12(38.7%) | 18(58.1%) | 14(21.2%) | 52(78.8%) |
| PAH (+) | 20 | 3(15.0%) | 8(42.1%) | 9(47.4%) | 14(35.0%)* | 26(65.0%)* | |
| *P<0.05 vs control | |||||||
通过对SERT基因表达检测,结果显示COPD组SERT基因表达 (0.000 33±0.000 20) 比对照组明显增高 (0.000 18±0.000 11)(P<0.05)。但在COPD组中,伴有PAH和不伴有PAH患者SERT基因表达没有发现明显差异 (P>0.05)。
2.5 COPD组中不同SERT基因型人群发病年龄、FEV1%及SERT表达差异COPD组LS基因型患者的发病年龄 (58.1±11.8) 明显低于SS基因型 (64.1±8.0)(P<0.05),说明LS型患者发病较早,但LL基因型与其他基因型相比没有发现统计学意议,可能与LL基因型样本量较少有关。COPD组中,比较3种基因型与FEV1%以及SERT基因表达差异没有统计学意义。
3 讨论近年来,人们发现5-HT作为一种血管活性物质与肺部炎症反应及PAH的形成密切相关。动物实验表明,在野百合碱诱导的PAH大鼠模型中,应用5-HT再摄取抑制剂可降低肺动脉压,并抑制肺组织炎症反应[2, 6-7];对于COPD患者,尤其是伴有PAH的COPD患者,血小板大量释放存贮的5-HT,使血小板内5-HT浓度明显降低,并且降低幅度与PAH严重程度有相关性[3]。因此,目前认为5-HT在COPD发生发展中有重要作用,尤其与COPD晚期形成PAH密切相关。
5-HT主要通过与肺血管平滑肌细胞上的SERT转运,进而诱导血管平滑肌细胞增殖。SERT基因编码于17q11.2染色体,该基因包含35 kb,14个内含子。Di Bella等[8]报道,在其编码区域未发现有变异等位基因,而在其调控序列上发现有多态性存在,并且44 bp插入与缺失多态性与5-HT转运体基因的转录效率有关。近年来,研究发现SERT基因多态性与多种疾病有关,包括精神系统疾病 (如抑郁症、强迫症、孤独症等)、呼吸系统疾病 (如COPD、PAH等)、偏头痛、肠易激惹综合症等[9]。其中,对于SERT基因多态性与COPD及PAH的相关性,国外研究者针对不同种族人群做了大量研究,但对于中国人群还没有相关的报道。Eddahibi等[4]以67名法国COPD患者为研究对象,结果发现其中LL基因型占31.3%,而SS仅占18%。Ulasli等[5]对50名西班牙人研究发现,健康对照人群与PAH患者基因多态性分布没有明显的区别,以LS基因为优势基因,约占54%左右。本研究结果显示,对于中国汉族人群,无论COPD组还是健康对照组,SERT基因分型与欧美人群有很大差别,均以SS基因型为主要基因型,而LL基因型所占比例最低。这与Cao等[10]报道中国人群室间隔缺损 (VSD) 诱导的PAH与SERT相关性研究所得的结果一致。该研究结果显示,健康对照人群以SS占比例最高,LL比例最低。Guo等[11]研究中国汉族人群卒中后抑郁与SERT的关系,对于健康人群SERT基因分布结果也与本研究一致。
目前,有研究认为SERT基因多态性与继发性及原发性的PAH密切相关,LL基因型患者明显比SS基因型患者患PAH风险高[12]。但也有研究认为,SERT基因多态性在健康人群与PAH患者中并无差异,LL基因与PAH临床治疗及预后无关[13-14]。对于中国人群,Cao等[10]发现,LL基因型在VSD诱导PAH患者中所占比例比健康对照组升高,而LS和SS没明显差异,认为LL基因型可以提高VSD伴PAH的风险。本实验结果显示,COPD患者中伴有PAH患者L型基因所占比例比不伴有PAH患者及健康对照组高。因此,我们认为中国汉族COPD患者的L基因型与PAH发生有一定的相关性。
本研究结果显示,与健康对照组相比,COPD组SERT基因表达明显增高,但COPD组中伴PAH与不伴PAH患者SERT表达没有差异,不同基因型以及不同严重程度COPD患者的SERT表达也没有差异。我们推测,COPD炎症性病理改变诱导5-HT释放及SERT表达增加,但在慢性炎症持续刺激下,不同PAH水平SERT表达变化不明显可能与表达调控有关。Mercado等[15]研究PAH患者发现,初始时血小板对5-HT的重吸收及血小板膜上的SERT表达随着血浆中5-HT水平升高而增加,随着血浆中5-HT继续升高,SERT的表达则逐渐下降,甚至低于正常表达。他们认为持续升高的5-HT对血小板膜SERT表达有抑制作用,机制可能与调节小G蛋白Rab4途径及弹性蛋白磷酸化有关。因此,对于COPD患者SERT表达相关的调控机制仍需进一步研究。
另外,本研究发现中国汉族人群COPD患者中SERT基因多态性与COPD肺功能评价的重要指标FEV1%并没有明显相关性。Eddahibi等[4]报道,法国COPD患者LL基因型比LS和SS基因型FEV1%明显增高,但对于英国COPD患者研究数据显示3种基因型对FEV1%没有影响[5]。因此,我们认为可能由于种族不同,SERT对COPD肺功能的影响有所差异。我们研究还发现,LS基因型患者COPD的发病年龄比SS基因型患者小。这与Willers等[16]对家族性PAH研究发现LL基因型与PAH早期发病有关的结果一致,从一定程度上说明L基因可能增加COPD的遗传易感性。
综上所述,本研究表明,在COPD病理状态下SERT基因表达明显增高,SERT基因多态性的L等位基因频率增高,并且发病时间早于S基因型。基于以上研究,我们认为SERT基因多态性对COPD的遗传易感性及诱导PAH的形成有一定影响。
| [1] | Sardana M, Moll M, Farber H W. Novel investigational therapies for treating pulmonary arterial hypertension[J]. Expert Opin Investig Drugs, 2015, 24(12): 1571-96. doi:10.1517/13543784.2015.1098616 |
| [2] | 盖祥云, 林鹏程, 何彦峰, 等. 低氧性肺动脉高压中低氧性肺血管收缩的作用[J]. 中国药理学通报, 2016, 32(6): 768-72. Gai X Y, Lin P C, He Y F, et al. Effect of hypoxic pulmonary vasoconstriction on hypoxic pulmonary hypertension[J]. Chin Pharmacol Bull, 2016, 32(6): 768-72. |
| [3] | 李雪芹, 李运景, 缪炯燏, 等. 慢性阻塞性肺疾病血小板5-羟色胺变化及意义[J]. 中国现代医学杂志, 2011, 21(5): 612-6. Li X Q, Li Y J, Miao J Y, et al. Change of platelet 5-HT level in chronic obstructive pulmonary disease patients[J]. China J Mod Med, 2011, 21(5): 612-6. |
| [4] | Eddahibi S, Chaouat A, Morrell N, et al. Polymorphism of the serotonin transporter gene and pulmonary hypertension in chronic obstructive pulmonary disease[J]. Circulation, 2003, 108(15): 1839-44. doi:10.1161/01.CIR.0000091409.53101.E8 |
| [5] | Ulasli S S, Eyuboglu F O, Verdi H, et al. Associations between endothelial nitric oxide synthase A/B, angiotensin converting enzyme Ⅰ/D and serotonin transporter L/S gene polymorphisms with pulmonary hypertension in COPD patients[J]. Mol Biol Rep, 2013, 40(10): 5625-33. doi:10.1007/s11033-013-2664-6 |
| [6] | Li X Q, Hong Y, Wang Y, et al. Sertraline protects against monocrotaline-induced pulmonary hypertension in rats[J]. Clin Exp Pharmacol Physiol, 2006, 33(11): 1047-51. doi:10.1111/cep.2006.33.issue-11 |
| [7] | Li X Q, Wang H M, Yang C G, et al. Fluoxetine inhibited extracellular matrix of pulmonary artery and inflammation of lungs in monocrotaline-treated rats[J]. Acta Pharmacol Sin, 2011, 32(2): 217-22. doi:10.1038/aps.2010.187 |
| [8] | Di Bella D, Catalano M, Balling U, et al. Systematic screening for mutations in the coding region of the human serotonin transporter (5-HTT) gene using PCR and DGGE[J]. Am J Med Genet, 1996, 67(6): 541-5. doi:10.1002/(ISSN)1096-8628 |
| [9] | Bazan I S, Fares W H. Review of the ongoing story of appetite suppressants, serotonin pathway, and pulmonary vascular disease[J]. Am J Cardiol, 2016, 117(10): 1691-6. doi:10.1016/j.amjcard.2016.02.049 |
| [10] | Cao H, Gu H, Qiu W, et al. Association study of serotonin transporter gene polymorphisms and ventricular septal defects related possible pulmonary arterial hypertension in Chinese population[J]. Clin Exp Hypertens, 2009, 31(7): 605-14. doi:10.3109/10641960902993061 |
| [11] | Guo W Y, Zhang Z H, Mu J L, et al. Relationship between 5-HTTLPR polymorphism and post-stroke depression[J]. Genet Mol Res, 2016, 15(1): 1-6. |
| [12] | Zhang H, Xu M, Xia J, et al. Association between serotonin transporter (SERT) gene polymorphism and idiopathicpulmonary arterial hypertension:a meta-analysis and review of the literature[J]. Metabolism, 2013, 62(12): 1867-75. doi:10.1016/j.metabol.2013.08.012 |
| [13] | Baloira A, Núez M, Cifrian J, et al. Polymorphisms in the serotonin transporter protein (SERT) gene in patients with pulmonary arterial hypertension[J]. Arch Bronconeumol, 2012, 48(3): 77-80. doi:10.1016/j.arbres.2011.10.008 |
| [14] | Machado R D, Eickelberg O, Elliott C G, et al. Genetics and genomics of pulmonary arterial hypertension[J]. J Am Coll Cardiol, 2009, 54(1): S32-42. doi:10.1016/j.jacc.2009.04.015 |
| [15] | Mercado C P, Kilic F. Molecular mechanisms of SERT in platelets: regulation of plasma serotonin levels[J]. Mol Interv, 2010, 10(4): 231-41. doi:10.1124/mi.10.4.6 |
| [16] | Willers E D, Newman J H, Loyd J E, et al. Serotonin transporter polymorphisms in familial and idiopathic pulmonary arterial hypertension[J]. Am J Respir Crit Care Med, 2006, 173(7): 798-802. doi:10.1164/rccm.200509-1361OC |
