


2. 山西医科大学 第一医院内分泌科,山西 太原 030001
2. Dept of Endocrinology of the First Hospital, Shanxi Medical University, Taiyuan 030001, China
多巴胺 (dopamine, DA) 是一种主要由大脑分泌的神经传递物质,负责控制人的运动、情绪与感觉,并将兴奋信息上传,与精神和神经系统方面的疾病密切相关[1]。研究表明[2],在外周组织如肾脏、胰腺和上消化道中也可以合成并释放多巴胺,调节非神经系统的功能。由于外周多巴胺无法穿过血脑屏障,不会影响到神经系统的功能,但是它可以在其合成的组织中发挥着旁分泌的作用。近年来,多巴胺与胰岛素之间的关系受到越来越多的关注。临床发现长期使用多巴胺的前体左旋多巴治疗帕金森疾病,这些病人通过口服糖耐量实验发现糖的耐受力明显下降,这种现象在帕金森患病人群中高达50%~80%[3]。多巴胺被认为可以影响胰岛素的分泌[4],然而其作用机制尚不明晰。本研究拟通过胰岛素分泌实验以及膜片钳、钙成像技术,探究多巴胺对胰岛素分泌的作用及可能机制。
1 材料与方法 1.1 实验动物SD大鼠, ♂, 由中国人民解放军军事医学科学院实验动物中心提供,体质量180~250 g。生产许可证号:SCXK-(军)2012-0004。
1.2 试剂Dopamine hydrochloride (美国Sigma,批号:BCBG8676V);胶原酶P (瑞士Roche,批号:11104222);BSA (北京索莱宝,批号:83100513);RPMI 1640培养基 (上海生工,批号:C518FA0002);胎牛血清 (上海生工,批号:B326FA0092);青、链霉素 (北京索莱宝,批号:20150909);HEPES (北京索莱宝,批号:710B048);Histopaque 1077(美国Sigma,批号:RNBF1783);DispaseⅡ(美国Amresco,批号:10888700);D-葡萄糖 (北京索莱宝,批号:405A0918);胰岛素检测试剂盒 (北京北方生物技术研究所,批号:20160320)。
1.3 仪器电子天平 (上海精密仪器,型号:GB/T26497);体式显微镜 (上海中恒仪器, 型号:SM262);倒置显微镜 (日本OLYMPUS, 型号:AE-2000);台式离心机 (长沙湘仪仪器, 型号:SC-3610);细胞培养箱 (北京博奥恒信生物科技, 型号:HF100);Narishige MODEL PP-830电极拉制仪 (日本Narishige, 型号:PP-830);MIRO FORGE MF-830抛光仪 (日本Narishige, 型号:MF-200);EPC10全自动膜片钳 (德国HEKA, 型号:MP-285);钙成像 (北京MDE, 型号:LAMBDA 10-B)。
1.4 方法 1.4.1 大鼠胰岛、胰岛细胞的分离与培养♂ SD大鼠断头处死后,将1 g·L-1胶原酶P溶液 (RPMI 1640培养基溶解) 缓慢注入到胆总管中, 分离的胰腺经37℃水浴消化、Histopaque 1077梯度离心得到单个胰岛,并放于37℃、5% CO2的细胞培养箱中培养。分离胰岛细胞时,使用5 g·L-1的Dispase Ⅱ酶液消化胰岛,将细胞悬液均匀地接种在经细胞黏附剂处理过的玻片上,加入培养液后放于细胞培养箱中培养[5]。
1.4.2 胰岛素释放实验分得的单个胰岛经过夜修复后备用,每组7管,每管中放入5个胰岛。首先,使用2.8 mmol·L-1葡萄糖孵育液37℃孵育30 min, 弃除上清;然后,分别加入2.8 mmol·L-1和16.7 mmol·L-1葡萄糖孵育液以及含有不同浓度的DA孵育30 min, 收集上清液,采用放免法测得胰岛素含量;最后,加入乙醇粉碎胰岛,测得胰岛素的总含量。
1.4.3 膜片钳实验将分离的胰岛细胞置于倒置显微镜下,细胞膜电容>7 pF的为β细胞。记录电极经PP-830电极拉制仪两步法拉制,充满电极内液后电阻为4~7 MΩ, 当电极尖端与细胞膜之间形成高阻封接 (≥1 GΩ) 后,负压破膜,使电极内液与细胞内液相通,形成全细胞记录模式。记录电压门控性钙电流时,在-70 mV钳制电压下给予-50 mV~30 mV的电压刺激,记录50 ms内每次递增10 mV的钙电流。记录动作电位采用电流钳模式,封接破膜后,给予150 pA、4 ms的电流注入,计算从去极化开始到复极化于静息电位之上10 mV的时程为动作电位时程[6]。
1.4.4 钙成像实验细胞在37℃的环境下用2 μmol·L-1的Fura-2AM荧光探针染料染色约30 min。然后将细胞放置于激光共聚焦显微镜上,设定激发波长为340 nm/380 nm,发射波长为510 nm。以持续灌流的方式给予2.8 mmol·L-1葡萄糖 (2.8 G)、16.7 mmol·L-1葡萄糖 (16.7 G) 和10 μmol·L-1 DA (以16.7 G溶解),F340/F380的比值反映灌流液体对细胞内钙离子浓度的影响。该实验在30℃环境中进行。
1.4.5 统计学处理实验数据用x±s表示, 采用Sigmaplot12.0软件分析,t-text方法进行检验。膜片钳数据用Pulsefit软件分析。
2 结果 2.1 DA对大鼠胰岛素分泌的影响在2.8 mmol·L-1葡萄糖 (2.8 G) 和16.7 mmol·L-1葡萄糖 (16.7 G) 的基础上分别加入不同浓度的DA (0、1、10 mmol·L-1),孵育30 min后,检测上清液中胰岛素的含量。Tab 1结果显示,在2.8 G的条件下,DA对胰岛素的分泌没有产生明显的影响;在16.7 G的条件下,DA呈浓度依赖性抑制胰岛素的分泌 (P<0.01)。
| Glucose concentration/mmol·L-1 | Dopamine/μmol·L-1 | ||
| 0 | 1 | 10 | |
| 2.8G | 12.498±3.056 | 14.184±2.548 | 9.042±1.181 |
| 16.7 G | 158.588±9.721## | 91.154±5.528* | 45.930±6.706** |
| ##P<0.01 vs 2.8 G (DA 0 μmol·L-1); *P<0.05, **P<0.01 vs 16.7 G (DA 0 μmol·L-1) | |||
通过电压钳技术,在-70 mV的钳制电压下给予-50 mV~30 mV的电压刺激50 ms,每次递增10 mV检测胰岛β细胞上钙电流。与对照组相比,DA (10 μmol·L-1) 明显地抑制了钙电流[0 mV时,对照组 (-3.963±0.406) pA/pF, DA组 (-2.344±0.429) pA/pF, P<0.01]。见Fig 1。
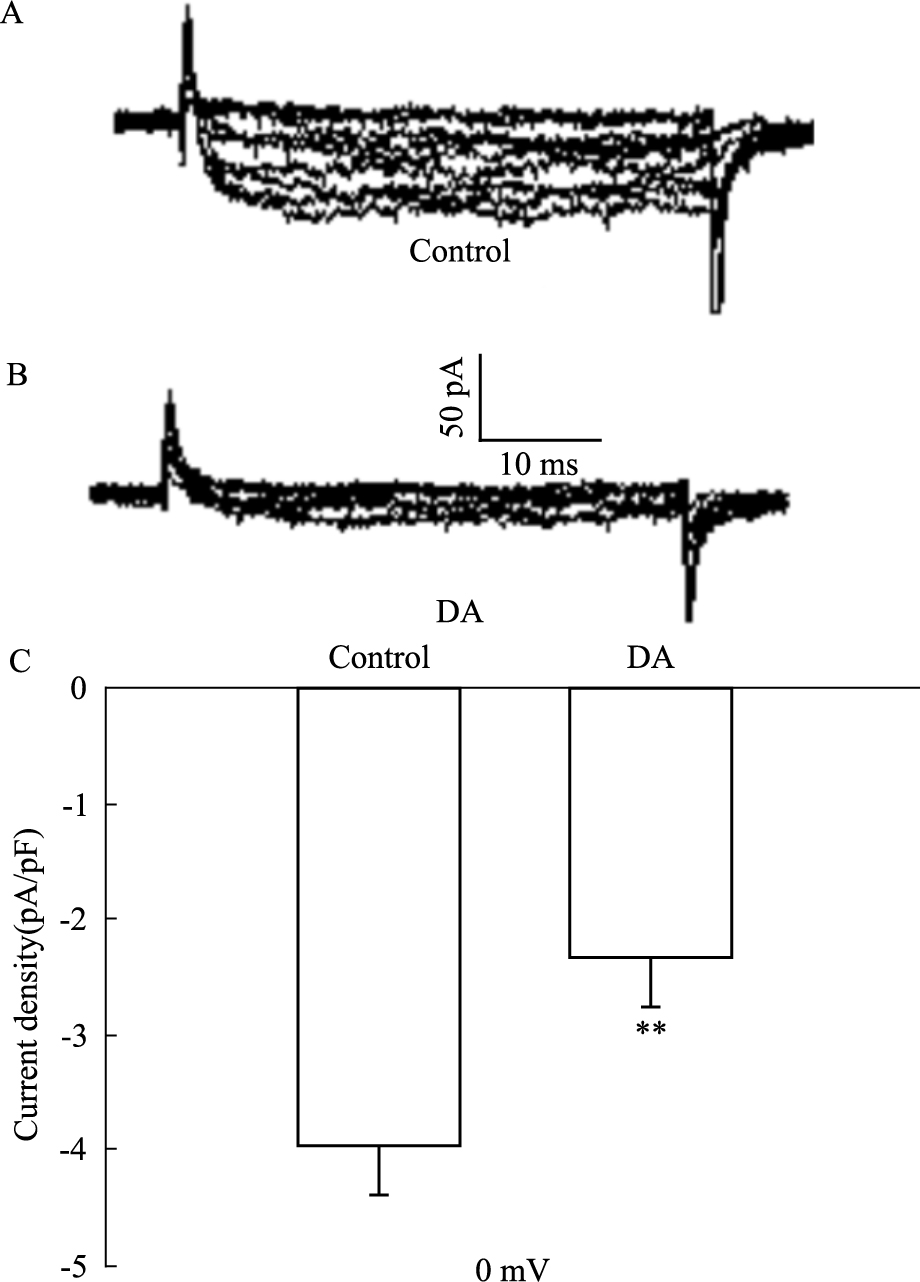
|
| Fig 1 Effect of DA on voltage-gated calcium channels A, B: Representative current traces recorded under the different treatment as indicated; C: Summary of the mean current density of Ca2+ currents at 0 mV (n=6).**P < 0.01 vs control |
通过电流钳技术,给予细胞150 pA、4 ms的电流注入,检测给药前后动作电位时程的变化。与对照组相比,DA (10 μmol·L-1) 明显地缩短了动作电位的时程 (P<0.01)。见Tab 2。
| Group | Action potential duration/ms |
| Control | 59.578±4.493 |
| Treatment with DA | 32.968±3.166** |
| **P<0.01 vs control | |
细胞在37℃的环境下使用2 μmol·L-1的Fura-2AM孵育约30 min,然后放置于340 nm/380 nm激发波长,510 nm发射波长下,测得DA对细胞内Ca2+浓度的影响。Fig 2结果显示,DA使细胞内Ca2+浓度减少。以灌流初始值 (F0) 标化后结果如下:2.8 G (0.036±0.001),8.3 G (0.631±0.033),DA (0.482±0.034)。
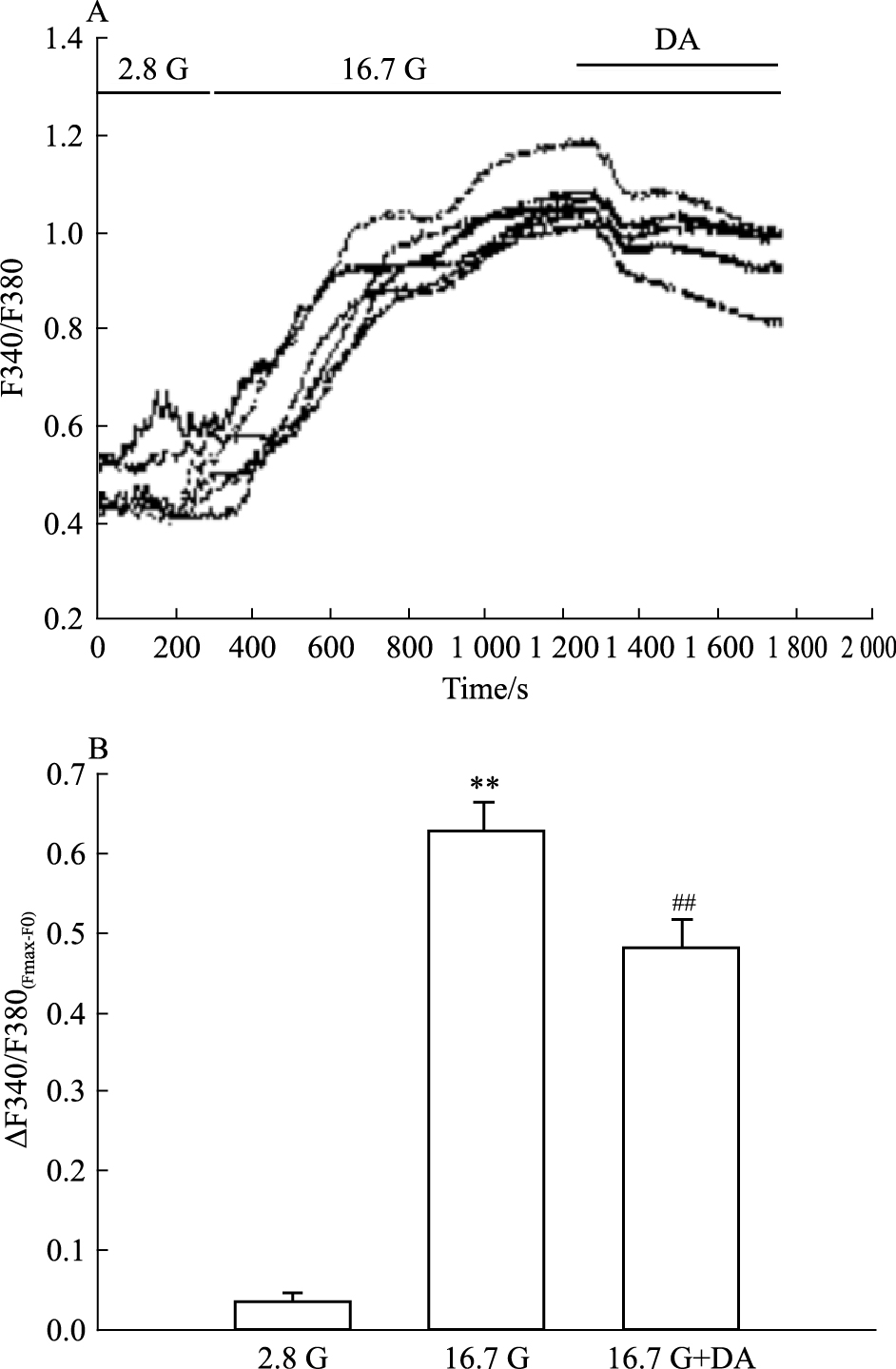
|
| Fig 2 Effect of DA on level of intracellular Ca2+ concentration A: The trace shows the changes of intracellular Ca2+ concentration in a representative cell perfused with 2.8, 16.7 and 16.7 G+DA (10 μmol·L-1); B:The mean value of ΔF340/F380(Fmax-F0) in response to different treatments as indicated (n=6).##P<0.01 vs 16.7G; **P<0.01 vs 2.8G. The change of intracellular calcium[ΔF340/F380(Fmax-F0)] was determined by subtracting the initial F340/F380 ratio from the maximum F340/F380 for each treatment |
在生理条件下,葡萄糖是影响胰岛素释放最主要的因素。葡萄糖通过主动转运的方式进入细胞内部后,经过糖酵解和氧化磷酸化生成ATP,ATP使细胞膜上的ATP敏感性钾通道 (KATP) 关闭,细胞膜去极化,达到一定程度后,电压依赖性钙通道开放,外钙内流,细胞内钙离子浓度升高,使成熟的分泌囊泡附着于微管微丝上,并通过两者的相互作用促进囊泡膜与细胞膜融合,最终诱导胰岛素的释放[7-8]。除此之外,外周的多种配体也发挥着重要的调节作用,如血管活性肠肽 (VIP)、胰高血糖素样肽 (GLP-1)、乙酰胆碱 (Ach) 等。有数据显示,多巴胺作为一个生理因子可以与β细胞上的多巴胺受体结合调节细胞的分泌活动[2, 7, 9],外周多巴胺的异常会影响胰岛素的正常调节。帕金森患者在治疗过程中,通常使用左旋多巴和苄丝肼以提高中枢神经系统中多巴胺的浓度,并阻止外周左旋多巴转换为多巴胺给机体带来负面影响[10],但在这一过程中仍然会有部分的多巴胺进入到外周[2],抑制葡萄糖刺激胰岛素的分泌活动,给胰岛功能造成慢性的压力,使得帕金森患者中糖耐量异常现象较为普遍[3, 10]。因此,了解外周配体,尤其是多巴胺对于调节胰岛素释放的机制变得越来越重要。现今的文献报道中,关于多巴胺对胰岛素分泌的影响存在着争议,有部分学者认为多巴胺及其类似物可以抑制葡萄糖刺激胰岛素分泌,而少部分认为急性多巴胺的大量累积可以促进胰岛素的分泌[9]。在本实验中,我们发现DA在16.7 G的基础上明显地抑制了胰岛素的分泌,而在2.8 G的基础上对胰岛素的分泌活动影响较小。电压-电流曲线关系表明,DA抑制了电压门控性钙通道的开放,减小了钙电流。通过给予150 pA、4 ms的电流注入,观察细胞动作电位时程的变化,结果表明,DA通过抑制钙电流,加快动作电位的复极化,明显缩短了动作电位的时程。DA干预后,细胞内钙离子浓度降低,这可能与电压门控性钙通道被抑制有关。
我们推测,DA可能是通过抑制了钙通道影响了胰岛素的分泌。由于β细胞的动作电位主要是由Ca2+通道和K+通道来产生的,是动作电位去极化和复极化的主要离子通道,而动作电位又可以直接调节胰岛素的分泌活动。本次实验证实了DA抑制了电压门控性Ca2+通道,使得动作电位去极化幅度降低,复极增快,动作电位时程缩短,细胞的兴奋性下降;同时也使细胞内Ca2+浓度下降,分泌囊泡与细胞膜融合缺乏动力,影响了囊泡的胞吐活动,最终抑制了胰岛素的分泌活动。但关于K+通道是否也参与其中仍待进一步的研究。
( 致谢: 本文实验在山西医科大学药理教研室章毅实验室完成,在此对实验人员表示感谢。 )
| [1] | Tritsch N X, Sabatini B L. Dopaminergic modulation of synaptic transmission in cortex and striatum[J]. Neuron, 2012, 76(1): 33-50. doi:10.1016/j.neuron.2012.09.023 |
| [2] | Ustione A, Piston D W, Harris P E. Minireview: dopaminergic regulation of insulin secretion from the pancreatic islet[J]. Mol Endocrinol, 2013, 27(8): 1198-207. doi:10.1210/me.2013-1083 |
| [3] | Sandyk R. The relationship between diabetes mellitus and Parkinson's disease[J]. Int J Neurosci, 1993, 69(1-4): 125-30. doi:10.3109/00207459309003322 |
| [4] | Lopez Vicchi F, Luque G M, Brie B, et al. Dopaminergic drugs in type 2 diabetes and glucose homeostasis[J]. Pharmacol Res, 2016, 109: 74-80. doi:10.1016/j.phrs.2015.12.029 |
| [5] | 章毅, 刘云峰, 高璟英, 等. 染料木黄酮对大鼠胰岛素分泌的调控作用[J]. 中国药理学通报, 2015, 31(5): 737-8. Zhang Y, Liu Y F, Gao J Y, et al. Regulatory effects of genistein on insulin secretion from rat pancreatic cells[J]. Chin Pharmacol Bull, 2015, 31(5): 737-8. |
| [6] | Collier J J, White S M, Dick G M, et al. Phosphatidylinositol 3-kinase inhibitors reveal a unique mechanism of enhancing insulin secretion in 832/13 rat insulinoma cells[J]. Biochem Biophys Res Commun, 2004, 324(3): 1018-23. doi:10.1016/j.bbrc.2004.09.149 |
| [7] | Rubi B, Ljubicic S, Pournourmohammadi S, et al. Dopamine D2-like receptors are expressed in pancreatic beta cells and mediate inhibition of insulin secretion[J]. J Biol Chem, 2005, 280(44): 36824-32. doi:10.1074/jbc.M505560200 |
| [8] | 赵艳丽, 丁亚琴, 王慧, 等. 1-磷酸鞘氨醇促进胰岛素分泌及可能机制研究[J]. 中国药理学通报, 2016, 32(11): 1516-20. Zhao Y L, Ding Y Q, Wang H, et al. Effects and possible mechanism of sphingosine-1-phosphate-stimulated insulin secretion from rat islets[J]. Chin Pharmacol Bull, 2016, 32(11): 1516-20. doi:10.3969/j.issn.1001-1978.2016.11.008 |
| [9] | Garcia Barrado M J, Iglesias Osma M C, Blanco E J, et al. Dopamine modulates insulin release and is involved in the survival of rat pancreatic beta cells[J]. PLoS One, 2015, 10(4): e0123197. doi:10.1371/journal.pone.0123197 |
| [10] | Ustione A, Piston D W. Dopamine synthesis and D3 receptor activation in pancreatic beta-cells regulates insulin secretion and intracellular [Ca2+] oscillations[J]. Mol Endocrinol, 2012, 26(11): 1928-40. doi:10.1210/me.2012-1226 |

