


2. 南京军区总医院麻醉科, 江苏 南京 210002
 ,
ZHANG Jie2,
GUO Wei-bing1,2,
CHEN Chun-long2,
LI Wen-jun1,2,
LIU Qing-zhen2,
LIU Jian2,
LI Wei-yan2
,
ZHANG Jie2,
GUO Wei-bing1,2,
CHEN Chun-long2,
LI Wen-jun1,2,
LIU Qing-zhen2,
LIU Jian2,
LI Wei-yan2

2. Dept of Anesthesiology, Jinling Hospital, Nanjing 210002, China
慢性病理性疼痛已经成为近代困扰人类健康和生命质量的一个重要的问题,其主要表现为痛觉过敏及痛觉超敏,其产生机制主要包括神经源性炎症反应、外周及中枢敏化、神经元可塑性改变等等,目前应用传统药物难以有效控制[1]。很多研究都显示脊髓中胶质细胞的大量激活参与了慢性病理性疼痛的发生和发展,活化的胶质细胞可以释放多种神经传导物质和细胞外信号分子以影响神经元细胞,引起神经元的异常放电,导致病理学疼痛[2, 12]。Verge等[3]发现脊髓中神经元细胞可以表达趋化因子CX3CL1,并且其在神经元和胶质细胞之间的信号传导起到了重要的作用[4]。以上皆是对于脊髓中胶质细胞对于慢性疼痛的影响的研究,而对不同脑区胶质细胞的作用知之甚少。本实验重点研究前扣带回皮层 (anterior cingulate cortex,ACC) 中胶质细胞和CX3CL1对于慢性病理学疼痛的影响。
1 材料与方法 1.1 实验动物与分组清洁级成年♂SD大鼠,体质量180~220 g,由南京军区南京总医院比较医学实验科提供。实验所执行的操作均符合国际疼痛研究会的准则,并且经动物伦理委员会许可。将大鼠随机分为4组:假手术组 (sham组)、疼痛模型组 (CCI-ION组)、PBS治疗对照组 (PBS组)、CX3CL1中和抗体治疗组 (anti-CX3CL1组),每组20只。
1.2 眶下神经结扎模型 (unilateral infraorbital nerve,CCI-ION)大鼠腹腔注射2%的戊巴比妥钠50 mg·kg-1。将麻醉后大鼠仰卧并固定其头部与四肢,沿其左侧第一磨牙牙龈边缘纵向切开约1 cm的切口,分离暴露眶下神经及周围组织,约1.5 mm粗细。从近端仔细分离眶下神经至远端的眶下孔,使用两根3.0的铬肠线疏松结扎眶下神经,要求视力下眶下神经直径略微变细,但尚不阻断神经外膜血液循环。2个结扎点相距2 mm。术后使用5.0缝合线缝合伤口。假手术组仅暴露眶下神经,不结扎,术后同样缝合伤口。
1.3 前扣带回皮层单次给药大鼠腹腔注射2%的戊巴比妥钠50 mg·kg-1,麻醉后将其固定于立体定向仪上,齿杆前上缘低于耳杆中心3.3 mm,将颅顶皮肤剃毛消毒。切开颅顶筋膜,暴露Bregma点,左侧前扣带回皮层进针点位于Bregma点前2.6 mm,向左旁开0.6 mm,进针深度为1.6 mm。使用5 μL的微量注射器给药,10 min缓慢将药剂注入ACC,并且于给药完毕5 min后退针。给药后,使用酒精消毒伤口,石蜡封闭伤口,最后缝合伤口处皮肤。
1.4 给药方案anti-CX3CL1组于CCI-ION术后d 5使用5 μL微量注射器于前扣带回皮层单次给予CX3CL1中和抗体 (50 mmol; R & D Systems)。CX3CL1中和抗体是一种单克隆抗体,它可以特异性地与ACC区中CX3CL1相结合,减少CX3CL1与小胶质细胞的接触,进而减弱CX3CL1对小胶质细胞的作用。中和抗体未使用时被保存于-80 ℃冰箱中,使用时,将抗体溶于0.9%的无菌生理盐水,通过实验给药剂量测试,发现每只大鼠给予0.1 pmol的中和抗体,即可产生理想的抑制作用,所以每只大鼠使用0.1 pmol的中和抗体单次给药。PBS组给予相同剂量的PBS溶液作为对照。本实验给药剂量参考文献[5]。
1.5 行为学测定Sham组与CCI-ION组分别于CCI-ION术后1、3、5、7、14 d,固定于早9 :00,将大鼠放置于安静室内,静置30 min,待其安静后,选择不同折力 (2.0、4.0、6.0、8.0、15、26、60 g) Von Fery纤维丝 (Stoleing公司,美国) 分别对大鼠左侧眶下V2区 (即触须部皮肤及其周边长毛的部位) 进行刺激,每次刺激持续3~5 s,若其出现:① 快速的后退动作,倦缩身子向笼壁靠拢,或将头面部藏于身下,躲避刺激物;② 攻击行为:快速抓咬刺激物; ③ 非对称性的面部搔抓:至少连续3次搔抓面部刺激区域的动作,通常合并后退动作。出现以上3种行为中的1种,即可视为阳性反应。anti-CX3CL1组及PBS组分别于给药后6 h使用Von Fery测痛仪测定术后大鼠左侧V2区痛阈,方法同上。
1.6 标本采集Sham组与CCI-ION组大鼠于1、3、5、7、14 d行为学测试完后,腹腔注射2%的戊巴比妥钠80 mg·kg-1处死,取大鼠ACC区组织。用于Western blot检测的标本用300~400 mL生理盐水快速冲洗血液,之后取出前扣带回皮层脑组织快速放入液氮中保存;用于免疫荧光检测的标本则再用400~500 mL的4%多聚甲醛先快后慢地灌注,取出ACC区脑组织,将其放入4%的多聚甲醛中后固定3 h,随后转入30%蔗糖中脱水2 d。anti-CX3CL1组及PBS组分别于给药6 h后行为学测试,测试完以后处死,取ACC区脑组织。用于Western blot检测的标本和用于免疫荧光检测的标本处理方法同上。
1.7 Western blot用含蛋白酶抑制剂、磷酸酶抑制剂和PMSF的RIPA裂解液将前扣带回皮层组织进行匀浆。蛋白定量煮样后,配制SDS-PAGE凝胶,每孔上样量50 μg (10 μL),电泳,转膜,用质量分数为5%的脱脂牛奶室温封闭1 h,加一抗:兔抗大鼠CX3XL1(1 :1 000,Abcam)、兔抗大鼠CD11b (1 :800,Abcam) 或者兔抗大鼠IL-1β(1 :400, R & D),4℃孵育过夜。d 2,TBST洗5 min×6次,羊抗兔二抗 (1 :1 000,Cell Signaling Technology) 室温孵育1 h,TBST洗5 min×6次,暗室内加显色底物,显色曝光,扫描。内参为β-actin (1 :1 000,Cell Signaling Technology)。扫描之后蛋白条带用Image J软件分析,以目的条带灰度值与内参蛋白的比值反映目的蛋白表达的相对水平,进行半定量分析。
1.8 统计学分析采用SPSS16.0软件进行统计学分析,计量资料以x±s表示;行为学测试结果采用重复测量方差分析;组间比较采用单因素方差分析;两两比较采用LSD法。
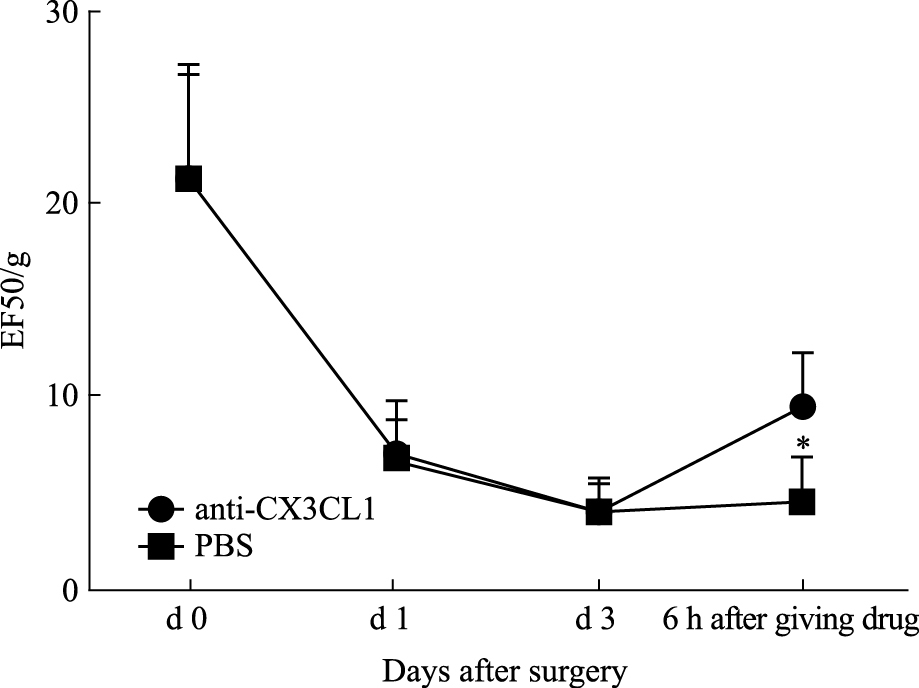
2 结果 2.1 大鼠行为学变化5组大鼠术前行为学差异无统计学意义 (P>0.05)。CCI-ION组大鼠与sham组比较,d 1两组大鼠痛阈都降低,但从d 3开始,可见CCI-ION组较sham组大鼠有明显痛阈降低 (P<0.05),见Fig 1;anti-CX3CL1组与PBS组相比,痛阈明显提高 (P<0.05),同时与sham组相比差异有统计学意义 (P<0.05),见Fig 2。

|
| Fig 1 Changes of EF50/g in all rats *P < 0.05 vs sham group |
|
| Fig 2 Changes of EF50/g in all rats *P < 0.05 vs PBS group |
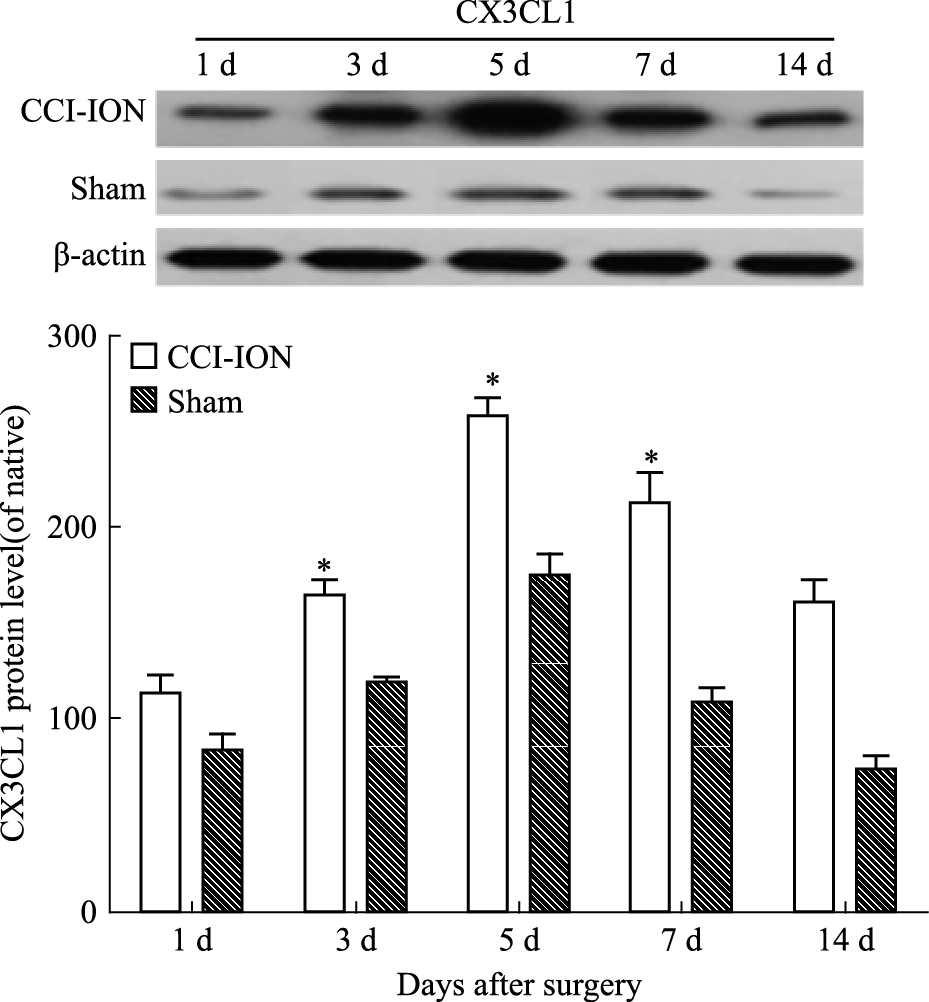
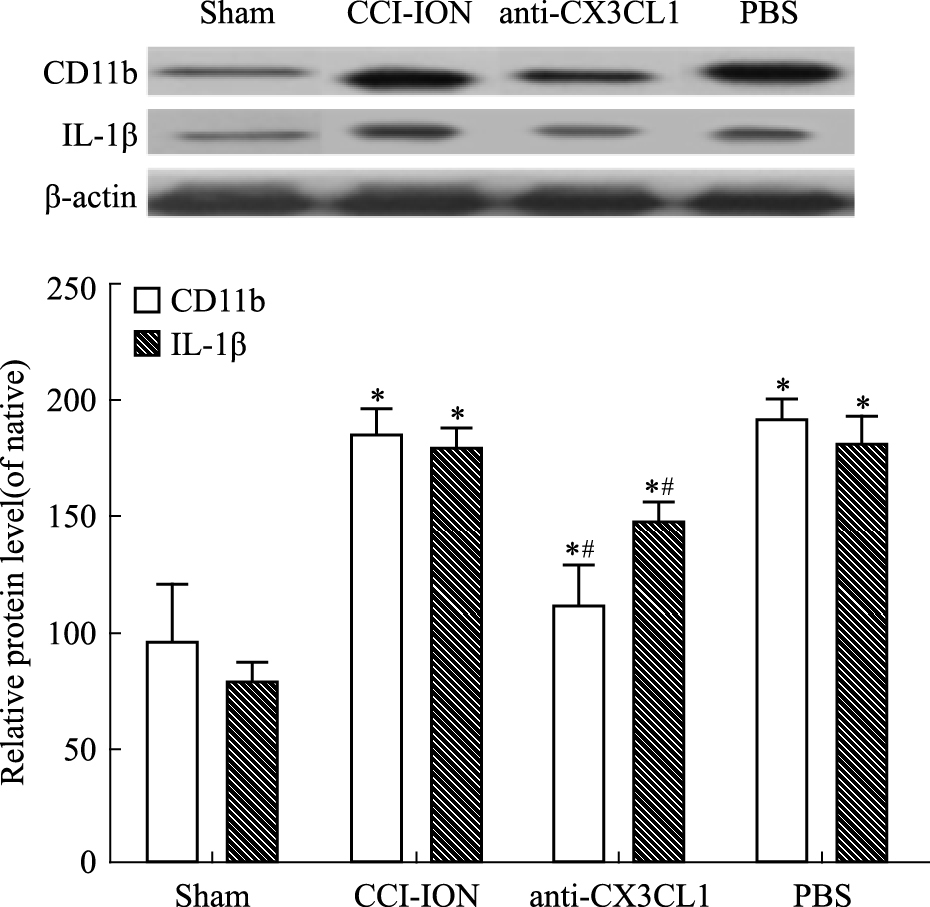
CCI-ION术后d 5,与sham组相比,ACC中趋化因子CX3CL1蛋白的含量明显提高 (P<0.05),见Fig 3;给予中和抗体以后,可见anti-CX3CL1组CD11b及IL-1β较PBS组有明显降低 (P<0.05),见Fig 4。
|
| Fig 3 Expression of CX3CL1 in ACC On the d 5, compared with sham group, the expression of CX3CL1 in the ACC of rats was significantly increased in CCI-ION group.*P < 0.05 vs sham group |
|
| Fig 4 Expression of CX3CL1 and IL-1β in ACC Compared with the sham group, the expression of CX3CL1 and IL-1β was significantly increased in CCI-ION group. Also both of them were significantly decreased in anti-CX3CL1 group after given antibody.*P < 0.05 vs sham group; #P < 0.05 vs CCI-ION group |
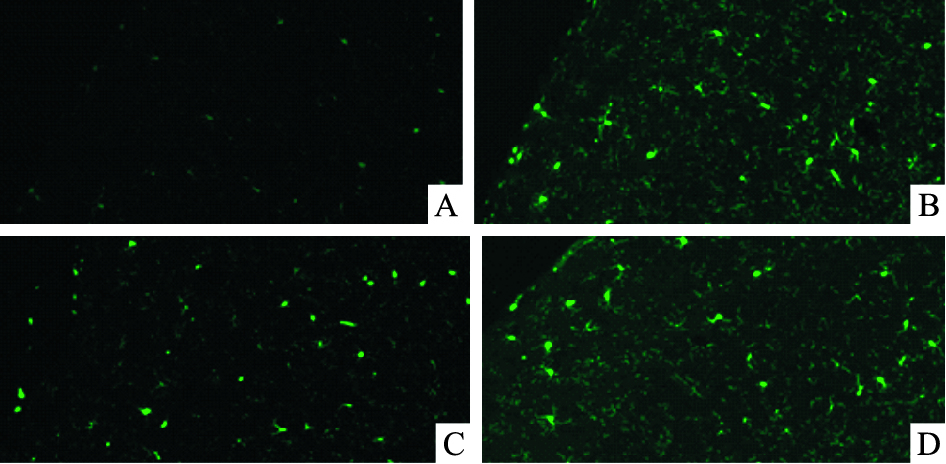
免疫荧光结果显示,sham组ACC中活化的小胶质细胞CD11b表达量较少;与sham组相比,CCI-ION组活化的小胶质细胞明显增加,CD11b表达量明显较多;给予CX3CL1中和抗体以后,anti-CX3CL1组ACC中CD11b表达量明显较PBS组减少,见Fig 5。
|
| Fig 5 The different expression of CD11b in ACC of rats A:Sham; B:CCI-ION; C:anti-CX3CL1;D:PBS.Compared with sham group, the immunoreactivity of CD11b in ACC of rats was markedly increased in CCI-ION group and PBS group, while compared with CCI-ION group, the immunoreactivity was markedly decreased in anti-CX3CL1 group |
近年来,研究发现趋化因子在胶质细胞的活化及神经病理性疼痛中发挥着重要作用。趋化因子CX3CL1是一种低分子量的蛋白,它可以刺激细胞分泌炎性介质,促进炎症反应同时还可以调控细胞的迁徙。Milior等[10]发现在慢性疼痛的大鼠模型中,脊髓背角神经细胞可以释放CX3CL1直接调节小胶质细胞的活性,促进其活化;激活的小胶质细胞可以激活p-p38 MAPK活化[13],同时可以进一步释放其他炎性因子,如IL-1β、肿瘤坏死因子α(TNF-α)、谷氨酸盐等刺激神经元细胞,导致痛觉高敏[6];而CX3CR1基因敲除大鼠的小胶质细胞释放的前炎性细胞因子蛋白量都减少,同时病理性疼痛也轻很多[7]。这些都说明在脊髓水平,慢性病理性刺激可以促使神经元细胞释放CX3CL1,激活小胶质细胞,进而导致痛觉高敏。
本实验是为了观察大鼠ACC中趋化因子CX3CL1对于神经病理性疼痛的影响。我们采用眶下神经结扎模型,相对于其他神经痛模型,本模型伤口愈合时间短,炎症反应少,同时不影响大鼠的活动能力,增加了大鼠的存活率,也减少了大鼠因造模的巨大创伤而引起的个体之间的误差,同时提高了行为学测试的准确度。
我们从以上行为学测试结果可以看出,sham组和CCI-ION组相比较,经过前2 d的急性疼痛期,从d 3开始,CCI-ION组大鼠痛阈明显降低,并且呈持续状态,直至d 5痛阈达到最低,此后慢慢恢复,但是d 14阈值仍然低于sham组。这个结果与Western blot结果相对应,Western blot显示,术后d 3,大鼠ACC中CX3CL1蛋白表达量明显增加,d 5达到高峰,随后慢慢减少。这些结果说明在ACC中,CX3CL1的增加可能参与了慢性病理性疼痛的过程。
为了明确ACC中CX3CL1和小胶质细胞活化之间的关系和它是否能够影响慢性病理性疼痛的产生和发展,本实验追加采用了2组给药组,一组给予CX3CL1中和抗体,用于拮抗CX3CL1的作用;另一组给予PBS溶液作为对照。2组溶液均在CX3CL1表达量最高的当天给予,最大程度地抑制CX3CL1的表达,给予药物后6 h进行行为学测试。结果显示,PBS组大鼠给药后痛阈与给药以前相比变化不大,而anti-CX3CL1组大鼠痛阈有较大提升,差异有统计学意义,说明CX3CL1的增多可以增加大鼠的痛觉高敏。
我们已知正常的神经细胞也可以表达CX3CL1,而它的受体CX3CR1正表达于小胶质细胞膜上[8],CX3CL1的大量表达会引起小胶质细胞的活化。Sheridan等[9]也发现CX3CL1是神经元细胞调节小胶质细胞的一个非常重要的途径,敲除CX3CR1基因后,神经细胞便不能再调控小胶质细胞的形态[10],进一步也不能影响小胶质细胞炎性介质的释放。因此,我们猜测ACC区CX3CL1参与慢性病理性疼痛的机制也与小胶质细胞相关,所以在给予中和抗体后,我们对ACC区CD11b进行免疫荧光标记,CD11b通常被认为是活化的小胶质细胞的标志[6]。免疫荧光结果显示,给予中和抗体以后,活化的小胶质细胞较给药前有明显减少;PBS组变化不大。说明在ACC区,CX3CL1增多确实会激活小胶质细胞。
上文中提到小胶质细胞可以释放大量炎性介质,其中炎性介质IL-1β的大量释放可以刺激前列腺素E2(PGE2) 的表达,增强中枢谷氨酸盐的转运和神经突触的摄取[11],这些物质都可以增加痛觉高敏。因此,我们也对给药后大鼠ACC区IL-1β的蛋白表达量进行测试。Western blot结果显示,使用中和抗体后6 h,CX3CL1蛋白表达量较之前有明显降低,同时CD11b蛋白表达量也降低,IL-1β蛋白表达量也较PBS区降低。以上实验结果都说明抑制CX3CL1蛋白的表达,可以减少小胶质细胞的活化,减少小胶质细胞释放炎性介质IL-1β,同时减弱大鼠的慢性病理性疼痛。
综上所述,疏松结扎大鼠眶下神经可以引起大鼠ACC区CX3CL1蛋白表达增加,同时促进ACC区小胶质细胞的活化,进一步释放炎性介质,从而引起神经病理性疼痛。使用拮抗剂阻断CX3CL1的表达,减弱小胶质细胞活化,有望成为临床治疗慢性病理性疼痛的新的方式。
( 致谢: 本实验在南京军区南京总医院比较医学科麻醉科实验室完成,在此衷心感谢各位老师和同学的帮助! )
| [1] | Maruo T, Nakae A, Maeda L, et al. Validity, reliability, and assessment sensitivity of the Japanese version of the short-form McGill pain questionnaire 2 in Japanese patients with neuropathic and non-neuropathic Pain[J]. Pain Med, 2014, 15(11): 1930-7. doi:10.1111/pme.12468 |
| [2] | de Jong E K, Dijkstra I M, Hensens M, et al. Vesicle-mediated transport and release of CCL21 in endangered neurons: a possible explanation for microglia activation remote from a primary lesion[J]. J Neurosci, 2005, 25(33): 7548-57. doi:10.1523/JNEUROSCI.1019-05.2005 |
| [3] | Verge G M, Milligan E D, Maier S F, et al. Fractalkine (CX3CL1) and fractalkine receptor (CX3CR1) distribution in spinal cord and dorsal root ganglia under basal and neuropathic pain conditions[J]. Eur J Neurosci, 2004, 20(5): 1150-60. doi:10.1111/ejn.2004.20.issue-5 |
| [4] | Milligan E D, Sloane E M, Watkins L R. Glia in pathological pain: a role for fractalkine[J]. J Neuroimmunol, 2008, 198(1-2): 113-20. doi:10.1016/j.jneuroim.2008.04.011 |
| [5] | Wei F, Guo W, Zou S, et al. Supraspinal glial-neuronal interactions contribute to descending pain facilitation[J]. J Neurosci, 2008, 28(42): 10482-95. doi:10.1523/JNEUROSCI.3593-08.2008 |
| [6] | Chang E Y, Chen X, Sandhu A, et al. Spinal 5-HT3 receptors facilitate behavioural hypersensitivity induced by elevated calcium channel alpha-2-delta-1 protein[J]. Eur J Pain, 2013, 17(4): 505-13. doi:10.1002/ejp.2013.17.issue-4 |
| [7] | Hinwood M, Tynan R J, Charnley J L, et al. Chronic stress induced remodeling of the prefrontal cortex: structural re-organization of microglia and the inhibitory effect of minocycline[J]. Cereb Cortex, 2013, 23(8): 1784-97. doi:10.1093/cercor/bhs151 |
| [8] | Limatola C, Ransohoff R M. Modulating neurotoxicity through CX3CL1/CX3CR1 signaling[J]. Front Cell Neurosci, 2014, 8: 229. |
| [9] | Sheridan G K, Murphy K J. Neuron-glia crosstalk in health and disease: fractalkine and CX3CR1 take centre stage[J]. Open Biol, 2013, 3(12): 130181. doi:10.1098/rsob.130181 |
| [10] | Milior G, Lecours C, Samson L, et al. Fractalkine receptor deficiency impairs microglial and neuronal responsiveness to chronic stress[J]. Brain Behav Immun, 2015, 55: 114-25. |
| [11] | Yang S, Liu Z W, Wen L, et al. Interleukin-1beta enhances NMDA receptor-mediated current but inhibits excitatory synaptic transmission[J]. Brain Res, 2005, 1034(1-2): 172-9. doi:10.1016/j.brainres.2004.11.018 |
| [12] | Belsky J, Pluess M. Beyond diathesis stress: differential susceptibility to environmental influences[J]. Psychol Bull, 2009, 135(6): 885-908. doi:10.1037/a0017376 |
| [13] | 王芬, 刘清珍, 刘健, 等. 脊髓脂质运载蛋白-2对大鼠吗啡耐受形成的影响[J]. 中国药理学通报, 2015, 31(4): 565-9. Wang F, Liu Q Z, Liu J, et al. Effect of spinal cord lipocalin-2 on development of morphine tolerance in normal rats[J]. Chin Pharmacol Bull, 2015, 31(4): 565-9. |