


 ,
CHEN Meng-jing,
WANG Ke,
GONG Xue-yuan,
GONG Heng-pei,
ZHONG Xiao-min,
CHENG Ru-bin,
HUANG Zhen
,
CHEN Meng-jing,
WANG Ke,
GONG Xue-yuan,
GONG Heng-pei,
ZHONG Xiao-min,
CHENG Ru-bin,
HUANG Zhen

脑缺血 (cerebral ischemia) 是指脑内血液供应障碍导致大脑区域性的缺血缺氧[1]。据WHO数据显示,2012年全球因卒中死亡总人数约670万;据2015年10月25日中国卒中协会发布的中国卒中流行报告显示,目前我国每年死于脑卒中的患者约130万,新发卒中患者270万,脑卒中已成为我国居民死亡的首要原因。目前,线粒体介导的凋亡通路在脑缺血的研究中日益受到重视,本课题组前期研究中发现玄参中的主要活性成分哈巴苷可通过增加线粒体内SOD和Ca2+-Mg2+-ATPase的活性、下调缺血区capase-3阳性细胞的表达从而发挥一定的抗脑缺血作用[2-3]。本研究通过建立急性脑缺血模型 (middle cerebral artery occlusion,MCAO),旨在探讨哈巴苷对急性脑缺血的保护作用及其对线粒体介导的caspase依赖性细胞凋亡信号通路的影响,为临床应用哈巴苷治疗急性脑缺血疾病提供实验依据。
1 材料 1.1 实验动物ICR小鼠,SPF级,♂,体质量23~25 g,由浙江中医药大学实验动物中心提供,动物许可证号:SCXK (沪):2013-2016。饲养环境温度22~25 ℃,相对湿度45%~70%,昼夜周期12 h/12 h,喂以普通饲料,自由饮水。
1.2 药物及试剂哈巴苷 (批号:15030621,上海同田生物技术股份有限公司);依达拉奉 (批号:86-141106,南京先声东元制药有限公司);氯化三苯基四氮唑 (TTC)(批号:2191C072,美国Amresco公司);线粒体蛋白提取试剂盒 (批号:20151228,凯基生物技术股份有限公司);BCA蛋白定量检测试剂盒 (批号:10121,北京康为生物科技有限公司);5×蛋白上样缓冲液 (批号:LMYG 15502,杭州诺森德生物技术有限公司);预染蛋白Marker (批号:00135995,美国赛默飞世尔科技有限公司);Cyt C兔抗人单克隆抗体,caspase-3兔抗人单克隆抗体稀释液,兔抗GADPH抗体 (批号:4272S-0006,9662S-0017,5174P-0004,美国CST公司);β-actin单克隆抗体 (批号:3700S-10,美国Abcam公司);山羊抗兔荧光二抗,山羊抗鼠荧光二抗 (批号:C50113-05,C50331-05,美国LI-COR公司)。
1.3 仪器HM560型冷冻切片机 (美国赛默飞世尔科技有限公司);Nikon SMZ745正置生物显微镜 (日本尼康公司);Centrifuge 5804R高速冷冻离心机 (德国Eppendorf公司);Power Wave X340型酶标仪 (美国BioTek仪器有限公司);VE180微型垂直电泳槽,VE186转移电泳槽,EPS600电泳仪 (上海天能科技有限公司);0.22 μm PVDF膜 (批号:PR03259,美国Millipore公司);Odyssey荧光扫描成像系统 (美国LI-COR公司)。
2 方法 2.1 分组、造模及给药实验前小鼠禁食不禁水12 h,按体质量随机分为6组:假手术组、模型组、依达拉奉3.2 mg·kg-1组及哈巴苷4、8、12 mg·kg-1组。4%水合氯醛麻醉[(0.1 ml·(10 g)-1,腹腔注射],参考改进的Zea Longa法[4]建立小鼠MCAO模型。各组小鼠造模后立即经尾静脉注射给予相应药物[0.1 ml·(10 g)-1],假手术组及模型组同法给予等量生理盐水。
2.2 神经功能评分参照Bederson[5-6]确立的5级评分法,造模6 h后,对小鼠的神经功能进行评分。评分在1~3级者定为造模成功小鼠,0级和4级者弃去。
2.3 脑梗死体积测定造模6 h后,迅速断头取脑,去掉嗅球、小脑及低位脑干,脑组织于-20 ℃迅速冷冻15 min后行冠状切面,利用小鼠脑切片模具切片 (2 mm/片,共5片)。将切片置于5 mL含有2% TTC的磷酸缓冲溶液中,37 ℃避光温孵15 min,染色期间翻面。染色后4%多聚甲醛避光固定,立即用数码相机拍照,采用Image J 1.48U系统对图片进行分析,计算脑梗死体积。
2.4 脑组织病理形态学观察造模6 h后,迅速断头取脑,小鼠经心脏灌流生理盐水继以4%多聚甲醛后取脑,4%多聚甲醛4 ℃固定12 h后,置20%蔗糖溶液脱水,标本沉底后转移到30%蔗糖溶液中,标本脱水后行冰冻切片机切片,片厚8 μm,行常规苏木精-伊红染色,中性树胶封片,光镜下观察脑组织病理形态学变化。每张切片随机选择3个400倍镜视野对形态完整的大脑皮层神经细胞的数量进行分析。
2.5 Western blot法检测线粒体中Cyt C及胞质中pro-caspase-3的蛋白表达造模6 h后,各组小鼠脱颈处死,立即于冰上取大脑,仔细分离左侧大脑皮层及海马组织,按线粒体蛋白提取试剂盒说明书分别制备线粒体蛋白提取液及胞质蛋白提取液。按BCA蛋白定量试剂盒说明书定量蛋白并以PBS调整蛋白浓度一致,加入5×上样缓冲液 (蛋白液:5×上样缓冲液=4:1) 后100 ℃变性10 min,室温冷却后,4 ℃保存,备用。每泳道以30 μg蛋白上样,Cyt C及pro-caspase-3分别经12%及10% SDS-聚丙烯酰胺凝胶电泳 (Cyt C以GAPDH为内参照,pro-caspase-3以β-actin为内参照),待目的蛋白电泳至距胶上侧2/3位置时停止电泳。100 V、转膜时间110 min,将蛋白从SDS-聚丙烯酰胺凝胶转至0.22 μm PVDF膜上。5%BSA封闭2 h后,TBST缓冲液漂洗膜3次,5 min/次。分别加入Cyt C兔抗人单克隆抗体稀释液 (1:1000)、caspase-3兔抗人单克隆抗体稀释液 (1:1000),4 ℃过夜。回收一抗后,TBST缓冲液漂洗PVDF膜3次,5 min/次;加入兔二抗,于摇床上室温孵育2 h后,TBST缓冲液漂洗膜3次,5 min/次,应用Odyssey荧光扫描成像系统对蛋白结果进行分析。以目的蛋白的灰度值与对应的内参蛋白GAPDH或β-actin的灰度值的比值作为该样品中目的蛋白的相对表达量。
2.6 数据处理实验数据均以x±s表示,采用SPSS 18.0统计软件进行数据分析。组间均值采用单因素方差分析 (One-way ANOVA),使用LSD法进行组间的多重比较。
3 结果 3.1 哈巴苷对MCAO小鼠神经功能评分的影响与假手术组相比,模型组小鼠神经功能评分为1~3级,表明造模成功;与模型组相比,哈巴苷4、8 mg·kg-1剂量组小鼠神经功能评分明显降低 (P < 0.05,P < 0.01) (Fig 1)。
3.2 哈巴苷对MCAO小鼠脑梗死体积的影响与假手术组相比,模型组小鼠脑梗死体积呈明显升高 (P < 0.01),表明造模成功。与模型组相比,哈巴苷各剂量组小鼠脑梗死体积均呈明显降低 (P < 0.05,P < 0.01) (Fig 1,Tab 1)。
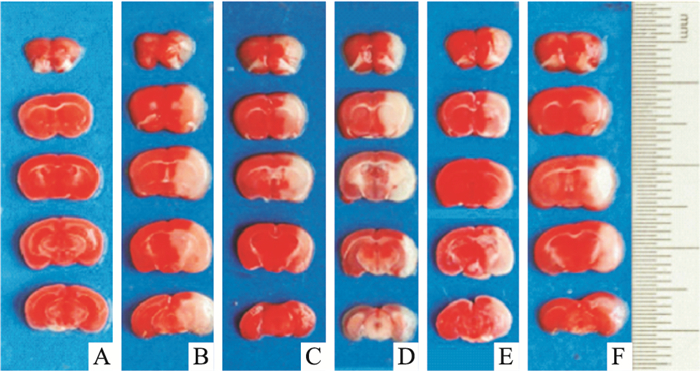
|
| Fig 1 Effect of harpagide on volume of cerebral ischemia in MCAO mice A: Contol; B: Model; C: Edaravone 3.2 mg·kg-1; D: Harpagide 4 mg·kg-1; E: Harpagide 8 mg·kg-1; F: Harpagide 12 mg·kg-1 |
| Group | Dose/mg·kg-1 | Neurological severity scores/scores | Volume of cerebral ischemia/% | Number of nerve cell/times |
| Control | - | 0 | 0 | 77.4±6.67 |
| Model | - | 2.75±0.40** | 30.19±6.08** | 53.1±7.13** |
| Edaravone | 3.2 | 2.05±0.47## | 20.4±3.75## | 65.6±5.68## |
| Harpagide | 4 | 2.20±0.46# | 21.96±4.36# | 63.6±5.12## |
| 8 | 2.15±0.45## | 19.13±6.45## | 64.2±5.93## | |
| 12 | 2.45±0.61 | 21.07±2.25## | 61.6±7.20# | |
| **P < 0.01 vs control;#P < 0.05,##P < 0.01 vs model. | ||||
假手术组脑组织神经元及神经胶质细胞结构正常,核仁明显可见,未见神经细胞变性坏死及炎细胞浸润等明显病理变化。模型组脑组织神经元结构模糊、构型紊乱,出现不同程度的核深染、核固缩、核体不规则。哈巴苷各剂量组与模型组相比均有不同程度的缓解恢复,其中哈巴苷8 mg·kg-1剂量组脑组织神经元核固缩、核体不规则程度与模型组相比有明显的减轻,软化灶明显减少。定量分析形态完整的大脑皮层神经细胞数量的结果显示,与假手术组相比,模型组大脑皮层神经细胞数明显减少 (P < 0.01)。与模型组相比,哈巴苷各剂量组大脑皮层神经细胞数均明显增加 (P < 0.01,P < 0.05) (Fig 2,Tab 1)。
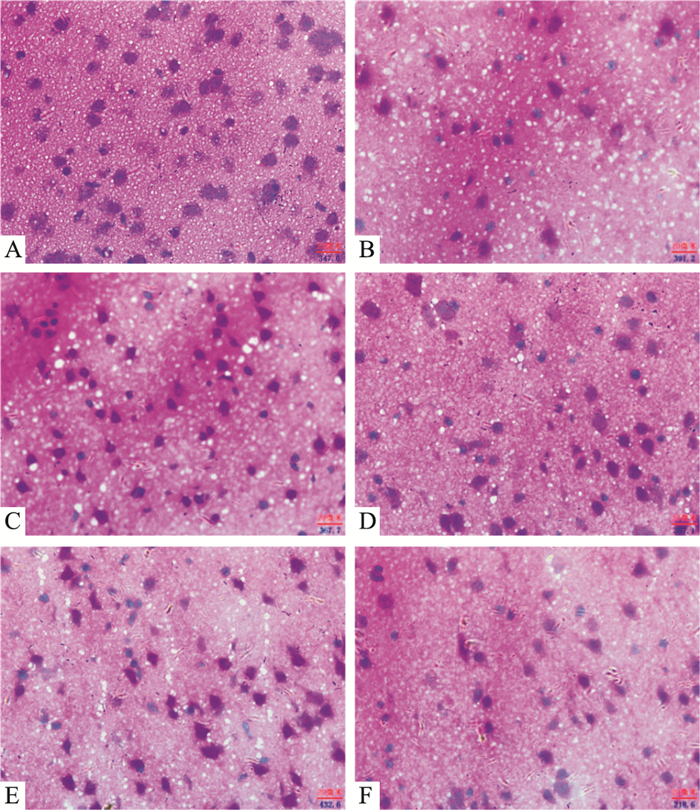
|
| Fig 2 Effect of harpagide on pathological changes of cerebral tissue in MCAO mice (HE staining, ×400) A: Control; B: Model; C: Edaravone 3.2 mg·kg-1; D: Harpagide 4 mg·kg-1; E: Harpagide 8 mg·kg-1; F: Harpagide 12 mg·kg-1 |
与假手术组相比,模型组小鼠脑组织线粒体中Cyt C及胞质中pro-caspase-3蛋白表达均呈明显下调;与模型组相比,哈巴苷8、12 mg·kg-1剂量组可明显上调脑组织中Cyt C及胞质中pro-caspase-3的蛋白表达 (P < 0.05,P < 0.01) (Fig 3,4,Tab 2)。
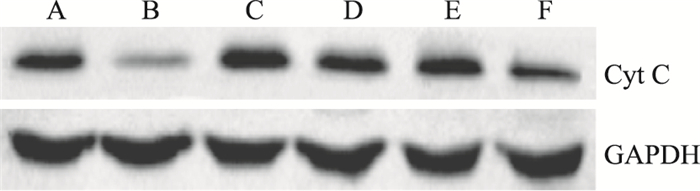
|
| Fig 3 Effects of harpagide on contents of Cyt C in mitochondrion A: Control; B: Model; C: Edaravone 3.2 mg·kg-1; D: Harpagide 4 mg·kg-1; E: Harpagide 8 mg·kg-1; F: Harpagide 12 mg·kg-1 |
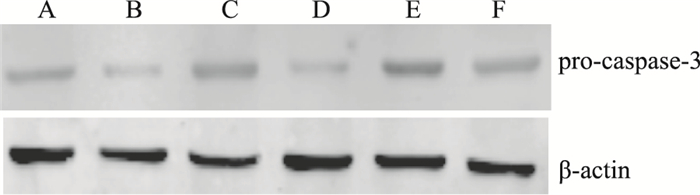
|
| Fig 4 Effects of harpagide on contents of pro-caspase-3 in endochylema A: Control; B: Model; C: Edaravone 3.2 mg·kg-1; D: Harpagide 4 mg·kg-1; E: Harpagide 8 mg·kg-1; F: Harpagide 12 mg·kg-1 |
| Group | Dose/mg·kg-1 | Cyt C/GAPDH | pro-caspase-3/β-actin |
| Control | - | 1.058±0.133 | 0.35±0.021 |
| Model | - | 0.723±0.087** | 0.256±0.046** |
| Edaravone | 3.2 | 0.955±0.043## | 0.337±0.023## |
| Harpagide | 4 | 0.815±0.038 | 0.291±0.035 |
| 8 | 0.947±0.124## | 0.319±0.024## | |
| 12 | 0.906±0.139# | 0.303±0.017# | |
| **P < 0.01 vs control;#P < 0.05,##P < 0.01 vs model. | |||
缺血性脑血管疾病占脑血管疾病的80%~85%,其发病率高、致残率高,严重影响到中老年人的身体健康与生活质量。大脑中动脉是人类卒中的多发部位,因此MCAO模型已成为研究脑缺血模型发病机理和治疗药物的主要模型之一[7]。本文通过建立MCAO模型研究哈巴苷对急性脑缺血的影响,结果表明,哈巴苷可明显降低MCAO小鼠神经功能评分及脑梗死体积;各剂量组能不同程度减轻MCAO小鼠大脑神经细胞的损伤,进而发挥一定的抗脑缺血作用。
研究发现,神经细胞凋亡是脑缺血疾病造成神经系统损伤的重要机制,其通路主要包括线粒体、死亡受体通路等。基于神经细胞凋亡与脑缺血损伤关系的深入研究,抗凋亡治疗已成为治疗脑缺血疾病的重要途径[8]。细胞凋亡主要通过内源性的线粒体凋亡、外源性的死亡受体信号途径及内质网途径实现。内源性的线粒体凋亡途径又包括caspase依赖性及caspase非依赖性细胞凋亡[9-11]。线粒体介导的caspase依赖性细胞凋亡主要为线粒体功能受损,使Cyt C释放入胞质中,并与细胞凋亡激活因子1(Apaf-1) 结合,活化caspase-9前体,进而激发caspase-3,引起细胞凋亡,其中Cyt C与caspase-3在此过程中发挥了重要作用[12-13]。因此,本研究选择上游线粒体中的Cyt C及下游胞质中的pro-caspase-3作为评价神经细胞凋亡及哈巴苷抗急性脑缺血作用的指标[14-15],研究结果显示,哈巴苷能减少脑缺血小鼠脑组织线粒体Cyt C的释放,并减少胞质中pro-caspase-3的活化,改善由缺血引起的神经细胞凋亡,表明哈巴苷能通过抑制Caspase依赖性细胞凋亡,从而抑制神经细胞凋亡发挥抗脑缺血作用。
综上所述,本研究建立MCAO模型后立即iv给药治疗,符合发病特点和临床治疗原则,在一定程度上体现药物治疗效果。结果表明哈巴苷可通过减少脑缺血小鼠脑组织线粒体Cyt C的释放,抑制pro-caspase-3的活化,降低神经细胞凋亡率,通过抑制线粒体介导的Caspase依赖性细胞凋亡途径进而发挥抗脑缺血作用。
( 致谢: 本文的实验地点:浙江省杭州市浙江中医药大学药学院中药资源研究所,非常感谢钟晓明及黄真教授在实验过程中所给予的指导,以及陈梦静、王可、龚雪媛、龚恒佩、程汝滨在实验过程中所给予的帮助。 )
| [1] | 张蔺珊, 李娟娟, 吴春云. 脑缺血的损伤机制及相关信号通路的研究进展[J]. 神经解剖学杂志, 2014, 30 (6): 729-32. Zhang L S, Li J J, Wu C Y. Research progress of the injury mechanism and related signal pathways of cerebral ischemia[J]. Chin J Neuroanat, 2014, 30 (6): 729-32. |
| [2] | 应夏丽, 钟晓明, 徐慕蝶, 等. 哈巴苷对急性脑缺血小鼠神经保护作用及线粒体保护机制的研究[J]. 中国药学杂志, 2015, 50 (12): 1026-31. Ying X L, Zhong X M, Xu M D, et al. Neuro-protective effect of harpagide on acute cerebral ishcemic injury in mice and its mechanism involving mitochondia[J]. Chin Pharm J, 2015, 50 (12): 1026-31. |
| [3] | 李官泽, 徐慕蝶, 肖文喜, 等. 哈巴苷对缺氧缺糖诱导下大鼠海马神经细胞游离Ca2+浓度的影响[J]. 中药材, 2015, 38 (2): 361-5. Li G Z, Xu M D, Xiao W X, et al. Effects of harpagide on neuron intracellular free Ca2+ under the condition of OGD[J]. J Chin Med Materials, 2015, 38 (2): 361-5. |
| [4] | Longa E Z, Weistein P R, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20: 84-91. doi:10.1161/01.STR.20.1.84 |
| [5] | Bederson J B, Pitts L H, Tsuji M, et al. Rat middle cerebral artery occlusion: evaluation of the model and development of a neurologic examination[J]. Stroke, 1986, 17 (3): 472-6. doi:10.1161/01.STR.17.3.472 |
| [6] | 陈绍春, 潘伟生, 李明, 等. 神经行为学实验Narrow-Alley Test及Corner Test改良:Narrow-Alley Corner Test[J]. 中国实验动物学报, 2007, 15 (6): 406-9. Chen S C, Pan W S, Li M, et al. A Modified experimental neurological behavioral test: the narrow-alley corner test[J]. Acta Laborat Anim Sci Sin, 2007, 15 (6): 406-9. |
| [7] | 王富明, 徐虹, 孙华. 脑缺血再灌注损伤治疗的实验研究进展[J]. 医学研究杂志, 2015, 44 (2): 12-5. Wang F M, Xu H, Sun H. Research progress of cerebral ischemia reperfusion therapy[J]. J Med Res, 2015, 44 (2): 12-5. |
| [8] | 乔靖怡, 张小磊, 王灿, 等. 短暂脑缺血动物模型及特点[J]. 时珍国医国药, 2011, 22 (3): 748-50. Qiao J Y, Zhang X L, Wang C, et al. Transient cerebral ischemia animal model and its characteristics[J]. Lishizhen Med Mat Med Res, 2011, 22 (3): 748-50. |
| [9] | 宋修云, 胡金凤, 陈乃宏. 神经细胞凋亡与脑缺血疾病[J]. 中国药理学通报, 2012, 28 (3): 307-10. Song X Y, Hu J F, Chen N H. Apoptosis of nerves and cerebral ischemia[J]. Chin Pharmacol Bull, 2012, 28 (3): 307-10. |
| [10] | 李敏, 林俊. 细胞凋亡途径及其机制[J]. 国际妇产科学杂志, 2014, 41 (2): 103-7. Li M, Lin J. The pathways and mechanisms of apoptosis[J]. J Int Obstet Gynecol, 2014, 41 (2): 103-7. |
| [11] | 常青, 王晓良. 细胞色素C、线粒体与凋亡[J]. 中国药理学通报, 2003, 19 (3): 241-4. Chang Q, Wang X L. Cytochrome C, mitochondrion and apoptosis[J]. Chin Pharmacol Bull, 2003, 19 (3): 241-4. |
| [12] | Susin S A, Daugas E, Ravagnan L, et al. Two distinct pathways leading to nuclear apoptosis[J]. J Exp Med, 2000, 192 (4): 571-80. doi:10.1084/jem.192.4.571 |
| [13] | 赵丹, 贺莉芳, 刘晖, 等. 线粒体、细胞色素C、Caspase与细胞凋亡[J]. 医学动物防制, 2012, 28 (12): 1337-40. Zhao D, He L F, Liu H, et al. Mitochondrion, cytochrome C, caspase and apoptosis[J]. J Med Pest Control, 2012, 28 (12): 1337-40. |
| [14] | 崔耀梅, 程慧娴, 曾宪明, 等. 富氢液对大鼠脑缺血/在关注损伤后海马线粒体通透性转换孔及细胞凋亡的影响[J]. 中国药理学通报, 2012, 28 (6): 853-8. Cui Y M, Cheng H X, Zeng X M, et al. Effects of hydrogen-rich saline on hippocampus mitochondrial permeability transition pore and apoptosis of rats with global cerebral ischemia-reperfusion injury[J]. Chin Pharmacol Bull, 2012, 28 (6): 853-8. |
| [15] | 万晓红, 王雁, 赵国良, 等. 转导血红素氧合酶-1蛋白减轻脑缺血/再灌注沙土海马神经元的损伤[J]. 中国药理学通报, 2014, 30 (5): 628-32. Wan X H, Wang Y, Zhao G L, et al. Effect of transducted heme oxygenase-1 protein on rat brain ischemia-reperfusion injury[J]. Chin Pharmacol Bull, 2014, 30 (5): 628-32. |