


胚胎期是人类初始发育过程中最关键而敏感的时期,胎儿在母体子宫内的时间约占整个妊娠期 (从受精到分娩) 的75%。近年来,大量研究表明孕期多种不良因素 (包括体内、外环境) 均会对胎儿的生长发育造成影响,诱发机体组织结构、代谢功能等出现可逆或永久性损伤,进而可能导致出生后个体罹患某些疾病的易感性增加[1-2]。英国Barker教授在20世纪初期首次提出了胎源性疾病理论[3]:成年期的某些疾病可能起源于胚胎期,即宫内胎儿可因孕期不良环境的影响“种下”病根,并在出生后或成年时期表现出对某种疾病的易感性,即产生“印迹”效应。
世界卫生组织 (WHO) 推荐成人正常食盐摄入量为3~5 g每天。由于中国膳食特点,流行病学调查显示我国居民日常饮食中食盐的摄入量普遍偏高,北方部分地区甚至达到14~20 g每天,已属高盐摄入范畴。健康机体调节自身水、电解质平衡是有一定限度的。盐的过量摄入可能会通过影响体液中电解质浓度及血浆渗透压水平等,诱发心血管和肾脏等组织器官功能损伤,引起循环血容量扩增、血压升高等病理生理改变,最终导致机体的主要脏器及内分泌系统功能的失衡[4]。大量盐的摄入对肾脏血流动力学、肾脏功能乃至组织结构均有影响[5]。既往研究报道了孕期母体过量摄盐后,胎儿的摄 (排) Na+量、醛固酮水平均可发生相应的改变[6],且母体孕期高盐饮食出生的子代血浆肾素活性明显降低[7]。众所周知,肾脏是机体维持和调控水、电解质平衡的最重要器官之一。其中,肾脏小动脉发挥了重要的作用。肾脏血管 (包括叶间动脉和肾动脉) 的重塑,不仅对体液平衡调控有重大影响,而且与肾性高血压的发生发展密切相关。尽管现有研究已经显示孕期母体高盐饮食对胎儿体液调节的相关因子有一定影响[6],但对胎肾发育尤其是对肾脏血管功能的影响却鲜有报道。因此本实验将以此为切入点,研究孕期母体高盐饮食对子代肾脏小动脉功能的影响及相关机制,进一步探讨肾脏疾病的胎源性起源。
1 材料 1.1 动物由苏州大学实验动物中心提供的清洁级Sprague-Dawley大鼠,使用许可证号为SYXK (苏)2012-0045。♀♂大鼠性成熟后,于每晚6:00点以1 :1合笼,次日9:00~11:00收集阴道涂片,以观察到精子视为妊娠d 1,并将♂鼠与其分笼。将孕鼠随机分为实验组及对照组,每组10只。实验组在妊娠期d 1~21给予高盐鼠粮 (8% NaCl),对照组标准鼠粮 (1% NaCl) 喂养,两组均自由饮水,自然分娩。妊娠期其它时间及哺乳期两组均给予标准鼠粮和水。子代大鼠于1月龄时♀♂分笼。待实验组和对照组子代生长至成年 (18~20周时),取♂鼠用于实验。
1.2 药物与仪器KCl、Phenylephrine、Acetylcholine、IBXT、GF109203X均购自美国Sigma公司;一抗肾上腺素α1受体 (AR-α1) 购自美国Santa Cruz公司;一抗β-actin、二抗山羊抗兔IgG购自碧云天;Myograph微血管张力检测系统购自丹麦DMT公司;Axon膜片钳700B型购自美国Axon Instruments公司;UVP生物成像系统购自上海斯高勒生物科技有限公司。
2 方法 2.1 血管功能检测♂大鼠麻醉后打开腹腔取出肾脏,迅速置于4℃已预饱和的HEPES缓冲液中,显微镜下快速分离出肾脏叶间动脉 (直径100~200 μm),并立即将血管移至DMT浴槽中,读出血管最佳预张力下的长度 (IC1值,此时的血管张力等效于其在体时的状态),然后将血管牵张长度调整于此。稳定30 min后,以60 mol·L-1 KCl刺激血管收缩3次,当收缩反应稳定后,记录并计算血管的平均收缩强度。稳定于基线张力的微血管,以1 μmol·L-1的Phe预收缩达到平台后,即以10 μmol·L-1的乙酰胆碱使血管舒张,若舒张幅度>60%的1 μmol·L-1 Phe的血管收缩强度,则认为血管内皮是完整的。随后分别检测肾脏叶间动脉对Phe (0.01~100 μmol·L-1) 的反应,以及在PKC非选择性阻断剂GF109203X (1 μmol·L-1) 存在下血管对Phe (0.01~100 μmol·L-1) 的反应。
2.2 电生理实验将分离好的肾脏叶间动脉在4℃预饱和的分离液中剪碎,静置10 min,用配好的消化酶液置于37℃恒温水槽中缓慢摇晃消化25 min,取出用0℃的分离液终止消化,静置10 min,最后用吸管轻柔吹打消化的血管2~3 min,过滤悬液,显微镜下观察到长梭形的即为血管平滑肌细胞。悬液置于4℃冰箱内4~6 h可保持良好活性,可用于膜片钳实验。全细胞模式形成后,在电压钳模式下,将细胞膜钳制电压调至-70 mV,测试电压从-60 mV去极化至+60 mV,步阶10 mV,时程500 ms,刺激间隔10~15 s,记录各刺激电压下的电流。当记录到稳定电流5 min后,分别孵育IBTX (0.1 μmol·L-1)、Phe (10 μmol·L-1) 或GF109203X (1 μmol·L-1)。最终,数据导出后以电流 (I) 密度对电压 (V) 做图,即I-V曲线。
2.3 Western blot试验取大鼠肾叶间动脉液氮中研磨,与裂解液充分混匀后冰上静置15 min,4℃离心 (3 500×g)30 min,吸上清液按Bradford法计算蛋白质浓度。取70 μg总蛋白样品进行SDS-PAGE电泳,将蛋白转移至PVDF膜。5%脱脂牛奶室温封闭2 h后按抗体说明书比例加入稀释的AR-α1一抗,4℃孵育过夜,洗膜后加入按说明书比例稀释的二抗,室温孵育1~2 h后TBST充分漂洗。将ECL显色液滴在PVDF膜上,UVP生物成像系统 (上海斯高勒生物科技有限公司,上海) 曝光条带并分析灰度值。以β-actin单克隆抗体作为内参照,方法同上。目的蛋白相对表达量以目的蛋白灰度值/β-actin灰度值表示。每组标本重复检测3次,取平均值。
2.4 统计学方法所有实验数据以x±s表示,组间统计学处理采用组间t检验或双因素方差分析 (Two-way ANOVA)。所有统计学计算和绘图均由GraphPad 6统计软件处理完成。
3 结果 3.1 肾血管组织学改变与对照组相比,高盐组肾脏叶间动脉血管壁组织结构出现明显异常。表现为血管内膜欠光滑,局部内皮细胞缺失,中膜平滑肌层菲薄、排列紊乱以及外膜弹性纤维、胶原纤维等结缔组织稀疏、断裂。见Fig 1。
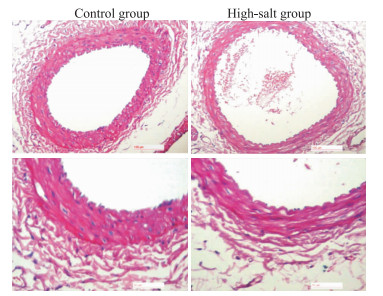
|
| Fig 1 HE staning of renal interlobar arteries Up:20×, Down:40×; Left:Control group, Right: High salt group |
Phe引起收缩量效曲线的Emax两组比较差异无统计学意义 (P>0.05),但高盐子代肾血管收缩量效曲线的EC50明显小于对照组子代 (P < 0.01)。见Fig 2。
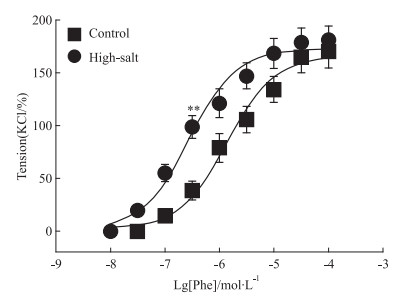
|
| Fig 2 Contraction response of renal interlobar arteries to Phe High salt group vs Control group, **P < 0.01 |
在GF109203X作用下,Phe引起的血管收缩量效曲线的EC50在两组中均有所减小,但高盐组减小的程度比对照组更明显。EC50减小的差值 (ΔEC50) 在两组间差异也有统计学意义 (P < 0.05), 见Fig 3。
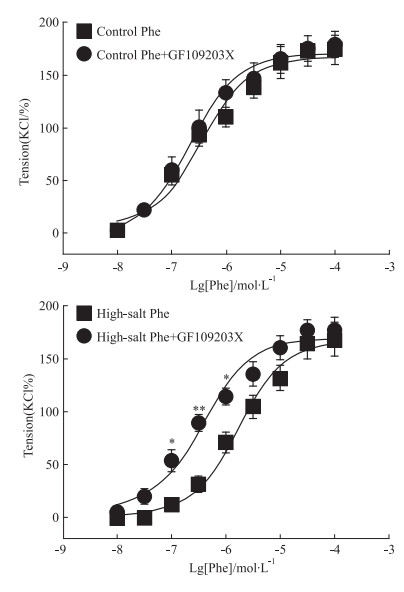
|
| Fig 3 Effect of GF109203X in contraction responseof renal interlobar arteries to Phe After vs before, *P < 0.05, **P < 0.01 |
在全细胞记录模式下,分别记录加入BK通道特异性阻断剂IBTX前后的全钾电流,可得到BK电流。在此基础上再分别记录加入Phe前后的电流,可观察到Phe对两组子代肾脏小动脉VSMC的BK电流均有抑制作用,但在高盐组中的抑制作用更为明显 (P < 0.05)。见Fig 4。
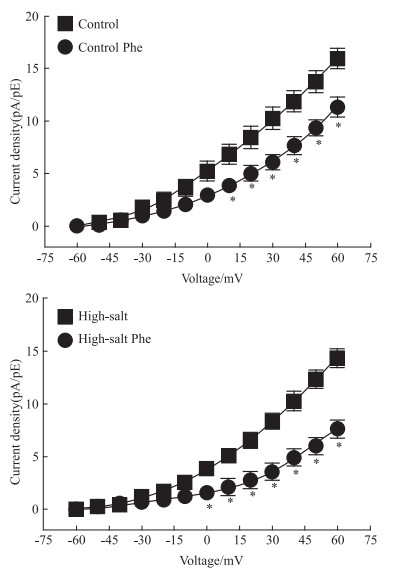
|
| Fig 4 Inhibition of Phe to BK current in VSMC After vs before, *P < 0.05 |
预先孵育了PKC抑制剂GF109203X后,用上述同样的方法分别记录加入IBTX和Phe前后的电流。Fig 5结果显示,无论在高盐组还是对照组,孵育GF109203X时得到的BK电流与再加入Phe后得到的BK电流相比,差异无统计学意义 (P>0.05)。由此结果提示,PKC抑制剂可能会影响Phe对BK电流的抑制作用。
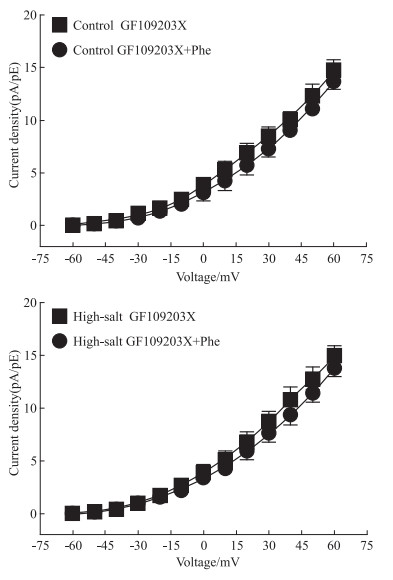
|
| Fig 5 Regulation of GF109203X ininhibition effect of Phe to BK currents |
Fig 6结果显示,高盐组与对照组肾血管AR-α1受体蛋白表达差异无统计学意义 (P>0.05)。
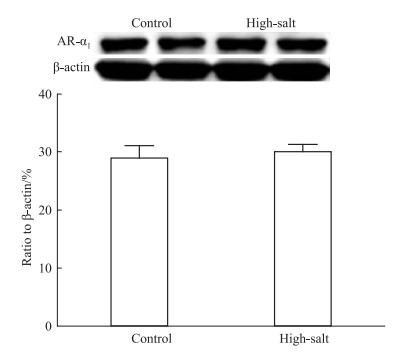
|
| Fig 6 Protein expression of AR-α1in renal interlobar arteries |
近年研究表明,出生缺陷除了与传统意义上的“遗传”有关之外,还与孕期环境的影响密切相关[2]。大量研究已证实孕期不良环境因素 (如:吸烟、缺氧、高糖饮食等) 与诸多成人慢性疾病的发生发展的相关性,即胎源性疾病的“印迹”效应[3]。本研究着眼于探讨孕期母体高盐饮食对子代肾脏小动脉发育和功能的影响及其机制。研究发现孕期母体高盐饮食会引起:①子代肾脏小动脉组织结构异常;②子代肾脏小动脉对Phe引起的血管收缩的敏感性增加,且与PKC对BK通道调节作用的改变有关。
肾脏叶间动脉作为肾脏阻力血管,在体液的调节中起重要作用。临床上常以其阻力指数作为评价肾脏血管损伤 (如肾动脉狭窄、肾血管血栓形成等) 的辅助诊断标准[8-9]。因此本文选用肾脏叶间动脉作为研究对象。在组织学研究中,高盐组子代肾血管相比对照组出现明显血管壁各层结构异常,提示其相关的血管功能可能发生一定变化。在血管功能实验中,孕期母体高盐饮食后其子代对Phe引起的收缩反应更敏感。与对照组相比,高盐组子代肾脏血管在更低浓度的Phe作用下即能发生收缩反应,但在收缩量效曲线中,Phe引起的最大收缩张力在两组并无统计学差异,这与本实验室近期研究结果相符[10]。AR-α1是Phe发挥药理作用的特异型受体,蛋白印记实验显示,两组AR-α1的蛋白表达量无明显差异。而EC50的明显改变提示AR-α1受体下游信号通路可能发生了相关变化,因此我们展开了进一步研究。
血管张力在调节血管阻力和血流量中起关键作用,而钾离子通道活性的改变能够直接影响血管张力。钾离子通道是机体内分布最广泛、具有重要生理功能的离子通道。当钾离子通道被抑制时,细胞膜发生去极化,进而促使电压依赖性钙通道开放,细胞内钙离子增加,导致血管收缩。反之,当钾离子通道被激活时,细胞膜静息电位会出现超极化并进一步导致血管舒张。此外,钾离子通道的开放还可促进VSMC动作电位的复极,起到稳定细胞膜的作用。因此,钾离子通道不但是调节VSMC静息膜电位的关键因素,且在稳定血管张力和血压的过程中也有着不可忽视的作用。大量研究表明,许多心血管疾病如高血压、动脉粥样硬化,内分泌疾病如糖尿病等的发生发展与钾通道功能的改变有着密切的联系[10-11]。目前已知的VSMC钾离子通道主要有4种:大电导钙激活性钾通道 (high-conductance Ca2+-activated K+ channel, BK通道)、电压依赖性钾通道 (voltage-dependent K+ channel, KV通道)、ATP敏感的钾通道 (ATP-sensitive K+ channel, KATP通道) 以及内向整流性钾通道 (inward rectifying K+ channel, Kir通道)。其中BK通道在VSMC上有着广泛的表达[12-13],可通过调控血管 (尤其是小动脉) 的肌源性张力,直接影响器官或组织的血流动力学。本研究结果表明Phe对BK电流有抑制作用,且抑制幅度在高盐组和对照组中差异有统计学意义。该结果提示:Phe在离体血管功能研究中引起两组不同强度的血管收缩反应可能与Phe对两组VSMC上的BK电流抑制作用不同有关。PKC是参与细胞功能调节的一类蛋白激酶,主要与平滑肌的生长和收缩有关。研究表明PKC对不同类型钾通道具有不同调节作用[14],而PKC的激活会抑制BK通道的开放。本文中,PKC通路非选择性阻断剂GF109203X在Phe介导的收缩反应中两组间作用效应不同,提示PKC可能参与了Phe对BK的调节。电生理实验的结果进一步验证了该种假设,阻断PKC通路后Phe对BK的抑制作用基本被消除。综合以上结果可以表明,Phe在高盐组与对照组子代肾脏小动脉引起的血管收缩反应的差异,是由于Phe对两组动脉平滑肌细胞上BK的不同抑制作用导致的,且这一作用与PKC通路的调节相关。
综上所述,本研究显示孕期母体高盐饮食可对其成年♂子代的肾脏小动脉的发育产生“印迹”效应,表现为肾脏小动脉组织结构异常、对血管活性物质收缩效应以及VSMC电生理行为改变等。这些结构和功能的异常变化可能会增加子代某些心、脑血管疾病和肾脏疾病的发生风险。本文的研究结果不仅进一步验证并丰富了胎源性疾病的“印迹”机理,并且为相关的发育源性血管、肾脏疾病的早期预防、治疗以及药物靶点的选取提供了重要实验信息和理论依据,同时也为围产期营养保健提供了一定的科学指导。
( 致谢: 本文实验主要在苏州大学附属第一医院胎儿医学研究所内完成,在此对实验室内各位老师、同学对本实验的指导和帮助表示衷心的感谢! )
| [1] | 胡小和, 谭谷权, 谭亮. 胚胎发育时期的环境致畸因素[J]. 中国医师杂志, 2006 (S1): 434-7. Hu X H, Tan G Q, Tan L. Teratogenic environmental factors during embryonic development[J]. J Chin Physician, 2006 (S1): 434-7. |
| [2] | Barker D J. In utero programming of cardiovascular disease[J]. Theriogenology, 2000, 53 (2): 555-74. doi:10.1016/S0093-691X(99)00258-7 |
| [3] | Barker D J. Intrauterine programming of adult disease[J]. Mol Med Today, 1995, 1 (9): 418-23. doi:10.1016/S1357-4310(95)90793-9 |
| [4] | Lai F R. Relationship between high sodium diet and hypertension and results of intervention in high sodium diet population[J]. Zhonghua Yu Fang Yi Xue Za Zhi, 1992, 26 (3): 168-70. |
| [5] | Yasuhara A, Wada J, Malakauskas S M, et al. Collectrin is involved in the development of salt-sensitive hypertension by facilitating the membrane trafficking of apical membrane proteins via interaction with soluble N-ethylmaleiamide-sensitive factor attachment protein receptor complex[J]. Circulation, 2008, 118 (21): 2146-55. doi:10.1161/CIRCULATIONAHA.108.787259 |
| [6] | Baum M. Role of the kidney in the prenatal and early postnatal programming of hypertension[J]. Am J Physiol Renal Physiol, 2010, 298 (2): 235-47. doi:10.1152/ajprenal.00288.2009 |
| [7] | Silva A A, da Noronha I L, da Oliveira I B, et al. Renin-angiotensin system function and blood pressure in adult rats after perinatal salt overload[J]. Nutr Metab Cardiovasc Dis, 2003, 13 (3): 133-9. doi:10.1016/S0939-4753(03)80172-2 |
| [8] | Li J C, Jiang Y X, Dai Q, et al. Evaluation of renal artery stenosis with velocity parameters of Doppler sonography[J]. Ultrasound Med Biol, 2006, 32 (5Suppl): 181-2. |
| [9] | Laplante S, Patriquin H B, Robitaille P, et al. Renal vein thrombosis in children: evidence of early flow recovery with Doppler US[J]. Radiology, 1993, 189 (1): 37-42. doi:10.1148/radiology.189.1.8372216 |
| [10] | Jiang L, Yin X, He A, et al. High-salt diets during pregnancy increases renal vascular reactivity due to altered soluble guanylyl cyclase-related pathways in rat offspring[J]. J Nutr Biochem, 2016, 28: 121-8. doi:10.1016/j.jnutbio.2015.10.009 |
| [11] | Jaggar J H, Porter V A, Lederer W J, et al. Calcium sparks in smooth muscle[J]. Am J Physiol Cell Physiol, 2000, 278 (2): 235-56. |
| [12] | Paternò R, Heistad D D, Faraci F M. Functional activity of Ca2+-dependent K+ channels is increased in basilar artery during chronic hypertension[J]. Am J Physiol, 1997, 272 (3 Pt 2): 1287-91. |
| [13] | 何琼, 王家宁, 干艳捷, 等. 茜草素激活Wistar大鼠肾叶间动脉平滑肌细胞大电导钙激活钾通道[J]. 中国药理学通报, 2016, 32 (9): 1264-7. He Q, Wang J, Gan Y J, et al. Alizarin activates large-conductance Ca2+-activated K-channels on renal interlobar arterial vascular smooth muscle cells in Wistar rat[J]. Chin Pharmacol Bull, 2016, 32 (9): 1264-7. |
| [14] | 杜肖娜, 何宏涛, 王川, 等. PKC对两种表达系统中内向整流性钾通道调节的不同及机制研究[J]. 中国药理学通报, 2008, 24 (12): 1615-9. Du X N, He H T, Wang C, et al. Study of the mechanism of different regulation of Kir current in two expressions systems by PKC[J]. Chin Pharmacol Bull, 2008, 24 (12): 1615-9. |

