


2. 南京中医药大学 江苏省中医药防治肿瘤协同创新中心, 江苏 南京 210023
 ,
CAO Yu-zhu1,
SHEN Pei-liang1,
ZHANG Ting-ting1,
WANG Ai-yun1,2
,
CAO Yu-zhu1,
SHEN Pei-liang1,
ZHANG Ting-ting1,
WANG Ai-yun1,2
 ,
CHEN Wen-xing1,2,
LU Yin1,2
,
CHEN Wen-xing1,2,
LU Yin1,2
2. Jiangsu Collaborative Innovation Center of Traditional ChineseMedicine (TCM) Prevention and Treatment of Tumor, Nanjing University of Chinese Medicine, Nanjing 210023, China
正常机体中血小板主要通过释放和聚集功能发挥促凝血以及促进伤口愈合的作用。而在肿瘤微环境中,大量研究揭示了血小板对于肿瘤的增殖、侵袭、血管生成等恶性生物学行为都具有促进作用[1]。但是以往对于肿瘤微环境中血小板的研究多集中于血小板聚集、黏附以及释放功能,最新的研究显示肿瘤微环境中血小板RNA水平会发生明显的改变,并且这些RNA对于肿瘤的恶性发展具有着重要的作用[2-3]。血小板作为人体内第二大血细胞,虽然是一种无核的细胞碎片,但是血小板内却包含有丰富的RNA,包括:信使RNA (messenger RNA, mRNA)、转运RNA (Transfer Ribonucleic Acid, tRNA)、核糖体RNA (ribosomal RNA, rRNA)、核仁小分子RNA (small nucleolar RNA, snoRNA)、微小核糖核酸 (microRNA, miRNA) 等大量的RNAs,其中miRNA最丰富,占血小板总RNA的80%[4],并且在血小板中发挥剪接和转录的重要功能。已有大量的研究证实[5-6],在激活的血小板中RNA被翻译成蛋白能够发挥一定的作用。最新的研究显示,血小板与肿瘤细胞之间存在RNA交互作用,并且血小板可能通过携带肿瘤细胞来源的RNA对机体远端产生重要的影响[2, 3, 7]。
1 正常机体内血小板RNA的生理作用众所周知,血小板在正常机体中主要起到促进凝血的作用,有研究显示血小板被激活后能有效地将RNA翻译成蛋白质,从而改变自身的蛋白质水平,发挥着促凝血、抗炎等多种生理功能[8]。Landry等[9]研究发现血小板能够通过自身的microRNA网络调节P2Y12受体的表达,从而影响血小板的聚集能力。Denis等[10]研究也发现血小板整合素以及血小板表面受体激活后能够精确切除IL-1β的pre-mRNA中的内含子。Shashkin等[11]发现在脂多糖刺激后,血小板pro-IL-1β的mRNA水平发生改变,IL-1β蛋白质表达上调,激活的血小板能够发挥抵抗细菌感染的作用。此外,当凝血酶激活血小板时,血小板将miRNA-223释放入血,这些miRNA-223被HUVECs吞噬后能够调节HUVECs中基因的表达并且影响内皮细胞的功能[5]。
2 肿瘤微环境中血小板RNA的作用 2.1 肿瘤微环境对血小板RNA水平的影响大量研究显示肿瘤细胞能够分泌含有RNA的外泌体[12-15],这些RNA不仅与肿瘤自身的发生发展有关[16],当这些外泌体被肿瘤细胞释放到血液中,血液中的血小板会吞噬这些外泌体并获得外泌体中含有肿瘤来源的RNA,从而改变了血小板中RNA的水平[3]。Calverly等[17]证明,在转移性肺癌患者体内血小板携带的基因水平较非转移性肺癌患者表达存在显著性差异,这些差异可能是由于肿瘤微环境中的外泌体对于血小板的影响。并且Risitano等[18]通过体外共孵育系统验证了血小板和血管内皮细胞之间的相互作用是血小板通过释放微粒将GFP标记的RNA转运至单核细胞和内皮细胞中,而发挥调节单核细胞和内皮细胞的功能。已有研究证明血小板中RNA的改变是调节血小板功能的物质基础[19],当这些血小板被激活时就会释放包含肿瘤来源RNA的微囊泡至受体细胞,从而影响受体细胞的功能。总结近年来最新的研究发现,肿瘤细胞通过将包含自身RNA的外泌体释放入血,血液中的血小板吞噬含有肿瘤RNA的外泌体,从而改变血小板中的RNA水平。一方面血小板具有翻译RNA的功能,这些肿瘤来源的RNA能够在血小板中被表达,从而影响血小板的一些生物功能,例如炎症、血管生成、组织再生等;另一方面,血小板也可以通过血小板微粒的释放,将RNA转运至远端,对受体细胞发挥作用,例如影响内皮细胞功能、促进血管生成以及促进肿瘤细胞侵袭等。
2.2 肿瘤微环境中血小板RNA的生物效应以往的研究显示,血小板与肿瘤细胞通过多种途径相互影响。一方面,临床研究显示肿瘤患者体内血小板功能和数目发生异常,并且超微结构发生改变[20];另一方面,大量研究证实肿瘤细胞激活的血小板能够通过其分泌和黏附功能促进肿瘤增殖、转移以及血管生成[1]。但是,肿瘤转移和血小板激活之间的潜在作用机制尚不清楚。Liang等[21]在转移性肺癌患者体内发现患者的血小板功能和数目发生异常,血小板RNA水平也发生了明显的变化。研究显示血小板中具有较高水平的miRNA-223,血小板通过释放包含miRNA-223的微囊泡发挥着调控肺癌细胞侵袭的作用,并且这种调控机制可能与靶向抑制EPB41L3有关。Girardot等[22]在骨髓增生性肿瘤 (MPN) 病人中发现,血小板中miR-28能够靶向MPL的3′端非翻译区 (3′UTR),抑制MPL的表达水平,调控E2F6、MAP激酶MAPK1/ERK2,发挥调控细胞增殖和凋亡的作用。研究显示在肿瘤微环境中,血小板能够通过释放胞内物质从而促成肿瘤的恶性发展[23-24]。Janowska-Wieczorek等[25-27]采用A549、CRL 2066、CRL 2062、HTB 183、HTB 177五种人源性肺癌细胞以及鼠源性Lewis肺癌细胞研究血小板激活后释放的血小板微囊泡对于肿瘤转移的影响,研究发现血小板释放的微囊泡能够促进MAPK磷酸化以及整合素CD41的表达从而促进肿瘤细胞迁移。肿瘤微环境中血小板中的多种miRNA表达上调,例如miR-21[28]、miR-155[29]、miR-223[21]、miR-28[22]、miR-17-92 cluster[30]等,并且研究显示miR-21、miR-223、miR-28能够促进肿瘤细胞增殖、侵袭等[21-22, 31],miR-17-92能够促进肿瘤细胞DNA甲基环从而促进肿瘤恶性发展[32]。
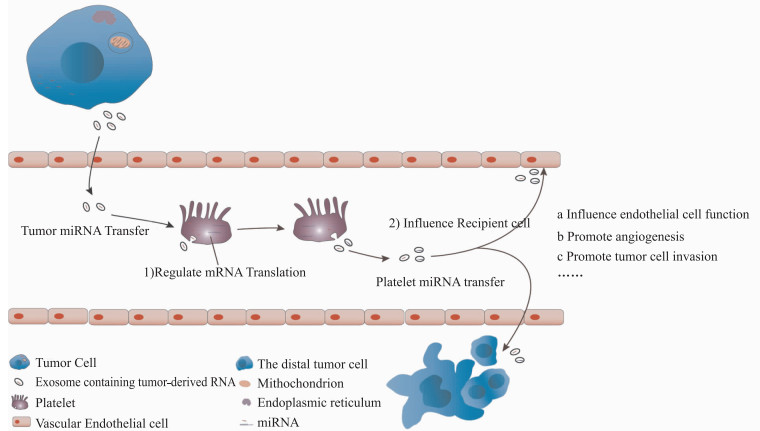
|
| 图 1 肿瘤微环境中血小板RNA作用示意图 |
| Implicated RNA | Up-regulated in tumor disease | Emerging role in tumor disease | Reference | |
| miRNA | miR-21 | lymphoma | promote cell proliferation and invasion | [28, 31] |
| miR-155 | lymphoma | promote the inflammation | [29, 33] | |
| miR-17-92 cluster | lymphoma | mediate DNA methylation | [30, 32] | |
| miR-223 | non-small cell lung cancer | regulate lung cancer cell invasion | [21] | |
| miR-28 | myeloproliferative neoplasms | Control cell proliferation and apoptosis | [22] | |
| mRNA | EGFRvIII | glioma | clinical examination index | [7] |
| PCA3 | prostate | clinical examination index | [7] |
有研究显示血小板中RNA水平能够反映出人体潜在的疾病状态。例如,体指数较高的患者在高脂饮食的刺激下,巨核细胞会选择性的输出炎症相关RNA至血小板,导致患者体内血小板中含有较高的炎性相关RNA[22, 25]。在肿瘤疾病的临床研究中,早在2011年Nilsson等[7]通过体内外实验验证了肿瘤细胞能将一些RNA转运至血小板中,研究发现从神经胶质瘤和前列腺癌患者体内分离出的血小板中分别包含了神经胶质瘤和前列腺癌的RNA特征指标EGFRvIII和PCA3。2015年发表于Cancer Cell的一项研究表明,肿瘤相关血小板的RNA图谱一方面可以区别健康人以及其他6种癌症患者的血液样本,并且能够定位原发癌症的发生部位;另一方面,RNA图谱还能够用于识别肿瘤携带的突变基因,因而可能具有指导癌症治疗的作用[3]。此外,研究人员所研发的新一代的血小板RNA基因表达图谱以及计算算法,可准确的检测癌症的发生,且准确性可达96%。并且血小板容易获得和分离,对病人机体损伤较小,表明血小板RNA检测可能成为一个有效的临床诊断方式,为早期肿瘤发现以及肿瘤的治疗提供新的简单有效肿瘤诊断策略。
4 展望已有研究显示,血小板RNA无论是通过血小板直接翻译肿瘤来源的RNA改变其蛋白水平,还是通过微囊泡释放到受体细胞,其在血小板功能中都发挥着重要的作用。并且大量的临床研究显示了肿瘤微环境中血小板RNA水平发生了明显的改变,这些变化一方面能够促进肿瘤恶性发展,另一方面,也可能为临床治疗肿瘤提供一定的指导。而在心血管疾病中,患者体内血小板中MRP-8/14已经被证明可以作为心血管疾病的标志物应用于临床检测[34]。虽然已经有大量研究表明肿瘤微环境中血小板RNA发生了明显改变,并且研究已经验证肿瘤相关血小板的RNA图谱能够识别肿瘤携带的突变基因以及定位原发癌症的发生部位,但是目前仍没有明确的研究能够解释在肿瘤微环境中,血小板是否通过简单的吞噬作用转运肿瘤细胞的RNA,并且这种转运是否具有选择性,以及这些RNA是如何影响受体细胞等。这些未知的问题都值得研究者们进行更深入的研究。虽然肿瘤微环境中血小板RNA转运以及在肿瘤患者体内作用的具体机制尚不清楚,但是目前的研究已经提示血小板能够通过调节内皮细胞作用而影响血管健康,并且在肿瘤发展中也发挥着重要的作用[35]。因此,阐明血小板RNA的作用机制及其对肿瘤发生发展的影响都显得尤为重要,这不仅能够加强对血小板在肿瘤微环境中发挥作用机制的理解[36],不久的将来,也有可能对肿瘤的诊断和治疗发挥更为重要的作用。
| [1] | 曹玉珠, 刘兆国, 单云龙, 等. 血小板介导肿瘤血行转移的作用及其机制研究进展[J]. 中国药理学通报, 2015, 31 (2): 166-9. Cao Y Z, Liu Z G, Shan Y L, et al. Research progress on the role of platelet in mediating tumor metastasis by hematogenous spread and its mechanisms[J]. Chin Pharmacol Bull, 2015, 31 (2): 166-9. |
| [2] | Lieben L. Cancer genetics: RNA-seq for blood-based pan-cancer diagnostics[J]. Nat Rev Genet, 2015, 16 (12): 688. |
| [3] | Best M G, Sol N, Kooi I, et al. RNA-Seq of tumor-educated platelets enables blood-based pan-cancer, multiclass, and molecular pathway cancer diagnostics[J]. Cancer Cell, 2015, 28 (5): 666-76. doi:10.1016/j.ccell.2015.09.018 |
| [4] | Plé H, Landry P, Benham A, et al. The repertoire and features of human platelet microRNAs[J]. PLoS One, 2012, 7 (12): e50746. doi:10.1371/journal.pone.0050746 |
| [5] | Laffont B, Corduan A, Plé H, et al. Activated platelets can deliver mRNA regulatory Ago2·microRNA complexes to endothelial cells via microparticles[J]. Blood, 2013, 122 (2): 253-61. doi:10.1182/blood-2013-03-492801 |
| [6] | Weyrich A S, Schwertz H, Kraiss L W, Zimmerman G A. Protein synthesis by platelets: historical and new perspectives[J]. J Thromb Haemost, 2009, 7 (2): 241-6. doi:10.1111/jth.2009.7.issue-2 |
| [7] | Nilsson R J, Balaj L, Hulleman E, et al. Blood platelets contain tumor-derived RNA biomarkers[J]. Blood, 2011, 118 (13): 3680-3. doi:10.1182/blood-2011-03-344408 |
| [8] | Clancy L, Freedman J E. The role of circulating platelet transcripts[J]. J Thromb Haemost, 2015, 13 (1): S33-9. |
| [9] | Landry P, Plante I, Ouellet D L, et al. Existence of a microRNA pathway in anucleate platelets[J]. Nat Struct Mol Biol, 2009, 16 (9): 961-6. doi:10.1038/nsmb.1651 |
| [10] | Denis M M, Tolley N D, Bunting M, et al. Escaping the nuclear confines: signal-dependent pre-mRNA splicing in anucleate platelets[J]. Cell, 2005, 122 (3): 379-91. doi:10.1016/j.cell.2005.06.015 |
| [11] | Shashkin P N, Brown G T, Ghosh A, et al. Lipopolysaccharide is a direct agonist for platelet RNA splicing[J]. J Immunol, 2008, 181 (5): 3495-502. doi:10.4049/jimmunol.181.5.3495 |
| [12] | Skog J, Würdinger T, van Rijn S, et al. Glioblastoma microvesicles transport RNA and proteins that promote tumour growth and provide diagnostic biomarkers[J]. Nat Cell Biol, 2008, 10 (12): 1470-6. doi:10.1038/ncb1800 |
| [13] | Nilsson J, Skog J, Nordstrand A, et al. Prostate cancer-derived urine exosomes: a novel approach to biomarkers for prostate cancer[J]. Br J Cancer, 2009, 100 (10): 1603-7. doi:10.1038/sj.bjc.6605058 |
| [14] | Zomer A, Vendrig T, Hopmans E S, et al. Exosomes: Fit to deliver small RNA[J]. Commun Integr Biol, 2010, 3 (5): 447-50. doi:10.4161/cib.3.5.12339 |
| [15] | Arroyo J D, Chevillet J R, Kroh E M, et al. Argonaute2 complexes carry a population of circulating microRNAs independent of vesicles in human plasma[J]. Proc Natl Acad Sci USA, 2011, 108 (12): 5003-8. doi:10.1073/pnas.1019055108 |
| [16] | 毛玉娣, 丁西平, 王华. 微小RNA与胃癌关系的研究进展[J]. 中国药理学通报, 2016, 32 (6): 756-60. Mao Y D, Ding X P, Wang H. Research progress on relationship between microRNA and gastric cancer[J]. Chin Pharmacol Bull, 2016, 32 (6): 756-60. |
| [17] | Calverley D C, Phang T L, Choudhury Q G, et al. Significant downregulation of platelet gene expression in metastatic lung cancer[J]. Clin Transl Sci, 2010, 3 (5): 227-32. doi:10.1111/cts.2010.3.issue-5 |
| [18] | Risitano A, Beaulieu L M, Vitseva O, Freedman J E. Platelets and platelet-like particles mediate intercellular RNA transfer[J]. Blood, 2012, 119 (26): 6288-95. doi:10.1182/blood-2011-12-396440 |
| [19] | Schubert S, Weyrich A S, Rowley J W. A tour through the transcriptional landscape of platelets[J]. Blood, 2014, 124 (4): 493-502. doi:10.1182/blood-2014-04-512756 |
| [20] | Wang R, Stone R L, Kaelber J T, et al. Electron cryotomography reveals ultrastructure alterations in platelets from patients with ovarian cancer[J]. Proc Natl Acad Sci USA, 2015, 112 (46): 14266-71. doi:10.1073/pnas.1518628112 |
| [21] | Liang H, Yan X, Pan Y, et al. MicroRNA-223 delivered by platelet-derived microvesicles promotes lung cancer cell invasion via targeting tumor suppressor EPB41L3[J]. Mol Cancer, 2015, 14: 58. doi:10.1186/s12943-015-0327-z |
| [22] | Girardot M, Pecquet C, Boukour S, et al. miR-28 is a thrombopoietin receptor targeting microRNA detected in a fraction of myeloproliferative neoplasm patient platelets[J]. Blood, 2010, 116 (3): 437-45. doi:10.1182/blood-2008-06-165985 |
| [23] | Freedman J E, Larson M G, Tanriverdi K, et al. Relation of platelet and leukocyte inflammatory transcripts to body mass index in the Framingham heart study[J]. Circulation, 2010, 122 (2): 119-29. doi:10.1161/CIRCULATIONAHA.109.928192 |
| [24] | Nagalla S, Shaw C, Kong X, et al. Platelet microRNA-mRNA coexpression profiles correlate with platelet reactivity[J]. Blood, 2011, 117 (19): 5189-97. doi:10.1182/blood-2010-09-299719 |
| [25] | Gay L J, Felding-Habermann B. Contribution of platelets to tumour metastasis[J]. Nat Rev Cancer, 2011, 11 (2): 123-34. doi:10.1038/nrc3004 |
| [26] | Janowska-Wieczorek A, Wysoczynski M, Kijowski J, et al. Microvesicles derived from activated platelets induce metastasis and angiogenesis in lung cancer[J]. Int J Cancer, 2005, 113 (5): 752-60. doi:10.1002/(ISSN)1097-0215 |
| [27] | Heijnen H F, Schiel A E, Fijnheer R, et al. Activated platelets release two types of membrane vesicles: microvesicles by surface shedding and exosomes derived from exocytosis of multivesicular bodies and alpha-granules[J]. Blood, 1999, 94 (11): 3791-9. |
| [28] | Lawrie C H, Soneji S, Marafioti T, et al. MicroRNA expression distinguishes between germinal center B cell-like and activated B cell-like subtypes of diffuse large B cell lymphoma[J]. Int J Cancer, 2007, 121 (5): 1156-61. doi:10.1002/ijc.v121:5 |
| [29] | Eis P S, Tam W, Sun L, et al. Accumulation of miR-155 and BIC RNA in human B cell lymphomas[J]. Proc Natl Acad Sci USA, 2005, 102 (10): 3627-32. doi:10.1073/pnas.0500613102 |
| [30] | He L, Thomson J M, Hemann M T, et al. A microRNA polycistron as a potential human oncogene[J]. Nature, 2005, 435 (7043): 828-33. doi:10.1038/nature03552 |
| [31] | Shi C, Zhang X, Li X, et al. Effects of microRNA-21 on the biological functions of T-cell acute lymphoblastic lymphoma/leukemia[J]. Oncol Lett, 2016, 12 (5): 4173-80. |
| [32] | Zagorac S, Alcala S, Fernandez Bayon G, et al. DNMT1 inhibition reprograms pancreatic cancer stem cells via upregulation of the miR-17-92 cluster[J]. Cancer Res, 2016, 76 (15): 4546-58. doi:10.1158/0008-5472.CAN-15-3268 |
| [33] | Chen C, Luo F, Liu X, et al. NF-kB-regulated exosomal miR-155 promotes the inflammation associated with arsenite carcinogenesis[J]. Cancer Lett, 2016, 30 (16): 30715-7. |
| [34] | Healy A M, Pickard M D, Pradhan A D, et al. Platelet expression profiling and clinical validation of myeloid-related protein-14 as a novel determinant of cardiovascular events[J]. Circulation, 2006, 113 (19): 2278-84. doi:10.1161/CIRCULATIONAHA.105.607333 |
| [35] | Franco A T, Corken A, Ware J. Platelets at the interface of thrombosis, inflammation, and cancer[J]. Blood, 2015, 126 (5): 582-8. doi:10.1182/blood-2014-08-531582 |
| [36] | Grover A, Sanjuan-Pla A, Thongjuea S, et al. Single-cell RNA sequencing reveals molecular and functional platelet bias of aged haematopoietic stem cells[J]. Nat Commun, 2016, 7: 11075. doi:10.1038/ncomms11075 |