


麻黄汤为中医经典方剂,在临床上有数千年的使用历史。麻黄汤来源于张仲景的《伤寒论》,由麻黄、桂枝、杏仁、甘草组成[1],具有发汗、止咳平喘的功效。麻黄汤发挥药效的有效成分是其君药麻黄中的生物碱类成分 (主要为麻黄碱、伪麻黄碱和甲基麻黄碱),现代药理研究表明麻黄生物碱具有兴奋中枢、镇咳平喘、降血压、收缩血管、发汗、扩张支气管等作用[2-5],但同时具有一定的中枢神经系统毒性[6]。有研究认为麻黄碱导致神经变性可能与脑中谷氨酸 (Glu) 神经递质释放有关[7],Glu过度释放对神经细胞具有兴奋性的毒性作用,对脊髓神经元、海马、丘脑及楔核等结构都产生较强的兴奋作用[8]。Glu、天冬氨酸 (Asp) 为脑中主要的兴奋性氨基酸神经递质,γ-氨基丁酸 (GABA) 和甘氨酸 (Gly) 为脑中主要的抑制性氨基酸神经递质。
笔者在进行麻黄生物碱大鼠体内药代动力学研究时发现,麻黄生物碱给药后,可引起大鼠表现出不同程度的兴奋性,剂量越大,大鼠兴奋性越高,过度兴奋时容易导致大鼠的死亡,而这可能与脑内神经递质的释放有关。故本实验采用脑微透析取样技术,结合高效液相-电化学法 (HPLC-ECD) 研究麻黄汤对大鼠脑海马区氨基酸类神经递质释放的影响,并与麻黄药材和麻黄生物碱的作用进行对比。
微透析是一种新型、微创、基于探针的生物采样技术,能够对组织及细胞外液进行取样而不会对生物体造成明显损伤[9-10]。与传统的断脑取组织匀浆法比较,微透析可在同一时间进行多靶点取样,收集活体动物脑内微透析液,动态监测脑组织样品浓度变化,并且样品无需复杂的处理即可进仪器检测,故而在脑部研究方面具有独特的优势[11-12]。
1 材料 1.1 仪器与试剂Waters 2695高效液相色谱仪,2465电化学检测器 (美国Waters公司);Agilent Eclipse XDB-C18 (4.6 mm×150 mm,5μm) 色谱柱 (美国Agilent公司);MD1001灌注器推进泵,1 mL MD 0100灌注器,MD l000流速控制器 (美国BAS公司);脑微透析套管 (MAB2/6/9.14),脑微透析探针 (MAB6.14.4,截留分子质量15 ku,膜长4 mm,瑞典Microbiotech/se AB公司),脑立体定位仪 (68025,深圳市瑞沃德生命科技有限公司),pH计 (FE20,梅特勒-托利多公司);Millipore纯水仪 (美国Millipore公司);AL104电子天平 (上海梅特勒-托利多仪器有限公司)。
Glu对照品 (批号SLBC5771V)、GABA对照品 (批号BCBH1414V),美国Sigma公司;Gly对照品 (批号SM0315GA14)、Asp对照品 (批号KN1123CA13),邻苯二甲醛 (OPA,批号JM0326YA14),上海源叶生物科技有限公司;盐酸麻黄碱对照品 (批号171241-201007),盐酸伪麻黄碱对照品 (批号171237-201208),盐酸甲基麻黄碱对照品 (批号171247-200301),中国食品药品检定研究院;甲醇为色谱纯;其余化学试剂均为分析纯;自凝牙托水 (批号20150427),自凝牙托粉 (批号20150117),上海新世纪齿科材料有限公司。
1.2 实验动物健康♂ SD大鼠,体质量 (250±20) g,SPF级,由浙江中医药大学实验动物中心提供,合格证号:SCXK (沪)2012-0002。
1.3 溶液的制备人工脑脊液 (ACSF):精密称取氯化钠8.599 g、氯化钾0.201 g、氯化钙0.133 g、氯化镁0.081 g,溶于1 L超纯水中,0.22 μm过膜,使用前超声脱气20 min。
对照品储备液的制备:分别精密称取Asp、Glu、Gly、GABA对照品各10 mg,分别加ACSF于10 mL容量瓶中,超声溶解,ACSF稀释至刻度,得浓度分别为1 g·L-1的对照品储备液。
OPA衍生溶液的制备:精密称取440 mg硼酸钠溶于10 mL超纯水,0.22 μm微孔滤膜过膜,即得OPA溶液。精密吸取OPA溶液100 μL,加入亚硫酸钠溶液100 μL,硼酸钠溶液180 μL,涡旋混匀,当天配制当日使用。
麻黄汤制备:27 g麻黄加720 mL水浸泡20 min,先煎30 min,再和桂枝18 g、杏仁18 g、甘草9 g共煎30 min,滤液旋转蒸发浓缩至以麻黄生药计0.5 g·mL-1麻黄汤灌胃药液。麻黄水煎液制备:27 g麻黄加720 mL水浸泡20 min,煎煮30 min,抽取滤液,旋转蒸发减压浓缩至以麻黄生药计0.5 g·mL-1麻黄灌胃药液。麻黄生物碱给药溶液制备:精密称取麻黄碱14 mg,伪麻黄碱4.8 mg,甲基麻黄碱2.24 mg,加生理盐水18 mL溶解 (采用HPLC法[13]测定麻黄汤中麻黄碱、伪麻黄碱、甲基麻黄碱的含量分别为0.35%、0.12%、0.03%,依据中剂量麻黄汤给药剂量折算)。
1.4 色谱条件Agilent Eclipse XDB-C18(4.6 mm×150 mm,5 μm) 色谱柱,流动相A:12 g磷酸二氢钾、0.177g氯化钠、0.014 g乙二胺四乙酸二钠 (溶于100 μL 5 mol·L-1的氢氧化钠溶液) 溶于超纯水中,加5 mol·L-1氢氧化钠调pH至5.4,流动相B为甲醇,采用梯度洗脱方式0~12 min,4%B~4%B;12~14 min,4%B~16%B;14~29 min,16%B~16%B;29~30 min,16%B~4%B。流速为0.6 mL·min-1,柱温35 ℃,电化学检测器温度35 ℃,检测电压0.8 V。10 μL衍生剂加入30 μL微透析样品,混匀后20 μL进液相检测。
1.5 方法学考察 1.5.1 标准曲线的制备精密吸取4个氨基酸神经递质对照品储备液适量,加ACSF稀释得到8个不同浓度的混合对照品溶液,分别为Asp、Glu、Gly:0.001、0.002、0.01、0.02、0.1、0.2、1、10 mg·L-1,GABA:0.000 5、0.001、0.005、0.01、0.05、0.1、0.5、5 mg·L-1。分别精密吸取上述混合对照品溶液30 μL,加衍生剂10 μL,涡旋混匀,取20 μL,按上述色谱条件进样检测,色谱图见Fig 1。以浓度X为横坐标,峰面积Y为纵坐标,进行线性回归,得到标准曲线和相关系数。Gly:Y=4 000 000X-64 862,r=0.999 9,线性范围为0.001~10 mg·L-1;Asp:Y=1 000 000X-39 648,r=0.999 9,线性范围为0.001~10 mg·L-1;Glu:Y=1 000 000X-47 124,r=0.999 8,线性范围为0.001~10 mg·L-1;GABA:Y=2 000 000X-5 976,r=1.000 0,线性范围为0.000 5~5 mg·L-1,标准曲线见Fig 2。
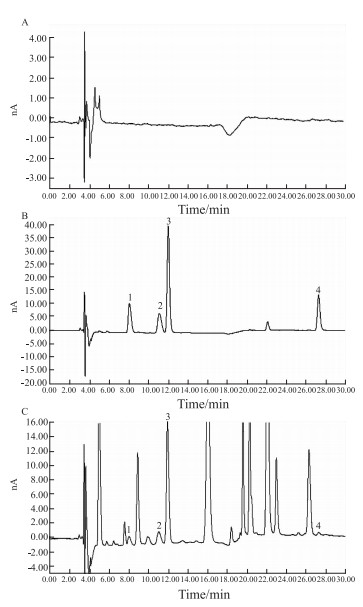
|
| Fig 1 Microdialysis chromatograms of rat brain A:Blank perfusate; B:Blank perfusate spiked with Asp, Glu, Gly and GABA; C:Perfusate sample after oral administration. 1:Asp, 2:Glu, 3:Gly, 4:GABA |
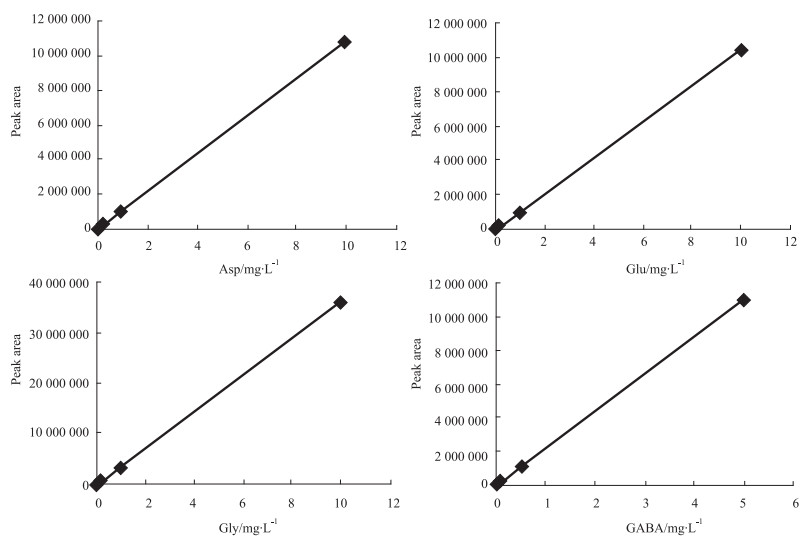
|
| Fig 2 Standard curve of Asp, Glu, Gly and GABA |
吸取质量浓度为1 mg·L-1的Asp、Glu、Gly,0.5mg·L-1的GABA混合对照品溶液,衍生后连续进液相测定6次,记录峰面积,计算峰面积的RSD值。得到Asp、Glu、Gly、GABA 4种氨基酸类神经递质的RSD分别为2.78%、2.38%、2.77%、2.88%。
1.5.3 稳定性考察取大鼠海马区空白脑透析液30 μL,加入10 μL衍生剂,混匀,取20 μL进液相进行检测,样品连续进样3次,峰面积RSD值分别为Asp 3.2%、Glu 7.5%、Gly 1.2%、GABA 7.8%,Glu和GABA稳定性较差,因此,衍生后的样品应立即进液相进行检测。
1.5.4 重复性考察取大鼠海马区空白脑透析液30 μL,加入10 μL衍生剂,混匀,同法制备样品6份,进液相检测,计算含量,得到Asp、Glu、Gly、GABA含量的RSD值分别为2.99%、2.51%、2.64%、2.94%。
1.6 微透析实验 1.6.1 手术大鼠按3 mL·kg-1剂量腹腔注射10%水合氯醛麻醉后,固定于大鼠专用脑立体定位仪上,头部用剃毛机剃毛,75%酒精消毒,根据坐标定位于海马区 (AP:+4.8 mm,ML:+5 mm,DV:-3 mm),将探针套管插入海马区,用钉子固定后再用牙科水泥固定,待大鼠恢复3~5 d,可自由饮水、进食后方可用于实验。
1.6.2 给药大鼠随机分为6组,每组5只。麻黄汤高剂量组 (MHDH,以麻黄生药量计4 g·kg-1给药)、麻黄汤中剂量组 (MHDM,以麻黄生药量计2 g·kg-1给药)、麻黄汤低剂量组 (MHDL,以麻黄生药量计1 g·kg-1给药),麻黄组 (ephedra,以麻黄生药量计2 g·kg-1给药),麻黄生物碱组 (ephedra alkaloids,麻黄碱7 mg·kg-1、伪麻黄碱2.4 mg·kg-1、甲基麻黄碱1.12 mg·kg-1依据中剂量麻黄汤给药剂量折算),空白组 (Control,灌胃同体积生理盐水)。
1.6.3 神经递质的采集清醒状态下拔掉大鼠头部探针套管,插入探针,以1 μL·min-1流速灌流ACSF,探针平衡2 h,灌胃后每30 min收集1份透析液,共收集3 h,收集的样品立即转入-72℃冰箱保存,待测。实验结束后,取出探针,大鼠用过量水合氯醛腹腔注射处死,断头取脑,验证取样部位海马区。
1.6.4 探针回收率的测定将探针置入含Asp、Glu、Gly 0.1 mg·L-1,GABA 0.05 mg·L-1的混合对照品溶液中,以1 μL·min-1流速灌流ACSF,收集体外透析液,并按1.4项下的色谱条件进行测定,计算Asp、Glu、Gly、GABA的体外探针回收率分别为30.3%、35.6%、32.4%、34.9%。
1.7 统计学分析数据以x±s表示,采用SPSS17.0两独立样本t检验进行统计学分析。
2 结果 2.1 麻黄汤、麻黄药材和麻黄生物碱对大鼠海马区Asp释放的影响由Tab 1可知,与空白组比较,麻黄汤、麻黄药材和麻黄生物碱组大鼠的海马区Asp含量有明显升高 (P < 0.05)。灌胃高剂量麻黄汤后,海马区Asp含量呈先增后降的明显趋势,随着麻黄汤给药剂量增加,Asp含量亦增加。Asp在给药麻黄汤、麻黄药材和麻黄生物碱后90 min左右达峰值。
| Group | Time/min | |||||
| 30 | 60 | 90 | 120 | 150 | 180 | |
| Control | 14.09±0.89 | 13.70±0.23 | 13.76±0.07 | 13.96±0.43 | 14.65±1.06 | 15.45±0.76 |
| MHDL | 14.85±1.06 | 15.61±0.40 | 16.63±4.16 | 16.30±0.30* | 14.19±1.55 | 15.71±1.02 |
| MHDM | 16.73±3.07 | 19.47±2.97* | 19.17±1.55* | 19.77±2.01* | 16.04±3.23 | 16.50±2.28 |
| MHDH | 20.92±2.97* | 23.53±3.47* | 42.48±8.91* | 31.91±8.15 | 24.39±2.57* | 22.61±3.93* |
| Ephedra | 15.78±3.89 | 17.62±1.85 | 20.56±4.75 | 14.92±0.361#* | 19.47±5.71 | 20.07±8.35 |
| Ephedra alkaloids | 21.85±2.11* | 17.92±2.18 | 19.60±3.37 | 18.32±1.72* | 17.85±1.58* | 16.67±2.34 |
| *P < 0.05 vs control group in the same time; #P < 0.05 vs MHDM group in the same time | ||||||
由Tab 2可知,与空白组比较,麻黄汤、麻黄药材和麻黄生物碱组在给药后90~150 min对Gly含量有明显影响 (P < 0.05),Gly含量升高。麻黄汤高、中剂量组、麻黄组和麻黄生物碱组分别在给药后120 min、150 min、150 min和90 min大鼠海马区Gly含量达峰值。与麻黄汤中剂量组相比,麻黄生物碱组在给药60 min后各时间点Gly含量低于麻黄汤中剂量各时间点,且在90 min时明显降低了Gly含量。
| Group | Time/min | |||||
| 30 | 60 | 90 | 120 | 150 | 180 | |
| Control | 8.30±0.80 | 7.53±0.68 | 5.68±0.22 | 6.64±1.17 | 6.08±0.77 | 6.42±0.59 |
| MHDL | 8.40±0.80 | 8.98±1.02 | 6.94±0.3* | 6.36±1.17 | 5.71±0.80 | 6.45±0.96 |
| MHDM | 6.60±1.60 | 8.15±1.36 | 12.87±1.17* | 9.41±1.76 | 14.29±3.52* | 6.76±1.51 |
| MHDH | 8.46±0.28 | 8.77±0.65 | 9.23±1.42* | 11.57±1.88* | 9.81±1.60* | 7.47±0.80 |
| Ephedra | 7.28±0.59 | 6.73±0.90 | 11.70±1.54* | 6.57±0.31 | 16.05±4.88 | 6.02±0.74 |
| Ephedra alkaloids | 7.56±1.17 | 6.60±0.49 | 9.60±0.80*# | 6.91±1.36 | 8.92±2.07 | 7.72±1.23 |
| *P < 0.05 vs control groupin the same time; #P < 0.05 vs MHDM group in the same time | ||||||
由Tab 3可知,各给药组与空白组比较有差异 (P < 0.05),Glu含量增加,且麻黄汤、麻黄药材和麻黄生物碱组Glu含量呈先增后降的动态变化。麻黄汤3个剂量组均在120 min Glu含量达峰值,其中麻黄汤高剂量组Glu含量最高。麻黄药材组和麻黄生物碱组分别在90、150 min时Glu水平达峰值,达峰值时Glu含量均明显增加,与相应时间点中剂量麻黄汤组比较。
| Group | Time/min | |||||
| 30 | 60 | 90 | 120 | 150 | 180 | |
| Control | 14.44±1.80 | 21.60±3.40 | 16.10±2.56 | 18.60±3.37 | 20.59±3.82 | 19.97±3.29 |
| MHDL | 17.61±3.79 | 24.89±1.99 | 49.97±3.46* | 88.29±2.30* | 64.30±5.28* | 46.15±7.98* |
| MHDM | 14.61±1.63 | 62.13±4.13* | 59.30±7.19* | 84.41±4.97* | 49.19±7.19* | 25.14±6.21 |
| MHDH | 24.69±3.03* | 60.87±10.03* | 78.71±5.90* | 127.28±10.62* | 101.71±5.45* | 70.14±11.43* |
| Ephedra | 21.80±2.72*# | 37.39±8.90*# | 79.19±6.10*# | 38.09±3.37 *# | 35.11±5.03* | 19.19±2.50 |
| Ephedra alkaloids | 15.81±1.83 | 48.74±9.02* | 65.93±6.66* | 68.06±11.40* | 83.46±8.26*# | 40.39±8.54* |
| *P < 0.05 vs control group in the same time; #P < 0.05 vs MHDM group in the same time | ||||||
由Tab 4可知,各给药组与空白组比较,GABA含量增加 (P < 0.05)。与麻黄汤中剂量组比较,麻黄生物碱组GABA含量在60、120、150 min时较低。麻黄组与麻黄汤中剂量组比较,麻黄组前60 min GABA含量升高,90~150 min GABA含量下降。
| Group | Time/min | |||||
| 30 | 60 | 90 | 120 | 150 | 180 | |
| Control | 10.37±1.49 | 8.80±0.40 | 10.86±0.63 | 10.69±1.20 | 10.54±1.12 | 9.86±0.86 |
| MHDL | 13.15±1.15 | 19.68±1.86* | 26.36±1.49* | 20.92±2.44* | 12.52±2.23 | 9.68±3.35 |
| MHDM | 10.43±1.15 | 17.28±1.60* | 16.39±1.58* | 26.99±1.2* | 15.01±1.46* | 9.14±0.60 |
| MHDH | 11.92±1.15 | 17.85±2.38* | 20.74±2.52* | 22.26±1.66* | 24.04±4.13* | 11.66±1.46 |
| Ephedra | 10.92±1.69 | 18.88±2.78* | 14.04±2.03 | 23.21±3.98* | 12.61±1.66 | 10.95±1.58 |
| Ephedra alkaloids | 11.26±1.15 | 16.05±1.23* | 10.32±1.17# | 15.90±2.87*# | 10.40±1.23# | 9.60±2.06 |
| *P < 0.05 vs control group in the same time; #P < 0.05 vs MHDM group in the same time | ||||||
氨基酸类神经递质的检测方法有高效液相色谱法[14]、气相色谱法[15]以及毛细管电泳法[16],其中最常用的是高效液相色谱法。高效液相的检测模式有荧光、紫外以及电化学,而氨基酸类神经递质无紫外吸收,样品需经衍生化后才能进液相进行检测。考虑到氨基酸类神经递质在大鼠脑海马区含量低,而电化学检测器灵敏度高,故本研究选取电化学检测器。
流动相中加入乙二胺四乙酸二钠可缩短4种神经递质的分析时间。分析流速不能太快,流速过高导致物质峰面积降低,过低导致分析时间过长,降低工作效率,经综合考虑,流速选为0.6 mL·min-1。
氨基酸类神经递质在大鼠脑内含量较低,本实验选取了ECD电极电压0.7~0.9 V范围进行优化,电极电压过低导致仪器灵敏度降低,电极过高时虽然能增加分析的灵敏度,但基线噪音大,故选择0.8 V为本实验检测器的电极电压。
3.2 体内探针回收率体内探针回收率校正建立在体外探针回收率基础上,当体外探针相对回收率RR和相对释放率RL相近时,可采用RL法作为体内探针回收率的校正方法,即当药物在体内几乎检测不到时,用含有药物的灌流液灌流取样部位,由此得到的回收率作为体内探针校正方法,但神经递质是内源性物质,不给药时体内也能检测到,所以RL法无法作为神经递质体内探针校正方法[17],故本实验未做探针回收率考察。
3.3 麻黄汤组、麻黄组和麻黄生物碱组对神经递质的影响在一定剂量范围内,抑制性氨基酸神经递质的升高可能是动物的一种自我保护、自我调节反应,以此来对抗兴奋性氨基酸神经质的过度释放,保持体内神经递质的相对平衡[18]。与空白组比较,各剂量麻黄汤组、麻黄组和麻黄生物碱组大鼠的脑海马区氨基酸类神经递质Asp、Glu、Gly、GABA水平均有明显升高 (P < 0.05),麻黄生物碱可能是麻黄汤及麻黄引起大鼠脑海马区神经递质水平升高的物质基础。相对于其它3种氨基酸神经递质在给药后海马区的动态变化,Glu在给药后含量变化最大,说明4种神经递质中,麻黄汤、麻黄及麻黄生物碱对Glu的影响最大。
大鼠口服各剂量麻黄汤后,海马区兴奋性神经递质Asp和Glu水平均随时间呈现先增后降的趋势。同时随着麻黄汤给药剂量的增加,Asp和Glu含量亦增加,说明麻黄汤剂量与Asp、Glu含量的增加呈现一定的正相关性。麻黄汤各剂量组大鼠Glu和Asp水平在给药后90~120 min达峰值。麻黄组和麻黄生物碱组的Glu水平分别在90 min和150 min达峰值,与相应时间点中剂量麻黄汤组比较,麻黄组和麻黄生物碱组达峰值时Glu含量均明显增加,说明麻黄汤中其它组分抑制了麻黄和麻黄生物碱升高Glu水平的作用。
大鼠口服中剂量麻黄汤及麻黄水煎液后,抑制性氨基酸神经递质Gly含量呈现先升后降、再升再降的趋势,高剂量麻黄汤及麻黄生物碱呈现先升后降的趋势。与麻黄汤中剂量组相比,麻黄生物碱组在给药60 min后各时间点Gly含量低于相应时间点的麻黄汤中剂量组,且在90 min时明显降低;同时麻黄生物碱组GABA水平下降,这说明麻黄汤中的其它组分抑制了麻黄生物碱对GABA及Gly含量的升高,口服麻黄汤后Gly的增加可抑制麻黄生物碱对脑产生的兴奋性,即以麻黄汤用药更安全。
( 致谢: 本实验在浙江中医药大学心脑血管病研究所完成,感谢万海同教授为本实验提供的实验平台。 )
| [1] | 魏凤环.麻黄汤组方原理的研究-PK-PD法研究组方对君药麻黄效应成分及药理活性的影响[D].广州:第一军医大学, 2004. Wei F H. Studies on compatibility principles of HED-the effect of the different compatibility groups on the effeetive components and pharmacological response of HE[D]. Guangzhou:First Military Med Univ, 2004. |
| [2] | Cooper S D, Fletcher B L, Silinski M A, et al. Determination of L-ephedrine, pseudoephedrine, and caffeine in rat plasma by liquid chromatography-tandem mass spectrometry[J]. J Anal Toxicol, 2011, 35 (6): 341-8. doi:10.1093/anatox/35.6.341 |
| [3] | 李树学, 郝宏兴, 崔宏鹏, 等. 甲基麻黄碱与伪麻黄碱镇咳平喘作用比较研究[J]. 内蒙古中医药, 2014 (13): 99-100. Li S X, Hao H X, Cui H P, et al. Study on the effect of antitussive and antiasthmatic of methylephedrine and pseudoephedrine[J]. Inner Mongol J Tradit Chin Med, 2014 (13): 99-100. |
| [4] | 丁丽丽, 施松善, 崔健, 等. 麻黄化学成分与药理作用研究进展[J]. 中国中药杂志, 2006, 31 (20): 1661-4. Ding L L, Shi S S, Cui J, et al. Advances in research of chemical constituents and pharmacological activities of Ephedra[J]. China J Chin Mat Med, 2006, 31 (20): 1661-4. |
| [5] | 杨艳芳, 陆毅, 吴高峰, 等. 麻黄根提取物对自发性高血压大鼠降压作用的观察[J]. 中国医院药学杂志, 2010, 30 (17): 1434-6. Yang Y F, Lu Y, Wu G F, et al. Experimental study on the hypotensive effect of Ephedra root extracts on the spontaneously hypertensive rats[J]. Chin Hosp Pharm J, 2010, 30 (17): 1434-6. |
| [6] | 张秀明.麻杏石甘方药效/毒两性成分存效减毒整合机制研究—中枢神经系统[D].广州:南方医科大学, 2010. Zhang X M. Studies on conserving effect and reducing toxicity integrated mechanism of the effect/toxicity amphiprotic components from Ma-Xing-Shi-Gan prcscription-central nervous system[D]. Guangzhou:Southern Med Univ, 2010. |
| [7] | Bowyer J F, Hopkins K J, Jakab R, et al. L-ephedrine-induced neurodegeneration in the parietal cortex and thalamus of the rat is dependent on hyperthermia and can be altered by the process of in vivo brain microdialysis[J]. Toxicol Lett, 2001, 125 (1-3): 151-66. doi:10.1016/S0378-4274(01)00440-4 |
| [8] | 张东明, 张佳民, 马万云, 等. 急性力竭运动对大鼠下丘脑氨基酸神经递质的影响[J]. 高等学校化学学报, 2002, 23 (2): 230-3. Zhang D M, Zhang J M, Ma W Y, et al. Effect of exhausting exercise on amino acid neurotransmitters in hypothalamus of rats[J]. Chem J Chin Univ, 2002, 23 (2): 230-3. |
| [9] | Saarinen J V, Harvima R J, Naukkarinen A, et al. Release of histamine and leukotriene C4, in immediate allergic wheal reaction as measured with the microdialysistechnique[J]. Arch Dermatol Res, 2000, 292 (7): 333-40. doi:10.1007/s004030000137 |
| [10] | Plock N, Buerger C, Kloft C. Successful management of discovered pH dependence in vancomycin recovery studies: novel HPLC method for microdialysis and plasma samples[J]. Biomed Chromatogr, 2005, 19 (3): 237-44. doi:10.1002/(ISSN)1099-0801 |
| [11] | 张春颖, 杜贵友, 王巍, 等. 微透析技术在脑缺血动物神经递质研究中的应用[J]. 中国药理学通报, 2004, 20 (11): 1209-11. Zhang C Y, Du G Y, Wang W, et al. Application of microdialysis in the study of neurotransmitters in cerebral ischemia animals[J]. Chin Pharmacol Bull, 2004, 20 (11): 1209-11. |
| [12] | 何雪辉, 杨志宏, 孙晓波. 微透析与LC-MS~n联用测定脑组织中咪达唑仑/1′-羟基咪达唑仑及其脑内药代特征的研究[J]. 中国药理学通报, 2014, 30 (4): 578-82. He X H, Yang Z H, Sun X B. Quantification of midazolam/1' hydroxymidazolam and their pharmacokinetic characteristics in rat brain by microdialysis combined with LC-MSn[J]. Chin Pharmacol Bull, 2014, 30 (4): 578-82. |
| [13] | 唐映红, 万海同, 陈建真, 等. 麻黄汤中9个有效成分的微透析体外回收率研究[J]. 中国中药杂志, 2015, 40 (18): 3667-73. Tang Y H, Wan H T, Chen J Z, et al. In vitro microdialysis recoveries of nine active ingredients in Mahuang decoction[J]. China J Chin Mat Med, 2015, 40 (18): 3667-73. |
| [14] | 黄翔.基于脑微透析技术的丹红注射液抗脑缺血药效学研究[D].杭州:浙江中医药大学, 2013. Huang X. Study on quality control of Danhong injection and study on pharmacodynamic of brain based microdialysis[D]. Hangzhou:Zhejiang Chinese Medical University, 2013. |
| [15] | 赵艳萍, 丁晓霞, 王勇, 等. 氨基酸类神经递质分析方法的研究进展[J]. 甘肃医药, 2015, 34 (10): 740-4. Zhao Y P, Ding X X, Wang Y, et al. Research progress on analytical methods of amino acid neurotransmitters[J]. Gansu Med J, 2015, 34 (10): 740-4. |
| [16] | 党红梅, 付敏, 马万云. 中药对大鼠海马区痕量氨基酸神经递质影响的初探[J]. 分析科学学报, 2005, 21 (2): 131-4. Dang H M, Fu M, Ma W Y. Study of influence of Chinese tradition medicine on trace amino acid neurotransmitters in hippocampus of rats by CZE-LIF[J]. J Anal Sci, 2005, 21 (2): 131-4. |
| [17] | 张春颖, 杜贵友, 王巍, 等. 天麻钩藤方对自由活动大鼠脑缺血海马细胞外液递质氨基酸的影响[J]. 中国中药杂志, 2004, 29 (11): 1061-5. Zhang C Y, Du G Y, Wang W, et al. Effects of Tianma Gouteng Fang on transmitter amino acids in the hippocampus extracellular liquids in freely moving rats subjected to brain ischemia[J]. China J Chin Mat Med, 2004, 29 (11): 1061-5. |
| [18] | 魏凤环, 罗佳波, 莫志贤. 麻黄配伍前后对大鼠大脑额叶皮层氨基酸类神经递质含量的影响[J]. 山东中医药大学学报, 2006, 30 (5): 392-4. Wei F H, Luo J B, Mo Z X. Effect of Herba ephedrae fore-and-aft compatibility on the contents of amino acids in the rat[J]. J Shandong Univ Tradit Chin Med, 2006, 30 (5): 392-4. |

