


2. 宁夏医科大学药学院,宁夏 银川 750004;
3. 甘肃省人民医院药剂科质控科,甘肃 兰州 730000
2. Dept of Pharmacology, Ningxia Medical University, Yinchuan 750004, China;
3. Dept of Medical Quality Control, People′s Hospital of Gansu Province, Lanzhou 730000, China
γ-氨基丁酸 (gamma aminobutyric acid,GABA) 是哺乳动物中枢神经系统内主要的抑制性神经递质,通过作用于特异的受体启动中枢抑制作用,而GABA能神经信号突触传递的强弱和时程长短主要依赖GABA转运体 (GABA transporter, GAT) 的调节。GAT可快速摄取突触间隙和细胞外液的GABA,终止GABA对突触后膜受体的作用,研究发现GAT与疼痛、癫痫、阿尔茨海默症 (AD)、酒精的耐受性等都有密切关系[1]。
氧化槐定碱 (oxysophoridine, OSR) 是从豆科槐属植物苦豆子中提取的主要生物碱,基本结构由2个3价氮原子稠和的双哌啶环构成[2]。本实验组前期的研究表明,OSR对多种致痛模型所致的疼痛均有明显的缓解作用,其中镇痛作用机制与中枢GABA、甘氨酸含量的升高和GABAA受体表达的增加有关[3]。本实验在前期研究的基础上,进一步探讨OSR的镇痛作用与高位中枢GAT-1的关系。
1 动物与材料 1.1 实验动物健康成年昆明种小白鼠,宁夏医科大学实验动物中心提供,合格证号:SCXK (宁)2005-001,SPF级,体质量18~22 g,所有小鼠给予常规饲料正常喂养。
1.2 药品与试剂OSR购自宁夏紫金花药业公司,批号:071217;盐酸吗啡注射液 (morphine, Mor) 购自沈阳第一制药厂,批号051106;兔抗鼠GAT-1多克隆抗体 (批号:BA0880)、即用型SABC试剂盒 (批号:SA1022)、DAB显色试剂盒 (批号:AR1022) 均购自武汉博士德生物工程有限公司。TransStart Green qPCR SuperMix试剂盒 (批号:D20729)、TransZol试剂 (批号:D70811)、2×EasyTaq PCR SuperMix试剂盒 (批号:D10610)、TransScript First-Strand cDNA Synthesis SuperMix试剂盒 (批号:D20729) 均购自北京全式金生物技术有限公司。
1.3 仪器低温冰箱MDF290AT (日本Sanyo公司);WD900G格兰仕光波/微波炉 (广东格兰仕集团有限公司);LEICA RM2235切片机 (德国Leica公司);BMJ-Ⅲ型病理组织包埋冷冻台、BMJ-Ⅲ型包埋机 (常州中威电子仪器厂);OLYMPUS BH-2显微镜 (中日合资Olymous Optical CO. LTD);实时定量IQ5 PCR仪、高速低温离心机、核酸浓度测定仪 (美国Bio-Rad公司)。
2 方法 2.1 福尔马林舔足法小鼠随机分为5组,每组10只,分别为生理盐水 (normal saline, NS) 组、Mor (20 mg·kg-1) 组、OSR (500、250、125 mg·kg-1) 组。Mor组ip,其余各组均iv,给药容量为0.01 mL·g-1。给药后60 min,在小鼠右后足跖皮下用微量注射器注射体积分数为0.02福尔马林20 μL,观察并记录注射后0~5 min (第Ⅰ时相) 和10~60 min (第Ⅱ时相) 两个时间段累计舔足时间,分别代表Ⅰ相和Ⅱ相的疼痛指标。
2.2 免疫组织化学法小鼠20只,♀♂兼用,随机分为2组:NS组和OSR组。OSR组ip OSR 500 mg·kg-1,NS组给予等容量的生理盐水,45 min后麻醉,用100 mL体积分数为0.04的多聚甲醛灌注至动物发硬。迅速取脑,放入4℃的多聚甲醛固定液48 h,常规脱水、透明、浸蜡、石蜡包埋,制成4 μm切片,60 ℃烤箱加温2 h,用于免疫组化染色。染色后每个动物随机取2张切片,每个切片随机抽取2个不重叠代表性视野,在显微镜下观察大脑皮质和丘脑内GAT-1免疫阳性细胞并计数。
2.3 Real time RT-PCR小鼠30只,♀♂兼用,随机分为3组,每组10只:福尔马林组、正常对照组、OSR组。福尔马林组和OSR组分别iv NS和OSR (500 mg·kg-1),35 min后小鼠足下注射体积分数为0.02福尔马林20 μL,60 min后取大脑 (去掉小脑) 于液氮中。正常对照组iv NS后于95 min取大脑 (去掉小脑) 于液氮中。
总RNA提取:每100 mg组织加1 mL TransZol匀浆,提取RNA。使用核酸测定仪测OA值及1.5%琼脂糖凝胶电泳鉴定RNA质量,按TransScript First-Strand cDNA Synthesis SuperMix试剂盒说明配制体系反应液,置于PCR仪中,42 ℃ 50 min,70 ℃ 15 min,将mRNA反转录成cDNA。
2.4 OSR对大脑GAT-1 mRNA表达的影响采用荧光染料 (SYBRgreenⅠ) 实时定量PCR系统检测GAT-1和GAPDH基因的表达水平,反应体系如下: TransStart Green qPCR SuperMixUDG (2×) 12.5 μL,Passive Reference Dye 0.5 μL,cDNA溶液2.5 μL,GAT-1上、下游引物分别为:5′-AACTCCTTCACCACGACC-3′和5′-TCCCAGAACTCCACCAC-3′,产物长度125 bp,退火温度52 ℃。GAPDH上、下游引物分别为:5′-AGTCAAGGCCGAGAATGGGAAG-3′和5′-AAGCAGTTGGTGGTGCAGGATG-3′,产物长度294 bp,退火温度52 ℃。GAT-1和GAPDH引物由上海生工生物工程有限公司设计和合成。PCR的参数为: 94 ℃ 5 min,94 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,共35个循环。GAT-1和GAPDH基因同步扩增。实验结果自动以CT值给出。相对表达量计算按照2-ΔΔCt方法进行计算。反应完毕后,将扩增的PCR产物做溶解曲线分析。
2.5 统计学方法统计方法采用SPSS11.5统计软件包中的One-Way ANOVA检验,所有数据以x±s表示。
3 结果 3.1 OSR对福尔马林致小鼠舔足潜伏期的影响与NS组比较,Mor (20 mg·kg-1,ip) 对福尔马林所致小鼠舔足潜伏期的Ⅰ相和Ⅱ相反应均有明显的延长作用 (P < 0.01),OSR (500、250、125 mg·kg-1,iv) 对Ⅰ相和Ⅱ相反应也表现出明显的延长作用 (P < 0.05,P < 0.01),并随剂量增加镇痛作用增强;与Mor比较,OSR的抑制作用稍弱,但高剂量OSR在Ⅰ相的镇痛效果接近于Mor,见Tab 1。
| Group | Dose /mg·kg-1 |
Licking time/s | |
| Phase Ⅰ reaction (0~5 min) |
Phase Ⅱ reaction (10~60 min) |
||
| NS | - | 75.21±11.24 | 179.56±17.65 |
| Mor | 20 | 21.30±10.28** | 75.71±21.38** |
| OSR | 500 | 33.01±12.12** | 100.21±21.34**# |
| 250 | 47.13±11.75*# | 107.87±21.23**# | |
| 125 | 65.58±17.21## | 143.84±23.15*## | |
| *P < 0.05, **P < 0.01 vs NS group; #P < 0.05, ##P < 0.01 vs Mor group | |||
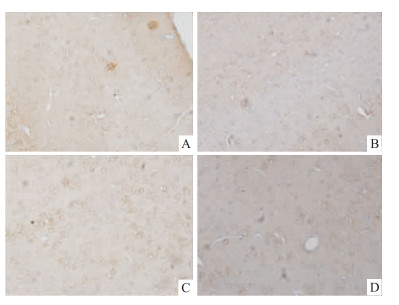
与NS组比较,ip OSR 500 mg·kg-1后小鼠大脑皮层和丘脑的GAT-1免疫阳性细胞数明显减少 (P < 0.01)。阳性细胞数分别降低了59%和69%,见Tab 2、Fig 1。
| Group | Dose /mg·kg-1 |
Positive cell number/visual fields | |
| Cerebral cortex | Hypothalamus | ||
| NS | - | 169.95±6.811 | 118.50±7.695 |
| OSR | 500 | 99.85±2.280** | 82.10±3.598** |
| **P < 0.01 vs NS group | |||
|
| Fig 1 Effect of OSR on expression of GAT-1 incerebral cortex and hypothalamus of mice (×100) A:Cerebral cortex of control group; B:Cerebral cortex of OSR group; C:Hypothalamus of control group; D:Hypothalamus of OSR group |
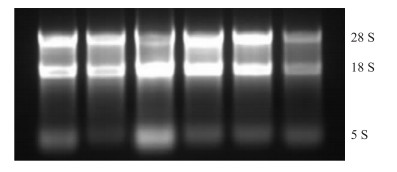
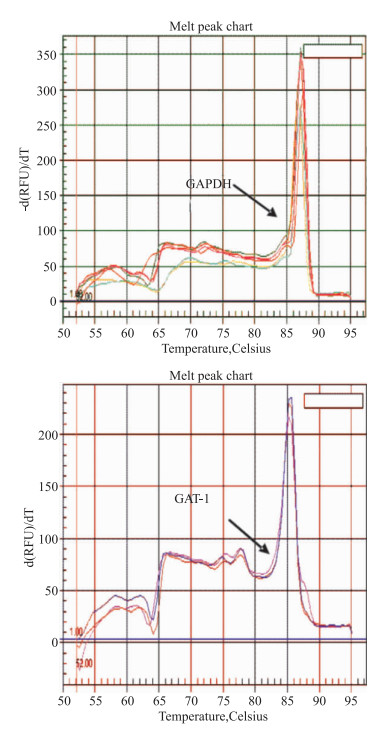
提取的RNA的OD值A260/280均在1.8到2.0之间,琼脂糖凝胶电泳检测可见3条明显的RNA特征条带:5S、18S、28S,反转录所得cDNA特异性强、质量好,熔解曲线显示GAPDH和GAT-1定量PCR产物峰值均一、未见到其他明显的异常波形。见Fig 2~4。
|
| Fig 2 Agarose gel electrophoresis result of total RNA in brain |
|
| Fig 3 Solubility curve of GAPDH and GAT-1 |
|
| Fig 4 Cumulative results of GAPDH and GAT-1 |
与NS组比较,福尔马林组小鼠大脑GAT-1 mRNA的表达明显升高,是NS的3.54倍,而OSR (500 mg·kg-1,iv) 可明显抑制福尔马林诱导的GAT-1 mRNA的表达 (P < 0.05),接近于NS组,见Tab 3。
| Group | Dose | GAT-1 mRNA relative expression |
| NS | - | 0.39±032Δ |
| Formalin | 1 μL·g-1 | 1.38±0.88* |
| OSR | 500 mg·kg-1 | 0.46±0.56Δ |
| *P < 0.05 vs NS group; ΔP < 0.05 vs formalin group | ||
GAT是存在于囊泡膜、突触前膜或胶质细胞膜中Na+依赖的神经递质转运体,能快速重摄取突触间隙的GABA,对GABA能神经信号突触传递的强弱和时程长短有调控作用。GAT-1在脊髓和脑组织中含量丰富,占GAT总数的80%[4-5],GAT-1作为GABA代谢系统中重要的构成部分,在痛觉信息的传递和调控过程中发挥重要作用。研究表明,GAT-1过表达的小鼠会出现痛觉过敏,而GAT-1敲除的小鼠明显的对疼痛有抗伤害作用[6-7]。鞘内注射GAT-1抑制剂NO-711可明显减轻坐骨神经结扎大鼠机械痛敏和热痛敏[8]。另有研究表明,通过强迫游泳激活内源性阿片或非阿片依赖的下行痛觉抑制机制与阻断GAT-1的功能有关[9]。
本实验组前期通过扭体、热板和热甩尾等致痛模型研究表明OSR具有明显的镇痛作用[10],鞘内注射OSR可明显升高福尔马林致痛小鼠脊髓和脑GABAARα1 mRNA和蛋白表达量[11];侧脑室注射OSR能增加大鼠皮层、海马GABA免疫阳性细胞数目[12]。本实验结果显示,对于福尔马林所致小鼠舔足潜伏期无论是Ⅰ相反应还是Ⅱ相反应,OSR均表现出明显的抑制作用,提示OSR的镇痛作用涉及中枢和外周。OSR可明显降低小鼠大脑GAT-1免疫阳性细胞和GAT-1 mRNA表达,提示OSR的镇痛机制与高位中枢神经系统中GAT-1下调有关。OSR通过抑制GAT-1的表达,减少GAT-1对GABA的重摄取,使神经突触间隙GABA的相对表达量增加,增强GABA介导的中枢抑制作用,抑制痛觉信息的传递。OSR的镇痛机制明显与吗啡不同,可能不会产生类似于吗啡的成瘾性和耐受性,因此,有关OSR更详细的镇痛机制及可能产生的副作用有待于进一步研究。
( 致谢: 本实验在宁夏医科大学药学院药理实验室完成,感谢药理实验室的各位老师和同学对本实验的大力支持。 )
| [1] | 李翠限, 王莹, 周春, 等. GABAA受体转运及其在神经性疾病中的作用[J]. 中国药理学通报, 2011, 27 (7): 889-92. Li C X, Wang Y, Zhou C, et al. Transportation and role of GABAA receptor in neurological diseases[J]. Chin Pharmacol Bull, 2011, 27 (7): 889-92. |
| [2] | 余建强, 李玉香, 朱万平, 等. 氧化槐定碱对大鼠额叶皮层脑电活动及功率谱的影响[J]. 中国药理学通报, 2010, 26 (8): 1026-9. Yu J Q, Li Y X, Zhu W P, et al. The effect of oxysophoridine on electric activities and its power spectrums of cerebral frontal cortex in rats[J]. Chin Pharmacol Bull, 2010, 26 (8): 1026-9. |
| [3] | 易正洪, 杨光, 闫琳, 等. 氧化槐定碱对福尔马林致痛大鼠脊髓氨基酸含量的影响[J]. 中国药学杂志, 2011, 46 (11): 826-9. Yi Z H, Yang G, Yan L, et al. Effect of oxysophoridine on amino acid content in spinal cord of rats with formalin-induced pain[J]. Chin Pharm J, 2011, 46 (11): 826-9. |
| [4] | Scimemi A. Structure, function, and plasticity of GABA transporters[J]. Front Cell Neurosci, 2014, 8 : 161. |
| [5] | Zink M, Vollmayr B, Gebicke-Haerter P J, et al. Reduced expression of GABA transporter GAT3 in helpless rats, an animal model of depression[J]. Neurochem Res, 2009, 34 (9): 1584-90. doi:10.1007/s11064-009-9947-2 |
| [6] | Christiansen B, Meinild A K, Jensen A A, et al. Cloning and characterization of a functional human gamma-aminobutyric acid (GABA) transporter, human GAT-2[J]. Biol Chem, 2007, 282 (27): 193-9. |
| [7] | Ma Y H, Zhou X G, Duan S H, et al. Overexpression of γ-aminobutyric acid transporter subtype Ι leads to cognitive deterioration in transgenic mice[J]. Acta Pharmacol Sin, 2001, 22 (4): 340-8. |
| [8] | 李轶聪, 付宝军, 刘芳, 等. 鞘内注射GABA转运体-1抑制剂NO-711对神经病理痛大鼠脊髓Fos蛋白表达的影响[J]. 中国新药杂志, 2011, 20 (12): 1112-6. Li Y C, Fu B J, Liu F, et al. Effect of intrathecal NO-711 injection on expression of Fos protein after chronic constriction injury of the sciatic nerve in rats[J]. Chin J New Drugs, 2011, 20 (12): 1112-6. |
| [9] | Hu J H, Yang N, Ma Y H, et al. Decrease of morphine-induced reward effects and withdrawal symptoms in mice overexpressing gamma-aminobutyric acid transporter I[J]. Neurosci Res, 2003, 74 (4): 614-21. doi:10.1002/(ISSN)1097-4547 |
| [10] | 高进贤, 陶丽君, 余建强, 等. 氧化槐定碱镇痛作用及其对小鼠中枢PKCγ表达的影响[J]. 中国药理学通报, 2009, 25 (11): 1453-6. Gao J X, Tao L J, Yu J Q, et al. The analgesic action of oxysophoridine and its effect on the expression of PKCγ in central nervous system of mice[J]. Chin Pharmacol Bull, 2009, 25 (11): 1453-6. |
| [11] | 杨光, 闫琳, 高进贤, 等. 氧化槐定碱镇痛作用及其对小鼠中枢GABAA Rα 1表达的影响[J]. 中国药理学通报, 2011, 27 (8): 1055-8. Yang G, Yan L, Gao J X, et al. Analgesic effect of oxysophoridine with intravenous injection and its influence on central GABAARα 1 receptor in mice[J]. Chin Pharmacol Bull, 2011, 27 (8): 1055-8. |
| [12] | 余建强, 蒋袁絮. 氧化槐定碱对大鼠皮层及海马谷氨酸及γ-氨基丁酸免疫阳性细胞的影响[J]. 中国中药杂志, 2006, 31 (19): 1611-4. Yu J Q, Jiang Y X. Effects of oxysophoridine on Glu and GABA imuno-reaction positive neurons in cortex and hippocampus of rats[J]. China J Chin Mater Med, 2006, 31 (19): 1611-4. |

