


2. 贵州医科大学药学院,贵州 贵阳 550004;
3. 民族药与中药开发应用教育部工程研究中心,贵州 贵阳 550004;
4. 国家苗药工程技术研究中心,贵州 贵阳 550004
2. School of Pharmacy, Guizhou Medical University, Guiyang 550004, China;
3. Engineering Research Center for the Development and Application of Ethnic Medicine and TCM, Ministry of Education, Guiyang 550004, China;
4. National Engineering Research Center of Miao's Medicines, Guiyang 550004, China
斑马鱼 (zebrafish) 又名花条鱼,是辐鳍亚纲 (Actinopterygii) 鲤科 (Cyprinidae) 短担尼鱼属 (Danio) 的一种热带淡水鱼[1]。因斑马鱼具有个体小、繁殖周期短、胚胎透明易于观察、饲养简便等优点[2],使其成为一种理想的生物模型。且斑马鱼和人类之间的基因同源性高达87%,在分子、细胞和组织水平上,斑马鱼和哺乳动物高度相似,这意味着用斑马鱼开展药物实验所得到的结果在多数情况下也适用于人体。同时,斑马鱼实验是一个整体动物实验,它能准确反映待测药物在体内的吸收、分布、代谢及排泄等动态生理过程[3-5],这为斑马鱼用于药物代谢提供了遗传和生理基础。
头花蓼 (Polygonum capitatum Buch.-Ham. ex D. Don) 又名太阳草、水绣球、红酸杆,系蓼科 (Polygonaceae) 蓼属 (Polygonum) 多年生草本植物[6],在《苗族医药学》、《中华本草·苗药卷》、《贵州植物志》、2003版《贵州省中药、民族药质量标准》中均有收载[7],具有活血散瘀、清热利湿、利尿通淋的功效,临床上主要用于治疗肾盂肾炎、泌尿系统结石、膀胱炎等疾病[8]。经研究发现[9],头花蓼的化学成分主要为挥发油、黄酮类及酚酸类等化合物。基于实验室前期对头花蓼治疗泌尿系统感染的研究中发现,头花蓼的药理活性主要与酚酸类成分密切相关[10],但是目前对头花蓼中酚酸类成分的代谢研究较少。因此,本实验以模式生物斑马鱼为体内代谢模型,以头花蓼提取物中具有代表性的,且被证明有活性的2个酚酸类成分[11-12](没食子酸、原儿茶酸) 为研究对象,研究2个酚酸类成分在斑马鱼体内的代谢过程,分析2个酚酸类成分在斑马鱼体内的代谢产物,为阐明该药在体内发挥疗效的药效物质基础和作用机制提供科学依据。
1 材料与方法 1.1 仪器、试剂与实验动物UHPLC-Q-TOF/MS (超高压液相色谱-四级杆-飞行时间串联质谱仪,包括1290 Infinity二元泵、高性能自动进样器、二级管阵列检测器、柱温箱、代谢分析软件Metabolite Tools、质量亏损过滤MDF功能等);EL204电子天平 (梅特勒-托利多仪器有限公司);MTN-2800D氮吹浓缩装置 (天津奥特塞恩斯仪器有限公司);Allegra 64R低温高速离心机 (美国Beckman Coulter公司);CQ 250A-TS超声波清洗机 (上海跃进医用光学器械厂)。
没食子酸对照品 (批号M32-110518)、原儿茶酸对照品 (批号1198-101018):中药固体制剂制造技术国家工程研究中心。甲酸为色谱纯、乙腈为色谱纯 (德国Merck公司);水为娃哈哈纯净水;其他试剂均为分析纯。斑马鱼成鱼,野生型 (Tuebigen系后代),由南京大学模式生物研究所提供。
1.2 色谱条件色谱柱:Agilent Eclipse Plus C18 RRHD (2.1 mm×100 mm,1.8 μm),柱温:45 ℃,流动相:0.1%甲酸水 (A)-0.1%甲酸乙腈 (B) 梯度洗脱,洗脱表见Tab 1。进样体积为2 μL。
| Time /min |
Flow velocity /mL·min-1 |
A phase /% |
B phase /% |
| 0 | 0.3 | 95 | 5 |
| 10 | 0.3 | 55 | 45 |
| 14 | 0.3 | 5 | 95 |
| 15 | 0.3 | 0 | 100 |
| 16 | 0.3 | 95 | 5 |
电喷雾离子源,扫描方式为负离子扫描,锥孔电压:80 V,毛细管电压3 KV,雾化气 (N2) 压力:1.2 bar,离子源温度:110℃,气体体积流量:50 L·h-1,流速:8.0 L·min-1,温度200℃,脱溶剂气体积流量:550 L·h-1,脱溶剂气温度:300℃,四级杆电子能量为8.0 eV,扫描范围为m/z 50~1 000,校正模式选用:Enhanced Quadratic,准确质量测定采用甲酸钠校正标准液,数据分析:Data Analysis软件、Metabolite ToolsTM (包括Metabolite Predict及Metabolite Detect) 软件、质量亏损过滤 (MDF)。
1.4 给药与取药方法给药方法:取15条成年斑马鱼,♂♀均有,随机分成3组,每组5只,分别置于30 mL含有0.4% DMSO纯净水溶液 (空白鱼组)、含有0.11 g·L-1没食子酸的0.4% DMSO纯净水溶液 (药物鱼组)、含有0.11 g·L-1原儿茶酸的0.4% DMSO纯净水溶液 (药物鱼组) 的棕色瓶中。同时分别设30 mL不含鱼的0.4% DMSO纯净水溶液 (空白溶液组)、不含鱼但含有0.11 g·L-1没食子酸的0.4% DMSO纯净水溶液 (空白药物组) 及不含鱼但含有0.11 g·L-1原儿茶酸的0.4% DMSO纯净水溶液 (空白药物组)。
取药方法:药物鱼组分别于斑马鱼暴露药液后0、2、4、6、8、12、18、24 h时间点每条鱼取药液0.4 mL,各时间点药液分别混合,于-70℃冰箱放置。于末次取样时间点24 h,同时将鱼取出,用纯净水迅速洗涤3次,处死,去除鱼鳍和鱼磷,称重,于-70℃冰箱放置。空白鱼组、空白溶液组及空白药物组于0、24 h同法取样。
1.5 样品处理药液处理:将不同时间点药液各2 mL,于37℃下N2吹干,残留物加200 μL体积分数为0.5的甲醇溶解,15 000 r·min-1离心5 min,取上清液,采用UHPLC-Q-TOF/MS进样分析。
斑马鱼体处理:取各组24 h斑马鱼分别混合,剪碎,取1 g,加质量分数为0.9% NaCl溶液5 mL匀浆,5 000 r·min-1离心10 min,取上清液,加4倍量甲醇涡旋混匀除蛋白,3 500 r·min-1离心10 min,再取上清液用N2吹干,残留物加200 μL体积分数为0.5的甲醇溶解,15 000 r·min-1离心5 min,上清液采用UHPLC-Q-TOF/MS进样分析。
2 结果通过UHPLC-Q-TOF/MS联用技术,在正、负离子模式同时检测没食子酸、原儿茶酸经斑马鱼作用后的药液及鱼体内的代谢产物,研究发现负离子模式较正离子模式灵敏,因此本次研究运用负离子模式对斑马鱼作用后的药液及鱼体内的代谢产物进行检测。运用Metabolite Detect软件处理后,分别得到没食子酸和原儿茶酸的空白药物、空白鱼代谢24 h后的体外药液、给药鱼代谢24 h后的体外药液、给药鱼代谢24 h与空白鱼代谢24 h后的体外药液差异图谱、空白鱼体、给药鱼体、给药鱼体与空白鱼体差异图谱,见Fig 1和Fig 3。
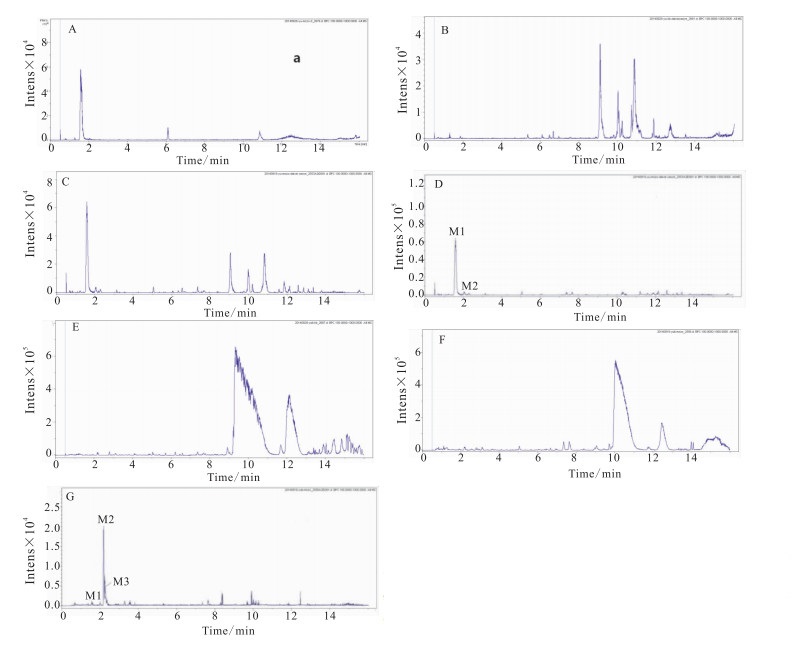
|
| Fig 1 Base peak chromatograms of zebrafish in vitro solution and in vivo after combination being exposed to zebrafish for 24 h and different chromatograms from gallic acid in negative mode A:Blank drug; B: In vitro solution of blank zebrafish; C: In vitro solution of zebrafish with drug; D: Different chromatograms of C and D; E:In vivo of blank zebrafish; F:In vivo of zebrafish with drug; G:Different chromatograms of F and G |
由Metabolite Detect软件得到的差异图谱 (Fig 1) 中可知,在1.6 min处存在m/z 169.013 5[M-H]-峰的化合物,与没食子酸对照品相同,由此确定TR 1.6 min的M1为没食子酸。
2.1.2 甲基硫酸化代谢产物鉴定由Metabolite Detect软件得到的差异图谱 (Fig 1) 中可知,在2.2、2.3 min处分别存在m/z 262.987 0、262.987 6[M-H]-峰的化合物,显示183.030 2[M-H-SO3-CH2]-的主要碎片离子峰,由SmartFormula预测的化学式分别为C8H7O8S、C8H7O5,推测TR 2.2、2.3 min的M2、M3为没食子酸甲基硫酸化代谢产物[13]。
2.1.3 没食子酸代谢产物及可能的代谢途径见Fig 2。
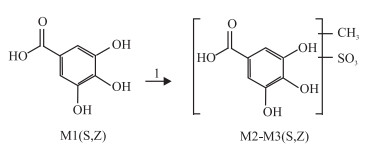
|
| Fig 2 The major metabolites of gallic acid and possible biotransformation pathways in vitro andin vivo zebrafish 1:methylation and sulfate conjugation; Z: in vivo of zebrafish; S: in vitro solution of zebrafish |
经Metabolite Detect软件处理后,检测到没食子酸在模式生物斑马鱼中的体内外代谢产物,见Tab 2。
| No. | Metabolic pathway | m/z Found | PPM | RT/min | Formula | Source |
| M1 | Parent | 169.013 5 | 3.6 | 1.6 | C7H5O5 | Z, S |
| M2 | Methylation+sulfate conjugation | 262.987 0 | -1.2 | 2.2 | C8H7O8S | Z, S |
| M3 | Methylation+sulfate conjugation | 262.987 6 | -3.6 | 2.3 | C8H7O8S | Z |
| Z:in vivo of zebrafish; S: in vitro solution of zebrafish | ||||||
由Metabolite Detect软件得到的差异图谱 (Fig 3) 中可知,在2.5 min处存在m/z 153.019 8[M-H]-峰的化合物,与原儿茶酸对照品相同,由此确定TR 2.5 min的M3为原儿茶酸。
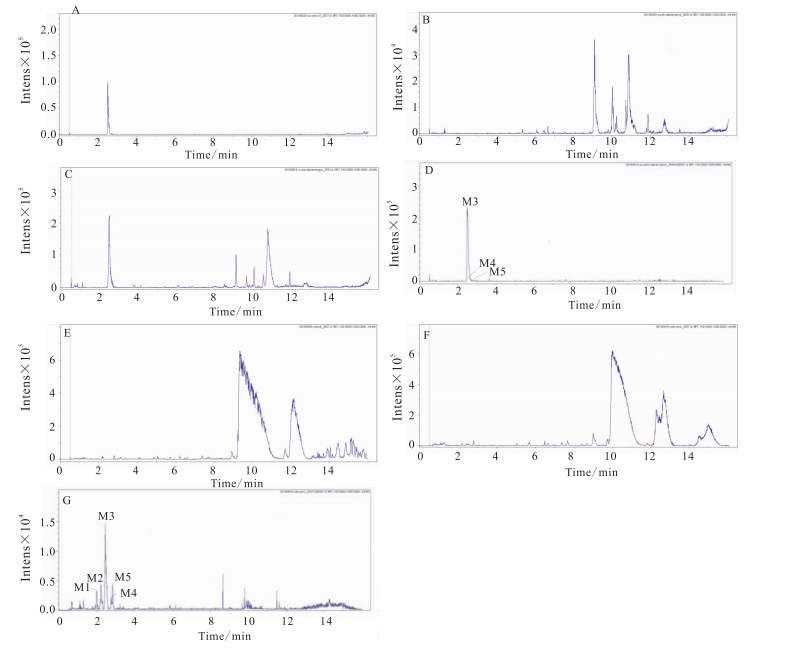
|
| Fig 3 Base peak chromatograms of zebrafish in vitro solution and in vivo after combination being exposed to zebrafish for 24 h and different chromatograms from protocatechuic acid in negative mode A:Blank drug; B:In vitro solution of blank zebrafish; C:In vitro solution of zebrafish with drug; D:Different chromatograms of C and D; E:In vivo of blank zebrafish; F:In vivo of zebrafish with drug; G:Different chromatograms of F and G |
由Metabolite Detect软件得到的差异图谱 (Fig 3) 中可知,在2.7、2.9 min处分别存在m/z 246.993 8、246.991 2[M-H]-峰的化合物,显示167.035 1[M-H-SO3]-、153.020 1[M-H-SO3-CH2]-、109.030 1[M-H-SO3-CH2-COO]-的主要碎片离子峰,推测TR 2.7、2.9 min的M4、M5为原儿茶酸甲基硫酸化代谢产物[14]。
2.2.3 硫酸化代谢产物鉴定由Metabolite Detect软件得到的差异图谱 (Fig 3) 中可知,在2.0、2.2 min处分别存在m/z 232.976 6、232.975 1[M-H]-峰的化合物,显示153.020 1[M-H-SO3]-的主要碎片离子峰,由SmartFormula预测的化学式分别为C7H5O7S、C7H5O4,且其保留时间较原儿茶酸缩短,亲水性增加,推测TR 2.0、2.2 min的M1、M2为原儿茶酸硫酸化代谢产物[14]。
2.2.4 原儿茶酸代谢产物及可能的代谢途径见Fig 4。
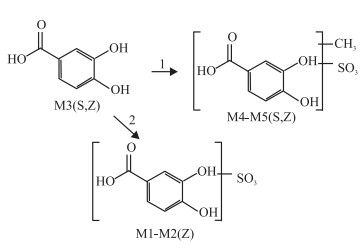
|
| Fig 4 The major metabolites of protocatechuic acid and possible biotransformation pathways in vitro andin vivo zebrafish 1: methylation and sulfate conjugation; 2: sulfate conjugation; Z: in vivoof zebrafish; S: in vitro solution of zebrafish |
经Metabolite Detect软件处理后,检测到原儿茶酸在模式生物斑马鱼中的体内外代谢产物,见Tab 3。
| No. | Metabolic pathway | m/z Found | PPM | RT/min | Formula | Source |
| M1 | Sulfate conjugation | 232.976 6 | -2.1 | 2.0 | C7H5O7S | Z |
| M2 | Sulfate conjugation | 232.975 1 | 4.6 | 2.2 | C7H5O7S | Z |
| M3 | Parent | 153.019 8 | -6.3 | 2.5 | C7H5O4 | Z, S |
| M4 | Methylation+sulfate conjugation | 246.993 8 | 2.3 | 2.7 | C8H7O7S | Z, S |
| M5 | Methylation+sulfate conjugation | 246.991 2 | 1.7 | 2.9 | C8H7O7S | Z, S |
| Z:in vivo of zebrafish; S: in vitro solution of zebrafish | ||||||
本实验运用具有高通量、高重复性、离子传输效率高等优势的UHPLC-Q-TOF /MS技术进行体外代谢实验研究。以模式生物斑马鱼为动物模型,分别考察头花蓼有效组分中具有代表性且与其药理活性密切相关的2个酚酸类成分 (没食子酸、原儿茶酸) 的代谢规律;通过没食子酸和原儿茶酸在斑马鱼和大鼠体内的代谢途径比较,酚酸类化合物在生物体内主要以甲基硫酸化、葡萄糖醛酸化、硫酸化形式存在[15]。结合Metabolite Predict、MetaboliteDetect、MDF及SmartFormula等数据处理技术,分析生物样品中的代谢产物,在斑马鱼鱼体组织中能检测到没食子酸、原儿茶酸的原型成分,表明头花蓼有效组分中没食子酸、原儿茶酸均能吸收进入斑马鱼体内;同时检测到没食子酸及原儿茶酸的甲基硫酸化和硫酸化产物,这与没食子酸和原儿茶酸在大鼠体内代谢产物基本一致[13-15],揭示没食子酸和原儿茶酸在斑马鱼体内的代谢途经类似现有模型的Ⅱ相代谢反应。这为探讨模式生物斑马鱼用于头花蓼有效组分中多成分代谢研究的可行性及合理性提供了可靠的实验依据,也为阐明该药对在体内发挥疗效的药效物质基础和作用机制提供了科学依据。
| [1] | 刑学锋, 马钦海, 徐成贺, 等. 斑马鱼模型在中医药研究中的应用[J]. 中国中医药现代远程教育, 2014, 12 (16): 154-6. Xing X F, Ma Q H, Xu C H, et al. Application of zebrafish model in the research of traditional Chinese medicine[J]. Chin Med Mod Distance Educ China, 2014, 12 (16): 154-6. |
| [2] | 王荣春, 韩利文, 陈锡强, 等. 利用斑马鱼模型研究芦荟大黄素对宫颈癌细胞SiHa的抑制作用[J]. 山东科学, 2016, 29 (2): 14-8. Wang R C, Han L W, Chen X Q, et al. Inhibitory effect of aloe emodine on cervical cancer cell line SiHa with zebrafish xenograft model[J]. Shandong Sci, 2016, 29 (2): 14-8. |
| [3] | 赵琪, 汪溪洁, 马璟. 斑马鱼模型在药物非临床毒代动力学研究中的应用[J]. 中国药理学与毒理学杂志, 2015, 29 (4): 621-5. Zhao Q, Wang X J, Ma J. Application of zebrafish in non-clinical drug toxicokinetics research[J]. Chin J Pharmacol Toxicol, 2015, 29 (4): 621-5. |
| [4] | 辛胜昌, 赵艳秋, 李松, 等. 斑马鱼模型药物筛选中的应用[J]. 遗传, 2012, 34 (9): 1144-52. Xing S C, Zhao Y Q, Li S, et al. Application of zebrafish models in drug screening[J]. Hereditas, 2012, 34 (9): 1144-52. |
| [5] | 刘可春, 孙晨, 王希敏, 等. 斑马鱼模型在药物早期安全性评价中的应用[J]. 山东科学, 2014, 27 (5): 1-8. Liu K C, Sun C, Wang X M, et al. Application of zebrafish model in early safety evaluation of drugs[J]. Shandong Sci, 2014, 27 (5): 1-8. |
| [6] | 王洪平, 曹芳, 杨秀伟. 头花蓼地上部分的化学成分研究[J]. 中草药, 2013, 44 (1): 24-30. Wang H P, Cao F, Yang X W. Chemical constituents in aerial parts of Polygonum capitatum[J]. Chin Tradit Herb Drugs, 2013, 44 (1): 24-30. |
| [7] | 刘跃, 胡杰, 谢玉敏, 等. UPLC-MRM-MS法同时测定头花蓼药材中7个指标成分[J]. 天然产物研究与开发, 2015, 27 (1): 73-6. Liu Y, Hu J, Xie Y M, et al. Determination of seven components in Polygonum capitaum by UPLC-MRM-MS[J]. Nat Prod Res Dev, 2015, 27 (1): 73-6. |
| [8] | 荆文光, 赵叶, 张开霞, 等. 头花蓼水提物化学成分研究[J]. 时珍国医国药, 2015, 26 (1): 47-50. Jing W G, Zhao Y, Zhang K X, et al. Study on the chemical constituents from aqueous of Polygonum capitatum[J]. Lishizhen Med Mater Res, 2015, 26 (1): 47-50. doi:10.1007/s10856-015-5393-7 |
| [9] | 杨阳, 杨颖博, 朱斌, 等. 头花蓼的化学成分Ⅱ[J]. 中国实验方剂学杂志, 2011, 17 (23): 92-4. Yang Y, Yang Y B, Zhu B, et al. Chemical constituents of Polygonum capitatum Ⅱ[J]. Chin J Exp Tradi Med Formul, 2011, 17 (23): 92-4. |
| [10] | 李占彬, 杨鸿波, 谭红, 等. 贵州特色中药头花蓼中六种酚酸类有效成分的HPLC-MS/MS同时测定[J]. 时珍国医国药, 2015, 26 (4): 850-2. Li Z B, Yang H B, Tan H, et al. Simultaneous determination of six kinds of Guizhou traditional Chinese medicine effective components of phenolic acids in Polygonum capitatum by HPLC-MS/MS[J]. Lishizhen Med Mater Res, 2015, 26 (4): 850-2. |
| [11] | 孙长生, 梁斌, 王传芳. 头花蓼研究进展[J]. 中药研究与信息, 2005, 7 (4): 26-8. Sun C S, Liang B, Wang C F. Research progress of Polygonum capitatum[J]. Res Inf Tradit Chin Med, 2005, 7 (4): 26-8. |
| [12] | 张丽娟, 廖尚高, 詹哲浩. 头花蓼酚酸类化学成分研究[J]. 时珍国医国药, 2010, 21 (8): 1946-7. Zhang L J, Liao S G, Zhan Z H. Study on chemical constituents of Polygonum capitatum phenolic acids[J]. Lishizhen Med Mater Res, 2010, 21 (8): 1946-7. |
| [13] | 丁雯, 钱大伟, 段金廒, 等. 当归赤芍药对中阿魏酸和没食子酸在大鼠血浆和尿液中的代谢物研究[J]. 中国中药杂志, 2012, 37 (3): 366-71. Ding W, Qian D W, Duan J A, et al. Study on metabolites of ferulic acid and gallic acid compatible with Danggui and Chihao in rat plasma and urine[J]. China J Chin Mater Med, 2012, 37 (3): 366-71. |
| [14] | 姜璇, 金艺, 袁波, 等. 复方丹参滴丸的体内代谢产物分析[J]. 沈阳药科大学学报, 2012, 29 (2): 126-31. Jiang X, Jin Y, Yuan B, et al. Analysis on the metabolites of compound prescription salvia miltiorrhiza drop pill in vivo of rats[J]. J Shenyang Pharm Univ, 2012, 29 (2): 126-31. |
| [15] | 斯日古楞, 刘洪涛. 中药酚酸的体内代谢研究进展[J]. 亚传统医药, 2008, 4 (6): 49-51. Si R G L, Liu H T. Research progress on metabolism of phenolic acids in vivo[J]. Asia-Pacific Tradit Med, 2008, 4 (6): 49-51. |

