


2. 江苏省中西医结合老年病防治重点实验室,江苏 扬州 225001
2. Jiangsu Key Laboratory of IntegratedTraditional Chinese and Western Medicine for Prevention and Treatment of Senile Diseases, Yangzhou Jiangsu 225001, China
雷公藤内酯醇 (triptolide, TP) 是中国传统中药雷公藤 (Tripterygium wilfordii) 的主要活性物质,具有抗炎、抗肿瘤和免疫抑制等多种药理活性[1]。采用大鼠的整体实验研究表明,TP可诱导大鼠体内几种CYPs[2]。而体外肝细胞模型能否复制体内TP对CYPs的诱导作用,另一重要的代谢酶亚家族CYP2D能否被诱导,以及TP对CYPs的诱导作用机制未见报道。因此,本研究对大鼠原代肝细胞在TP作用后CYPs、核受体及转录因子p53的表达进行了分析。此外,为考察TP对CYPs的诱导作用是否可能在人体发生,本研究对人源的HepG2肝癌细胞在TP作用下CYPs的表达变化进行了分析。
1 材料与方法 1.1 试剂雷公藤内酯醇 (四川维克奇生物制品有限公司,纯度≥98%,溶于二甲基亚砜DMSO),I型鼠尾胶原蛋白 (生友生物技术有限公司),胶原酶IV型 (Sigma),HBSS (+) 和HBSS (-)(上海生工),Percoll (Pharmacia),0.4%台盼蓝染液 (Solarbio),7-乙基香豆素 (7-EC,Sigma),T4 Ligase (New England BioLAB),感受态大肠杆菌 (DH5α,宝生物公司),反转录试剂盒 (HiScript Q RT SuperMix for qPCR,Vazyme),Taqman法实时定量PCR试剂盒 (FastStart Universal Probe Master,Roche),Taqman探针 (Life technologies),SYBR Green法实时定量PCR试剂盒 (FastStart Essential DNA Green Master,Roche),鼠抗CYP3A4(Millipore),兔抗p53(Proteintech),兔抗CAR (Proteintech),兔抗PXR (Proteintech),鼠抗GAPDH (KANGCHEN),山羊抗鼠IgG、山羊抗兔IgG (北京中杉金桥生物技术有限公司)。
1.2 仪器CO2培养箱 (Thermo),FluorChem E多功能成像分析系统 (Proteinsimple公司),荧光酶标仪 (Biotech公司),LC/MS/MS (AB公司),电泳系统 (Biored公司),实时定量PCR仪 (Roche公司)。
1.3 动物清洁级Wistar大鼠,♂,体质量 (195±15) g,购自扬州大学医学比较中心[动物合格证号:SCXK (苏)2012-0004]。
1.4 大鼠原代肝细胞的分离与培养大鼠原代肝细胞采取两步胶原酶灌注法分离。Wistar大鼠用质量分数为1%的水合氯醛 (ip) 麻醉后暴露腹腔,门静脉流入37 ℃灌注液 (NaCl 0.142 mol·L-1、KCl 6.7 mmol·L-1、HEPES 0.01 mol·L-1、EDTA 0.05 mmol·L-1,pH=7.4,流速10 mL·min-1),同时剪开腹静脉。肝脏灌注至黄白色后换成胶原酶溶液[0.5 g·L-1溶于HBSS (+),37 ℃]灌注15 min。移出肝脏用HBSS (-) 清洗,于HBSS (-) 中去除肝叶表面的膜并轻挑肝脏,采用200目细胞筛过滤细胞悬液至50 mL离心管中。4 ℃、126×g离心细胞悬液1 min两次。用体积分数为28%的Percoll重悬细胞后4 ℃、126×g离心10 min,移去上清。用DMEM培养基 (含有10%胎牛血清、100 kU·L-1青霉素和100 mg·L-1链霉素、MEM NEAA 2 mmol·L-1、HEPES 10 mmol·L-1) 重悬细胞,0.4%台盼蓝染液1 :1稀释后细胞计数,每孔4×105接种于Ⅰ型鼠尾胶原蛋白包被的6孔板。于37 ℃、5% CO2培养箱中培养12 h后用TP (0、50、100 nmol·L-1) 处理,每12 h更换含药培养基。
1.5 p53敲低的HepG2细胞的建立由于HepG2细胞直接转染效率较低,采用慢病毒建立p53敲低的HepG2细胞株。合成p53 shRNA编码序列 (序列在Sigma mission shRNA的基础上修改所得,见Tab 1) 后进行退火反应,形成带有粘性末端的双链序列。采用T4 Ligase将上述退火产物与BbsI酶切后的MSCV-puro-BbsI进行连接反应,连接产物转化至感受态大肠杆菌,挑选阳性克隆并测序鉴定,获得质粒分别命名为MSCV-puro-532和MSCV-puro-533。分别将上述构建好的质粒或阴性对照MSCV-puro-SCR与pCMV-Gag-Pol和pCMV-VSV-G (DNA含量分别为1.8、0.6、0.6 μg) 共转染至293T细胞,24 h后使用293T细胞培养基感染HepG2细胞。培养48 h后更换含2 mg·L-1嘌呤霉素的培养基,再培养72 h,之后用1 mg·L-1嘌呤霉素维持培养,获得的细胞命名为HepG2-532、HepG2-533和HepG2-SCR。
| Forward primer (5′→3′) | Reverse primer (5′→3′) | |
| p53-sh2 | AAAACACCATCCACTACAACTACATGTCGACATGTAGTTGTAGTGGATGGTG | |
| p53-sh3 | AAAAGTCCAGATGAAGCTCCCGAAGTCGACTTCTGGGAGCTTCATCTGGAC | |
| Rat CYP2C6 | ATGGCAGCCCTGCCTCCTCT | GGCATGCGGCTCCTGTCCTG |
| Rat CYP2C7 | TGCCTTTCTCAGCAGGAAAACGAGC | ACAACTGCATGCGGGCCAGG |
| Rat CYP2C12 | TGATTGGGAGACACCGCAGCC | AGGGCATGTGGATCCTGTCCAAC |
| Rat PXR | GGAGGGCAGGGGCTGACAGA | GAAACACCGCAGGTAGCCGGA |
| Rat CAR | GGCGCCCACACTCGTCATGT | GCCGGAGGCCTGAACTGCAC |
| Human CYP1A1 | AAGGGGCGTTGTGTCTTTGT | ATACACTTCCGCTTGCCCAT |
| Human CYP2B6 | AGACGCCTTCAATCCTGACC | CCTTCACCAAGACAAATCCGC |
| Human CYP2C9 | AGGAAAAGCACAACCAACCA | TCTCAGGGTTGTGCTTGTC |
| Human CYP2C19 | GCAGGAAAACGGATTTGTGT | GTCAAGGTCCTTTGGGTCAA |
| Human CYP2E | TCAATCTCTGGACCCCAACTGT | AGTCACGGTGATACCGTCCATT |
| Human CYP3A4 | CACAGATCCCCCTGAAATTAAGCTTA | AAAATTCAGGCTCCACTTACGGTG |
TP处理大鼠原代肝细胞或HepG2细胞48 h后,TRIzol法提总RNA进行反转录。Taqman探针法检测大鼠CYP1A2、2B1、2D2、2E1、3A1和3A9的mRNA的表达变化。SYBR Green法检测大鼠的CYP2C6、2C7、2C12、PXR和CAR,以及人CYP1A1、2B6、2C9、2C19、2E1和3A4的mRNA的表达变化,SYBR Green引物序列见Tab 1。
1.7 Western blot检测蛋白表达水平TP (0,50和100 nmol·L-1) 处理大鼠原代肝细胞后,RIPA裂解液提取总蛋白,BCA法测蛋白浓度,以50 μg上样,电泳转膜,封闭1 h,分别加一抗CYP3A4(1 :1 000)、p53(1 :1 000)、CAR (1 :1 000)、PXR (1 :1 000) 和GAPDH (1 :1 000) 于4 ℃孵育过夜,洗膜后加二抗,室温孵育1 h。ECL显色,用FluorChem E多功能成像分析系统成像。
1.8 CYPs活性检测全CYPs活性采用7-EC检测。大鼠原代肝细胞2×105接种于12孔板,用TP处理72 h后,更换含7-乙基香豆素的培养基继续孵育30 min,收集培养基,剩余细胞采用BCA法测蛋白浓度。培养基加等体积乙醇沉淀蛋白,13 000×g离心后,采用荧光酶标仪,于350 nm下激发,检测450 nm发射光,该结果采用每孔蛋白含量进行标准化。大鼠原代肝细胞2×106接种于培养皿,采用TP (0、50、100 nmol·L-1) 处理72 h后,细胞刮刀取全部细胞离心并用PBS清洗两次,细胞重悬于磷酸钾缓冲液 (100 mmol·L-1,pH 7.4) 中,玻璃匀浆器研磨后于9 000×g离心,所得上清为S9。睾酮 (250 μmol·L-1) 或丁呋洛尔 (70 μmol·L-1) 分别与含MgCl2(5 mmol·L-1)、NADPH (1 mmol·L-1) 和S9(0.225 g·L-1) 的磷酸钾缓冲液 (100 mmol·L-1,pH 7.4) 于37 ℃下孵育30 min,反应产物6β-羟基睾酮和1-羟基丁呋洛尔采用LC/MS/MS检测[3]。
1.9 统计学分析数据统计分析采用Graph Pad Prism 6软件,结果以x±s表示,组内比较采用ANOVA检测。
2 结果 2.1 TP诱导大鼠原代肝细胞中CYPs的表达和活性TP处理大鼠原代肝细胞后,qRT-PCR检测CYPs mRNA的变化。该结果与整体实验的趋势相似[2],TP可诱导大鼠原代肝细胞内的CYP1A2、2C11、2E1、3A1的mRNA的表达,50 nmol·L-1下的诱导倍数分别为18.5、31.2、88.3、34.0,100 nmol·L-1下的诱导倍数分别为20.3、29.6、83.0、38.5(Fig 1A~1D)。该结果提示,大鼠原代肝细胞可能成为研究TP对CYPs诱导的体外模型。应用该模型,研究发现CYP2C7、2C12和2D2的mRNA水平也被TP诱导,50 nmol·L-1下的诱导倍数分别为2.2、3.2和21.5,100 nmol·L-1下的诱导倍数分别为4.6、23.1和61.1(Fig 1E~1G)。Western blot实验结果显示,TP可导致CYP3A的蛋白水平上调 (Fig 2),提示了蛋白上调与mRNA上调一致。
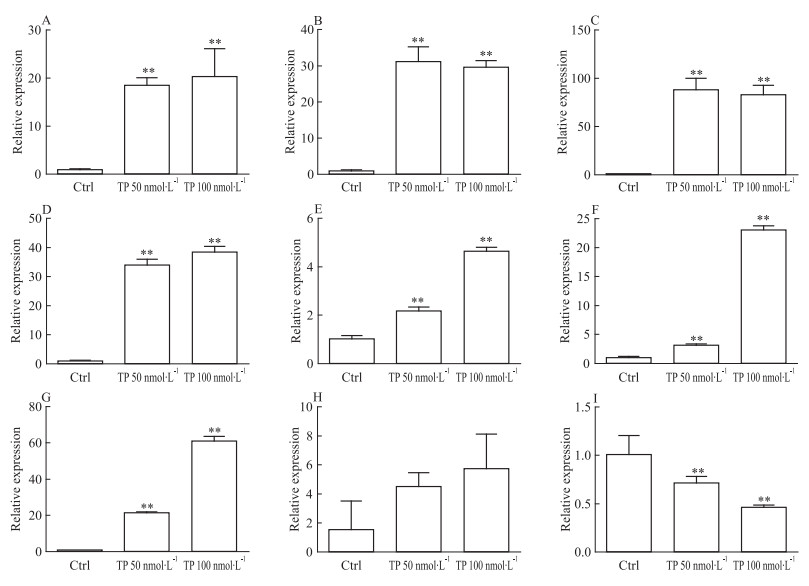
|
| Fig 1 Changes of mRNA level of CYP1A2(A), CYP2C11(B), CYP2E1(C), CYP3A1(D), CYP2C7(E), CYP2C12(F), CYP2D2(G), CYP2B1(H) and CYP3A9(I) in rat primary hepatocytes after triptolide treatment **P < 0.01vs control group |
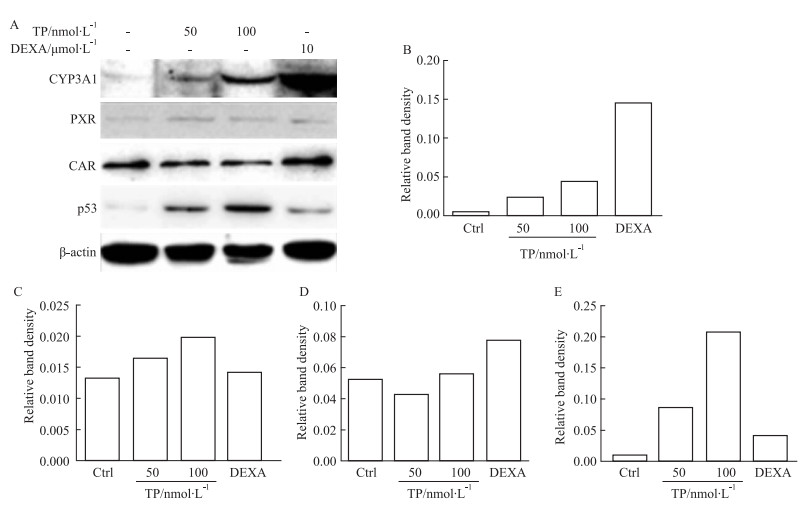
|
| Fig 2 Western blot results (A) and relative band density of CYP3A (B), PXR (C), CAR (D) and p53(E) in rat primary hepatocytes after triptolide treatment |
大鼠原代肝细胞在TP处理72h后,采用全CYPs底物7-EC共孵育,7-EC的生成速率明显上调,提示TP可能诱导大鼠原代肝细胞内的CYPs活性 (Fig 3A)。制备S9进行体外代谢反应,结果与整体实验趋势一致[2],TP导致6β-羟基睾酮的生成速率加快 (Fig 3B),提示该体外原代肝细胞模型可作为TP对CYPs诱导的研究模型。由于本研究首次报道CYP2D2的mRNA水平被诱导,因此对TP处理大鼠原代肝细胞后的S9代谢丁呋洛尔为1-羟基丁呋洛尔的代谢速率进行分析,发现1-羟基丁呋洛尔的生成速率上升约1.7倍 (Fig 3C),提示TP在表达和酶活性水平均可诱导CYP2D2。
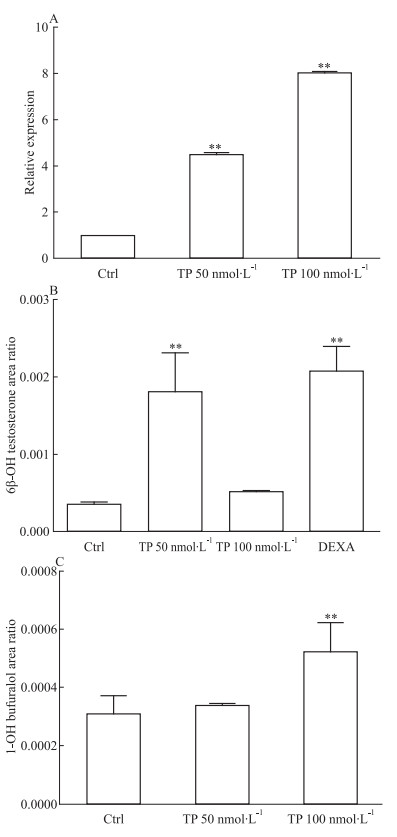
|
| Fig 3 Changes of metabolic rate of 7-EC (A), testosterone (B) and bufuralol (C) in rat primary hepatocytes after triptolide treatment **P < 0.01 vs control group |
核受体是CYPs表达调控的重要分子,因此采用qRT-PCR及Western blot对TP作用后核受体CAR和PXR的表达量进行分析。结果显示在TP作用后CAR和PXR的mRNA水平下调 (Fig 4A、4B),50 nmol·L-1 TP处理下,CAR和PXR的mRNA水平分别为对照组的0.8和0.3倍,而100 nmol·L-1 TP处理后分别为0.2和0.1倍,但是蛋白水平变化不明显 (Fig 2)。
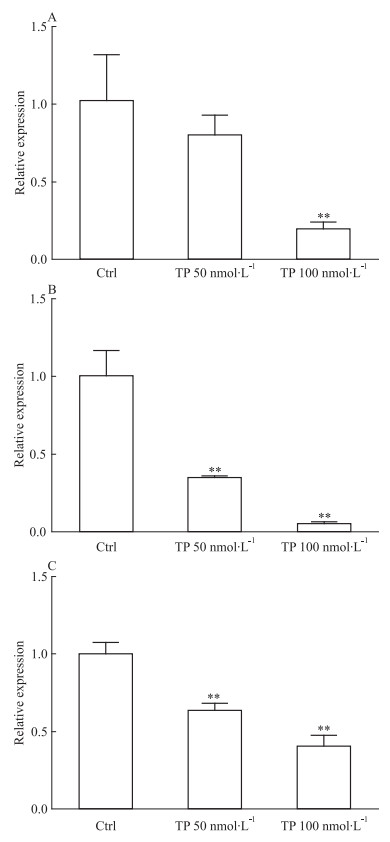
|
| Fig 4 Changes of mRNA level of CAR (A), PXR (B) and P-gp (C) in rat primary hepatocytes after triptolide treatment **P < 0.01 vs control group |
该结果提示TP可能不通过诱导核受体CAR和PXR而提高CYPs的表达,但由于核受体表达量的变化不能完全反映其活性,而其下游靶基因的表达水平可间接反映核受体活性。为进一步检测PXR与CAR的活性的可能变化,我们检测了其下游靶基因P-糖蛋白 (P-gp) 的mRNA水平。结果表明,TP作用下P-gp的mRNA水平下调 (Fig 4C),在50、100 nmol·L-1的TP作用下,分别为对照组的0.6和0.4倍,提示了PXR和CAR活性水平的下调。该结果表明,TP可能不活化核受体PXR和CAR,因此核受体可能并不参与TP对CYPs的诱导。
2.3 转录因子p53的表达据报道p53可能诱导CYPs的转录调控,进而导致CYPs活性上调[4-6]。在50、100 nmol·L-1的TP处理CYPs后,p53蛋白水平上调 (Fig 2)。为进一步检测p53在TP调控CYPs中的作用,将p53抑制剂Pifithrin-α hydrobromide与TP共同作用于大鼠原代肝细胞后,提取总RNA并检测CYPs的mRNA水平变化。结果显示,100 nmol·L-1的TP对大鼠CYP1A2、2D2、2E1和3A1诱导倍数分别为100.5、130.6、426.4、420.0倍;加入p53抑制剂后,诱导倍数分别为17.2、22.3、111.1、22.0。该结果表明p53抑制后,TP对细胞内CYP1A2、2D2、2E1和3A1的诱导能力降低。但p53抑制剂对TP诱导CYP2C7的作用无明显影响。p53抑制剂导致TP对CYP2C11、2C12的诱导能力提高 (Fig 5),100 nmol·L-1的TP对上述两酶的诱导倍数分别为29.6和13.0,加入p53抑制剂后,诱导倍数分别为45.9和34.8。该结果提示,p53可能在TP对CYPs诱导作用中发挥作用。
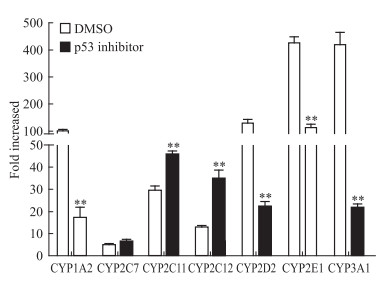
|
| Fig 5 Changes of mRNA level of CYP1A2, CYP2D2, CYP2E1, CYP3A1, CYP2C7, CYP2C11 and CYP2C12 when rat primary hepatocytes were co-treated with triptolide (100 nmol·L-1) and p53 inhibitor (pifithrin-α hydrobromide, 20 μmol·L-1) **P < 0.01 vs DMSO group |
由于人与大鼠CYPs的诱导调控机制可能存在种属的差异,因此本研究采用HepG2细胞以考察TP是否也可通过p53信号途径诱导CYPs的表达。在HepG2-SCR细胞中,50 nmol·L-1 TP诱导CYP1A1、2B6、2C9、2C19、2D6、2E1和3A4的mRNA表达,分别为48.0、20.8、114.0、67.8、36.4、6.2和21.0倍。因为HepG2细胞中核受体PXR和CAR表达极低或缺失[8-9],该结果提示在人源肝细胞模型中,TP对CYPs的诱导作用可能也可不通过这两个核受体。在p53敲低的HepG2-532和HepG2-533细胞中,CYP2C9和CYP3A4的诱导在两株细胞中均被抑制 (Fig 6),提示TP在HepG2细胞中对这两个酶的诱导作用可能通过p53。
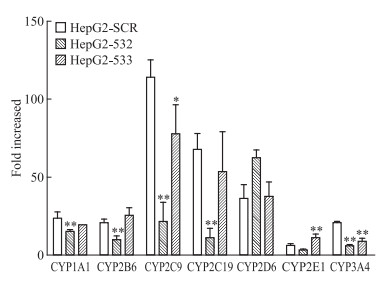
|
| Fig 6 Changes of mRNA level of CYP1A1, CYP2B6, CYP2C9, CYP2C19, CYP2D6, CYP2E1 and CYP3A4 in HepG2-SCR, HepG2-532 and HepG2-533 cells after 50 nmol·L-1 triptolide treatment **P < 0.01 vs HepG2-SCR group |
前期研究表明,TP灌胃后大鼠肝内的CYP1A2、2C11、2E1、3A1可被诱导[2]。但体内CYPs的调控可能是复杂的过程,其表达可能与体内的微环境变化相关,包括内源性的氧化类固醇、胆汁酸、雄激素、孕激素、肾上腺素和炎症因子等。为进一步确认TP对CYPs的诱导作用是否可在肝细胞水平上发生或依赖于体内环境的变化,本研究采用大鼠原代肝细胞对TP的诱导作用进行了检测。结果发现大鼠原代肝细胞内CYP1A2、2C11、2E1、3A1的表达均被TP诱导,与体内实验结果一致。因此本研究结果提示,大鼠原代肝细胞可成为TP对CYPs诱导研究的体外模型。应用大鼠原代肝细胞的模型,本研究发现TP也可诱导CYP2C7、2C12、2D2的表达。应用HepG2细胞的实验结果表明,TP可诱导人CYP1A1、2B6、2C9、2C19、2D6、2E1、3A4的表达。结果表明,TP对CYPs的诱导作用可发生在肝细胞水平,大鼠原代肝细胞和人HepG2细胞均可成为研究TP对CYPs的诱导机制的体外模型。
据报道,TP能够被人和大鼠体内CYP3A代谢为低毒的羟基化产物[7],并可能抑制CYPs的活性,提示TP与其他药物共服可能诱导药药相互作用 (DDI)。但值得注意的是,TP对CYP1A2和CYP3A4的IC50分别为14.18、8.36 μmol·L-1[8],但在服用雷公藤多苷片的个体中,Cmax约在182~441 nmol·L-1[9],因此在正常用药的情况下,发生直接基于TP抑制代谢酶的DDI的可能性较低。而本研究发现在50~100 nmol·L-1的浓度下,TP可诱导CYPs在大鼠原代肝细胞和人肝癌细胞中的CYPs表达,包括对临床药物代谢居前3位的CYP3A、2D、2C。鉴于雷公藤常与非甾体抗炎药 (主要代谢酶为CYP2C) 联合用于治疗类风湿性关节炎[10],本研究结果提示TP与非甾体类抗炎药共服,产生基于代谢酶诱导的DDI的可能性可能高于基于代谢酶抑制的DDI。
核受体是CYPs调节的关键分子,NR1I家族的PXR和CAR可诱导包括CYP1、CYP2和CYP3家族在内的多种CYPs的表达[11-12]。但在本研究中,TP作用后PXR和CAR的蛋白表达水平均无明显变化,且这两个核受体下游基因P-gp的表达水平也下调,表明PXR和CAR的活性下调;同时TP可诱导缺乏PXR和CAR这两种核受体表达的HepG2细胞中的CYPs[13-14],该结果表明,TP对CYPs的诱导作用可能不依赖核受体PXR和CAR的作用。
据报道,p53通过结合p53反应元件诱导CYP1A1、CYP2A6和CYP3A4基因的表达[4-6]。我们前期研究表明在LNCaP细胞内TP作用可以上调p53蛋白[15]。在大鼠原代肝细胞中,我们发现TP作用后p53的蛋白水平也发生了上调,进一步采用p53抑制剂后,CYP1A2、2D2、2E1、3A1的上调作用被抑制。而在HepG2细胞中,CYP3A4和2C9的上调也被抑制。该结果提示,TP对部分CYPs的诱导可能是通过p53发生的,但不同种属间可能存在调控差异。
综上,本研究发现大鼠原代肝细胞可能成为研究TP对CYPs的诱导作用的体外模型;TP可在nmol·L-1级的浓度下诱导大鼠原代肝细胞和人肝癌细胞HepG2中CYPs的表达,其对部分CYPs的诱导作用可能是通过核受体p53的上调实现的,核受体PXR和CAR可能在该过程中不发挥作用;TP对CYPs的诱导作用可能引发同服药物的相互作用的可能性。
( 致谢: 感谢转化医学实验中心的老师和同学技术指导和帮助。 )
| [1] | 张军, 陈玟, 刘史佳, 等. LC/APCI/MS/MS测定Beagle犬口服雷公藤片后血浆中雷公藤甲素[J]. 中国药理学通报, 2013, 29 (12): 1765-8. Zhang J, Chen M, Liu S J, et al. LC/APCI/MS/MS analysis for plasma concentration of triptolide in Beagle dogs following oral administration of tripterygium tablets[J]. Chin Pharmacol Bull, 2013, 29 (12): 1765-8. |
| [2] | Han F M, Peng Z H, Wang J J, Chen Y. In vivo effect of triptolide combined with glycyrrhetinic acid on rat cytochrome P450 enzymes[J]. Yao Xue Xue Bao, 2013, 48 (7): 1136-41. |
| [3] | Yu C, Shin Y G, Kosmeder J W, et al. Liquid chromatography/tandem mass spectrometric determination of inhibition of human cytochrome P450 isozymes by resveratrol and resveratrol-3-sulfate[J]. Rapid Commun Mass Spectrom, 2003, 17 (4): 307-13. doi:10.1002/(ISSN)1097-0231 |
| [4] | Wohak L E, Krais A M, Kucab J E, et al. Carcinogenic polycyclic aromatic hydrocarbons induce CYP1A1 in human cells via a p53-dependent mechanism[J]. Arch Toxicol, 2016, 90 (2): 291-304. doi:10.1007/s00204-014-1409-1 |
| [5] | Goldstein I, Rivlin N, Shoshana OY, et al. Chemotherapeutic agents induce the expression and activity of their clearing enzyme CYP3A4 by activating p53[J]. Carcinogenesis, 2013, 34 (1): 190-8. doi:10.1093/carcin/bgs318 |
| [6] | Hu H, Yu T, Arpiainen S, et al. Tumour suppressor protein p53 regulates the stress activated bilirubin oxidase cytochrome P450 2A6[J]. Toxicol Appl Pharmacol, 2015, 289 (1): 30-9. doi:10.1016/j.taap.2015.08.021 |
| [7] | Li W, Liu Y, He Y Q, et al. Characterization of triptolide hydroxylation by cytochrome P450 in human and rat liver microsomes[J]. Xenobiotica, 2008, 38 (12): 1551-65. doi:10.1080/00498250802503359 |
| [8] | Zhang H, Ya G, Rui H. Inhibitory effects of triptolide on human liver cytochrome P450 enzymes and P-glycoprotein[J]. Eur J Drug Metab Pharmacokinet, 2016 . |
| [9] | 李颖, 汪永忠, 罗欢, 等. 类风湿关节炎患者雷公藤甲素血清浓度测定及其药动学研究[J]. 中国中医药信息杂志, 2014, 21 (1): 85-7. Li Y, Wang Y Z, Luo H, et al. Determination of serum concentration of triptolide in patients with rheumatoid arthritis and its pharmacokinetics study[J]. Chin J Inf Tradit Chin Med, 2014, 21 (1): 85-7. |
| [10] | 焦娟, 唐晓颇, 员晶, 等. 复方雷公藤外敷剂对类风湿关节炎患者关节疼痛的影响[J]. 中国中西医结合杂志, 2016, 36 (1): 29-34. Jiao J, Tang X P, Yuan J, et al. Effect of external applying compound tripterygium wilfordii Hook F. on joint pain of rheumatoid arthritis[J]. Chin J Integr Tradit West Med, 2016, 36 (1): 29-34. |
| [11] | Chai X, Zeng S, Xie W. Nuclear receptors PXR and CAR: implications for drug metabolism regulation, pharmacogenomics and beyond[J]. Expert Opin Drug Metab Toxicol, 2013, 9 (3): 253-66. doi:10.1517/17425255.2013.754010 |
| [12] | 周涛, 王宇光, 马增春, 等. 银杏内脂B通过激活孕烷X受体诱导CYP3A4的表达[J]. 中国药理学通报, 2014, 30 (7): 926-31. Zhou T, Wang Y G, Ma Z C, et al. Ginkgolide B induces CYP3A4 expression through activation of human pregnane X recptor[J]. Chin Pharmacol Bull, 2014, 30 (7): 926-31. |
| [13] | Naspinski C, Gu X, Zhou G D, et al. Pregnane X receptor protects HepG2 cells from BaP-induced DNA damage[J]. Toxicol Sci, 2008, 104 (1): 67-73. doi:10.1093/toxsci/kfn058 |
| [14] | Fahmi O A, Raucy J L, Ponce E, et al. Utility of DPX2 cells for predicting CYP3A induction-mediated drug-drug interactions and associated structure-activity relationships[J]. Drug Metab Dispos, 2012, 40 (11): 2204-11. doi:10.1124/dmd.112.047456 |
| [15] | Li W, Liu Y, Li X X, et al. MAPKs are not involved in triptolide-induced cell growth inhibition and apoptosis in prostate cancer cell lines with different p53 status[J]. Planta Medica, 2011, 77 (1): 27-31. doi:10.1055/s-0030-1250076 |

