


急性痛风性关节炎 (acute gouty arthritis,AGA),是体内嘌呤代谢紊乱血尿酸升高,导致尿酸钠盐 (monosodium urate,MSU) 晶体在关节及周围组织沉积所引起的炎症反应。目前是危害人类健康的严重代谢性疾病,随着生活水平的提高,发病率逐年升高[1-2]。萆薢 (Dioscorea hypoglauca) 来源于薯蓣科植物粉萆薢 (Dioscorea hypoglauca polibin) 的干燥根茎,具有利湿浊、祛风湿之功效,主治膏淋、风湿痹痛、湿疹,含甾体皂苷1.1%-2.6%[3],是临床上治疗痛风和高尿酸血症的代表药物。课题组前期研究显示,萆薢总皂苷 (total saponin of Dioscorea,TSD) 可通过调节肾脏尿酸转运蛋白-1 (uric acid transporter 1,URAT1) 表达,促进尿酸排泄,防治高尿酸血症[4]。最新研究发现[5-7],固有免疫直接参与痛风的发展,多种固有免疫细胞参与识别并吞噬MSU晶体,激活胞内的信号转导,最终调节炎性细胞因子如白细胞介素-1β(interleukin-1β, IL-1β) 等的产生和成熟,其中NALP3(nod-like receptor protein 3,NALP3) 炎性体 (NALP3 inflammasome) 的形成是重要的信号活化产物。本实验以MSU诱导大鼠AGA模型,从与AGA急性发作相关的细胞因子TNF-α、IL-1β、IL-18入手,进一步研究TSD对大鼠关节滑膜组织NALP3炎性体相关蛋白的影响,阐明TSD防治AGA的可能作用机制,为TSD的临床应用提供实验依据。
1 材料与方法 1.1 药品与试剂萆薢总皂苷 (本课题组提供[8],批号201501)。尿酸 (Sigma公司, 10010995);秋水仙碱片 (西双版纳药业有限责任公司,H53021369);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-1β、IL-18酶联免疫吸附 (ELISA) 检测试剂盒 (武汉博士德科技有限公司,EK0393、EK0592、EK0526);NALP3一抗 (武汉博士德生物公司,BA3677),ASC一抗 (美国ImmunoWay公司,YT0365),pro-caspase-1一抗 (美国Abcam公司,ab108362),cleaved caspase-1一抗 (美国Santa Cruz公司,sc-1597),β-actin一抗 (美国CST公司,8H10D10);二抗 (HRP标记山羊抗兔IgG、山羊抗小鼠IgG)、ECL化学发光试剂盒 (碧云天生物技术公司A0208、A0239、P0018) 等。
1.2 动物Wistar大鼠,♂,72只,体质量 (200±20) g,SPF级,由安徽省医学实验动物中心提供,动物合格证编号:SCXK (皖)2015-001。
1.3 仪器YP202N电子天平 (上海精密仪器有限公司),TB-718生物组织包埋机 (湖北泰维电子有限公司),NOVA超薄切片机 (LKB公司),CKX41-F32FL型倒置显微镜 (美国Olympus公司),UV-754分光光度计 (上海精密仪器有限公司),酶标仪 (美国Thermo公司) Eppendorf 5430R台式高速冷冻离心机,DYY-7C电泳仪 (北京六一仪器),GE凝胶成像系统 (美国GE公司) 等。
1.4 方法 1.4.1 尿酸钠溶液的制备按照文献方法[9],取2g尿酸加入400 mL的沸水中,用1mol·L-1 NaOH溶液调pH至7.4,再加热至95℃,室温冷却并轻轻搅拌,4℃放置过夜,析出絮状沉淀,过滤,得微晶型尿酸钠,80℃高温灭菌。用前称取1g尿酸钠,充分研磨,加无菌生理盐水20 mL配成50 g·L-1的混悬液。
1.4.2 实验分组与给药大鼠随机均分为6组 (n=12):正常组,模型组,TSD低、中、高剂量组 (30、100、300 mg·kg-1) 和阳性对照组 (秋水仙碱0.3 mg·kg-1),正常组和模型组蒸馏水灌胃,TSD和秋水仙碱组灌胃给药,每日9点给药1次,连续7 d,d 5给药后1 h,正常组大鼠右侧踝关节背侧注射无菌生理盐水0.2 mL,其它各组在大鼠右侧踝关节背侧注射0.2 mL MSU混悬液,诱导AGA模型。
1.4.3 关节肿胀度测定关节肿胀度测定分别于造模前,造模后6、12、24、48 h测定大鼠右侧踝关节的容积,以 (造模后关节容积-造模前关节容积) 的差值作为关节肿胀度。
1.4.4 大鼠步态分级造模24 h后,按Coderre[10]的方法观察大鼠步态。0级:正常行走;1级:轻微跋行,受试下肢略有弯曲;2级:中度跋行,受试下肢刚触及地面;3级:重度跋行,受试下肢离开地面,三足着地行走。
1.4.5 大鼠踝关节组织病理学观察造模48 h后,各组取其中6只大鼠,处死后以受试踝关节为中心的上下0.5cm部位,经4%多聚甲醛固定1周,常规石蜡包埋,5μm纵向切片,脱蜡水化后苏木精、伊红染色,逐级脱水封片。200×光学显微镜下观察HE染色后踝关节滑膜组织、炎症细胞浸润等情况。
1.4.6 血清炎症因子TNF-α、IL-1β、IL-18的测定造模48h后,各组大鼠用10%水合氯醛麻醉,腹主动脉取血,静置20min后,以3 500 r·min-1离心15 min,收集血清。实验时按ELISA试剂盒步骤操作,测定大鼠血清TNF-α、IL-1β、IL-18表达。
1.4.7 大鼠踝关节滑膜组织IL-1β前体蛋白、NALP3炎性体相关蛋白表达造模48 h后,按照文献方法[11], 各组取6只大鼠,处死后快速分离出踝关节滑膜组织置于研磨器中,于冰上加入含1 mmol·L-1 PMSF的RIPA裂解液,并充分研磨,匀浆,于12 000 r·min-1,4 ℃离心5 min,收集上清液。Western blot检测pro-IL-1β,NALP3炎性体组成蛋白NALP3、ASC、pro-caspase-1和caspase-1活性形式的表达。
1.4.8 统计学分析数据处理采用SPSS 17.0进行统计学分析,所有计量资料、数据资料采用x±s表示,多组间比较采用单因素方差分析,等级资料采用Mann-Whitney U非参数检验。
2 结果 2.1 萆薢总皂苷对MSU诱导的急性痛风性关节炎大鼠关节肿胀度影响与正常组相比,模型组在造模后6、12、24、48 h关节肿胀度均明显增加 (P < 0.01)。与模型组相比,秋水仙碱组在造模后6、12、24、48 h关节肿胀度降低,TSD高、中剂量组大鼠 (300、100 mg·kg-1) 在造模后6、12、24、48 h关节肿胀度降低,差异具有显著性。TSD低剂量组 (30 mg·kg-1) 大鼠关节肿胀程度与模型组相比差异无统计学意义。见Fig 1。

|
| Fig 1 Effect of TSD on articular swelling in rats with AGA (x±s, n=12) One-way ANOVA analysis:▲▲P < 0.01 vsnormal; *P < 0.05, **P < 0.01 vsmodel |
模型组大鼠在注射MSU造模24h后,活动减少,后肢弯曲,轻触或抬离地面,呈三足步态,且关节局部红肿程度严重。TSD 30、100、300 mg·kg-1组及秋水仙碱组大鼠与模型组相比步态评分差异均有显著性,步态明显好转,见Tab 1。
| Group | Dose/mg·kg-1 | Gait level | Significance | |||
| 0 | 1 | 2 | 3 | |||
| Normal | - | 12 | 0 | 0 | 0 | |
| Model | - | 0 | 0 | 1 | 11 | 0.000▲▲ |
| TSD | 30 | 0 | 0 | 8 | 4 | 0.004** |
| 100 | 0 | 3 | 6 | 3 | 0.001** | |
| 300 | 2 | 5 | 3 | 2 | 0.000** | |
| Colchicine | 0.3 | 3 | 4 | 3 | 2 | 0.000** |
| Mann-Whitney U analysis:▲▲P < 0.01 vsnormal;**P < 0.01 vsmodel | ||||||
正常组大鼠滑膜组织无炎细胞浸润,未见毛细血管充血、水肿,滑膜层细胞均匀分布;模型组大鼠滑膜组织可见明显滑膜增生、充血水肿、大量中性粒细胞和单核细胞等炎性细胞浸润。TSD 30 mg·kg-1周围软组织充血水肿明显有较多的炎细胞浸润,较模型组略有改善。TSD 100 mg·kg-1组可见部分充血水肿,滑膜层细胞有增生,炎性细胞浸润较模型组改善明显。TSD 300 mg·kg-1组与秋水仙碱组相似,炎性细胞浸润少,滑膜层细胞基本正常,仅有轻微充血水肿,与模型组相比有明显改善。见Fig 2。
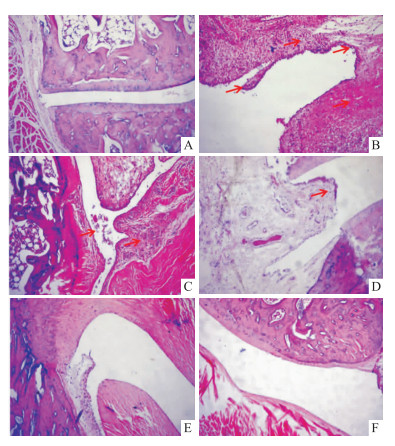
|
| Fig 2 Effect of TSD on histological pathology of ankle joint in AGA rats (200×) A:Normal; B:Model; C:TSD 30 mg·kg-1; D: TSD 100 mg·kg-1; E: TSD 300 mg·kg-1; F:Colchicine |
与正常组相比,模型组大鼠血清中TNF-α、IL-1β、IL-18水平明显增加。与模型组大鼠相比,秋水仙碱组和TSD高、中剂量组大鼠 (300、100 mg·kg-1) TNF-α、IL-1β、IL-18水平降低, 差异有显著性 (P < 0.05)。TSD低浓度组 (30mg·kg-1) 各炎性因子水平与模型组相比均未见明显差异。见Fig 3。

|
| Fig 3 Effect of TSD on TNF-α, IL-1β, and IL-18 in AGA rats (x±s, n=12) 1:Normal; 2:Model; 3:TSD 30 mg·kg-1; 4: TSD 100 mg·kg-1; 5: TSD 300 mg·kg-1; 6:Colchicine. One-way ANOVA analysis.▲▲P < 0.01 vsnormal; *P < 0.05, **P < 0.01 vsmodel |
Western blot和半定量统计结果显示,模型组大鼠pro-IL-1β表达较正常对照组明显上调,而TSD 300、100 mg·kg-1、秋水仙碱组与模型组相比明显降低。NALP3、ASC、pro-caspase-1和cleaved caspase-1蛋白在正常组大鼠中仅有微量表达,而在模型组大鼠中明显升高。与模型组相比,秋水仙碱组、TSD 300、100 mg·kg-1组可见NALP3、ASC、pro-caspase-1和cleaved caspase-1蛋白表达明显降低,呈剂量依赖性;而TSD 30 mg·kg-1组与模型组相比有降低趋势,但差异无统计学意义,见Fig 4。

|
| Fig 4 Effect of TSD on pro-IL-1β and NALP3 inflammasome in AGA rats (x±s, n=6) 1:Normal; 2:Model; 3:TSD 30 mg·kg-1; 4: TSD 100 mg·kg-1; 5: TSD 300 mg·kg-1; 6:Colchicine. One-Way ANOVA analysis:▲▲P < 0.01 vs normal; *P < 0.05, **P < 0.01 vsmodel |
急性痛风性关节炎是MSU晶体沉积在关节组织引起的,发作时以四肢远端关节非对称的急性剧痛、红肿、发热为主要特征,起病急剧,是痛风首发症状。缓解关节症状,抑制炎症反应对防治痛风性关节炎具有重要意义。现有大量研究显示NALP3炎性体信号通路在痛风炎症与免疫调节中发挥重要作用[12-14]。NALP3是NLRs受体家族中的重要亚族之一,主要由B淋巴细胞、T淋巴细胞等产生。NALP3作为胞内模式识别受体,识别病原相关分子模式和危险相关分子模式。如MSU、SiO2、CPPD、胞外ATP等危险信号分子,可作为配体被NALP3识别,使NALP3发生蛋白寡聚化,并招募衔接蛋白凋亡相关斑点样蛋白 (apoptosis associated speck-like protein containing,ASC) 和具有半胱天冬酶活化募集结构域 (caspase activiting and recruitment domain,CARD) 的半胱天冬酶-1(caspase-1),组装成NALP3炎性体,最终活化效应蛋白caspase-1。IL-1β是痛风急性发作的关键细胞因子[15],IL-18、IL-6、TNF-α等都被报道参与痛风的发展。近期研究发现[16-17],IL-1β的成熟受到两个信号调控,一是细胞外模式识别受体Toll样受体,调控pro-IL-1β的产生;另一个关键信号是经NALP3炎性体效应蛋白caspase-1剪切,使IL-1β的前体成有活性的形式。活化的IL-1β、IL-18等炎性因子分泌到细胞外产生痛风的炎症级联放大效应。NALP3、ASC、caspase-1是炎性体激活的关键,IL-1等炎性因子是炎性体激活后致炎的终产物,是目前防治急性痛风性关节炎新的研究要点。最新研究发现[18]:TRAIL与Neuropilin-2两种细胞因子在急性痛风发作时明显上调,亦可作为日后诊断、治疗的新指标。《药品化义》中记载,萆薢“性味淡薄,长于渗湿,主治风寒麻痹”,含甾体皂苷1.1%~2.6%,主要为粉背皂苷A (hypoglaucine A)、原粉背皂苷A (protohypoglaucine A)、纤细薯蓣皂苷 (gracillin)、原纤细薯蓣皂苷 (progracillin)[3]。甾体皂苷元 (主要是薯蓣皂苷元) 是半合成甾体激素的主要原料,最早法国专利报道薯蓣皂苷元 (diosgenin) 及其总皂苷有抗关节炎作用。美国Pfizer制药公司用替告皂苷元 (tigogenin) 和海柯皂苷元 (hecogenin) 为甾体母核所合成的纤维双糖苷有很强的降血脂作用。不同文献对痛风用药规律系统分析显示,在常用处方中萆薢使用频率排在前10位[19-22]。本实验以下游炎性因子和NALP3炎性体为出发点,探讨萆薢总皂苷防治急性痛风性关节炎的作用机制。
本实验采用大鼠踝关节注射MSU晶体复制AGA模型,造模后大鼠关节肿胀程度明显增加,后肢弯曲抬离地面,呈三足步态;病理切片结果显示,滑膜组织可见大量炎性细胞浸润,充血水肿明显,模型复制成功。本实验研究发现:TSD组与模型组比较,TSD各浓度均可改善大鼠步态,300、100 mg·kg-1的TSD能明显改善大鼠关节肿胀程度,使炎细胞的浸润减少,缓解组织充血水肿。以上结果表明,TSD可明显改善急性痛风性关节炎大鼠病变,效果与秋水仙碱类似。
模型组大鼠血清中IL-1β、IL-18、TNF-α表达明显升高,提示IL-1β、IL-18、TNF-α等炎性因子在痛风急性发作中起到重要作用。与秋水仙碱类似,TSD高、中剂量均可抑制炎性因子的表达。Martinon等[7]研究发现用MSU诱导小鼠腹膜炎,NALP3-/-、ASC-/-以及caspase-1-/-小鼠腹膜炎症反应比野生型小鼠明显减轻,IL-1β的成熟和释放受到明显抑制。提示MSU介导的炎症反应需要NALP3炎性体的参与,而IL-1β的成熟也是受到NALP3炎性体的直接调控。因而探讨TSD发挥作用是否与抑制NALP3炎性体的活化相关具有重要的研究意义。本实验中模型组大鼠滑膜组织NALP3、ASC、caspase-1的前体和活性形式表达均明显上调,说明NALP3炎性体参与AGA炎症的发展。与模型组相比,300、100mg·kg-1的TSD可明显降低NALP3、ASC、caspase-1前体和活性形式的表达,说明TSD抗AGA作用的发挥可能是通过抑制NALP3炎性体的装配以及活化,与秋水仙碱类似。因而实验结果表明,TSD可通过抑制NALP3炎性体的装配以及激活的caspase-1,调节下游炎性因子表达,缓解痛风急性发作的症状,防治急性痛风性关节炎。因其对IL-1β前体也具有抑制作用,TSD是否参与另一细胞膜上的固有免疫识别受体Toll样受体调节的通路还需要以后进一步研究。TSD发挥作用具有多靶点性,为临床实践提供有力的依据,并为NALP3炎性体通路相关的疾病防治提供参考。
( 致谢: 本研究在安徽中医药大学中西医结合临床学院药理学实验室完成,衷心感谢本课题组所有老师和同学的指导和帮助。 )
| [1] | Lu X, Li X, Zhao Y, et al. Contemporary epidemiology of gout and hyperuricemia in community elderly in Beijing[J]. Int J Rheum Dis, 2014, 17 (4): 400-7. doi:10.1111/apl.2014.17.issue-4 |
| [2] | Kuo C F, Grainge M J, Zhang W, et al. Global epidemiology of gout: prevalence, incidence and risk factors[J]. Nat Rev Rheumatol, 2015, 11 (11): 649-62. doi:10.1038/nrrheum.2015.91 |
| [3] | 国家中医药管理局《中华本草》编委会. 《中华本草 (精选本)》[M]. 上海: 上海科技出版社, 1998: 2107-11 . Editorial board of Chinese Materia Medica of State Administration of Traditional Chinese Medicine. Chinese Mateteria Medica[M]. Shanghai: Shanghai Scientific and Technical Publishers, 1998: 2107-11 . |
| [4] | 陈光亮, 朱立然, 那莎, 等. 萆薢总皂苷对大鼠慢性高尿酸血症和肾小管尿酸转运体1表达的影响[J]. 中国中药杂志, 2013, 38 (14): 2348-53. Chen G L, Zhu L R, Na S, et al. Effect of total saponin of Disoscorea on chronic hyperuricemia and expression of URAT1 in rats[J]. Chin J Chin Mater Med, 2013, 38 (14): 2348-53. |
| [5] | Qing Y F, Zhang Q B, Zhou J G. Innate immunity functional gene polymorphisms and gout susceptibility[J]. Gene, 2013, 524 (2): 412-4. doi:10.1016/j.gene.2013.04.039 |
| [6] | 王璐, 李璐, 陈光亮. NALP3炎性体在痛风中的作用与药物治疗研究进展[J]. 生命科学, 2016, 28 (3): 405-8. Wang L, Li L, Chen G L. Role of NALP3 inflammasome in the pathogenesis of gout and advances in drug treatment[J]. Chin Bull Life Sci, 2016, 28 (3): 405-8. |
| [7] | Martinon F, Pétrilli V, Mayor A, et al. Gout-associated uric acid crystals activate the NALP3 inflammasome[J]. Nature, 2006, 440 (7081): 237-41. doi:10.1038/nature04516 |
| [8] | 陈光亮.萆薢牛膝总皂苷防治痛风及其机制研究[D].合肥:安徽医科大学, 2005:34-6. Chen G L. Effcts and mechanisms of total saponin of Dioscorea and Achyranthes on gout[D]. Hefei:Anhui Medical University, 2005:34-6. |
| [9] | Huang H G, Sun Y F, Ming H U, et al. Characteristics of monosodium urate monohydrate crystal-induced acute arthritis in rats that mimicked human gouty arthritis[J]. Bull Acad Mil, 2005, 29 : 538-42. |
| [10] | Coderre T J, Wall P D. Ankle joint urate arthritis in rats provides a useful tool for the evaluation of analgesic and anti-arthritic agents[J]. Pharmacol Biochem Behav, 1988, 29 (3): 461-6. doi:10.1016/0091-3057(88)90004-4 |
| [11] | 胡雨峰, 俞晶华, 奚飞飞. 桂枝芍药知母汤对CIA大鼠关节炎的作用及其机制研究[J]. 江苏中医药, 2015, 47 (11): 76-82. Hu Y F, Yu J H, Xi F F. Influence and mechanism research of Guizhishaoyaozhimu decoction of CIA rats[J]. Jiangsu J Tradit Chin Med, 2015, 47 (11): 76-82. |
| [12] | Church L D, Cook G P, McDermott M F. Primer: inflammasomes and interleukin-1 beta in inflammatory disorders[J]. Nat Clin Pract Rheumatol, 2008, 4 (1): 34-42. doi:10.1038/ncprheum0681 |
| [13] | Tao J H, Zhang Y, Li X P. P2X7R: a potential key regulator of acute gouty arthritis[J]. Semin Arthritis Rheum, 2013, 43 (3): 376-80. doi:10.1016/j.semarthrit.2013.04.007 |
| [14] | Steiger S, Harper J L. Mechanisms of spontaneous resolution of acute gouty inflammation[J]. Curr Rheumatol Rep, 2014, 16 (1): 392. doi:10.1007/s11926-013-0392-5 |
| [15] | Kingsbury S R, Conaghan P G, McDermott M F. The role of the NLRP3 inflammasome in gout[J]. J Inflamm Res, 2011, 4 : 39-49. |
| [16] | McCormack W J, Parker A E, O'Neill L A. Toll-like receptors and NOD-like receptors in rheumatic diseases[J]. Arthritis Res Ther, 2009, 11 (5): 243. doi:10.1186/ar2729 |
| [17] | Motta V, Soares F, Sun T, et al. NOD-like receptors: versatile cytosolic sentinels[J]. Physiological Reviews, 2015, 95 (1): 149-78. doi:10.1152/physrev.00009.2014 |
| [18] | 姚丽, 霍红, 韩月, 等. 痛风性关节炎的生物标志物[J]. 中国药理学通报, 2012, 28 (10): 1432-5. Yao L, Huo H, Liu J, et al. The biomarkers of gouty arthritis[J]. Chin Pharmacol Bull, 2012, 28 (10): 1432-5. |
| [19] | 徐熠, 徐玲玲, 刘静, 等. 中药治疗慢性痛风性关节炎的规律及其Logistic回归分析[J]. 世界临床药物, 2013, 34 (8): 469-71. Xu Y, Xu L L, Liu J, et al. Treatment regularity with traditional Chinese medicine for chronic gouty arthritis and its Logistic regression analysis[J]. World Clinical Drugs, 2013, 34 (8): 469-71. |
| [20] | 佟金秋, 马宝东, 陈岩松. 痛风内治法用药规律系统综述[J]. 实用中医内科杂志, 2013, 27 (10): 1-2. Tong J Q, Ma B D, Chen Y S. The systematic review in external treatment medication rule of gout[J]. J Practical Tradit Chin Int Med, 2013, 27 (10): 1-2. |
| [21] | 孙益, 贾万贵, 李象钧, 等. 基于数据挖掘技术的中医药治疗痛风临床用药分析研究[J]. 中国中医急症, 2014, 23 (1): 58-9. Sun Y, Jia W G, Li X J, et al. Analysis research of TCM treatment experience in gout based on date mining technology[J]. J Emerg Tradit Chin Med, 2014, 23 (1): 58-9. |
| [22] | 潘碧琦, 潘建科, 刘军, 等. 基于关联规则和复杂系统熵聚类的痛风用药规律研究[J]. 中华中医药杂志, 2014, 29 (6): 2040-3. Pan B Q, Pan J K, Liu J, et al. Analysis on medication rule in herbal prescriptions for gout based on apriori and clustering algorithm[J]. Chin J Tradit Chin Med Pharmacy, 2014, 29 (6): 2040-3. |

